INTRODUCCIÓN
La relación causal entre los trastornos del metabolismo lipídico y las enfermedades cardiovasculares hace que la investigación sobre metabolismo lipídico sea intensa y muy fructífera y que año a año el avance del conocimiento sea enorme en esta área de la fisiología humana. En torno a un millón de citas aparecen en PubMed en relación con la entrada «lípidos», gran parte de ellas en los últimos cinco años. Por tanto, cualquier revisión sobre este tema necesariamente desborda el contenido de este artículo. Por este motivo, los autores nos hemos concentrado en determinados aspectos que por actualidad, interés científico o implicaciones terapéuticas nos parecen relevantes para los lectores de Nefrología. Las novedades en absorción intestinal de colesterol, el metabolismo periférico de las partículas ricas en triglicéridos (TGRL), el metabolismo hepático de las lipoproteínas de baja densidad (LDL), el papel de las lipoproteínas de alta densidad (HDL) y los esteroles no colesterol tienen entidad suficiente para ser objeto de su análisis.
ABSORCIÓN INTESTINAL DEL COLESTEROL
El colesterol es una molécula insoluble, por lo que su absorción intestinal tiene una cierta complejidad y precisa emulsión, hidrólisis del enlace éster (cuando el colesterol está esterificado), solubilización micelar, absorción en el yeyuno proximal, reesterificación en el citoplasma de los enterocitos y transporte a la linfa en los quilomicrones (QM)1,2. Junto al colesterol de los alimentos, el colesterol intestinal procede también de dos fuentes endógenas: la bilis y la descamación del epitelio intestinal. El colesterol en promedio se absorbe solo un 40 %, aunque con una gran variabilidad interindividual que oscila entre el 20 % y el 80 %3. El colesterol absorbido tiene como destino final el hígado, y cualquier variación en la eficiencia de la absorción del colesterol va a modificar el contenido intrahepático de colesterol y tiene el potencial de influir en la producción endógena de colesterol y de su aclaramiento a través de la captación de las partículas remanentes y LDL4.
A pesar de que los mecanismos moleculares responsables de la absorción intestinal de colesterol y esteroles vegetales no están completamente definidos, en los últimos años los progresos han sido significativos (5 %). En 2004 Altmann et al.5 identificaron la Niemann-Pick C1-like protein 1 (NPC1L1) como la proteína crítica en la absorción intestinal del colesterol de la dieta, al comprobar que la delección de NPC1L1 en ratones producía una drástica reducción de la absorción de colesterol. Establecían así que NPC1L1 era un modulador clave de la homeostasis corporal de colesterol6. Posteriormente García-Calvo et al. demostraron que el transportador intestinal del colesterol situado en el ribete en cepillo de los enterocitos NPC1L1 era la diana molecular de la ezetimiba, un inhibidor de absorción intestinal de colesterol, un fármaco hipolipemiante que había supuesto un gran estímulo en la búsqueda durante años de la proteína cuya función interfiere7. El hecho de que los ratones transgénicos deficientes en NPC1L1 muestren absorción residual de colesterol8 indica que puede haber otros transportadores, y se ha postulado que el heterocomplejo caveolina 1-anexina 2 también es una diana de la ezetimiba9, por lo que la búsqueda de transportadores intestinales del colesterol aún no ha terminado. Una vez dentro del enterocito, existe una selectividad en la absorción mediada por los heterodímeros, ABCG5 y ABCG8, que bombean colesterol y otros esteroles fuera de los enterocitos y los devuelven al lumen intestinal. El sistema ABCG5/ABCG8 en la membrana del hepatocito también es el responsable de la secreción biliar de colesterol y fitosteroles.
El colesterol captado por los enterocitos y no devuelto al lumen por la vía ABCG5/ABCG8 se difunde al retículo endoplasmático, donde es reesterificado por la enzima acil CoA: colesterol aciltransferasa-2 (ACAT2), que cumple la misma función en los hepatocitos10. El tráfico intracelular de colesterol, en el que interviene un número creciente de proteínas de transporte, reguladoras y activadoras de la transcripción de genes11, controla su metabolismo celular en los enterocitos del mismo modo que en las células de otros órganos, de manera que su aumento estimula la actividad ACAT, inhibe la síntesis endógena del esteroide y regula a la baja la expresión de receptores para las LDL12. El paso final es la incorporación del colesterol reesterificado, junto con una pequeña proporción de colesterol libre, a los QM nacientes, en asociación con triglicéridos y apolipoproteína (apo) B48, y su secreción a la linfa. El ensamblaje de los QM es un proceso fisicoquímico complejo en el cual es indispensable la acción de la enzima microsomal triglyceride transfer protein (MTP)13. Lógicamente, tanto la ACAT como la MTP son dianas terapéuticas para tratar de reducir la absorción intestinal del colesterol.
La eficiencia de la absorción se encuentra determinada por el efecto neto del transporte bidireccional de las moléculas de colesterol a través del ribete en cepillo de los enterocitos. Además de los genes, en su regulación intervienen también factores sobre todo dependientes de la dieta, como los esteroles no colesterol.
ESTEROLES NO COLESTEROL
Los esteroles son lípidos esenciales de las células eucariotas fundamentales en el control de las propiedades de las membranas celulares, especialmente las funciones de barrera. Los esteroles comprenden: los precursores de la síntesis de colesterol (como el desmosterol y el lanosterol), el colesterol y los esteroles vegetales, también conocidos como fitosteroles (como el campesterol o el sitosterol). Los fitosteroles son componentes naturales de las plantas cuya estructura y funciones en las membranas celulares son muy similares a las del colesterol, no siendo sintetizados en mamíferos, por lo que su ingesta mediante la dieta es la única fuente de estas moléculas en el plasma. El sitosterol y el campesterol son los esteroles vegetales más abundantes en los alimentos, siendo el aceite de maíz y el de girasol los más ricos en fitosteroles, aunque son cada día más los productos enriquecidos en estos compuestos. En la tabla 1 se recogen las principales características de los esteroles, incluidos los estanoles, las formas saturadas de los fitosteroles.
Para su absorción, el colesterol y los fitosteroles son captados en micelas que, cargadas de esteroles, interactúan con el cepillo intestinal permitiendo su absorción en los enterocitos. La competición en su absorción, junto con otros mecanismos no totalmente conocidos, hace que los fitosteroles inhiban la absorción intestinal del colesterol. Por ello, la ingesta de suplementos de esteroles vegetales ha sido establecida como manejo dietético de la hipercolesterolemia; se han conseguido reducciones de hasta casi un 10 % en el colesterol LDL, no siendo recomendables dosis superiores a 2 g diarios. Aun en cantidades dietéticas habituales (400-500 mg/día), se ha observado que los esteroles vegetales presentan este efecto hipocolesterolemiante14.
La mayor parte de los fitosteroles absorbidos son directamente eliminados a través del hígado y el sistema biliar por el heterodímero ABCG5/ABCG8, así que, en sujetos sanos, menos de un 1 % es retenido finalmente15. Por ello, las concentraciones séricas son muy bajas, aunque su determinación es de gran interés en la práctica clínica. Así como la determinación del colesterol está más que establecida como marcador de riesgo de enfermedad cardiovascular, las concentraciones séricas de fitosteroles también se relacionaron con un mayor riesgo cardiovascular14, aunque un reciente metaanálisis ha puesto en cuestión esta asociación16. Sí se ha observado de forma consistente una relación entre los niveles de fitosteroles y la obesidad, la diabetes mellitus tipo 2 y el síndrome metabólico, importantes factores de riesgo metabólico.
La utilidad de los niveles séricos de esteroles no colesterol como marcadores subrogados del metabolismo del colesterol ha sido ampliamente demostrada. Los fitosteroles (como el campesterol o el sitosterol) han sido establecidos como marcadores de la absorción intestinal de colesterol, junto con el colestanol, mientras que otros esteroles no colesterol (como el escualeno, el desmosterol o el latosterol) lo son de la síntesis endógena del colesterol17. Esto resulta de gran utilidad clínica especialmente en el estudio de la etiología de las dislipemias primarias, en las que la hiperabsorción o la hipersíntesis de colesterol constituyen dos importantes mecanismos etiopatogénicos18. Este mecanismo también influye en la eficacia a la respuesta al tratamiento hipolipemiante, ya que algunos estudios han demostrado una menor respuesta al tratamiento en aquellos pacientes «hiperabsorbedores» de colesterol. La dieta, que constituye un pilar esencial en el tratamiento de la dislipemia, también influye en la concentración de fitosteroles. Su determinación podría contribuir a valorar la adherencia a una dieta saludable, rica en vegetales y, por lo tanto, en fitosteroles, de una forma más objetiva que los métodos subjetivos de los que se dispone en la actualidad19.
CATABOLISMO DE PARTÍCULAS RICAS EN TRIGLICÉRIDOS
EL colesterol es un lípido que encontramos en todos los tipos de lipoproteínas, en contraste con los triglicéridos (TG), mayoritarios solo en los QM, que transportan los TG absorbidos de la dieta, y las lipoproteínas de muy baja densidad (VLDL), contenedoras de los TG provenientes del hígado. Estas lipoproteínas son conocidas como TGRL. Las TGRL comparten la fase inicial de su catabolismo. Al alcanzar el torrente sanguíneo, las TGRL se unen a la superficie endotelial de los capilares sanguíneos a través de los proteoglicanos heparan sulfato, donde son sustratos de la lipoprotein lipasa (LPL), enzima encargada de la hidrólisis de los TG, que requiere como activador la apo C-II20.
Mutaciones en los genes que codifican para LPL y apo C-II producen niveles de TG entre 1000-10 000 mg/dl, demostrando que la LPL es la enzima clave en el catabolismo de las TGRL. Recientemente, se han identificado individuos afectados de hipertrigliceridemia grave con mutaciones en el lipase maturation factor 1 (LMF1), concretamente en la región implicada en la maduración y dimerización de las lipasas: LPL, lipasa endotelial (EL) y lipasa hepática (HL)21. La HL participa en la hidrólisis de fosfolípidos y TG de las VLDL y las lipoproteínas de densidad intemerdia (IDL), en las fases previas a la formación de las LDL, y también participa en el aclaramiento de los QM degradados o remanentes que se lleva a cabo en el hígado20. El efecto contrario a LMF1 lo realiza la angiopoietin-like 4 (ANGPTL4), una proteína plasmática que inhibe la actividad de LPL y, presumiblemente, de HL y EL, promoviendo la conversión de los dímeros activos de las lipasas en monómeros inactivos22.
La LPL se sintetiza en las células parenquimatosas del tejido adiposo, muscular esquelético y cardíaco, y se transporta a la superficie endotelial. Recientemente se ha propuesto que la proteína glycosylphsopahtidylinositol-anchored high-density lipoprotein-binding protein 1 (GPIHBP1) podría estar involucrada en este transporte. Beigneux et al. demostraron que los ratones knock-out para GPIHBP1 mostraban niveles de TG > 2000 mg/dl. Esta relación se confirmó al identificar sujetos con hipertrigliceridemia grave con mutaciones en dominios implicados en la interacción de GPIHBP1 con LPL23. La observación por parte de Davies et al. de la co-localización de GPIHBP1 con LPL tanto en la superficie basolateral como en la apical de las células endoteliales concluyó que GPIHBP1 actuaba como una lanzadera, aportando una explicación plausible a la hipertrigliceridemia grave consecuencia de mutaciones en los dominios de interacción de GPIHBP1 con LPL24.
Apo A-V es una apolipoproteína que se encuentra en las VLDL, los QM y las HDL. Su participación en la eliminación de los TG colaborando en la hidrólisis de los TG mediante LPL está claramente aceptada. Sin embargo, su función no ha sido establecida todavía25. Estudios in vitro han demostrado que apo A-V facilita la hidrólisis de los TG interaccionando con LPL, los proteoglicanos y GIPHBP1. Además, apo A-V contiene una región de 42 aminoácidos similar a las regiones de apo B y apo E, que son responsables de la interacción con los proteoglicanos heparan sulfatos y los miembros de la familia del receptor LDL (LDLR)25. Por tanto, podría ser probable la participación de apo A-V en el aclaramiento de las TGRL. Tras la hidrólisis de los TG, se forman los QM y VLDL remanentes, que son eliminados del torrente sanguíneo a través del LDLR y de los LRP. Se ha demostrado que apo A-V interactúa con receptores de la familia LDLR: LDLR, LRP1, SorLA/LR11 y sortilina. La participación de LDLR y LRP1 en el catabolismo de las TGRL está ampliamente aceptada20. Recientemente se ha propuesto un modelo en el que SorLA/LR11 y sortilina estimulan la actividad de LPL mediada por apo A-V, hipótesis apoyada por la observación de que mutaciones en la región C-terminal de apo A-V impiden la interacción con sortilina y SorLA/LR11, dando lugar a una hipertrigliceridemia grave26.
El catabolismo de las TGRL es complejo y todavía quedan muchos detalles por elucidar que nos permitirán entender, de una mejor manera, las causas de las hipertrigliceridemias. En la tabla 2 se detallan las principales causas de hipertrigliceridemia.
PROPROTEÍNA CONVERTASA SUBTILISINA/KEXINA DE TIPO 9 (PCSK9): PAPEL EN EL METABOLISMO DEL COLESTEROL, LA HIPERCOLESTEROLEMIA FAMILIAR Y SU INHIBICIÓN EN EL TRATAMIENTO DE LA HIPERCOLESTEROLEMIA
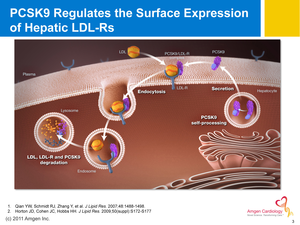
En el año 1999, identificamos un tercer locus causante de hipercolesterolemia autosómica dominante en la región cromosómica 1p34.1-p32 en diversas familias de Francia y España27. Este estudio de ligamiento dio lugar al descubrimiento del gen PCSK9, responsable de la hipercolesterolemia en dichas familias28. Este gen codifica PCSK9, una serin-proteasa que se sintetiza fundamentalmente en el hígado como un precursor que se somete a una escisión autocatalítica intracelular para ser secretado en su forma activa. En la circulación se une al receptor de LDL en la superficie celular y, posiblemente, a otros receptores relacionados con el receptor LDL. Una vez se produce la unión entre la partícula LDL y su receptor en la superficie celular, el complejo LDL-LDL receptor-PCSK9 se internaliza en las invaginaciones de la membrana ricas en clatrina29. La presencia de PCSK9 conduce a un catabolismo lisosomal del receptor LDL, lo que impide su reciclado a la superficie celular y por tanto a una disminución del número de receptores LDL disponibles. Las mutaciones de ganancia de función en PCSK9 producen una unión receptor LDL-PCSK9 más estables y favorecen una degradación mayor del receptor LDL30. Por el contrario, las mutaciones en PCSK9 que disminuyen o anulan su función tienen como consecuencia un catabolismo del receptor LDL reducido, un mayor número de receptores LDL disponibles en la superficie celular y una reducción en la concentración del colesterol LDL. Existen varias mutaciones en el gen de PCSK9 que disminuyen su función y se acompañan de concentraciones más bajas de colesterol LDL que el resto de la población. Aproximadamente, el 15 % de los afroamericanos son heterocigotos para mutaciones que producen alelos nulos, Y142X y C679X. Estos sujetos tienen medias de colesterol LDL en torno a 100 mg/dl, unos 30-35 mg/dl menos que el resto de la población. Esta reducción en el colesterol LDL desde el nacimiento se acompaña de una reducción en torno al 80 % de la enfermedad coronaria en estos sujetos31. Se han publicado dos casos de personas homocigotas para alelos nulos de PCSK9 que presentan concentraciones de colesterol LDL inferiores a 20 mg/dl, sin problemas de salud y vida normal32. Estos datos apoyan la idea de que PCSK9 es clave en el metabolismo del colesterol LDL y que la inhibición de PCSK9 podría ser utilizada como tratamiento hipolipemiante.
Con esa idea varias compañías han desarrollado anticuerpos monoclonales frente a PCSK9 que ya se encuentran en fase III de experimentación clínica. Estos anticuerpos administrados de forma subcutánea principalmente cada dos o cuatro semanas reducen la concentración de colesterol LDL en torno al 50-70 %, lo que supone que la gran mayoría de los pacientes logran con esos fármacos objetivos lipídicos33,34. Además, reducen la concentración de la lipoproteína (a) en torno al 35 % por mecanismos desconocidos en el momento actual. Varios ensayos clínicos con inhibidores de PCSK9 se están llevando a cabo con el objetivo de demostrar una reducción de eventos clínicos, pero sus resultados no se esperan antes de tres años. Los inhibidores de PCSK9 se perfilan como grandes fármacos hipolipemiantes para aquellos sujetos que no alcanzan objetivos de colesterol LDL a pesar del tratamiento hipolipemiante actual o bien para aquellos sujetos que son intolerantes a las estatinas35.
El conocimiento de PCSK9 ha ayudado a identificar una nueva causa de hipercolesterolemia autosómica dominante (tabla 3), así como a identificar una diana terapéutica muy atractiva con impacto clínico en un futuro próximo.
METABOLISMO DE LA LIPOPROTEÍNA DE ALTA DENSIDAD
La lipoproteína de alta densidad, o HDL, es un complejo macromolecular compuesto, aproximadamente, por un 50 % de lípidos y un 50 % de proteínas. Las HDL se caracterizan por ser las lipoproteínas más densas (> 1,063 g/ml) y pequeñas (diámetro: 5-17 nm, masa: 200-400 KDa) del plasma. Las diferentes subclases de HDL varían en el contenido de lípidos, apolipoproteínas, enzimas y proteínas transferidoras de lípidos, resultando en cambios de forma, densidad, tamaño, carga y antigenicidad36.
La biosíntesis de la HDL incluye la síntesis y secreción de las principales apolipoproteínas de la HDL, la adquisición de lípidos extracelulares (fosfolípidos y colesterol) y el ensamblaje de la HDL madura. La apo AI es la principal proteína de las HDL y constituye aproximadamente el 70 % del contenido proteico de la partícula. Las recién sintetizadas apolipoproteínas de la HDL adquieren fosfolípidos y colesterol para generar las partículas. En este paso, el transportador de la familia ABC (adenosine triphosphate-binding casette) ABCA1 tiene un papel esencial en la lipidación de la apo AI. Mutaciones en el gen de ABCA1 producen la enfermedad de Tangier, que cursa con concentraciones extremadamente bajas de colesterol HDL y apo AI. La mayor parte de los lípidos de las HDL proviene de tejidos periféricos. La HDL retira la mayoría del colesterol que transporta de las células y tejidos extrahepáticos37. El colesterol transportado por la HDL se cataboliza en el hígado, principalmente, a través del receptor basurero o scavenger SR-BI. Este receptor es capaz de captar, selectivamente, colesterol, tanto libre como esterificado, pero no apolipoproteínas.
En los últimos años se ha profundizado en el estudio de los mecanismos moleculares del eflujo de colesterol desde los tejidos periféricos hacia el hígado para su catabolismo y eliminación; el conocido como transporte reverso de colesterol38. El proceso tiene tres etapas principales: el eflujo de colesterol de tejidos periféricos, el transporte plasmático y la captación del colesterol por células hepáticas. El mecanismo más conocido de eflujo de colesterol es el del transportador ABCA1, a través del cual los macrófagos liberan colesterol libre hacia una apo AI pobre en lípidos como aceptor. Sin embargo, lo más frecuente, debido a la velocidad de maduración de las HDL nacientes, es que sea una HDL madura la que capte el colesterol de los macrófagos. En este caso, es otro transportador de la familia ABC, ABCG1, el responsable del eflujo de colesterol39.
Diversos estudios epidemiológicos han establecido que existe una relación inversa entre las cifras de colesterol HDL y el riesgo de enfermedad cardiovascular40. Además, se ha demostrado una disminución del 2 % al 3 % en la incidencia de eventos cardiovasculares por cada miligramo de colesterol HDL aumentado en sangre41. Esta relación entre el colesterol HDL y el riesgo de enfermedad cardiovascular se ha atribuido principalmente a la capacidad de la lipoproteína de captar colesterol desde los macrófagos en la pared arterial en uno de los primeros pasos del transporte reverso de colesterol. A través de este flujo de colesterol, las células eliminan el exceso de colesterol y mantienen su homeostasis. Además de su papel en el transporte de lípidos, existen otros mecanismos relacionados con la acción antiaterogénica de la HDL: propiedades antiinflamatorias42, protección frente a la oxidación lipídica43, propiedades antitrombóticas44, mantenimiento de la vasorreactividad dependiente del endotelio45, inhibición de la apoptosis de células endoteliales y reparación del endotelio dañado46.
En los últimos años, se ha prestado especial atención a la parte proteica de la HDL, y no tanto al colesterol que transporta, asumiendo que la composición proteica de esta determinará, en gran parte, su funcionalidad. A ello ha contribuido especialmente el desarrollo de la proteómica. Las diferentes técnicas proteómicas se pueden clasificar en técnicas basadas en gel y técnicas a gran escala no basadas en gel acopladas con espectrometría de masas. Con el avance de la tecnología han surgido modificaciones que han permitido aumentar la sensibilidad y la profundidad de estudio e, incluso, la cuantificación. La cromatografía multidimensional, las técnicas de marcaje isotópico estable, los arrays de proteínas y los marcajes diferenciales son algunas de las más importantes. Mediante técnicas proteómicas, en el año 2007, Vaisar et al. demostraron que el número de proteínas diferentes que transporta la HDL, aislada por ultracentrifugación, era mucho mayor de lo esperado y que, además, dichas proteínas jugaban un papel diferente del metabolismo lipídico. Estos autores consiguieron identificar más de cien proteínas asociadas a la partícula. Además de proteínas implicadas en el metabolismo lipídico, identificaron proteínas implicadas en la regulación del complemento, proteínas de fase aguda e inhibidores de proteinasas47.
Aunque son pocos los estudios que han utilizado la cromatografía de exclusión molecular para analizar el proteoma de la HDL, los resultados obtenidos son interesantes. En el trabajo realizado en 2010 por Gordon et al., se separó la fracción HDL en 17 subfracciones de distinto tamaño e identificaron 14 nuevas proteínas no descritas con anterioridad asociadas a la HDL relacionadas con regulación del complemento e inhibición de la proteolisis48. El alto grado de fraccionamiento de la partícula conseguido permitió profundizar en el análisis proteómico y visualizar la distribución de proteínas en las distintas subfracciones. Las proteínas menos abundantes se concentraban en las fracciones más densas, que corresponden, mayoritariamente, a las HDL de menor tamaño. La heterogeneidad observada en este estudio apoya la idea de que cada subpoblación de HDL desempeña diferentes funciones fisiológicas.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. PCSK9 se sintetiza en la célula hepática y se libera al torrente sanguíneo.
12338_19115_52500_es_12338_tabla1.doc
Tabla 1. Tipos y principales características de los esteroles.
12338_19115_52501_es_12338_tabla2.doc
Tabla 2. Clasificación etiopatogénica de las hipertrigliceridemias.
12338_19115_52502_es_12338_tabla3.doc
Tabla 3. Clasificación de las hipercolesterolemias de acuerdo a su mecanismo de producción.