El trasplante renal es el tratamiento de elección de la enfermedad renal crónica. La enfermedad cardiovascular, las infecciones, así como las neoplasias de novo postrasplante renal son las principales causas de mortalidad de los pacientes trasplantados. Las neoplasias más frecuentes en el postrasplante renal son los procesos linfoproliferativos y las neoplasias cutáneas. Otro tipo de neoplasias, como son los tumores renales, también representan aproximadamente el 3 % de todas las neoplasias de los trasplantados. Se ha realizado una revisión de los trasplantados renales de nuestra unidad entre julio de 1985 y octubre de 2012 que han presentado una masa a nivel del injerto renal, confirmando el diagnóstico por biopsia de la masa. Se ha analizado en todos los casos la patología de base, la función renal y el tratamiento inmunosupresor. Este artículo quiere dar importancia a la monitorización de la aparición de posibles masas tumorales en el injerto renal y su manejo.
Kidney transplant is the treatment of choice for chronic kidney disease. Cardiovascular disease, infections, and postransplant de novo neoplasms are the main causes of death in transplant patients. The most frequent kind of post kidney transplant neoplasms are lymphoproliferative processes and cutaneous neoplasms. Another type of neoplasm, that of kidney tumours, also represents approximately 3% of all neoplasms in transplant patients. A review of the kidney transplants from our unit performed between July 1985 and October 2012 which presented a mass in the kidney graft was carried out, confirming the diagnosis by taking a biopsy of the mass. In all the cases, the underlying pathology, kidney function and immunosuppressive treatment were analysed. This article aims to give importance to monitoring and management of the appearance of possible tumour masses in kidney transplants.
INTRODUCCIÓN
El trasplante renal es el tratamiento de elección de la enfermedad renal crónica terminal, así como la única alternativa al tratamiento sustitutivo con diálisis. Este hecho no obvia las frecuentes complicaciones, tanto médicas como quirúrgicas, que se observan a corto y largo plazo. A pesar de estas complicaciones, la supervivencia y la calidad de vida de los pacientes se han demostrado superiores tras el trasplante que manteniéndose en diálisis. La enfermedad cardiovascular, las infecciones y las neoplasias de novo tras el trasplante son las principales causas de mortalidad de los pacientes trasplantados1.
El aumento de la edad de los receptores, la mayor expectativa de vida del injerto y las pautas de inmunosupresión más potentes hacen que el cáncer sea una de las más serias preocupaciones que pueden comprometer la supervivencia del injerto y la vida del paciente trasplantado.
Las neoplasias más habituales en los pacientes trasplantados, y que se han relacionado directamente con la inmunosupresión, son las linfoproliferativas y las cutáneas, que llegan a ser hasta 100 veces más frecuentes que en la población general2. El desarrollo de neoplasias se ha considerado la complicación más común a largo plazo del tratamiento inmunosupresor3. Existen otros factores particulares que aumentan el riesgo de neoplasia, como las infecciones por virus oncogénicos o, en los pacientes con enfermedad renal terminal, la degeneración quística adquirida de los riñones atróficos3.
En el caso de las neoplasias renales, estas representan aproximadamente el 3 % de todas las neoplasias del adulto4, con una tasa de incidencia 10,02 casos por cada 100 000 habitantes/año (0,01 %) según datos del estudio epidemiológico llevado a cabo por la Asociación Española de Urología. De estos, aproximadamente el 80 % son carcinomas de células claras, mientras que tan solo el 10-15 % son tumores de células papilares5. No se ha observado mayor incidencia de este cáncer en los pacientes trasplantados en general; sin embargo, en los trasplantados renales la incidencia de neoplasia sobre riñón nativo representa hasta el 5 %6. La mencionada degeneración quística de los riñones atróficos remanentes tras el inicio de la diálisis o del trasplante se ha imputado como causante de la degeneración neoplásica de estos. A pesar de estos datos, en la última revisión de las guías clínicas de la Asociación Europea de Urología no se recoge la degeneración renal quística como factor etiológico4, posiblemente porque el incremento del riesgo es menor en los pacientes en diálisis no trasplantados que en los que ya han recibido un injerto renal y están en tratamiento inmunosupresor3.
Por otra parte, el tumor renal detectado sobre el injerto renal es una entidad muy poco frecuente, únicamente casos aislados y pocas series se encuentran descritas en la literatura médica. Su incidencia se cifra alrededor del 0,5 % de todos los pacientes trasplantados renales7 y la latencia desde el trasplante hasta su detección suele ser de varios años (10-21 años)7,8. La importancia de esta entidad radica en que la neoplasia recae sobre un órgano heterólogo, habitualmente funcionante, que está sustituyendo un déficit previo del paciente. El tratamiento en estos casos no está estandarizado, pero se deben priorizar, siempre que sea posible, los tratamientos con intención de preservar la función renal, ya sean nefrectomías parciales o tratamientos ablativos, pues la nefrectomía abocará indefectiblemente en diálisis. En la decisión del tratamiento adecuado intervienen tanto la localización y el tamaño del tumor como la función renal del injerto y las características del paciente.
MATERIAL Y MÉTODOS
Entre julio de 1985 y octubre de 2012 se han llevado a cabo en nuestro centro 813 trasplantes renales, 68 de los cuales son trasplantes de donante vivo. Los receptores iniciaron tras el trasplante un régimen clásico de triple terapia inmunosupresora mediante corticoides, anticalcineurínicos (ciclosporina o tacrolimus) y fármacos antiproliferativos (azatioprina o micofenolato), pudiendo variar esta en función de los episodios de rechazo o la hipersensibilización del receptor.
En los casos en que se detectó una masa en el injerto renal (n = 7) durante el seguimiento tras el trasplante se realizó confirmación histológica de la neoplasia por biopsia percutánea (Trucut 16 G) y se descartaron para el estudio todas las lesiones del injerto en las que no se confirmó malignidad ni por biopsia ni por seguimiento clínico posterior. Cuatro casos de tumor en el injerto renal (0,5 %) en otros cuatro pacientes trasplantados han sido diagnosticados durante su seguimiento. Todos estaban asintomáticos, con riñón funcionante y fueron detectados de manera incidental en un control ecográfico, ya fuera rutinario o por estudio de deterioro de la función renal. Tras la sospecha diagnóstica con ecografía se practicó tomografía axial computarizada (TAC) abdomino-pélvica en todos los casos y la mencionada punción biopsia de la masa, así como un estudio de extensión tumoral con radiografía simple de tórax, análisis completo y gammagrafía ósea.
RESULTADOS
Los tumores renales se diagnosticaron a los 10,1 años tras el trasplante renal (rango 1-17 años) (mediana: 13 años), el tamaño medio del tumor fue de 32 mm (rango 17-50 mm). Los pacientes diagnosticados siguieron un estudio de extensión tumoral, exploración física y se analizó de manera individualizada el pronóstico de la función del injerto.
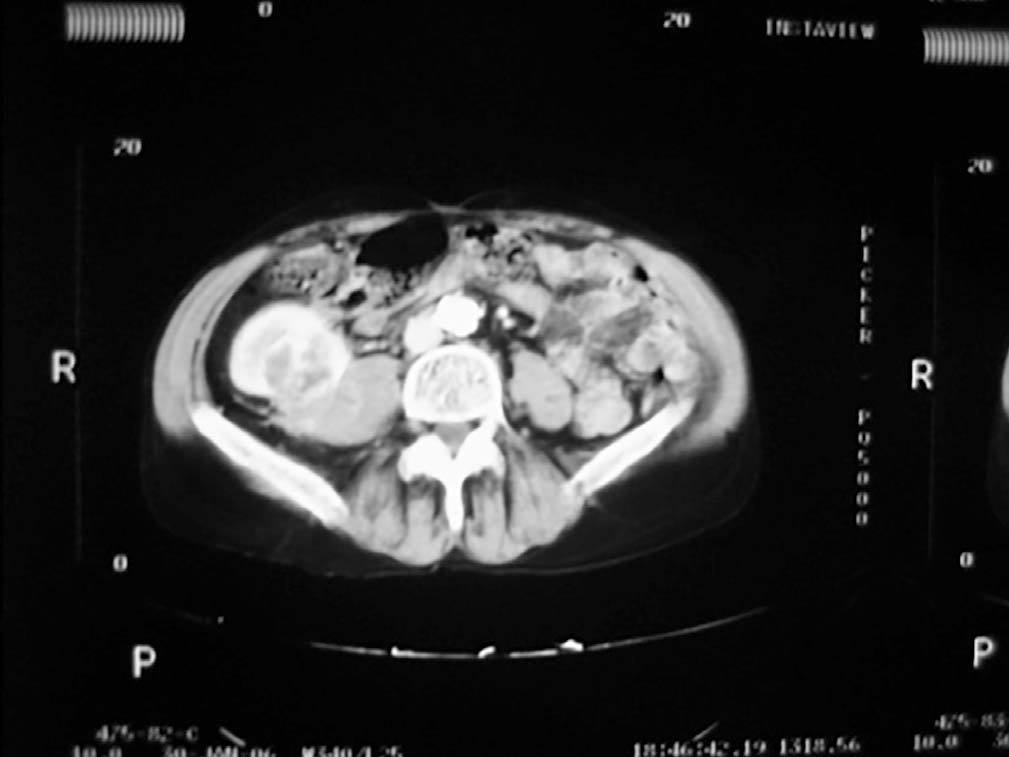
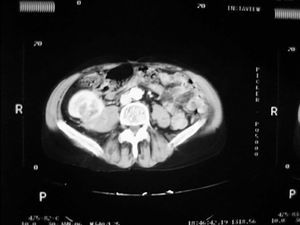
Caso 1. Varón de 56 años que inicia hemodiálisis en 1990 por nefropatía hipertensiva y en 1992 se le somete a un trasplante renal de donante cadáver que evolucionó sin complicaciones. En 2006, estando asintomático y por un deterioro de la función renal, se detecta por ecografía una masa en polo superior del injerto de 5 cm de diámetro máximo. Se procedió a una biopsia percutánea de la masa que confirmó la presencia de carcinoma de células renales. Se llevó a cabo un estudio de extensión con TAC (figura 1) y resonancia magnética nuclear (RMN), que no mostró extensión locorregional, y se procedió a transplantectomía extracapsular con linfadenectomía. El resultado en la anatomía patológica definitiva fue de carcinoma de células claras variante sarcomatoide de 5 cm infiltrando la cápsula del riñón y tejidos circundantes sin infiltración de vena ni de ganglios resecados (pT3aN0). Tras 6,5 años de seguimiento, el paciente está libre de enfermedad. En el estudio genético con micro-arrays de DNA se evidenció el origen tumoral de las células del propio paciente. Se descartó la presencia de neoplasia en los riñones nativos, y por tanto la hipótesis de metástasis procedente de estos.
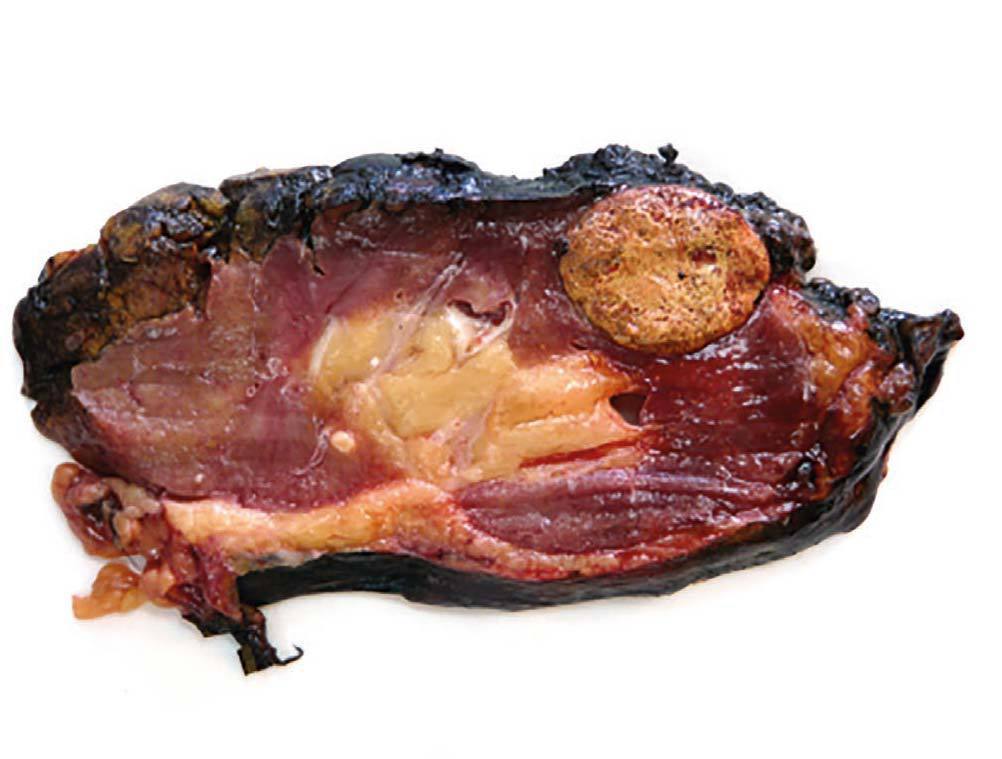
Caso 2. Mujer de 32 años, con insuficiencia renal crónica secundaria a nefropatía IgA, que recibió trasplante renal de cadáver (de un varón) a los 21 años. Por deterioro progresivo de la función renal con creatinina de 3,5 mg/dl y filtrado glomerular estimado de 16 ml/min/1,73 m2 se solicita ecografía que evidencia un nódulo sólido de 32 mm en el tercio superior del injerto. La biopsia practicada confirma la presencia de carcinoma de células renales. La exploración física es normal, la TAC no evidenció signos de extensión tumoral y la paciente estaba asintomática. Dado el mal pronóstico a medio plazo del injerto, se decide practicar una transplantectomía laparoscópica extracapsular, y la paciente volvió a diálisis tras la intervención. El resultado de anatomía patológica fue de carcinoma de células renales tipo papilar de 33 mm limitado al riñón con márgenes libres (pT1a) y glomerulonefritis crónica severa en el resto del riñón (figura 2). Tras 38 meses de seguimiento la paciente está libre de enfermedad. El estudio cromosómico determinó la presencia de cromosoma Y en las células tumorales, confirmando el origen tumoral del donante. Se estudió, asimismo, el otro receptor del mismo donante mediante ecografía abdominal y TAC, sin evidenciar neoformaciones.
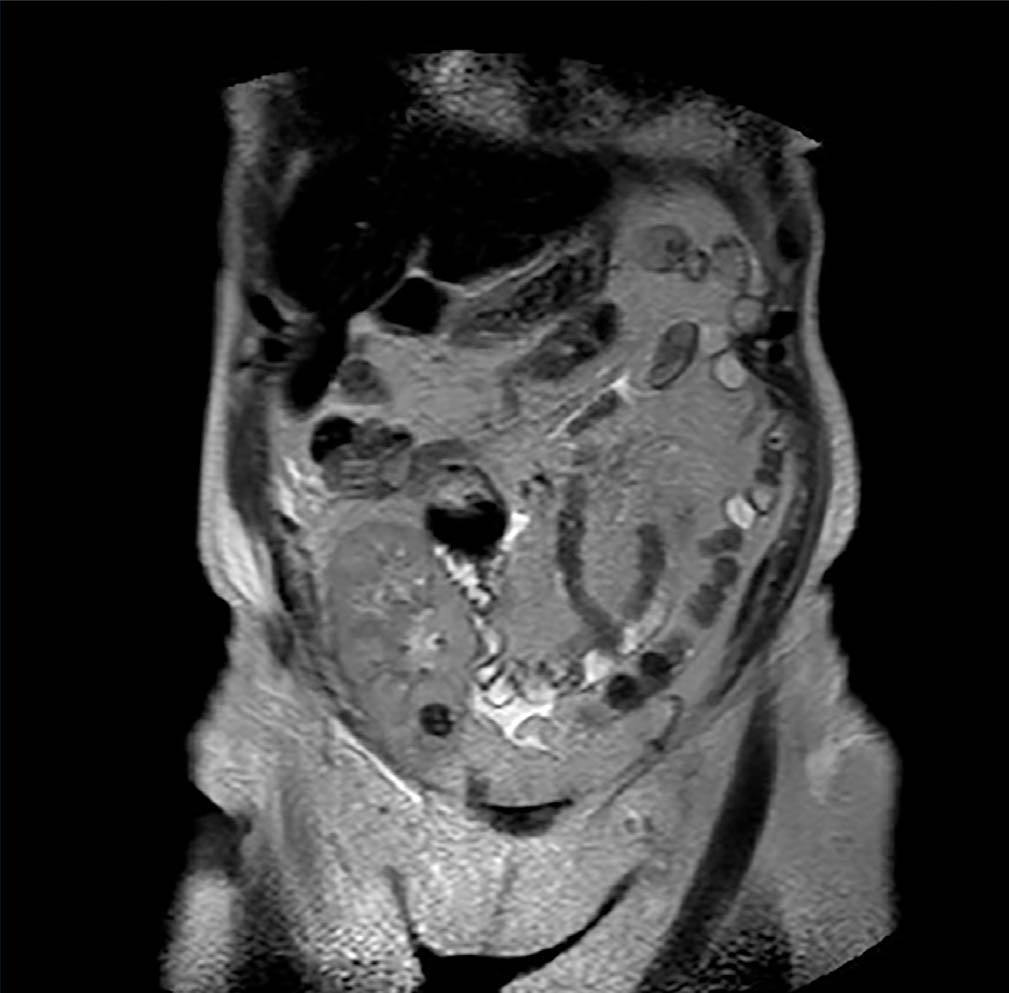
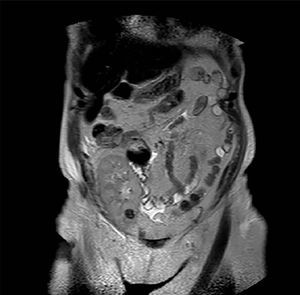
Caso 3. Mujer de 68 años afecta de nefropatía diabética, en hemodiálisis desde 2003. En enero de 2010 recibe injerto renal de donante cadáver, con posoperatorio sin complicaciones y funcionamiento inmediato del injerto. El riñón contralateral del mismo donante fue desestimado para trasplante en la extracción por presentar una biopsia con severa fibrosis intersticial y glomeruloesclerosis, y múltiples lesiones milimétricas corticales compatibles con adenomas tubulares, mientras que la biopsia y el aspecto macroscópico del injerto implantado fueron satisfactorios. En control rutinario a los 12 meses se detecta por ecografía un nódulo hiperecogénico en polo inferior del injerto de 12 mm de diámetro máximo, intrarrenal, no visualizado en exploraciones previas. Se confirma la existencia de dicha nodulación por RMN (figura 3) y se decide practicar una biopsia renal que confirma la presencia de células compatibles con carcinoma de células papilares tipo I. La función renal era estrictamente normal y la paciente decidió seguir controles ecográficos periódicos y no realizar ninguna actitud ablativa en primera instancia, debido a la óptima función renal y la difícil accesibilidad del tumor para tratamiento conservador. Se había iniciado tratamiento inmunosupresor con prednisona, ácido micofenólico y tacrolimus, y se procedió a cambio de la inmunosupresión, sustituyendo el tacrolimus por everolimus tras el diagnóstico del tumor renal. Tras 22 meses de seguimiento la paciente se encuentra asintomática, con una creatinina de 1,15 mg/dl y en los controles ecográficos posteriores no se ha evidenciado cambio del tamaño del tumor. Se estudió igualmente el receptor del hígado del mismo donante, que fue sometido a estudio de imagen sin hallar masas sospechosas en su injerto.
Caso 4. Mujer de 72 años, portadora de nefropatía IgA, que inició hemodiálisis en 1989. En 1994 se procedió a trasplante renal de donante cadáver de sexo masculino. Los controles posteriores han sido correctos, manteniendo en los últimos años una función renal con una creatinina de 1,9 mg/dl, MDRD 23. En julio de 2011 se realiza ecografía de seguimiento en la que se evidencia nódulo sólido de 20 mm en polo superior del injerto. Se lleva a cabo biopsia del nódulo, que es positiva para carcinoma de células renales, y biopsia de riñón no tumoral que confirma recidiva de nefropatía IgA. Dada la edad y la calidad de vida de la paciente, el tamaño tumoral y su localización, se decide practicar una nefrectomía parcial laparoscópica sin isquemia. El análisis de anatomía patológica del tumor fue de carcinoma de células renales tipo papilar de 22 mm de diámetro máximo, encapsulado y con márgenes libres de neoplasia (pT1a). No se realizó ningún cambio en el tratamiento inmunosupresor, dado que el filtrado glomerular era < 30 ml/min/1,73 m2 de superficie corporal, que en la actualidad era únicamente prednisona y ciclosporina. Tras 14 meses de seguimiento la paciente mantiene la misma función renal que antes de la intervención. En el estudio cromosómico del tumor se detectó la presencia del cromosoma Y en células tumorales, lo que ponía de manifiesto el origen del donante. La pareja que recibió el otro riñón del mismo donante fue igualmente estudiada, sin evidenciar lesiones en su injerto.
El seguimiento medio de estos pacientes es de 37,5 meses (14-76), mediana de 30 meses, sin evidenciar recidiva en ningún caso de los intervenidos ni aumento del tamaño tumoral en la paciente en que se decidió seguimiento.
DISCUSIÓN
La aparición de un tumor en el injerto renal es infrecuente. Se ha calculado una incidencia del 0,5 % de los pacientes trasplantados, siendo esta cifra bastante constante en las pocas series publicadas7-10. Esta incidencia es muy superior a la de tumores renales en la población general, pero es inferior a la de neoplasias en riñón nativo en pacientes trasplantados8. Se desconoce el motivo concreto del aumento de la incidencia de tumores en riñones trasplantados respecto a la población general, pero la inmunosupresión crónica a la que se somete el receptor junto con el mayor seguimiento (y por consiguiente detección más precoz de lesiones de pequeño tamaño) podrían ser la causa. A pesar de que la incidencia es baja, es esperable en las próximas décadas un aumento de ella por el incremento de la supervivencia de los injertos y al ascenso progresivo de la edad de los donantes a la que estamos asistiendo en los últimos años.
El tiempo de latencia entre el implante y el diagnóstico del tumor suele ser largo, con períodos superiores a los diez años por lo general, e incluso un caso descrito de veinte años después del trasplante11. Sin embargo, hay algunas series y casos aislados de diagnóstico antes de los 24 meses después del implante12, lo que corroboraría la hipótesis del trasplante del riñón con lesiones milimétricas o no visibles en el momento de la extracción ni del implante, pero estos casos suponen una pequeña proporción. De hecho, en la serie que presentamos, uno de los casos se diagnosticó a los 12 meses del implante. En este caso en particular, el riñón contralateral fue desestimado tanto por la presencia de múltiples lesiones milimétricas macroscópicas visibles en la superficie renal como por el dictamen de adenomas tubulares en la biopsia, aunque no se evidenciaron células malignas en dicho injerto. En los casos en que se ha realizado estudio genético se ha demostrado que las células formadoras del tumor en el injerto provienen del propio donante, es decir, se admite la degeneración neoplásica años después del implante de las propias células del injerto. La teoría de la degeneración de las propias células del riñón trasplantado favorecida por un ambiente de inmunosupresión prolongada es la más plausible como factor causal y explicaría el aumento de la frecuencia en relación con la población general. Sin embargo, en un caso de nuestra serie (y único en la literatura) se demostró origen tumoral en las células del receptor13, atribuyendo el origen a la existencia de stem cells circulantes que se implantan en el injerto y degeneran.
El tratamiento del tumor renal aparecido en el injerto no está estandarizado10, y el tamaño del tumor, su localización y el pronóstico funcional del injerto influirán en la decisión que se haya de tomar. En un principio existía la tendencia a practicar la exéresis completa de injerto, al tratarse de un paciente inmunodeprimido con una neoplasia, pero esa actitud lleva nuevamente al enfermo a la diálisis, que es lo que se quería evitar con el trasplante. La tendencia actual es a considerar la cirugía parcial como imperativa por tratarse de un paciente monorreno, pues, a pesar de la inmunosupresión, la recurrencia y progresión de este tipo tumoral no se ha demostrado superior a la de la población general no trasplantada ni se han reportado recidivas tras tratamientos conservadores, a pesar de llevarse a cabo en masas de hasta 6 cm14. La nefrectomía parcial suele practicarse por vía abierta, aunque en 2009 se publicó la primera nefrectomía parcial laparoscópica sobre injerto renal15. Se han comunicado, tanto en series como en casos aislados, en la mayoría de los casos nefrectomías parciales, siendo bajo el número de transplantectomías, 4 de 17 casos en la serie de Pluossard7 y 3 de 8 en la serie de Leveridge8, así como una transplantectomía realizada en 1992 para un tumor de 4,5 cm en polo inferior de un injerto normofuncionante16, que probablemente se hubiera tratado con cirugía parcial en la actualidad.
En los casos en que se opte por la cirugía parcial, la persistencia del aloinjerto en el receptor obliga a mantener la medicación inmunosupresora tras el diagnóstico; pero, dado que la inmunosupresión prolongada se ha relacionado con la aparición de neoplasias, es recomendable bien disminuir la inmunosupresión o bien modificar la pauta, incorporando fármacos que proporcionen al mismo tiempo protección contra el rechazo y efecto antiproliferativo tumoral. En los casos de neoplasia renal, la introducción de everolimus como tratamiento inmunosupresor parece ser la norma17. Su efecto como inhibidor de la acción de los linfocitos T combina el efecto inmunosupresor con el efecto antiproliferativo (indicado como quimioterapia de segunda línea en el carcinoma renal avanzado), bloqueando el factor de crecimiento del endotelio vascular. La no necesidad de modificar la dosis por edad o por insuficiencia renal hace de este fármaco el ideal para los casos de neoplasia en el injerto renal que precisen seguir con tratamiento inmunosupresor.
Es remarcable la prácticamente nula incidencia de neoplasias detectadas en injertos no funcionantes, no sabemos si porque no se han reportado en la literatura o porque existe algún factor protector al retirar o disminuir la inmunosupresión. Al revisar la literatura, encontramos únicamente un caso de carcinoma de células escamosas en un injerto previamente rechazado18. El seguimiento periódico con pruebas de imagen a que se someten los pacientes trasplantados explicaría el diagnóstico precoz de masas de pequeño tamaño, sin dar tiempo a que crezcan de forma silente, pero no se explica el poco número de tumores en injertos perdidos, cuando la transplantectomía tras la pérdida del órgano no es la norma, en la mayoría de centros se opta por dejar el injerto si este no provoca clínica de intolerancia19.
En conclusión, las neoplasias en los injertos renales son infrecuentes, aunque con una incidencia superior a la de los tumores renales en la población general, y de aparición generalmente tardía tras años del implante. En estos casos es mandataria la realización de una biopsia confirmatoria en todos los casos antes de decidir el tratamiento que se ha de seguir. El seguimiento periódico a que son sometidos estos pacientes hace que estas masas se diagnostiquen en estadios precoces y que las terapias de preservación renal (cirugía parcial o técnicas ablativas) puedan tenerse en cuenta como primera opción terapéutica para así preservar la función del injerto y evitar la diálisis. En el momento del diagnóstico es recomendable modificar la pauta inmunosupresora introduciendo everolimusal tratamiento por su doble acción inmunosupresora y antitumoral (antiproliferativa).
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 2. Carcinoma de células renales tipo papilar
Figura 3. Carcinoma de células papilares tipo I
Figura 1. Carcinoma de células renales variante sarcomatoide