La acidosis láctica asociada a metformina es un complicación rara (9/100.000 habitantes/año)1–3, pero grave, y suele ocurrir en presencia de ciertas condiciones que predisponen a ella, todas ellas contraindicaciones absolutas para su uso: la insuficiencia renal aguda, la enfermedad renal crónica severa, la enfermedad hepática, el abuso de alcohol, la insuficiencia cardiaca congestiva, la cardiopatía isquémica, la edad >80 años y los estados de hipoxia tisular acompañados de inestabilidad hemodinámica4. La acidosis láctica se define en presencia de pH<7,35, lactato en sangre >2,0mmol/l y PaCO2<42mmHg.
Se estudiaron 30 pacientes tratados con metformina que acudieron al servicio de urgencias (1 de septiembre de 2016 a 30 de septiembre de 2017) y que presentaban lactacidemia mayor a 2mmol/l. Catorce pacientes precisaron hemodiálisis (HD). Los criterios para realización de hemodiálisis fueron los clínicos y analíticos habituales en el fracaso renal agudo: oligoanuria, sobrecarga hídrica, alteraciones hidroelectrolíticas o ácido-base severas y elevación de productos nitrogenados. No se pudo monitorizar la depuración de metformina debido a que en el laboratorio de nuestro hospital no se miden niveles de la misma.
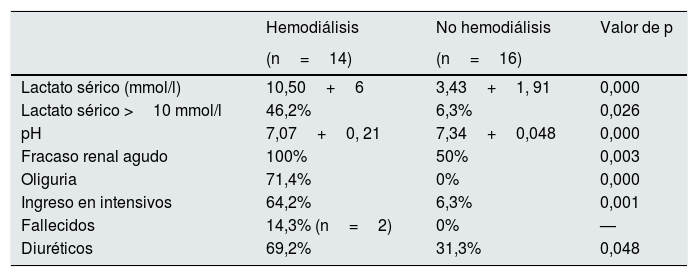
Desde un punto de vista clínico (tabla 1), los pacientes que precisaron HD presentaban una mayor lactacidemia (10,50±6,61 vs. 3,43±1,91 mmol/l; p=0,000), menor pH (7,07±0,21 vs. 7,34±0,048; p=0,000), una mayor frecuencia de fracaso renal agudo (FRA) asociado (100 vs. 50%; p=0,003) y un mayor porcentaje de ingresos en la UMI (64,2 vs. 6,3%; p=0,001).
Diferencias clínicas entre los pacientes que tomaban metformina y presentaban ácido láctico mayor a 2mmol/l en función de la necesidad de hemodiálisis
| Hemodiálisis | No hemodiálisis | Valor de p | |
|---|---|---|---|
| (n=14) | (n=16) | ||
| Lactato sérico (mmol/l) | 10,50+6 | 3,43+1, 91 | 0,000 |
| Lactato sérico >10 mmol/l | 46,2% | 6,3% | 0,026 |
| pH | 7,07+0, 21 | 7,34+0,048 | 0,000 |
| Fracaso renal agudo | 100% | 50% | 0,003 |
| Oliguria | 71,4% | 0% | 0,000 |
| Ingreso en intensivos | 64,2% | 6,3% | 0,001 |
| Fallecidos | 14,3% (n=2) | 0% | — |
| Diuréticos | 69,2% | 31,3% | 0,048 |
Desde un punto de vista terapéutico (tabla 1), los pacientes que precisaron HD tomaban más frecuentemente diuréticos (69,2 vs. 31,3%; p=0,048) no encontrándose diferencias ni respecto al tratamiento con IECA ni con ARA-II ni en cuanto a la dosis de metformina que tomaban.
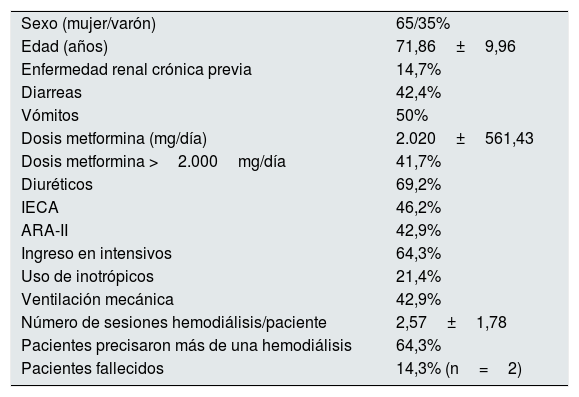
En la tabla 2 se muestran las características del grupo de pacientes que se dializaron.
Características de los pacientes que tomaban metformina y presentaban ácido láctico mayor a 2mmol/l y que precisaron hemodiálisis
| Sexo (mujer/varón) | 65/35% |
| Edad (años) | 71,86±9,96 |
| Enfermedad renal crónica previa | 14,7% |
| Diarreas | 42,4% |
| Vómitos | 50% |
| Dosis metformina (mg/día) | 2.020±561,43 |
| Dosis metformina >2.000mg/día | 41,7% |
| Diuréticos | 69,2% |
| IECA | 46,2% |
| ARA-II | 42,9% |
| Ingreso en intensivos | 64,3% |
| Uso de inotrópicos | 21,4% |
| Ventilación mecánica | 42,9% |
| Número de sesiones hemodiálisis/paciente | 2,57±1,78 |
| Pacientes precisaron más de una hemodiálisis | 64,3% |
| Pacientes fallecidos | 14,3% (n=2) |
ARA-II: antagonista de los receptores de angiotensina II; IECA: inhibidor de la enzima convertidora de angiotensina
Dado que tanto la metformina como los diuréticos de asa se eliminan por secreción tubular activa, se analizó si su interacción farmacológica pudiera tener lugar a este nivel. La secreción activa de metformina se realiza a través de la vía hOCT2 (trasportador humano de cationes orgánicos 2) (basolateral)/hMATE1/2-K (proteína humana extrusora de múltiples fármacos y toxinas 1 y 2-K) (apical)5,6, que es la vía de secreción de los ácidos orgánicos catiónicos. Sin embargo, la secreción tubular activa de los diuréticos del asa tiene lugar a través del hOAT1 y h OAT35 (basolateral)/hMATE 2/4-K (apical) que es la vía de secreción de los ácidos orgánicos aniónicos. Así, en principio y desde un punto de vista teórico no parece que exista interacción entre la metformina y los diuréticos de asa a nivel de la secreción tubular activa de ácidos orgánicos (hOCT o hOAT). Quedaría por determinar si la interacción se pudiera producir a nivel de los transportadores hMATE1 o hMATE2 localizados a nivel apical. De hecho, ha sido descrito que la furosemida aumenta las concentraciones de metformina en plasma y sangre en un 22%, sin que se observe ningún cambio significativo en el aclaramiento renal de la metformina si la función renal es normal.
Así mismo se podría hipotetizar que los diuréticos contribuirían a una mayor hipoperfusión renal en el fracaso renal agudo asociado a la acidosis láctica secundaria a metformina que suele presentarse con vómitos, diarreas e hipotensión, y quizás por ello sean los pacientes que más frecuentemente precisan HD.
En conclusión, los datos presentados sugieren que en los pacientes que precisan diuréticos en su tratamiento, debemos ser cuidadosos con la indicación de la metformina y con la dosis administrada, pues probablemente serán los pacientes que en caso de presentar hiperlactacidemia más probablemente precisarán HD e ingreso en la UMI.