La hipomagnesemia en hemodiálisis (HD) se asocia a mayor riesgo de mortalidad: su relación con el líquido de diálisis (LD).
IntroducciónConcentraciones bajas de magnesio (Mg) en sangre se han relacionado con el desarrollo de diabetes, hipertensión arterial, arritmias, calcificaciones vasculares y con mayor riesgo de muerte, en población general y en hemodiálisis. La composición del LD y su concentración de Mg es uno de los principales determinantes de la magnesemia en los pacientes en HD.
Objetivo: Estudiar las concentraciones de magnesio en los pacientes en HD, su valor predictivo de mortalidad y qué factores se asocian a la hipomagnesemia y mortalidad en HD.
MétodosEstudio retrospectivo de una cohorte de pacientes prevalentes en HD seguidos 2 años. Cada 6 meses se determina el Mg sérico. En el análisis se utiliza el Mg inicial y el medio de cada paciente, comparando los pacientes con Mg por debajo de la media, 2,1mg/dl, con los que están por encima. Durante el seguimiento se han utilizado 3 tipos de LD: tipo 1, magnesio de 0,5 mmol/l y tipo 3, Mg 0,37 mmol/l ambos con acetato y tipo 2, 0,5 mmol/l de Mg con citrato.
ResultadosSe han incluido en el estudio 137 pacientes en hemodiálisis, 72 hombres y 65 mujeres, con una edad media de 67(15) [26-95] años. Cincuenta y siete pacientes eran diabéticos y 70 pacientes estaban en hemodiafiltración en línea (HDF-OL) y 67 en hemodiálisis de alto flujo (HD-HF). El Mg medio de los 93 pacientes con LD tipo 1 era: 2,18(0,37) mg/dl, en 27 con el tipo 3: 2,02 (0,42) mg/dl y los 17 con tipo 2: 1,84 (0,24)mg/dl (p=0,01). El Mg se relaciona de forma directa significativa con el P y con la albúmina. Después de un seguimiento medio de 16,6(8,9)[3-24] meses, 77 seguían activos, 24 habían fallecido y 36 se habían trasplantado o trasladado. Los pacientes con un Mg superior a 2,1mg/dl tienen una supervivencia mayor, p=0,008. La supervivencia de los pacientes con los tres tipos de LD no difería significativamente, Log-Rank, p=0,424. Corregido por la magnesemia, los pacientes con LD con citrato tienen mejor supervivencia, p=0,009. En el análisis de regresión de COX se observa cómo la edad, albúmina sérica, Mg, técnica de diálisis y tipo de LD tienen valor predictivo de mortalidad independiente.
ConclusionesLos magnesios séricos bajos respecto a los altos se asocian a mayor riesgo de mortalidad. El tipo de LD influye en la concentración de Mg y en el riesgo de muerte.
Hypomagnesaemia in haemodialysis (HD) is associated with increased mortality risk: its relationship with dialysis fluid (DF).
IntroductionLow concentrations of magnesium (Mg) in blood have been linked to the development of diabetes, hypertension, arrhythmias, vascular calcifications and an increased risk of death in the general population and in haemodialysis patients. The composition of the dialysis fluid in terms of its magnesium concentration is one of the main determinants of magnesium in haemodialysis patients.
ObjectiveTo study magnesium concentrations in haemodialysis patients, their predictive mortality rate and what factors are associated with hypomagnesaemia and mortality in haemodialysis.
MethodsRetrospective study of a cohort of prevalent haemodialysis patients followed up for two years. Serum magnesium was measured every six months. The analysis used the initial and average magnesium values for each patient, comparing patients with magnesium below the mean (2.1mg/dl) with those with magnesium above the mean. During the follow-up, three types of dialysis fluid were used: type 1, magnesium 0.5 mmol/l; type 3, magnesium 0.37 mmol/l (both with acetate); and type 2, magnesium 0.5 mmol/l with citrate.
ResultsWe included 137 haemodialysis patients in the study, of which 72 were male and 65 were female, with a mean age of 67 (15) [26-95] years old. Of this group, 57 patients were diabetic, 70 were on online haemodiafiltration (OL-HDF) and 67 were on high-flow haemodialysis (HF-HD). The mean magnesium of the 93 patients with dialysis fluid type 1 was 2.18 (0.37) mg/dl. In the 27 patients with dialysis fluid type 3 it was 2.02 (0.42) mg/dl. And in the 17 with dialysis fluid type 2 it was 1.84 (0.24) mg/dl (p=.01). There was a pronounced direct relationship between Mg and P and albumin. After a mean follow-up of 16.6 (8.9) [3-24] months, 77 remained active, 24 had died and 36 had been transplanted or transferred. Patients with magnesium above than 2.1mg/dl had a longer survival (p=.008). The survival of patients with the three types of dialysis fluid did not differ significantly (Log-Rank, p=.424). Corrected for blood magnesium, patients with dialysis fluid with citrate have better survival (p=.009). The COX regression analysis shows how age, serum albumin, magnesium, dialysis technique and type of dialysis fluid have an independent predictive mortality rate.
ConclusionsLow serum magnesium levels have a greater association with an increased risk of mortality compared to high levels. The type of dialysis fluid affects the magnesium concentration and the risk of death.
Concentraciones bajas de magnesio (Mg) en sangre se han relacionado con el desarrollo de diabetes, hipertensión arterial, arritmias cardiacas e incluso con mayor riesgo de muerte, en población general1–8. La ingesta de magnesio está inversamente relacionada con la incidencia del síndrome metabólico9.
El magnesio extracelular correspondería a un 1% del Mg corporal. El 99% estaría intracelular. Los valores normales en suero serían 0,71-1,05 mmol/l (1,7-2,5mg/dl), que se distribuyen: unido a proteínas el 33%, ionizado 62% y asociado a aniones complejos 5%10–12. La magnesemia [Mg] está parcialmente regulada, siendo su reservorio funcional el hueso.
La ingesta de Mg va asociada a la ingesta de los alimentos recomendados en una dieta sana11,12. Un tercio del Mg ingerido se absorbería13. La absorción neta de Mg habitual sería de 100mg al día, que se compensa con una eliminación renal de 100mg/día, después de una reabsorción tubular de 2300mg/día. En la insuficiencia renal el Mg sérico tiende a aumentar por su menor eliminación renal, aunque se produce una disminución de su reabsorción tubular14.
En los pacientes en hemodiálisis (HD), sin una función renal residual significativa, la eliminación de Mg se produce durante las sesiones. Por tanto, su magnesemia va a depender de la ingesta, generalmente disminuida por el tipo de dietas recomendadas11,12 y de la dialisancia de Mg. La dialisancia del Mg depende de la efectividad de la HD, la K y de la concentración de Mg en el LD. Generalmente se suele dializar con una concentración de 0,5 mmol/l (1,2mg/dl), con lo que la magnesemia se suele mantener alrededor de 2,3 y 2,4mg/dl, pero con ese LD fijo existen pacientes con hipomagnesemia e hipermagnesemia. En esta situación también hay que tener en cuenta la toma de medicamentos con Mg en su composición15 o que interfieran con su absorción, como los prazoles12.
En los pacientes en HD las concentraciones séricas de magnesio también se relacionan con la mortalidad16–22. Las arritmias cardiacas son una causa muy prevalente de muerte en pacientes en HD. La hipomagnesemia se asocia a alargamiento del QT y arritmias23. La aparición concomitante de cambios en la kalemia y alcalosis metabólica puede potenciar sus efectos arritmógenos. Las muertes de causa cardiovascular son las más prevalentes entre los pacientes en HD. Las lesiones vasculares y su calcificación se asocian a mayor riesgo de muerte y son más frecuentes en los pacientes en HD. La magnitud de las calcificaciones vasculares en los pacientes en HD se relaciona inversamente con los niveles de magnesio24. Incluso con la suplementación de Mg se ha logrado disminuir el engrosamiento de la pared arterial25.
Para interpretar el significado de la asociación hipomagnesemia y mortalidad es fundamental conocer cuál es la causa de la hipomagnesemia. Una posibilidad es que se asocie a baja ingesta de Mg, malabsorción o en general a desnutrición. Otra posibilidad es que durante la hemodiálisis se produzca un mayor balance negativo de Mg no compensado por la ingesta.
Desde hace años venimos utilizando LD con citrato en lugar de acetato como estabilizante. Para una misma concentración de calcio en el LD, el balance de calcio en la HD es menor con citrato que con acetato26–29. Esto se debe al aumento del calcio asociado a citrato que difunde de la sangre al LD. Con el Mg sucede algo semejante que podría explicar la disminución de la magnesemia con el uso de LD con citrato30.
ObjetivoEstudiar las concentraciones de magnesio en los pacientes en HD y su valor predictivo de mortalidad y qué factores se asocian a hipomagnesemia y mortalidad en hemodiálisis.
1/ Estudiar las concentraciones de magnesio en los pacientes en HD y su valor como predictor de mortalidad.
2/ Analizar si los pacientes con LD con citrato tienen niveles de Mg inferiores a los de acetato.
3/ Estudiar qué factores se asocian a la hipomagnesemia y mortalidad de HD.
Material y métodosDiseñoEstudio retrospectivo, que valora la supervivencia en una cohorte de pacientes prevalentes en HD en 2014 y seguidos durante 2 años, hasta el final de 2016. Se ha estudiado la mortalidad durante el seguimiento en función de parámetros: epidemiológicos y de comorbilidad de los pacientes; de las hemodiálisis, con especial énfasis en el tipo de líquido de diálisis y de laboratorio, con especial énfasis en el Mg.
PacientesCriterios de inclusión: se han incluido los pacientes prevalentes en HD de la Unidad del Hospital Universitario Infanta Leonor durante el año 2014. Pacientes en HD crónica, mayores de 18 años y con consentimiento informado para la utilización de sus datos.
Criterios de exclusión: pacientes con seguimiento menor de 3 meses o con menos de 3 sesiones de HD a la semana por tener función renal residual significativa.
Técnica de hemodiálisisEn la Unidad de HD se utilizan máquinas AK200us® y Artis® (Baxter) y ST5008 (Fresenius, FMC, Bad Homburg, Alemania). Todas la máquinas cuentan con dialisancia iónica (Diascan® u OCM®). Las máquinas están conectadas a la aplicación informática TSS®, volcando automáticamente los datos de cada sesión. El líquido de diálisis es ultrapuro, definido por unos niveles de unidades formadoras de colonias/ml inferiores a 0,1 y niveles de endotoxinas inferiores a 0,03 UE/ml (Guía S.E.N.). Los pacientes se dializan 3 días por semana y un mínimo de 12h semanales, salvo aquellos con una función renal residual significativa. Los dializadores son de alta permeabilidad con membranas sintéticas, con una superficie de entre 1,8 y 2,1 m2. Los pacientes con reacciones adversas a esas membranas se dializan con triacetato de celulosa. Se utiliza el flujo sanguíneo máximo que permite el acceso vascular sin que la presión en línea arterial baje de−220mmHg. Las técnicas de diálisis son: hemodiafiltración on-line (HDF-OL) y HD de alto flujo (HD-HF).
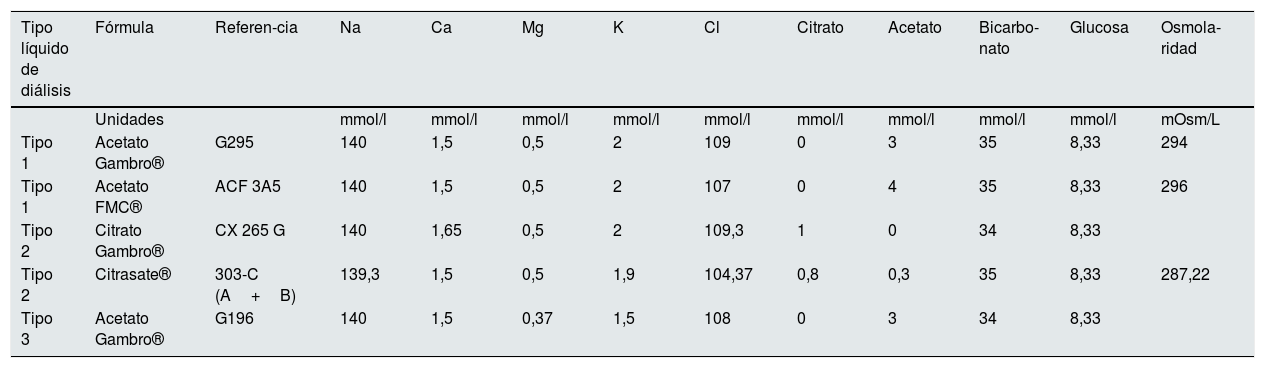
Durante el seguimiento se han utilizado 5 fórmulas de líquido de diálisis (LD), que se han agrupado en tres tipos: tipo 1, magnesio de 0,5 mmol/l y tipo 3, Mg 0,37 mmol/l ambos con acetato y tipo 2, 0,5 mmol/l de Mg con citrato. Su composición completa se especifica en la tabla 1.
Composición de los líquidos de diálisis utilizados
| Tipo líquido de diálisis | Fórmula | Referen-cia | Na | Ca | Mg | K | Cl | Citrato | Acetato | Bicarbo-nato | Glucosa | Osmola-ridad |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Unidades | mmol/l | mmol/l | mmol/l | mmol/l | mmol/l | mmol/l | mmol/l | mmol/l | mmol/l | mOsm/L | ||
| Tipo 1 | Acetato Gambro® | G295 | 140 | 1,5 | 0,5 | 2 | 109 | 0 | 3 | 35 | 8,33 | 294 |
| Tipo 1 | Acetato FMC® | ACF 3A5 | 140 | 1,5 | 0,5 | 2 | 107 | 0 | 4 | 35 | 8,33 | 296 |
| Tipo 2 | Citrato Gambro® | CX 265 G | 140 | 1,65 | 0,5 | 2 | 109,3 | 1 | 0 | 34 | 8,33 | |
| Tipo 2 | Citrasate® | 303-C (A+B) | 139,3 | 1,5 | 0,5 | 1,9 | 104,37 | 0,8 | 0,3 | 35 | 8,33 | 287,22 |
| Tipo 3 | Acetato Gambro® | G196 | 140 | 1,5 | 0,37 | 1,5 | 108 | 0 | 3 | 34 | 8,33 |
Las 5 fórmulas se agrupan en 3 tipos de LD: tipo 1, magnesio de 0,5 mmol/l y tipo 3, Mg 0,37 mmol/l ambos con acetato y tipo 2, 0,5 mmol/l de Mg con citrato.
Ca: calcio; Cl: cloro; Glu: glucosa; K: potasio; Mg: magnesio; Na: sodio.
Se analizaron: edad, sexo, enfermedad de base, comorbilidad, técnica de diálisis. HDF-OL/HD-HF y Kt.
Parámetros bioquímicos: sodio (Na), potasio (K), magnesio (Mg), calcio total (Ca t) e iónico (Ca++), fósforo (P) y hormona paratiroidea (PTH). El pH se determinó por potenciometría, la pCO2 por electrodo de Sveringhaus, la pO2 por amperometría y el Ca++por electrodo selectivo de iones (ISE). Las determinaciones bioquímicas se determinaron con un autoanalizador (ADVIA® 2400 Chemistry System, Bayer). Las determinaciones de PTH se realizaron por quimioluminiscencia, mediante el sistema ADVIA CENTAUR de Bayer.
Cada 6 meses se determina el Mg. Se utiliza el Mg inicial y la media de las determinaciones en cada paciente.
Se recogió la información sobre si el paciente estaba o no en tratamiento con inhibidores de la bomba de protones (IBPP).
EvoluciónLos pacientes han sido seguidos hasta el final de 2016, anotándose si seguían activos, se habían trasplantado, perdido en el seguimiento o fallecido.
EstadísticaLas variables continuas normales se expresan como la media y la desviación típica. La única variable con una distribución no normal ha sido la proteína C reactiva (PCR), Z de Kolmogorov-Smirnov y mediante Log ha sido posible transformarla en normal y así se expresa.
En los análisis estadísticos se ha utilizado la primera concentración sérica de Mg prediálisis determinada en cada paciente a su inclusión en el estudio. También se ha valorado la media de las determinaciones de Mg en cada paciente.
La variable concentración sérica de Mg prediálisis se ha categorizado en baja y alta, utilizando como punto de corte la media de los valores de la población, 2,1mg/dl.
Para comparar las diferencias de las variables analíticas según los tipos de LD se ha utilizado el análisis de varianza, de un paso, después de realizar el test de Levene.
Se han aplicado correlaciones bivariadas, tipo Pearson, después de comprobar que las variables eran normales.
Se han calculado las curvas de supervivencia de Kaplan-Meier y comparado los factores con la prueba de log rank (Mantel-Cox). Para dilucidar la asociación entre los factores y determinar los que influyen en la mortalidad de forma independiente se ha utilizado la regresión de Cox, por pasos (stepwise).
Se ha considerado como significativo una p <0,05. Se ha utilizado como paquete estadístico el SPSS 15.0 (Chicago. Illinois. EE. UU.).
ResultadosSe han incluido en el estudio 137 pacientes en hemodiálisis, 72 hombres y 65 mujeres, con una edad media de 6715 años, entre 26 y 95 años. Respecto a la etiología de la ERC en un 32,8% eran diabéticos; 16,1% glomerulonefritis; 11,7% de causa vascular; 7,3% nefritis tubulointersticiales; 5,8% enfermedad poliquística del adulto; 9,5% otras nefropatías y 16,8% de causa no filiada. En el momento del estudio 57 pacientes eran diabéticos.
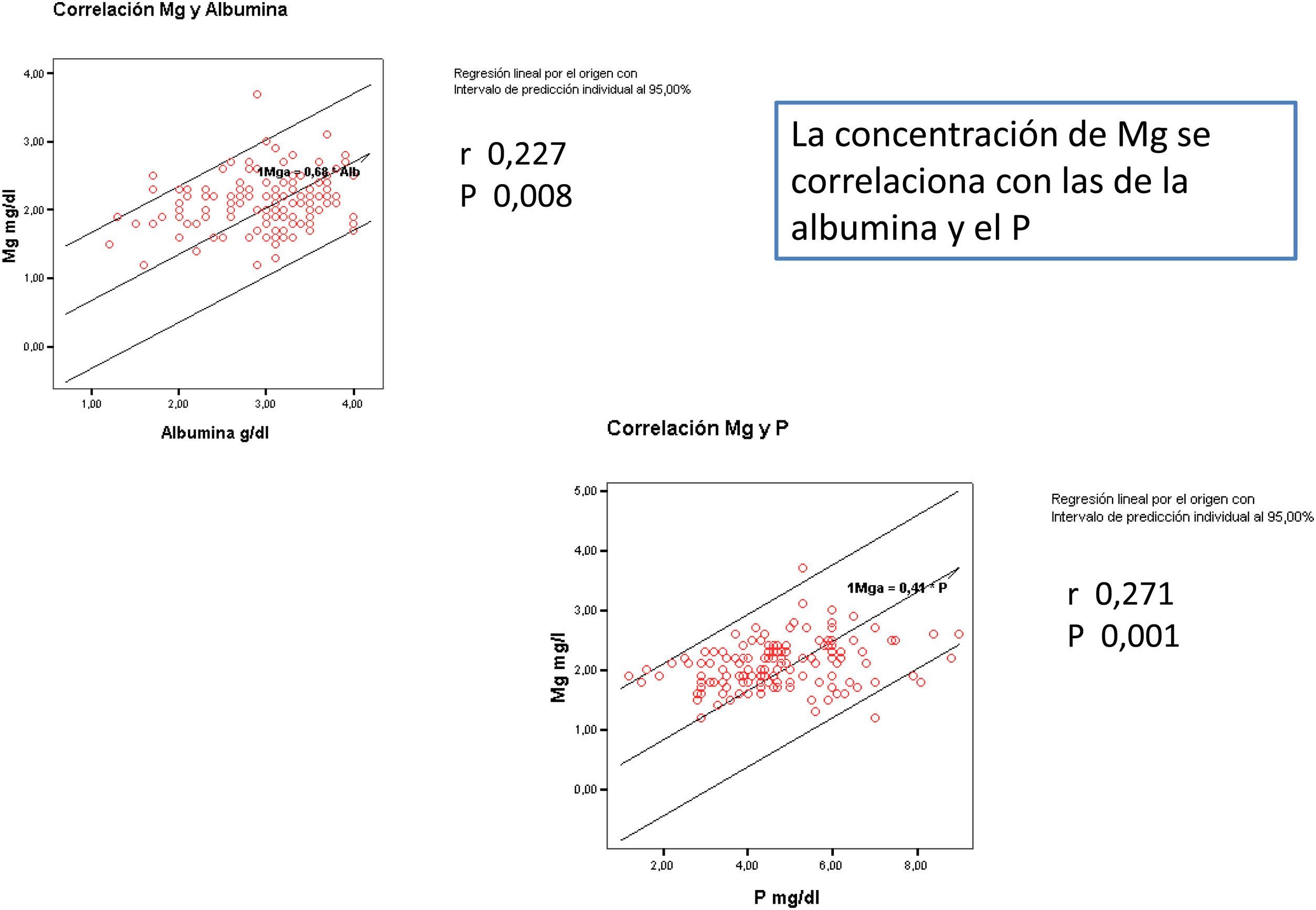
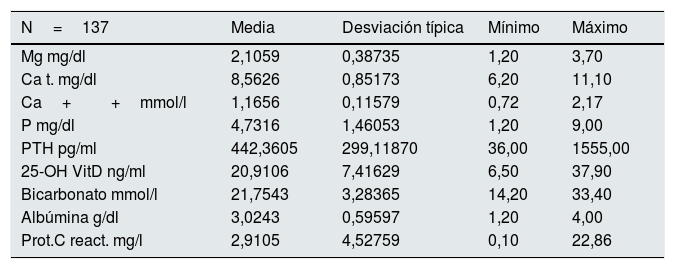
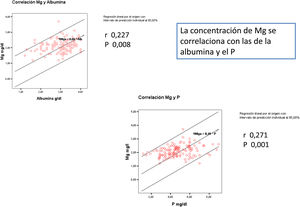
En la tabla 2 se aportan los datos del control analítico basal. La media del Mg inicial de los pacientes era de 2,1 (0,39) mg/dl. El Mg sérico se determinó en 578 ocasiones en los 137 pacientes, entre 1 y 5 veces por paciente durante el seguimiento. La media del Mg medio de cada paciente es 2,07 (0,34), entre 1,2 y 3,75mg/dl. El Mg inicial no difiere significativamente del Mg medio.
Analítica inicial (basal)
| N=137 | Media | Desviación típica | Mínimo | Máximo |
|---|---|---|---|---|
| Mg mg/dl | 2,1059 | 0,38735 | 1,20 | 3,70 |
| Ca t. mg/dl | 8,5626 | 0,85173 | 6,20 | 11,10 |
| Ca++mmol/l | 1,1656 | 0,11579 | 0,72 | 2,17 |
| P mg/dl | 4,7316 | 1,46053 | 1,20 | 9,00 |
| PTH pg/ml | 442,3605 | 299,11870 | 36,00 | 1555,00 |
| 25-OH VitD ng/ml | 20,9106 | 7,41629 | 6,50 | 37,90 |
| Bicarbonato mmol/l | 21,7543 | 3,28365 | 14,20 | 33,40 |
| Albúmina g/dl | 3,0243 | 0,59597 | 1,20 | 4,00 |
| Prot.C react. mg/l | 2,9105 | 4,52759 | 0,10 | 22,86 |
El Mg se relaciona de forma directa significativa con el P y con la albúmina (fig. 1).
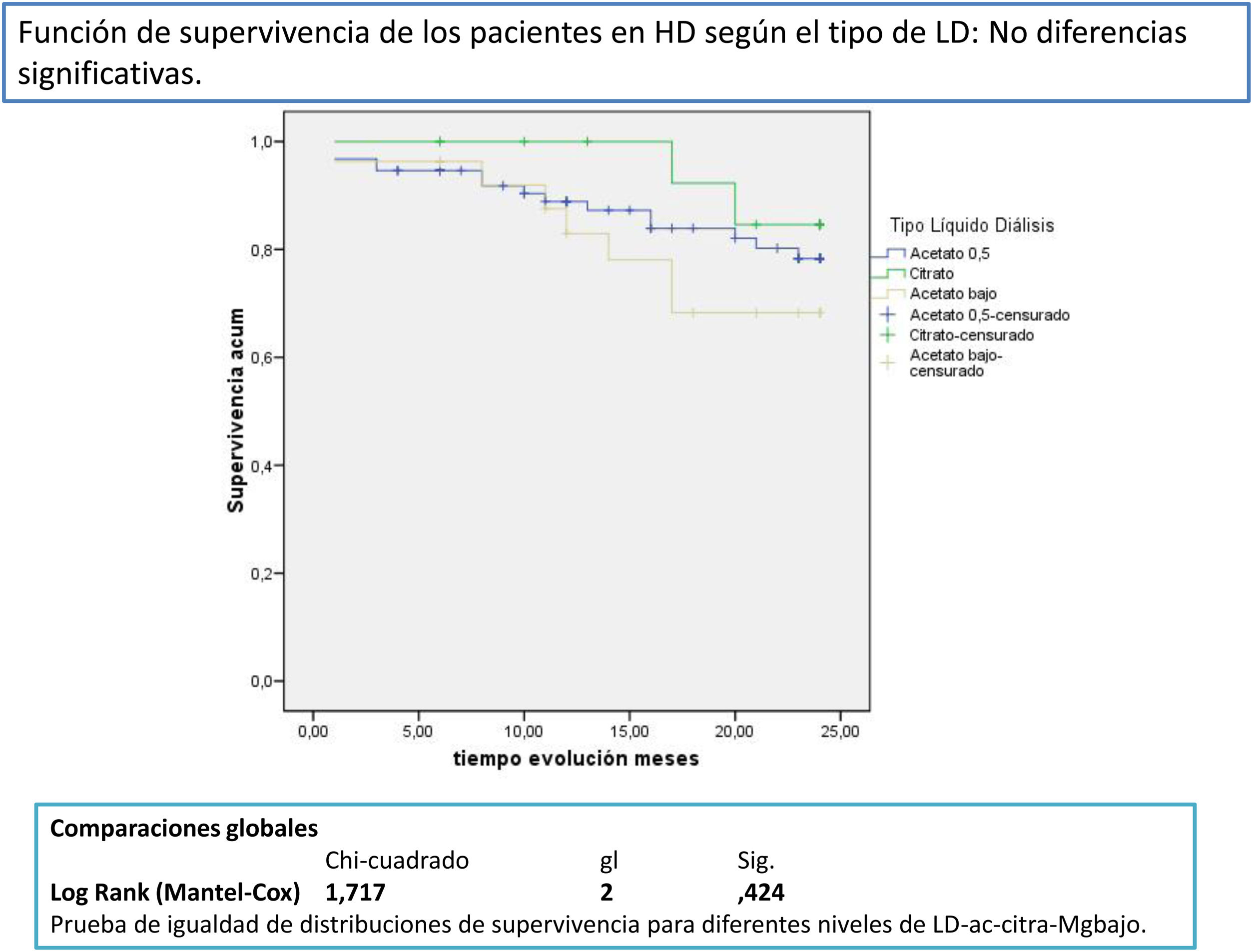
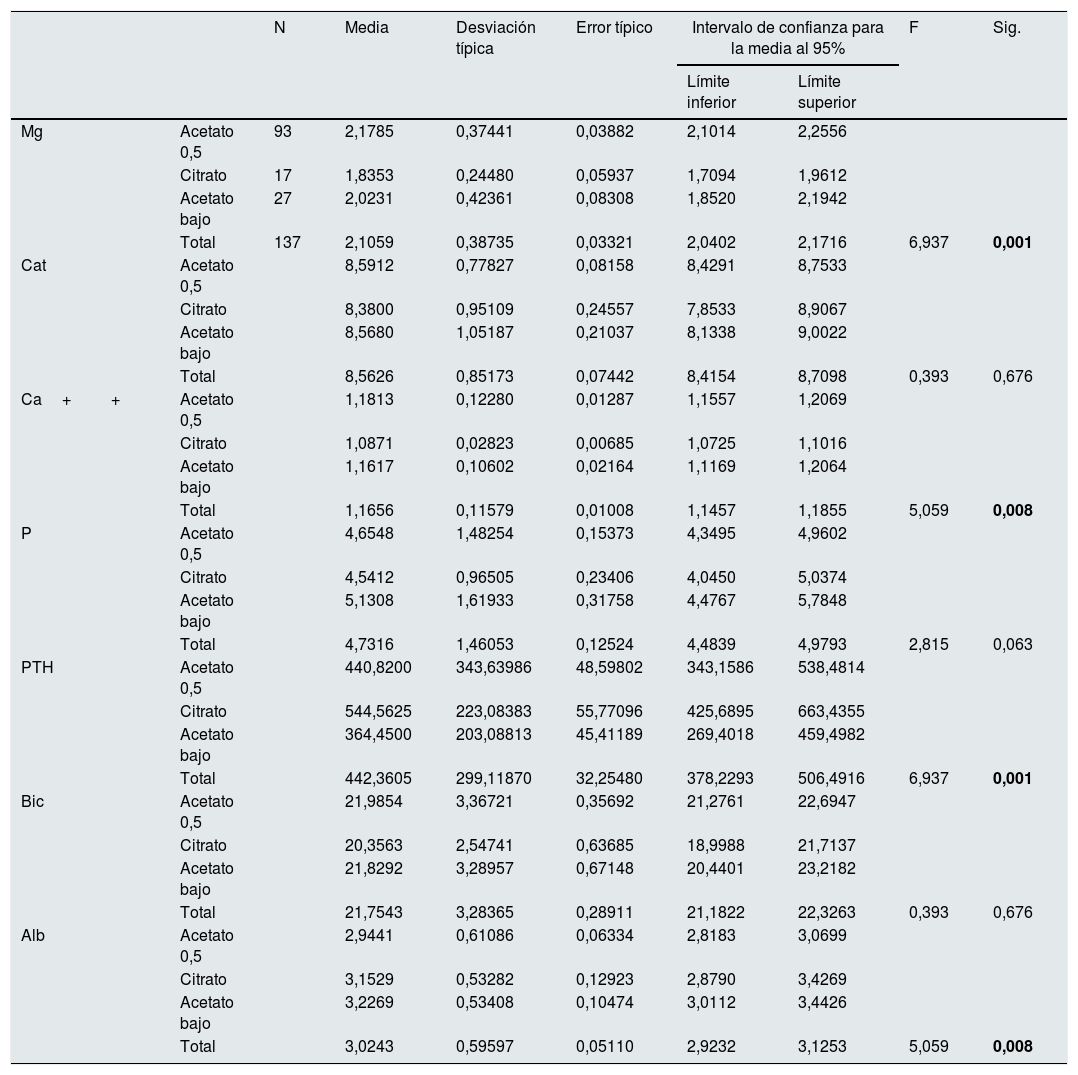
El 67,9% de los pacientes, 93, se dializaron con un LD (tipo 1) con acetato y 0,5 mmol/l de Mg; 17 pacientes, 12,4% con LD con citrato y 0,5 mmol/l de Mg (tipo 2) y 27 pacientes, el 19,7% con acetato y 0,37 mmol/l de Mg (tipo 3). El Mg medio de los 93 pacientes con LD tipo 1 era: 2,18 (0,37) mg/dl, en 27 con el tipo 3: 2,02(0,42) mg/dl y los 17 con tipo 2: 1,84(0,24) mg/dl (p=0,01) (tabla 3).
Analítica prehemodiálisis según el tipo de líquido de diálisis
| N | Media | Desviación típica | Error típico | Intervalo de confianza para la media al 95% | F | Sig. | |||
|---|---|---|---|---|---|---|---|---|---|
| Límite inferior | Límite superior | ||||||||
| Mg | Acetato 0,5 | 93 | 2,1785 | 0,37441 | 0,03882 | 2,1014 | 2,2556 | ||
| Citrato | 17 | 1,8353 | 0,24480 | 0,05937 | 1,7094 | 1,9612 | |||
| Acetato bajo | 27 | 2,0231 | 0,42361 | 0,08308 | 1,8520 | 2,1942 | |||
| Total | 137 | 2,1059 | 0,38735 | 0,03321 | 2,0402 | 2,1716 | 6,937 | 0,001 | |
| Cat | Acetato 0,5 | 8,5912 | 0,77827 | 0,08158 | 8,4291 | 8,7533 | |||
| Citrato | 8,3800 | 0,95109 | 0,24557 | 7,8533 | 8,9067 | ||||
| Acetato bajo | 8,5680 | 1,05187 | 0,21037 | 8,1338 | 9,0022 | ||||
| Total | 8,5626 | 0,85173 | 0,07442 | 8,4154 | 8,7098 | 0,393 | 0,676 | ||
| Ca++ | Acetato 0,5 | 1,1813 | 0,12280 | 0,01287 | 1,1557 | 1,2069 | |||
| Citrato | 1,0871 | 0,02823 | 0,00685 | 1,0725 | 1,1016 | ||||
| Acetato bajo | 1,1617 | 0,10602 | 0,02164 | 1,1169 | 1,2064 | ||||
| Total | 1,1656 | 0,11579 | 0,01008 | 1,1457 | 1,1855 | 5,059 | 0,008 | ||
| P | Acetato 0,5 | 4,6548 | 1,48254 | 0,15373 | 4,3495 | 4,9602 | |||
| Citrato | 4,5412 | 0,96505 | 0,23406 | 4,0450 | 5,0374 | ||||
| Acetato bajo | 5,1308 | 1,61933 | 0,31758 | 4,4767 | 5,7848 | ||||
| Total | 4,7316 | 1,46053 | 0,12524 | 4,4839 | 4,9793 | 2,815 | 0,063 | ||
| PTH | Acetato 0,5 | 440,8200 | 343,63986 | 48,59802 | 343,1586 | 538,4814 | |||
| Citrato | 544,5625 | 223,08383 | 55,77096 | 425,6895 | 663,4355 | ||||
| Acetato bajo | 364,4500 | 203,08813 | 45,41189 | 269,4018 | 459,4982 | ||||
| Total | 442,3605 | 299,11870 | 32,25480 | 378,2293 | 506,4916 | 6,937 | 0,001 | ||
| Bic | Acetato 0,5 | 21,9854 | 3,36721 | 0,35692 | 21,2761 | 22,6947 | |||
| Citrato | 20,3563 | 2,54741 | 0,63685 | 18,9988 | 21,7137 | ||||
| Acetato bajo | 21,8292 | 3,28957 | 0,67148 | 20,4401 | 23,2182 | ||||
| Total | 21,7543 | 3,28365 | 0,28911 | 21,1822 | 22,3263 | 0,393 | 0,676 | ||
| Alb | Acetato 0,5 | 2,9441 | 0,61086 | 0,06334 | 2,8183 | 3,0699 | |||
| Citrato | 3,1529 | 0,53282 | 0,12923 | 2,8790 | 3,4269 | ||||
| Acetato bajo | 3,2269 | 0,53408 | 0,10474 | 3,0112 | 3,4426 | ||||
| Total | 3,0243 | 0,59597 | 0,05110 | 2,9232 | 3,1253 | 5,059 | 0,008 | ||
Las 5 fórmulas se agrupan en 3 tipos de LD: tipo 1 (acetato 0,5), magnesio de 0,5 mmol/l y tipo 3 (acetato bajo), Mg 0,37 mmol/l ambos con acetato y tipo 2 (citrato), 0,5 mmol/l de Mg con citrato.
Albúmina g/dl; Bicarbonato mmol/l; Ca++mmol/l; Ca total mg/dl; Mg mg/dl; P mg/dl; PTH pg/ml.
En negrita, cifras estadísticamente significativas, p<0,05.
Los pacientes en tratamiento con IBP, 102, 74%, tenían un Mg no diferente de los 35 que no lo tomaban.
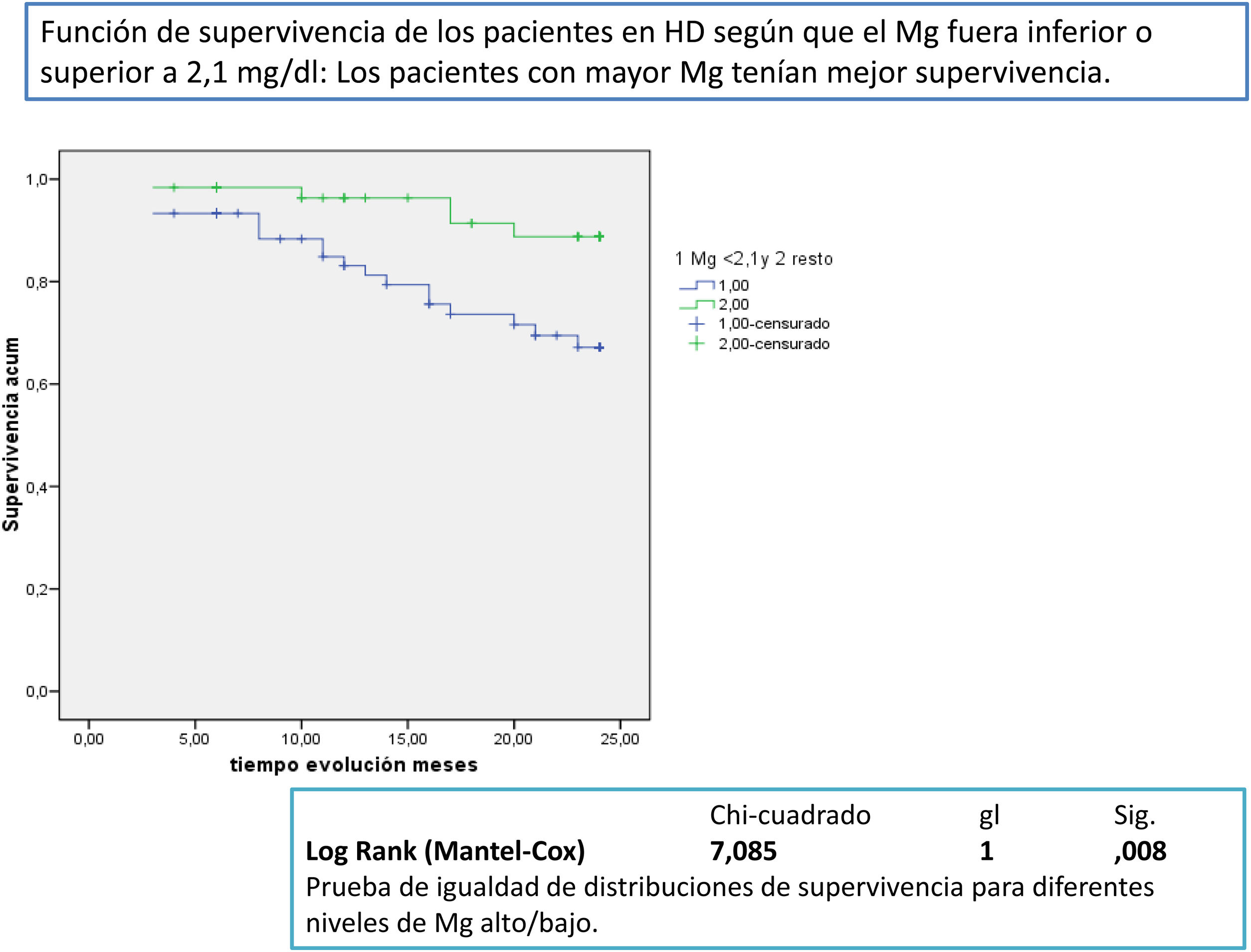
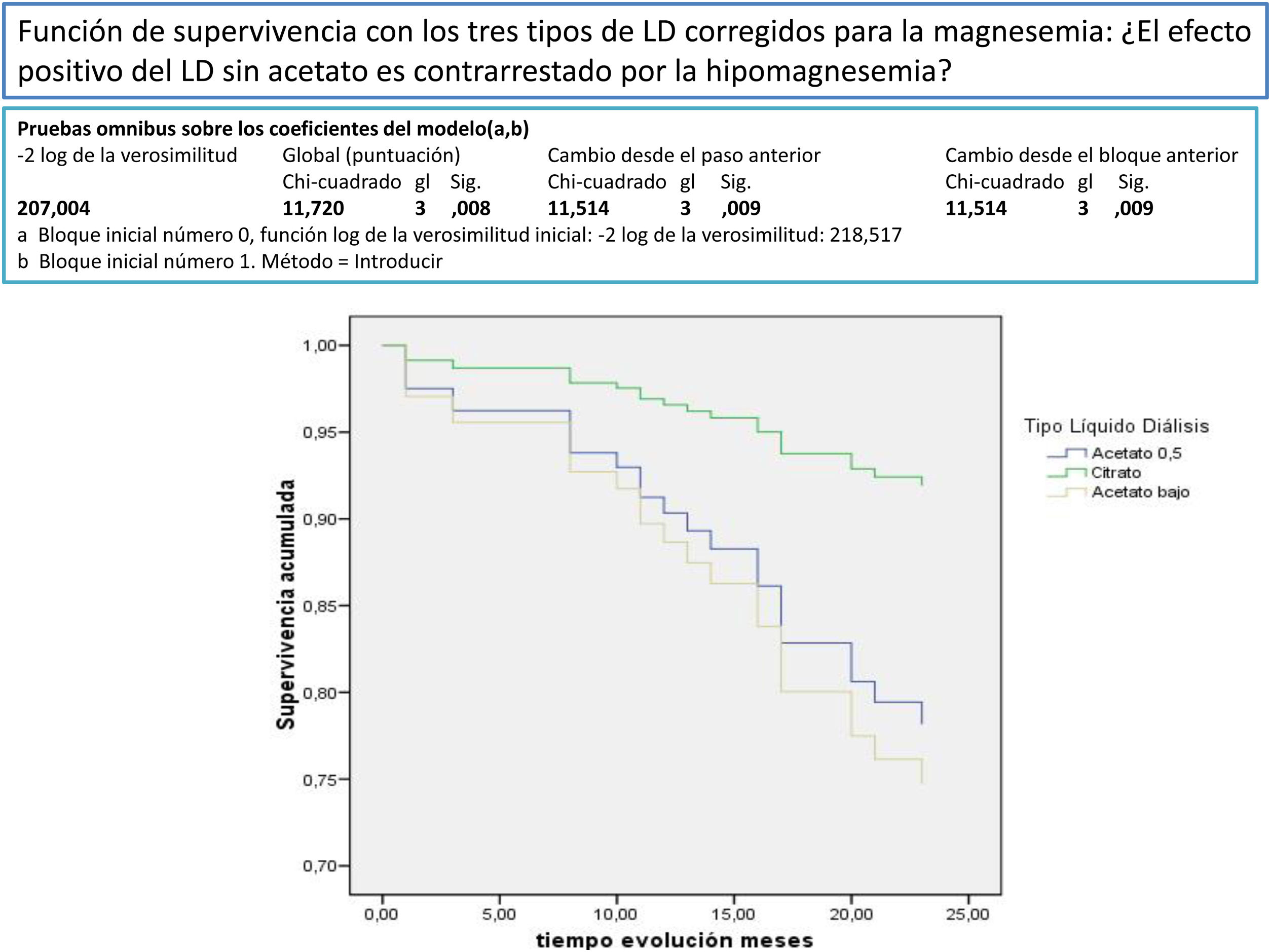
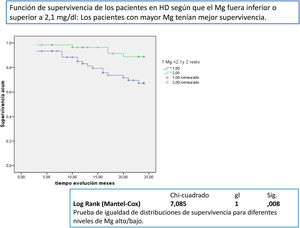
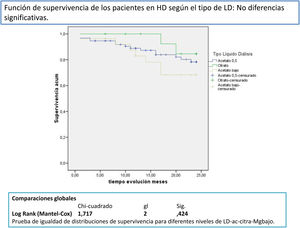
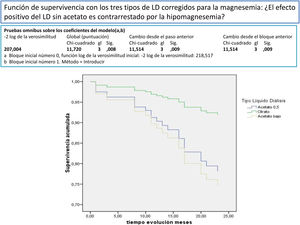
Después de un seguimiento medio de 168,9 [3-24] meses, 77 seguían activos, 24 habían fallecido y 36 se habían trasplantado o se habían trasladado. Los pacientes con un Mg superior a 2,1mg/dl tienen una supervivencia mayor que los de menor Mg (fig. 2). La supervivencia de los pacientes con los tres tipos de LD no difería significativamente, Log-Rank, p=0,424 (fig. 3). Si corregimos por la magnesemia el efecto del tipo de LD sobre la mortalidad, los pacientes con citrato, LD tipo 2, tienen mejor supervivencia que los que se dializan con acetato (fig. 4).
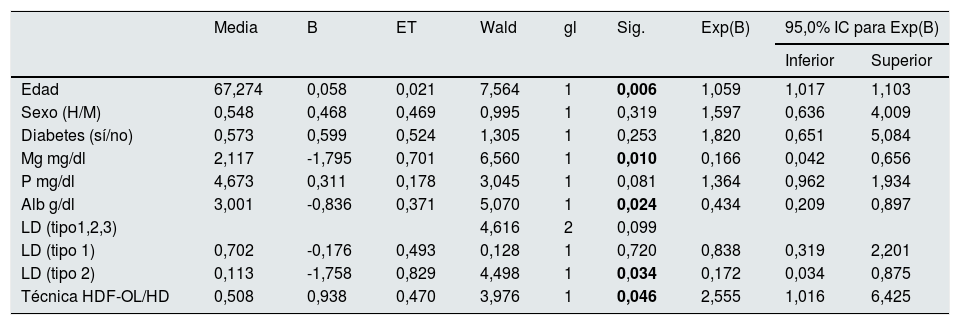
En la tabla 4 se observa cómo la edad, albúmina, Mg, técnica de diálisis y tipo de LD tienen valor predictivo de mortalidad independiente.
Análisis de de supervivencia de COX: puntuación global: gl 9, chi cuadrado 31,098; p=0,00
| Media | B | ET | Wald | gl | Sig. | Exp(B) | 95,0% IC para Exp(B) | ||
|---|---|---|---|---|---|---|---|---|---|
| Inferior | Superior | ||||||||
| Edad | 67,274 | 0,058 | 0,021 | 7,564 | 1 | 0,006 | 1,059 | 1,017 | 1,103 |
| Sexo (H/M) | 0,548 | 0,468 | 0,469 | 0,995 | 1 | 0,319 | 1,597 | 0,636 | 4,009 |
| Diabetes (sí/no) | 0,573 | 0,599 | 0,524 | 1,305 | 1 | 0,253 | 1,820 | 0,651 | 5,084 |
| Mg mg/dl | 2,117 | -1,795 | 0,701 | 6,560 | 1 | 0,010 | 0,166 | 0,042 | 0,656 |
| P mg/dl | 4,673 | 0,311 | 0,178 | 3,045 | 1 | 0,081 | 1,364 | 0,962 | 1,934 |
| Alb g/dl | 3,001 | -0,836 | 0,371 | 5,070 | 1 | 0,024 | 0,434 | 0,209 | 0,897 |
| LD (tipo1,2,3) | 4,616 | 2 | 0,099 | ||||||
| LD (tipo 1) | 0,702 | -0,176 | 0,493 | 0,128 | 1 | 0,720 | 0,838 | 0,319 | 2,201 |
| LD (tipo 2) | 0,113 | -1,758 | 0,829 | 4,498 | 1 | 0,034 | 0,172 | 0,034 | 0,875 |
| Técnica HDF-OL/HD | 0,508 | 0,938 | 0,470 | 3,976 | 1 | 0,046 | 2,555 | 1,016 | 6,425 |
En negrita, cifras estadísticamente significativas, p<0,05.
En este estudio los pacientes en hemodiálisis con concentraciones de magnesio sérico por encima de la media tienen una supervivencia mejor que los que están por debajo. En trabajos anteriores se ha observado un resultado similar16–22. En estos estudios se comparan los pacientes divididos en dos o tres categorías según sus concentraciones de Mg. Los pacientes con mejor pronóstico son los que tienen un Mg alto. En el trabajo de Ishimura et al.16 el punto de corte esta en 2,77mg/dl de Mg. En un trabajo en pacientes no diabéticos el punto de corte 2,5mg/dl, mayor que el 2,1 de nuestro estudio20. En este estudio la concentración media de Mg es más baja que en otros probablemente por utilizar en algunos pacientes LD con Mg bajo o con citrato. A partir de ese momento no se ha vuelto a utilizar Mg bajo y se ha pedido un LD con mayor Mg para algunos pacientes con acetato y para todos los que están con citrato.
La mejor supervivencia de los pacientes con Mg altos en HD se ha asociado con un estado nutricional mejor, con concentraciones de albúmina, triglicéridos, fósforo mayores y menores de PCR19 y con un menor grado de inflamación18,22,31. Yu et al.22 observan que las concentraciones séricas de albúmina, urea, creatinina y ácido úrico eran mayores en los pacientes con hipermagnesemia y la PCR y la lipoproteína A más bajas.
En el trabajo de Mizuiri et al.31 el Mg pierde su valor predictivo de mortalidad independiente al incluir la albúmina, lo que significaría para los autores que su papel se englobaría en el estado nutricional del paciente. En nuestro estudio el Mg mantiene su valor predictivo de mortalidad al mismo tiempo que lo hace la albúmina, sugiriendo algún otro efecto beneficioso a parte del estado de nutrición, como podría ser las calcificaciones vasculares y arritmias cardiacas.
¿Por qué algunos pacientes en HD mantienen un Mg sérico mayor que otros?En algunos de los trabajos anteriores se deduce que un mejor estado nutricional se relaciona con niveles mayores de Mg. La ingesta de Mg va asociada a la de los alimentos recomendados en una dieta sana11,12. La ingesta de Mg estaría actualmente disminuyendo y sería insuficiente para mantener magnesemias que prevengan enfermedades11. La dieta que se suele recomendar a los pacientes con ERC, con o sin HD, se centra en el K, P y proteínas y no en el Mg, siendo su contenido, con frecuencia, bajo en este elemento. Una ingesta adecuada y suficiente contribuirá a niveles mayores de Mg y a un mejor estado nutricional.
En otros estudios la mayor concentración de Mg sérico se debía al tratamiento con OMg19. El tratamiento con captores del P con Mg podría contribuir a mayores niveles de Mg15,32. En otros trabajos la menor concentración de Mg se asocia al tratamiento con fármacos IBPP33–35. En nuestro caso no aparece la asociación Mg-IBPP, probablemente porque se enmascara con las menores concentraciones de Mg inducidas por algunos LD.
En los pacientes en HD la concentración de Mg en el LD y la presencia de acetato o citrato, serían determinantes del Mg sérico como se observa en nuestros datos o al aumentar la concentración de Mg en el LD36.
En los pacientes en diálisis la relación Mg iónico/Mg total está disminuida. Esto es, valores «normales» de magnesio en población general pueden ser indicativo de hipomagnesemia real37. Lo que sería otro argumento más para subir el magnesio del LD. Las alteraciones en el equilibrio ácido-base podrían influir en la fracción libre del magnesio.
Los síntomas por hipermagnesemia aparecen por encima de 1,5 mmol/l (3,6mg/dl); por encima de 2,5 mmol/l aparece arreflexia y por encima de 4,5 mmol/l parada respiratoria o cardiaca. Se deben prevenir y evitar esos niveles, que generalmente aparecen en intoxicaciones agudas por contaminación del LD38 o por la ingesta masiva de la sal de Epson39. En el tratamiento de la eclampsia los límites terapéuticos estarían entre 2,06 y 3,7 mmol/l40.
Efectos del Mg que pueden influir en el pronóstico del paciente en HDAl igual que en la población general, la asociación Mg sérico con mortalidad se ha descrito también en pacientes con enfermedad renal cónica (ERC) no en diálisis41,42. Los niveles séricos bajos de Mg y la baja ingesta de magnesio con la dieta se asociarían a un aumento de la incidencia de ERC y de su progresión a la ERC avanzada42. Esto se podría deber a la asociación del Mg con otros factores de progresión de la ERC y también a efectos directos a través de la disfunción endotelial y las calcificaciones vasculares.
El tratamiento con HD sumaría otros factores:
Se ha descrito una relación entre el número de hipotensiones y la hipomagnesemia43. Las hipotensiones en diálisis son un determinante de morbimortalidad.
Está probado el papel del Mg en modelos de inflamación en animales44. La relación inversa entre la PCR y el Mg sugiere esa relación en pacientes en HD18. La hipomagnesemia sería otro de los factores implicados en el estado inflamatorio crónico de los pacientes en HD.
En modelos animales, como en ratas urémicas, el aumento de la ingesta de Mg reduce la mortalidad, al tiempo que disminuyen las calcificaciones vasculares45. El inicio de la calcificación mediante el complejo Ca-PL-PO4 es dependiente de la proporción Mg/Ca en el tejido calcificante46. El Mg inhibiría la calcificación de las células musculares lisas de los vasos inducidas por la hiperfosfatemia, impidiendo la maduración de las partículas de calciproteína42. El riesgo de mayor mortalidad asociado a la hiperfosfatemia se atenuaría ante concentraciones altas de Mg47. El Mg sérico sería un predictor independiente de la no progresión de las calcificaciones vasculares48. El incremento del Mg en el LD de 1,0 a 2,0 mEq/l disminuye el ritmo de calcificación en pacientes en HD49.
- El Mg es capaz de modular a la PTH pero con una potencia menor que el Ca. La hipermagnesemia se podría asociar a niveles menores de PTH50. Una discreta hipermagnesemia se asociaría a un riesgo menor de fracturas en los pacientes en HD51. El Mg siempre ha sido el gran olvidado de las alteraciones del metabolismo óseo y mineral52.
- -
Los cambios del Mg junto a los del K y Ca se asocian a la prolongación del QT y a la aparición de arritmias cardiacas53,54. Las arritmias cardiacas graves son una importante causa de mortalidad en HD.
- -
Concentraciones altas del Mg sérico se relacionarían con una mejor respuesta a la eritropoyetina (EPO)55. El índice de respuesta a la eritropoyetina es un marcador pronóstico.
- -
La función muscular estaría alterada en pacientes en HD con hipomagnesemia56.
- -
Todos estos efectos del déficit de Mg podrían explicar la relación Mg y mortalidad en los pacientes en HD.
El acetato en el LD, en las concentraciones que se utilizan habitualmente en la práctica clínica, 3-4 mmol/l, aumenta el estrés oxidativo, las citocinas proinflamatorias y la síntesis de óxido nítrico y puede actuar como coadyuvante de los otros estímulos proinflamatorios a los que están sometidos los pacientes urémicos en HD57. La eliminación del acetato en la HD podría mejorar la supervivencia en los pacientes en HD, al menos en los mayores de 70 años58. Los LD con citrato (LDC) no producen esta activación, por lo que podrían ser una alternativa en la clínica. La diálisis con citrato produce de forma aguda menor alcalemia posdiálisis y modifica de forma significativa el Ca, el Mg y la PTH30,59. El LDC tiene un impacto positivo sobre la tolerancia hemodinámica30. El citrato en el LD provoca un balance negativo de Ca y Mg26–29, por lo que podría inducir en algunos pacientes hipomagnesemia30. El efecto beneficioso de la retirada del acetato por el citrato se podría ver contrarrestado por la aparición de hipomagnesemia. En este trabajo los tres tipos de LD no influyen de forma significativa en la mortalidad, pero cuando el LD con citrato se asocia con otras variables y se corrige por la magnesemia se asocia a mejor supervivencia. En el LDC, CX 265 G (tabla 1) se ha aumentado la concentración del Ca a 1,65 mmol/l para contrarrestar el menor balance de Ca con citrato, igual habría que hacer con el Mg, que por lo menos debería aumentarse a 0,75 mmol/l. Esto también sería válido para algunos pacientes con LD con acetato; Schmaderer et al.36 al aumentar el Mg en el LD a 0,75 mmol/l mejoran la mortalidad cardiovascular. La utilización rutinaria de 0,5 mmol/l de Mg en el LD con acetato provocaría en la mayoría de los pacientes una lenta disminución del Mg sérico60.
Limitación de este estudioEl número de pacientes reclutados es bajo por ser un estudio unicéntrico. Este número reducido de pacientes ha dificultado incluir más variables en el modelo de regresión, aunque al estar todos los pacientes tratados con unas pautas iguales reduce el significado de esa limitación.
ConclusionesLas concentraciones de Mg sérico prediálisis por encima de 2,1mg/dl se asocian a menor mortalidad que las concentraciones menores.
Los líquidos de diálisis con Mg 0,37 mmol/l y acetato y con Mg 0,5 mmol/l y citrato se asocian a magnesemias bajas.
Los LD con citrato y Mg 0,5 mmol/l deplecionan al paciente de Mg y de esta forma se contrarresta el posible efecto beneficioso del LD con citrato.
Hipótesis (futuros estudios)Se postula que el contenido de Mg en el LD debería ser> de 0,5 mmol/l en algunos pacientes.
En el LD con citrato el Mg podría ser de 0,75 mmol/l.
Hipótesis 1: una concentración mayor de 0,5 mmol/l de Mg en el LD con citrato podrían mejorar los resultados clínicos con este tipo de estabilizante en HD.
Hipótesis 2: algunos pacientes con Mg bajos se podrían beneficiar de una concentración mayor de 0,5 mmol/l de Mg en el LD con acetato.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.