La gota es una artritis inflamatoria recurrente provocada por el depósito de cristales de urato monosódico en las articulaciones. Entre los factores de riesgo que predisponen a padecer gota se encuentran aquellos no modificables como sexo, edad, raza y genética y los modificables como dieta y estilo de vida. Se ha indicado que la heredabilidad de los niveles de ácido úrico en sangre es superior al 30%, lo que indica que la genética tiene un papel clave en dichos niveles.
La hiperuricemia es a menudo una consecuencia de la reducción de la excreción renal de urato, ya que más del 70% se excreta por el riñón, principalmente, por el túbulo proximal.
Los mecanismos que explican que la hiperuricemia asociada a la reducción de la excreción renal de urato es, en gran medida, una tubulopatía proximal, se han empezado a conocer al saberse la existencia de dos genes que codifican los transportadores URAT1 y GLUT9 que, cuando son portadores de mutaciones de pérdida de función, explican las dos variantes conocidas de hipouricemia tubular renal.
Algunos polimorfismos presentes en esos genes pueden tener un efecto contrario de ganancia de función, con la consecuencia de un incremento en la reabsorción de urato. A la inversa, polimorfismos de pérdida de función en otros genes que codifican trasportadores implicados en la excreción de urato (ABCG2, ABCC4) favorecen la hiperuricemia.
Los métodos de asociación genómica amplia (GWAS) han permitido localizar nuevos locus relacionados con gota asociada a reducción de la excreción renal de urato (NIPAL1, FAM35A).
Gout is recurrent inflammatory arthritis caused by the deposition of monosodium urate crystals in the joints. The risk factors that predispose to suffering from gout include non-modifiable factors such as gender, age, ethnicity and genetics, and modifiable factors such as diet and lifestyle. It has been shown that the heritability of uric acid levels in the blood is greater than 30%, which indicates that genetics play a key role in these levels.
Hyperuricaemia is often a consequence of reduced renal urate excretion since more than 70% is excreted by the kidneys, mainly through the proximal tubule.
The mechanisms that explain that hyperuricaemia associated with reduced renal urate excretion is, to a large extent, a proximal renal tubular disorder, have begun to be understood following the identification of two genes that encode the URAT1 and GLUT9 transporters. When they are carriers of loss-of-function mutations, they explain the two known variants of renal tubular hypouricaemia.
Some polymorphisms in these genes may have an opposite gain-of-function effect, with a consequent increase in urate reabsorption. Conversely, loss-of-function polymorphisms in other genes that encode transporters involved in urate excretion (ABCG2, ABCC4) can lead to hyperuricaemia.
Genome-wide association study (GWAS) methods have made it possible to locate new gout-related loci associated with reduced renal urate excretion (NIPAL1, FAM35A).
«Quien padece gota o mal de junturas es por su merecimiento; porq comen quâto les viene al appetito y no tienê regla è usar de buenos mâjares: y mas quâdo no hacen exercicio (sic)» (Luis Lobera)1
La gota es una enfermedad frecuente que causa episodios agudos de artritis asociados a hiperuricemia persistente y depósito de cristales de urato monosódico en articulaciones, tejidos blandos y riñones. Se trata de una condición conocida desde antiguo. En la época de Hipócrates (siglo V a. C.) se denominaba con el nombre de podagra (de pod[o]: pie y ágrā: caza, cepo, es decir, «cepo que coge el pie»). En cambio, la palabra gota deriva del latín gutta (gutta quam podagram vel artiticam vocant - la gota que es denominada podagra o artritis). Fue utilizada por los médicos en el Medievo para designar la enfermedad «causada por un humor que, aparentemente, fluía gota a gota, especialmente, en las articulaciones del pie». De muchos personajes históricos se sabe que padecieron la enfermedad como, por ejemplo, el rey Carlos I de España (la demostración de la existencia de cristales de acido úrico [AU] en uno de sus dedos meñiques fue realizada por Julián de Zulueta et al. en 2006)2. Luis Lobera la incluyó entre las cuatro enfermedades cortesanas junto al catarro o «rheuma», la calculosis vesical y el «mal francés» o «bubas» (sífilis)1. Thomas Sydenham (1624-1689), el célebre médico inglés afecto de la enfermedad, realizó una proverbial descripción clínica de las crisis agudas3.
Anton van Leeuwenhoek, el conocido comerciante innovador y notable microscopista (1632-1723) fue, al parecer, el primero en describir la apariencia de los cristales que conforman un tofo gotoso, aunque su composición química era desconocida en ese momento: «Observé la materia sólida que a nuestros ojos se asemeja a la tiza, y vi con gran asombro que estaba equivocado en mi opinión, ya que no consistía en nada más que en pequeñas partículas largas y transparentes, muchas puntiagudas en ambos extremos» (1679)4.
La historia científica de la gota comenzó en 1776 cuando el químico sueco Carl Wilhelm Scheele (1742-1786) descubrió el AU como componente de un cálculo renal5. William Hyde Wollaston (1766-1828), físico y químico británico, describió en 1797, en la Real Sociedad de Londres, el material obtenido de un tofo de su propia oreja y expuso que estaba constituido por ácido lítico (de litos, piedra) y un mineral alcalino6. El químico francés Antoine de Fourcroy (1755-1809) lo denominó ácido úrico.
A mediados del siglo XIX, Alfred Baring Garrod (1819-1907) realizó experimentos en los que demostró la existencia de una mayor cantidad de AU en la sangre de los enfermos gotosos y escribió que «the deposited urate of soda may be looked upon as the cause, and not the effect, of the gouty inflammation»7.
Una de las causas secundarias de la gota se conocía desde antiguo. Nos referimos a la gota saturnina que fue delimitada por el médico inglés William Musgrave (1657-1721)7,8. La intoxicación por plomo debió de ser muy frecuente en el pasado9. Este elemento estaba presente en muchos objetos usados por los seres humanos como las tuberías de agua, los recipientes de vino, las ollas de la cocina y las pinturas. Se ha relatado que personajes como Ludwig van Beethoven y Benjamín Franklin pudieron haber sido intoxicados por plomo, así como pintores como Caravaggio, Francisco de Goya y otros10.
Etiología de la hiperuricemiaLa hiperuricemia se puede clasificar en dos subtipos básicos etiológicos, uno por sobrecarga renal (renal overload) y otro por reducción de la excreción renal de AU (renal underexcretion).
La hiperuricemia secundaria a sobreproducción de AU puede ser consecuencia de un aumento del catabolismo de las purinas o de la degradación de ATP. Entre las causas genéticas de exceso de producción de AU se deben mencionar los síndromes de Lesch-Nyhan y de Kelly-Seegmiller, la hiperactividad de la fosforribosilpirofosfato-sintetasa (PRPP-sintetasa) y algunas glucogenosis. El aumento del catabolismo de las purinas ocurre en enfermedades hematológicas y neoplásicas y en la psoriasis extensa, así como ante la destrucción de una gran cantidad de células durante el tratamiento quimioterápico. La competición del AU en la excreción renal de otros ácidos orgánicos explica la hiperuricemia asociada a la cetoacidosis diabética, sobredosis alcohólica11,12 o a estados de ayuno. Entre las causas dietéticas se ha definido el efecto del exceso de ingesta de bebidas endulzadas con fructosa/azúcar13, de lácteos14 y de alimentos ricos en purinas13,15, así como la falta de ejercicio físico16. Entre los fármacos, el uso de diuréticos es una causa frecuente de hiperuricemia17; a través de la depleción de volumen dan lugar a una disminución del filtrado glomerular, a un aumento de la reabsorción tubular y, posiblemente, a una reducción de la secreción tubular. Otros fármacos como el ácido acetilsalicílico en dosis bajas, el ácido nicotínico, el etambutol, la ciclosporina y la pirazinamida18 interfieren en la excreción renal de AU.
Es notorio resaltar que en los últimos años se ha descrito una situación que asemeja una hiperproducción de origen extrarrenal sin serlo; nos referimos a algunos casos en los que existe una disminución en la excreción intestinal de AU19 [por este hallazgo, el tipo clasificatorio anterior de «sobreproducción» de AU fue cambiado por el concepto actual de hiperuricemia por «sobrecarga renal»]. También, es necesario recordar que existen causas de hiperuricemia en las que se combinan los dos mecanismos, como lo que acontece en el caso de algunas neoplasias en las que se conciertan una sobreproducción de purinas a causa del efecto de la lisis tumoral junto a una disminución de la excreción de AU relacionada con la nefrotoxicidad de los qumioterápicos20.
Pero, lo que nos interesa en esta revisión son las causas de la reducción de la excreción renal de AU. Para ello, es necesario revisar los transportadores que intervienen en su manejo tubular.
En este momento, es preciso recordar que a pH sanguíneo fisiológico (7,40), alrededor del 98% del AU se encuentra en forma de urato (forma aniónica) y que cuando el pH urinario es inferior a 5,5, se encuentra en la forma no disociada.
El manejo tubular renal del ácido úrico. Primeros hallazgos. La hipótesis de los cuatro componentesEn 1950, Berliner et al. intentaron hallar una explicación al hecho de que el aclaramiento de AU podía ser mayor que el de creatinina. Para dilucidar este «incomprensible fenómeno», esos autores indujeron hiperuricemia mediante una sobrecarga de carbonato de litio a un grupo de sujetos sanos. Estudiando los aclaramientos de inulina y de urato, llegaron a la conclusión de que el urato es excretado por filtración glomerular y de que existía una reabsorción tubular activa21. Ese mismo año, Praetorius y Kirk describieron un paciente con una marcada hipouricemia en el que el aclaramiento de AU era superior al de creatinina. Esto, les hizo asumir que el riñón de dicho individuo secretaba AU. Fue el primer caso descrito de la tubulopatía denominada más tarde como hipouricemia tubular renal22.
La existencia de una fase de secreción tubular de AU fue propuesta en 1957 cuando Gutman y Yu estudiaron a 300 pacientes con gota y concluyeron que una reducción en la secreción tubular de AU explicaría la reducción que mostraban en la uricosuria23. Cuatro años más tarde, esos mismos autores publicaron su teoría de los tres componentes, a saber, el urato filtrado en el glomérulo se reabsorbería activamente en el túbulo proximal y, a continuación, sería secretado hacia la luz tubular24. A principios de los años 70, Diamond y Paolino, mediante la utilización secuencial en sujetos sanos de diversos uricosúricos señalaron la existencia de una reabsorción de urato que se localizaría en un lugar distal a la secreción (reabsorción postsecretora)25. La hipótesis de los tres componentes se había transformado en la de los cuatro componentes de tal modo que el urato filtrado sería reabsorbido casi en su totalidad en el túbulo proximal permaneciendo en la luz tubular un 0-2% del filtrado. Posteriormente, se produciría una fase de secreción tubular quedando en la luz tubular un 50% de la cantidad del urato inicialmente filtrado. Por último, se volvería a producir una reabsorción tubular en una cifra cuantificada en el 80% del secretado. Así se explicaría que la cantidad de AU excretada en la orina sea, aproximadamente, el 10% de la cantidad del urato filtrado. De este modo, los defectos en el manejo tubular del AU asociados a hipouricemia podrían ser causados por defectos tanto en la reabsorción presecretora como en la postsecretora aislados o combinados, o bien, por un incremento en su secreción tubular. Los conocimientos sobre el metabolismo del AU no cambiaron hasta que llegaron los nuevos avances que fueron consecuencia de la aplicación de las técnicas de biología molecular. Gracias a ellas, se han identificado varios transportadores que han demostrado la complejidad del manejo del ion urato en el túbulo proximal. No obstante, en la actualidad, no se ha logrado encajar y relacionar aún la actividad de esos transportadores con la hipótesis de los cuatro componentes.
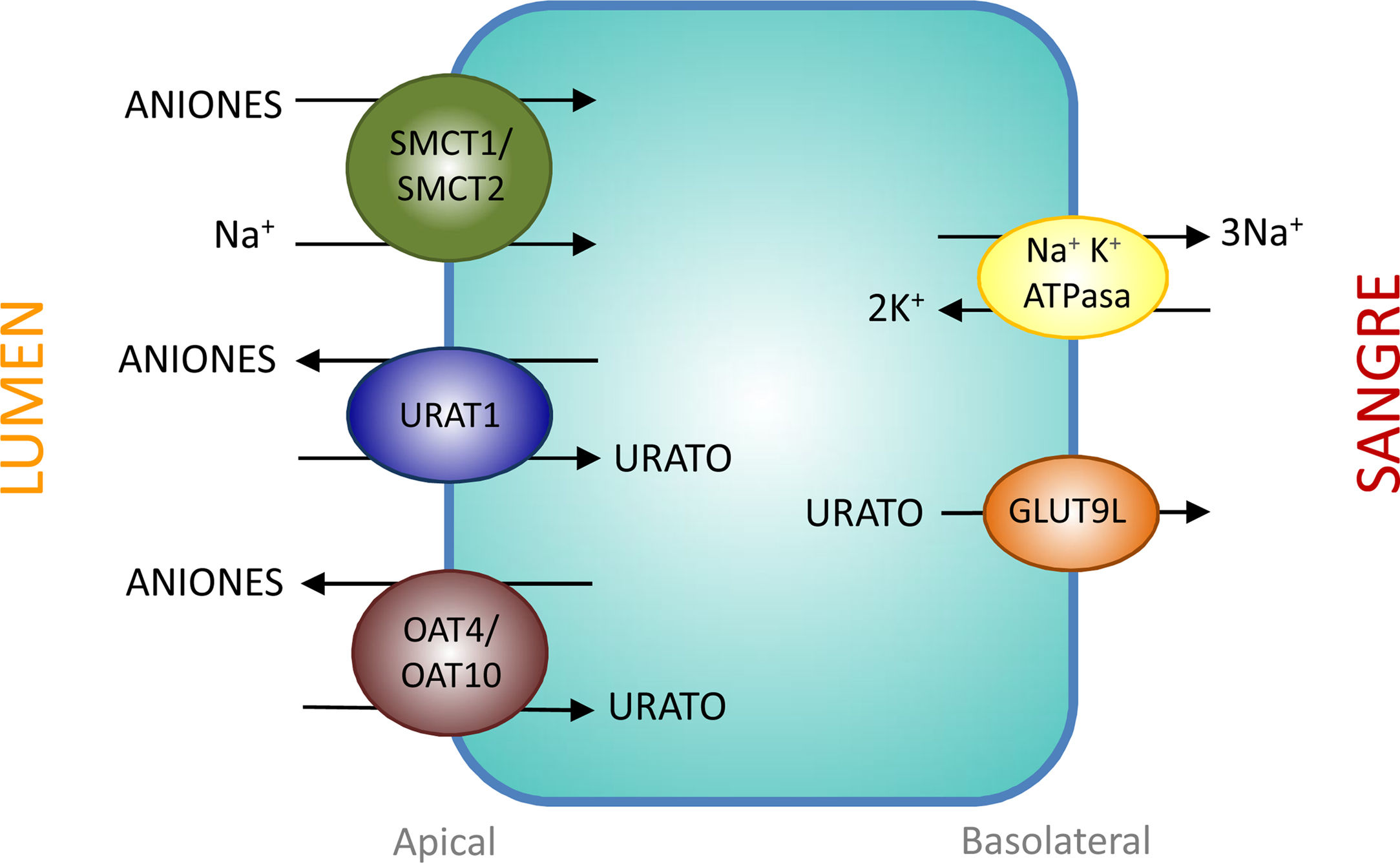
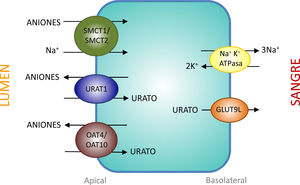
Transportadores tubulares proximales que intervienen en la reabsorción de uratoEl intercambiador urato-anión URAT1 (urate-anion transporter 1) que reabsorbe el urato filtrado, fue identificado por Enomoto et al. en 200226. Está localizado en la membrana apical de las células del túbulo proximal y es codificado por el gen SLC22A12 ubicado en el cromosoma 11q13. URAT1 pertenece a la familia de transportadores de aniones orgánicos (organic anion transporter [OAT]). En el riñón humano, el urato es transportado por medio del URAT1 a través de la membrana apical de las células tubulares proximales que se intercambia con aniones que son transportados hacia la luz tubular para mantener un balance eléctrico adecuado (fig. 1).
Reabsorción de urato en las células epiteliales del túbulo proximal. La reabsorción de urato en la membrana apical de las células del túbulo proximal se realiza mediante los transportadores URAT1, OAT4 y OAT10. Su acción es favorecida por un aumento en la concentración intracelular de aniones orgánicos debida a la acción de los transportadores SMCT1 y SMCT2. En la membrana basolateral, GLUT9L transporta el urato fuera de la célula hacia la sangre.
La evidencia de que URAT1 tiene un papel importante en el manejo renal del urato proviene de la identificación de mutaciones inactivantes de URAT1 en pacientes con hipouricemia tubular renal tipo 126–28. Estos pacientes se caracterizan por mostrar niveles reducidos de AU (entre 0,5 y 1,5mg/dl), una excreción fraccional elevada (entre 20 y 90ml/100ml FGR) y una respuesta atenuada de la uricosuria al probenecid y la pirazinamida27. También, tanto losartán como benzbromarona ejercen su acción uricosúrica inhibiendo la acción de URAT1.
En realidad, la reabsorción tubular del urato filtrado en el túbulo proximal es más compleja, al estar involucrada una interacción de dos modelos de transporte. En el intercambio urato-anión, además de URAT1, participan los intercambiadores de aniones orgánicos OAT4 y OAT10 que están codificados, respectivamente, por los genes SLC22A11 y SLC22A1329 (fig. 1). Además, en las células de los túbulos proximales se realiza la reabsorción de urato y aniones monocarboxilato, como lactato, mediante un cotransporte dependiente de Na+. Este proceso está mediado por los cotransportadores de monocarboxilatos acoplados a Na+, SMCT1 y SMCT2 codificados, respectivamente, por los genes SLC5A8 y SLC5A1230 (fig. 1).
La salida del AU hacia el espacio peritubular se realiza mediante un transportador basolateral. En 2003, Jutabha et al. identificaron un nuevo transportador de aniones sensible a voltaje, (voltage-driven organic anion transporter 1), que facilita la salida de urato de la célula31. Es codificado por el gen SLC2A932. Posteriormente, fue denominado GLUT9 (fig. 1), al conocerse que pertenece a la clase II de la familia GLUT (glucose transporters) de transportadores de hexosas (fructosa, glucosa)32. Los estudios de expresión en ovocitos de Xenopus han demostrado que GLUT9 intercambia urato por glucosa y fructosa33. Se ha demostrado que el transporte de urato mediado por GLUT9 depende de voltaje lo que supone una característica adecuada para la salida de urato de la célula32. Se han descrito dos isoformas GLUT9 diferentes. En los riñones humanos, GLUT9L (540 aminoácidos) se localiza en la membrana basolateral de las células del túbulo proximal mientras que la isoforma corta GLUT9S (511 aminoácidos) se ubica en la membrana apical de los ductos colectores34.
Mutaciones en el gen SLC2A9 son causantes de la hipouricemia tubular renal tipo 228,35,36. GLUT9 es responsable de una gran parte de la reabsorción de urato, de tal modo que la pérdida completa de su función conduce a una excreción masiva que es mayor que la observada en la hipouricemia tubular renal tipo 1, por lo que los pacientes muestran niveles más reducidos de AU (menores de 0,5mg/dl) y unos valores de excreción fraccional superiores a 150ml/100ml FGR36. Los portadores heterocigotos tienen niveles de AU moderadamente reducidos36.
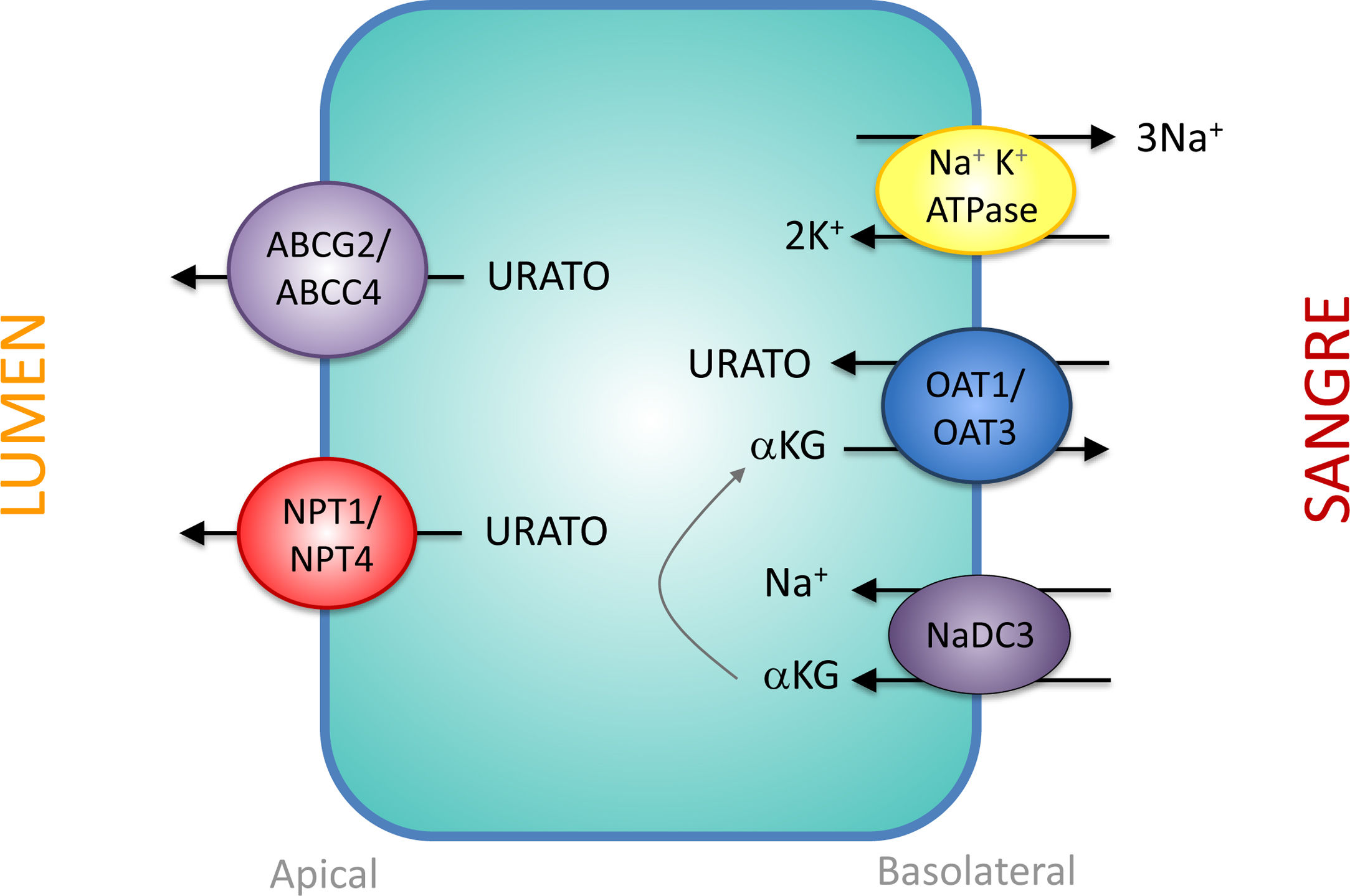
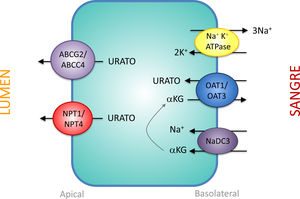
Transportadores tubulares proximales que intervienen en la secreción de uratoLos mecanismos que intervienen en la secreción de urato por parte del túbulo proximal son una imagen especular de los que participan en su reabsorción. En la región basolateral, los transportadores de urato OAT1 y OAT3 trasladan el urato hacia el interior de la célula en intercambio con α-cetoglutarato. El gradiente de α-cetoglutarato es proporcionado por el cotransportador de Na+, NaDC3, codificado por el gen SLC13A3 (fig. 2). La salida de urato hacia la luz en la región apical es realizado por los transportadores estimulados por ATP, ABCC4 (ATP Binding Cassette Subfamily C Member 4; miembro 4 de la subfamilia C del casete de unión a ATP, codificado por el gen ABCC4) y ABCG2 (ATP Binding Cassette Subfamily G Member 2; miembro 2 de la subfamilia G del casete de unión a ATP, codificado por el gen ABCG2) y los transportadores apicales de urato electrogénicos NPT1 y NPT4 que están codificados, respectivamente, por los genes SLC17A1 y SLC17A3 (fig. 2)30. Es notorio resaltar que se ha comunicado que el polimorfismo rs1165196 del gen del cotransportador de fosfato tipo 1 dependiente de sodio (NPT1) más arriba mencionado, disminuye significativamente el riesgo de gota al aumentar la exportación de urato hacia la luz tubular37.
Genética y gota. Polimorfismos favorecedores de hiperuricemia en los genes que codifican los transportadores URAT1, GLUT9, ABCG2 y ABCC4En 1992, Emmerson et al. intentaron demostrar la existencia de una predisposición genética a padecer gota por medio del estudio del aclaramiento renal de urato en 37 pares de gemelos normouricémicos. Los autores observaron que los gemelos monocigóticos tenían valores más similares de eliminación de urato que los dicigóticos38. Calcularon que la heredabilidad del aclaramiento renal de urato era del 60%, mientras que la heredabilidad de la excreción fraccional era del 87%.
Se ha demostrado que diferentes polimorfismos en SLC22A12 pueden tener efecto sobre la excreción renal de urato a través de un incremento de la función de URAT1, por lo que se han asociado a hiperuricemia y disminución de su excreción fraccional con el correspondiente riesgo de gota39,40. En un estudio realizado en una cohorte constituida por 69 pacientes con gota se hallaron seis mutaciones diferentes en el gen SLC22A12 en 16 de los casos (23%)41.
Los métodos de asociación genómica amplia (genome-wide association) han descubierto variantes genéticas comunes de SLC2A9 asociadas con niveles elevados de urato sérico y gota en cohortes de población humana relacionados con un incremento de la actividad funcional de GLUT942. Ciertos alelos de SLC2A9 se han relacionado con la gota tofácea43. Este hecho es remarcable porque SLC2A9 se expresa en los condrocitos44, lo que podría estar relacionado con que algunos pacientes desarrollen tofos y otros no43.
La capacidad secretora de ABCG2 se confirmó al demostrarse que la variante rs2231142 de ABCG2, que da lugar al cambio de glutamina por lisina en el codón 141, favorece una reducción del 53% de la tasa de transporte de urato45. Woodward et al. han estimado que, al menos, el 10% de todos los casos de gota en caucásicos son atribuibles a la variante rs223114245; estudios poblacionales han confirmado un vínculo con los niveles de AU y la presencia de gota, aunque la asociación es más fuerte en hombres que en mujeres45. Es probable que ABCG2 tenga un papel importante en la gravedad de la gota. Así, un estudio reciente encontró que una variante de ABCG2 se asocia con un aumento del 50% en la frecuencia de gota tofácea en comparación con los casos de la enfermedad que cursan sin producción de tofos46. En 2012, Ichida et al. describieron que ABCG2 se expresa en tejidos extrarrenales. Así, los ratones knockout Abcg2 muestran una reducción de la excreción intestinal de urato19. Ichida et al. han indicado que los pacientes con mutaciones en el gen ABCG2 serían portadores de un tipo «combinado» de hiperuricemia en el que existiría un incremento en la excreción urinaria de AU (más de 600mg/día/1,73 m2) junto con una excreción fraccional de AU menor de 5,5ml/100ml FGR19, lo que es difícil de entender desde el punto de vista nefrológico, salvo que exista una hiperfiltración glomerular asociada. Asimismo, se ha demostrado en población maorí y del Pacífico de Nueva Zelanda que la variante rs4148500 de ABCC4 se asocia significativamente con hiperuricemia y gota47.
Otros genes relacionados con la gota causada por reducción de la excreción renal de ácido úricoLos métodos de asociación genómica amplia (GWAS) han permitido localizar nuevos locus relacionados con la gota asociada a reducción de la excreción renal de AU, como Nipa-Like domain containing 1 (NIPAL1)48 y Family with sequence similarity 35, member A (FAM35A)48,49. NIPAL1 codifica un transportador de magnesio; el análisis funcional no ha detectado que intervenga en el transporte de urato, lo que sugiere una asociación indirecta con su manejo renal. FAM35A codifica una proteína que desempeña un papel importante en la reparación de roturas de ADN de doble cadena. Los análisis de localización en el riñón humano han revelado que NIPAL1 y FAM35A se expresan fundamentalmente en los túbulos distales, lo que sugiere la participación de la nefrona distal en el manejo renal del urato48. En este punto, es conveniente recordar la nefropatía tubulointersticial autosómica dominante (en el pasado, conocida como nefropatía hiperuricemica familiar juvenil) que está causada por mutaciones en el gen UMOD que codifica la proteína uromodulina o de Tamm-Horsfall. Pues bien, esta proteína se produce en las células epiteliales de la rama ascendente del asa de Henle. ¿La ausencia de uromodulina en esa nefropatía repercute modificando el transporte de urato por GLUT950 o interviene en la función de esos «nuevos» transportadores distales?
EpílogoLa progresión a la gota clínicamente evidente transcurre desde la presencia de hiperuricemia hasta el depósito de cristales de urato monosódico en varios tejidos con una sintomatología relacionada con la respuesta inmune innata a esos cristales y la expresión de diversos genes que codifican proteínas que influyen en la activación del NLRP3 inflamasoma.
Muchos genes intervienen en el manejo renal e intestinal y en la producción del AU que están interrelacionados con ciertos factores como edad, sexo y etnia y otros modificables como dieta y estilo de vida.
La complejidad del manejo corporal del AU implica que no se trata de un producto de «desecho» sino de una sustancia cuyos niveles deben ser exquisitamente custodiados por su papel protector como potente antioxidante, aunque un fallo en el sistema puede contribuir al desarrollo de gota, daño renal e hipertensión arterial. En este sentido, en el título de este trabajo se menciona que la gota asociada a reducción de la excreción renal de AU es una tubulopatía que no tratamos los nefrólogos. Ciertamente, es una verdad a medias, porque los pacientes aparecen en la consulta del nefrólogo cuando desarrollan enfermedad renal crónica.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.