El desarrollo de un fracaso renal agudo (FRA) condiciona complicaciones a corto, medio y largo plazo. El objetivo de nuestro estudio fue analizar el impacto de las alteraciones cardiacas en el pronóstico cardiovascular de pacientes que presentan un episodio de FRA.
Materiales y métodosRealizamos un estudio observacional de cohortes retrospectivo incluyendo a todos los pacientes con FRA en 2013 y 2014. Basalmente recogimos variables epidemiológicas, comorbilidades y parámetros ecocardiográficos. Seguimos a los pacientes tras el ingreso durante una media de 49 ± 28 meses, recogiendo la incidencia de eventos cardiovasculares (ECV) y los factores asociados a los mismos.
ResultadosSe incluyeron 1.255 pacientes (55% varones, edad 75 ± 13 años). De los 676 (54%) pacientes que disponían de un ecocardiograma previo, el 46% tenían hipertrofia de ventrículo izquierdo, el 38% hipertensión pulmonar, el 38% disfunción diastólica y el 22% disfunción sistólica. Tras la hospitalización por FRA, 484 (39%) tuvieron un ECV. Los factores asociados a presentar un ECV fueron el sexo (varón), la edad, diabetes mellitus, hipertensión arterial, dislipidemia, cardiopatía isquémica, insuficiencia cardiaca, fibrilación auricular, neoplasia previa y enfermedad renal crónica (y el filtrado glomerular estimado basal y tras el FRA). El análisis de supervivencia demostró que todos los parámetros ecocardiográficos se asociaban a ECV. Un modelo de regresión de Cox ajustado demostró que la edad (HR 1,017), la diabetes mellitus (HR 1,576) y la disfunción diastólica (HR 1,358) eran predictores independientes de ECV.
ConclusionesLa disfunción diastólica es un predictor independiente de ECV a largo plazo tras un episodio hospitalario de FRA.
Acute kidney injury (AKI) conditions several short- and long-term complications. The aim of the present study was to analyse the impact of cardiac function and structure in the cardiovascular prognosis after an in-hospital AKI episode.
Materials and methods This is an observational retrospective cohorts study including all in-hospital AKI episoes in 2013 and 2014 in our centre. At baseline, epidemiological values, comorbidities and echocardiography parameters were collected. During a follow-up of 49 ± 28 months, cardiovascular events (CVEs) were collected, and associated factors were analysed.
Results1255 patients were included (55% male, age 75 ± 13 years). Of the 676 (54%) that had a previous echocardiogram, 46% had left ventricular hypertrophy, 38% pulmonary hypertension, 38% diastolic dysfunction and 22% systolic dysfunction. During the follow-up, 484 (39%) developed a CVE. Associated factors to CVE were male sex, age, diabetes mellitus, hypertension, dyslipidemia, coronary heart disease, heart failure, atrial fibrillation, neoplasia and chronic kidney disease (also, glomerular filtration rate at baseline and after the AKI episode). Survival curves demonstrated that all the echocardiographic parameters were associated to CVE. An adjusted Cox regression model showed that age (HR 1.017), diabetes (HR 1.576) and diastolic dysfunction (HR 1.358) were independent predictors for CVE.
ConclusionDiastolic dysfunction is an independent predictor for long-term CVEs after an in-hospital AKI episode.
El desarrollo de un fracaso renal agudo (FRA) es una complicación frecuente en pacientes hospitalizados que condiciona una alta morbimortalidad1,2. Más allá del impacto sobre el pronóstico inmediato del deterioro de función renal, su importancia trasciende a medio y largo plazo con complicaciones tales como eventos cardiovasculares (ECV), desarrollo de enfermedad renal crónica (ERC) y mortalidad3,4. Además, considerando el FRA como un síndrome complejo, se han demostrado otras complicaciones como las infecciones, alteraciones neurológicas y cognitivas5.
La asociación entre la disfunción renal y cardiaca se engloba bajo el término de síndrome cardiorrenal6. Tanto en la lesión renal aguda como en la ERC, existe una mayor incidencia de ECV lo que obedece a numerosos factores que se relacionan de manera intrincada y que incluyen la activación de mecanismos neurohumorales (como el sistema renina-angiotensina-aldosterona [SRAA], el sistema nervioso simpático y la secreción de vasopresina) capaces de generar cambios estructurales y funcionales a nivel cardiaco7,8. Además, determinados factores tales como la hipertensión arterial, la sobrecarga hídrica, los trastornos del equilibrio ácido-base y del metabolismo mineral, la inflamación o las toxinas urémicas coexisten en ambas patologías, potenciando los efectos deletéreos sobre los sistemas renal y cardiaco9–11. Esto condiciona que numerosos pacientes con disfunción renal presenten alteraciones estructurales y funcionales cardiacas que ensombrecen su pronóstico y cuya detección precoz permitiría estratificar su riesgo12,13.
En el campo del FRA, la utilidad de los parámetros ecocardiográficos y su impacto pronóstico han sido menos estudiados. Por dicho motivo, presentamos un estudio cuyo objetivo es determinar la asociación entre la ecoestructura y la función cardiaca y la incidencia de eventos cardiovasculares en pacientes que desarrollan un FRA.
Pacientes y métodosDiseñamos un estudio observacional de cohorte retrospectivo unicéntrico, que incluyó a todos los pacientes que ingresaron con el diagnóstico de FRA en los años 2013 y 2014 con el objetivo de analizar los ECV tras la hospitalización y su relación con la ecoestructura y la función cardiaca. Se excluyó a los pacientes que presentaban errores en la codificación del FRA, aquellos sin datos de función renal previa al ingreso o los portadores de un trasplante renal. Asimismo, se excluyó del análisis final a aquellos que fallecieron durante el ingreso, los que requirieron terapia renal sustitutiva al alta o a los que se les perdió el seguimiento.
En el momento basal y, haciendo uso de la historia clínica electrónica, recogimos datos epidemiológicos (sexo, edad), así como comorbilidades (hipertensión arterial, diabetes mellitus, dislipemia, cardiopatía isquémica, insuficiencia cardiaca, fibrilación auricular, enfermedad vascular periférica, ictus y neoplasia previa). Se estableció la presencia de deterioro cognitivo y se calculó el índice de dependencia funcional mediante una escala de Barthel modificada (sobre un total de 40 puntos, siendo mayor la puntuación a mayor independencia)14. En cuanto a la función renal, se recogió la presencia de ERC y el filtrado glomerular estimado (FGe) (por Chronic Kidney Disease Epidemiology Collaboration [CKD-EPI]) basal, el mínimo durante el episodio de FRA y el final (que se estableció a los siete días del máximo deterioro de función renal)15. Se determinó la gravedad del episodio del FRA de acuerdo con la escala Acute Kidney Injury Network (AKIN)16. Dicha escala utiliza un criterio analítico basado en la creatinina sérica y el flujo urinario para definir el estadio, de manera que a mayor estadio, mayor gravedad:
Estadio 1: aumento de 1,5 a 1,9 veces el valor de la creatinina basal o incremento superior a 0,3 mg/dL o presencia de un flujo urinario inferior a 0,5 mL/kg/hora durante más de seis horas.
Estadio 2: aumento de 2 a 2,9 veces el valor de la creatinina basal o la presencia de un flujo urinario inferior a 0,5 mL/kg/hora durante más de 12 horas.
Estadio 3: aumento superior a tres veces el valor de la creatinina basal, valor de la creatinina superior a 4 mg/dL o necesidad de terapia renal sustitutiva; o flujo urinario inferior a 0,3 mL/kg/hora en 24 horas o anuria durante 12 horas.
De los tratamientos habituales, se recogieron aquellos pacientes que tenían prescritos diuréticos y/o bloqueantes del SRAA.
En los pacientes en los que estaba disponible un ecocardiograma en los seis meses previos, se registraron los siguientes parámetros17:
- -
Disfunción sistólica: definida como fracción de eyección del ventrículo izquierdo (FEVI) inferior a 45%
- -
Disfunción diastólica: definida como una razón superior a 14 entre las ondas E y e’, volumen de la aurícula izquierda superior a 34 mL/m2, velocidad e’ septal inferior a 7 cm/s o lateral inferior a 10 cm/s y velocidad de la regurgitación tricuspídea superior a 2,8 m/2 (debiendo cumplir tres o más parámetros)18.
- -
Hipertensión pulmonar: definida como una presión en la arteria pulmonar superior a 30 mmHg.
- -
Hipertrofia de ventrículo izquierdo: definida como un índice de masa de ventrículo izquierdo superior a 130 g/m2(hombres) o 105 g/m2 (mujeres).
En función de la FEVI, se establecieron tres categorías: severamente deprimida (inferior a 40%), medianamente deprimida (40-49%), normal (superior a 50%)19.
Durante el seguimiento de 49 ± 28 meses, se registraron los eventos cardiovasculares (mortales o no mortales) que se definieron como insuficiencia cardiaca, cardiopatía isquémica, enfermedad vascular periférica, ictus o arritmias graves. Se analizaron los factores asociados a presentar eventos cardiovasculares, incluyendo el impacto de los parámetros ecocardiográficos.
El estudio cumple la normativa vigente de protección de datos, así como los principios éticos y ha sido aprobado por el Comité Ético del Hospital Universitario de La Princesa (referencia 3447, 11/2018).
Métodos estadísticosEn el análisis estadístico, las variables numéricas se expresan como media ± desviación estándar o como mediana (rango intercuartílico) en función de la distribución de cada una de ellas. Dado que queremos establecer el impacto de la disfunción diastólica en los eventos cardiovasculares, realizamos una comparación entre los pacientes que presentaban esta alteración ecocardiográfica y los que no. Para la inferencia estadística utilizamos los test X2 o test F de Fisher y t de Student o de Mann-Whitney en función de los resultados de la normalidad (determinada por el test de Shapiro-Wilk). Para las variables continuas, si las varianzas no son iguales tras utilizar la prueba de Levene, aplicamos una corrección de Welch a la t de Student. Realizamos un análisis univariante mediante regresión de Cox para establecer los factores asociados a presentar eventos cardiovasculares. Para determinar los predictores independientes realizamos un modelo multivariable ajustado para las variables significativas en el análisis univariante o aquellas consideradas de confusión. El modelo obtenido se validó con las pruebas de discriminación (área bajo la curva Receiver Operating Characteristic [ROC] del modelo y estadístico C de Harrell) y calibración (mediante la prueba de Hosmer-Lemeshow). Representamos gráficamente la asociación entre los parámetros ecocardiográficos y los eventos cardiovasculares mediante las curvas de supervivencia de Kaplan-Meier. Los análisis estadísticos y los gráficos se realizaron con SPSS 26.0®. Se consideró estadísticamente significativo un valor de p < 0,05.
ResultadosCaracterísticas basalesDurante el periodo de estudio, 1.720 pacientes ingresaron en nuestro centro por un episodio codificado como FRA. De ellos, 179 (10%) presentaban criterios de exclusión (mala codificación o necesidad de terapia renal sustitutiva al alta) y 286 (16%) fallecieron durante el episodio, por lo que fueron excluidos. Finalmente, se analizó a 1.255 (73%) de los que 696 (55%) eran varones, siendo la edad media de 75 ± 13 años. Como se muestra en la tabla 1, 943 (76%) tenían hipertensión arterial, 379 (30%) diabetes mellitus, 560 (45%) dislipemia, 543 (43%) ERC, 334 (28%) insuficiencia cardiaca y 247 (20%) cardiopatía isquémica.
Características basales de los pacientes
| Pacientes ingresados con FRA | Con disfunción diastólica | Sin disfunción diastólica | p | |
|---|---|---|---|---|
| (n = 1.255) | (n = 205) | (n = 334) | ||
| Sexo (varón), n (%) | 696 (55) | 104 (51) | 177 (53) | 0,657 |
| Edad (años) | 75 ± 13 | 78 ± 10 | 75 ± 13 | 0,004 |
| Diabetes mellitus, n (%) | 379 (30) | 66 (32) | 103 (31) | 0,775 |
| Hipertensión arterial, n (%) | 943 (76) | 177 (86) | 258 (77) | 0,010 |
| Dislipemia, n (%) | 560 (45) | 116 (57) | 150 (45) | 0,010 |
| Insuficiencia cardiaca, n (%) | 334 (28) | 114 (56) | 105 (32) | < 0,001 |
| Fracción de eyección del ventrículo izquierdo, n (%) | < 0,001 | |||
| Preservada | 453 (78) | 143 (71) | 275 (83) | |
| Moderadamente deprimida | 77 (13) | 27 (13) | 48 (14) | |
| Deprimida | 51 (9) | 35 (16) | 11 (3) | |
| Cardiopatía isquémica, n (%) | 247 (20) | 63 (31) | 74 (22) | 0,025 |
| Fibrilación auricular, n (%) | 299 (24) | 69 (34) | 103 (31) | 0,568 |
| Ictus, n (%) | 182 (15) | 40 (20) | 50 (15) | 0,191 |
| Enfermedad vascular periférica, n (%) | 116 (11) | 30 (16) | 29 (9) | 0,031 |
| Neoplasia previa, n (%) | 299 (24) | 35 (17) | 73 (22) | 0,186 |
| Enfermedad renal crónica, n (%) | 543 (43) | 107 (54) | 159 (48) | 0,245 |
| FGe basal (mL/min/1,73 m2) | 57 ± 25 | 51 ± 22 | 56 ± 24 | 0,030 |
| FGe mínimo en el episodio de FRA (mL/min/1,73 m2) | 30 ± 18 | 31 ± 17 | 30 ± 17 | 0,984 |
| FGe tras el episodio de FRA (mL/min/1,73 m2)* | 53 ± 27 | 46 ± 25 | 51 ± 25 | 0,015 |
| Diuréticos, n (%) | 568 (46) | 129 (63) | 168 (49) | 0,001 |
| BSRAA, n (%) | 651 (53) | 136 (66) | 179 (54) | 0,005 |
| Deterioro cognitivo, n (%) | 217 (19) | 39 (20) | 39 (12) | 0,016 |
| Escala de Barthel modificada (puntuación) | 34 ± 12 | 32 ± 11 | 35 ± 8 | 0,010 |
| Severidad del FRA, n (%) | 0,059 | |||
| AKIN-1 | 758 (60) | 147 (78) | 214 (68) | |
| AKIN-2 | 209 (18) | 24 (13) | 56 (18) | |
| AKIN-3 | 151 (12) | 18 (10) | 45 (14) | |
| Etiología del FRA, n (%) | 0,604 | |||
| Funcional | 883 (70) | 152 (74) | 248 (74) | |
| Obstructivo | 92 (7) | 10 (5) | 9 (3) | |
| NTA | 56 (5) | 7 (3) | 18 (5) | |
| Intersticial | 13 (1) | 1 (1) | 4 (1) | |
| Glomerular | 11 (1) | 2 (1) | 6 (2) | |
| Vascular | 12 (1) | 3 (1) | 2 (1) | |
| No filiado | 188 (15) | 30 (15) | 47 (14) | |
| Ecocardiograma disponible, n (%) | 676 (54) | |||
| Hipertrofia del ventrículo izquierdo | 258 (46) | 133 (67) | 105 (32) | < 0,001 |
| Hipertensión pulmonar | 198 (38) | 86 (47) | 95 (29) | < 0,001 |
| Disfunción sistólica | 128 (22) | 59 (29) | 54 (17) | 0,001 |
| Disfunción diastólica | 205 (38) | --- | --- | --- |
AKIN: Acute Kidney Injury Network; BSRAA: bloqueantes del sistema renina angiotensina aldosterona; FGe: filtrado glomerular estimado por CKD-EPI; FRA: fracaso renal agudo; NTA: necrosis tubular aguda.
Datos expresados como media ± desviación estándar o como mediana (rango intercuartílico).
*Se considera FGe final el que se registra tras 7 días de alcanzar el FGe más bajo durante el episodio de FRA.
Disponían de un ecocardiograma transtorácico previo al episodio de FRA, 676 pacientes (54%) (algunos de ellos no informaban de todos los parámetros). De ellos, 258 (46%) presentaban hipertrofia del ventrículo izquierdo, 198 (38%), hipertensión pulmonar, 205 (38%) disfunción diastólica y 128 (22%) disfunción sistólica (tabla 1).
En la tabla 1, se muestran las diferencias entre los pacientes que presentaban disfunción diastólica y los que no. Encontramos una asociación significativa entre la disfunción diastólica y la edad, la hipertensión arterial, la dislipemia, el antecedente de insuficiencia cardiaca, cardiopatía isquémica, enfermedad vascular periférica, el deterioro cognitivo y la dependencia funcional. Además, aquellos pacientes que presentaban disfunción diastólica tenían un FGe más bajo tanto basal como posterior al episodio de FRA y, con más frecuencia, tenían prescritos diuréticos y bloqueantes del SRAA. Encontramos una asociación significativa entre la disfunción diastólica y el resto de los parámetros ecocardiográficos (disfunción sistólica, hipertrofia de ventrículo izquierdo e hipertensión pulmonar).
Incidencia y tipo de eventos cardiovascularesTras la hospitalización por FRA, se realizó un seguimiento de los pacientes durante una media de 49 ± 28 meses. Se produjeron 484 (39%) ECV, siendo la insuficiencia cardiaca el más frecuente (353 [73%]), seguido de enfermedad vascular periférica (49 [10%]), accidente cerebrovascular (40 [8%]), cardiopatía isquémica (32 [7%]) y arritmias graves (10 [2%]). Fallecieron 23 pacientes (2%) por el evento cardiovascular.
Factores asociados a eventos cardiovascularesRealizamos un análisis univariante (tabla 2) en el que se demostró que la incidencia de ECV tras un episodio de FRA estaba asociado al sexo (varón), edad, al antecedente de diabetes mellitus, hipertensión arterial, dislipidemia, cardiopatía isquémica, insuficiencia cardiaca, fibrilación auricular y neoplasia previa. En cuanto a la función renal, el desarrollo de eventos cardiovasculares, se asoció a tener una ERC basal (y al FGe basal) pero también al FGe tras el episodio de FRA.
Factores asociados a presentar un ECV tras un episodio de FRA
| HR (IC 95%) | p | |
|---|---|---|
| Sexo (varón) | 1,214 (1,015-1,452) | 0,034 |
| Edad (por año) | 1,025 (1,017-1,032) | < 0,001 |
| Diabetes mellitus | 1,365 (1,133-1,646) | 0,001 |
| Hipertensión arterial | 2,152 (1,670-2,774) | < 0,001 |
| Dislipidemia | 1,582 (1,322- 1,894) | < 0,001 |
| Insuficiencia cardiaca | 2,706 (2,253-3,250) | < 0,001 |
| Cardiopatía isquémica | 1,719 (1,405- 2,103) | < 0,001 |
| Fibrilación auricular | 2,223 (1,841- 2,683) | < 0,001 |
| Ictus | 1,274 (1,002-1,621) | 0,048 |
| Enfermedad vascular periférica | 0,948 (0,696-1,291) | 0,736 |
| Neoplasia previa | 0,599 (0,468-0,767) | < 0,001 |
| Enfermedad renal crónica | 2,132 (1,775-2,561) | < 0,001 |
| FGe basal (por mL/min/1,73 m2) | 0,985 (0,981-0,989) | < 0,001 |
| FGe mínimo en el episodio de FRA (por mL/min/1,73 m2) | 0,997 (0,992-1,002) | 0,019 |
| FGe tras el episodio de FRA (por mL/min/1,73 m2)* | 0,988 (0,985-0,992) | < 0,001 |
| Diurético | 2,396 (1,995- 2,877) | < 0,001 |
| BSRAA | 1,852 (1,534-2,235) | < 0,001 |
| Metformina | 1,013 (0,781-1,314) | 0,923 |
| Deterioro cognitivo | 0,859 (0,735-1,005) | 0,057 |
| Barthel (por cada punto) | 1,003 (0,995- 1,011) | 0,490 |
| Severidad del FRA (por cambio de categoría) | 0,662 (0,568-0,772) | < 0,001 |
| Etiología del FRA (funcional vs. otros) | 1,402 (1,138-1,727) | 0,001 |
| Parámetros ecocardiográficos | ||
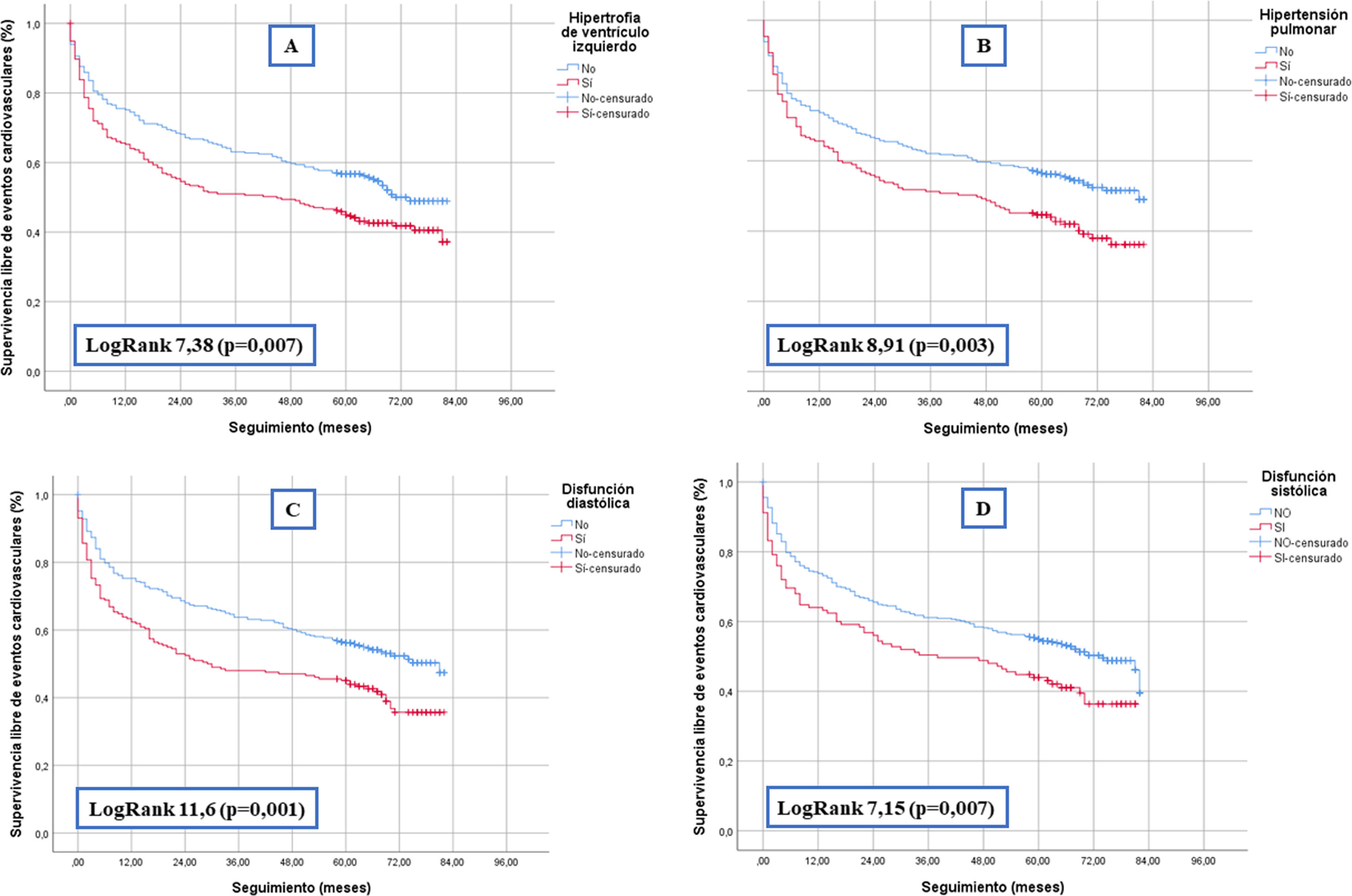
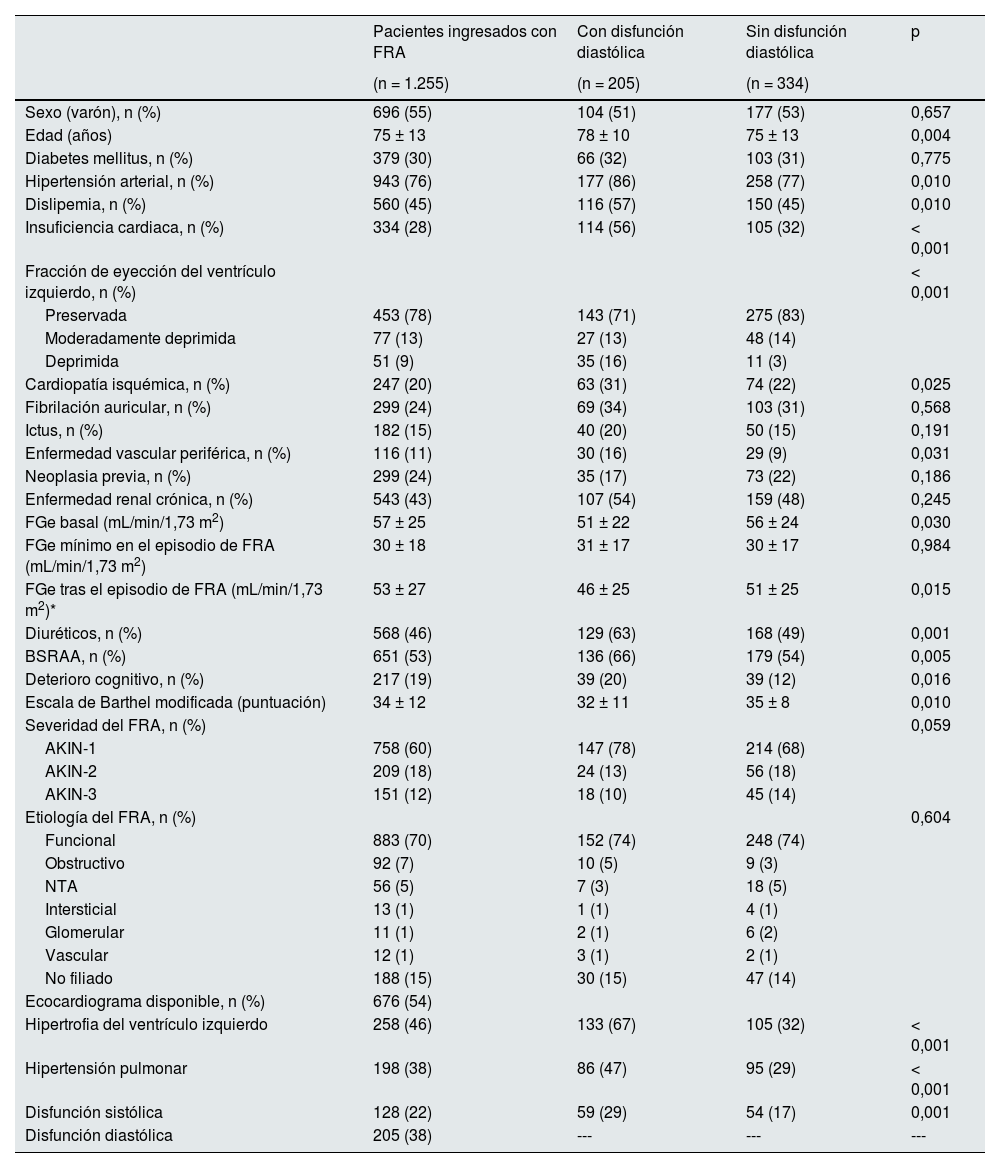
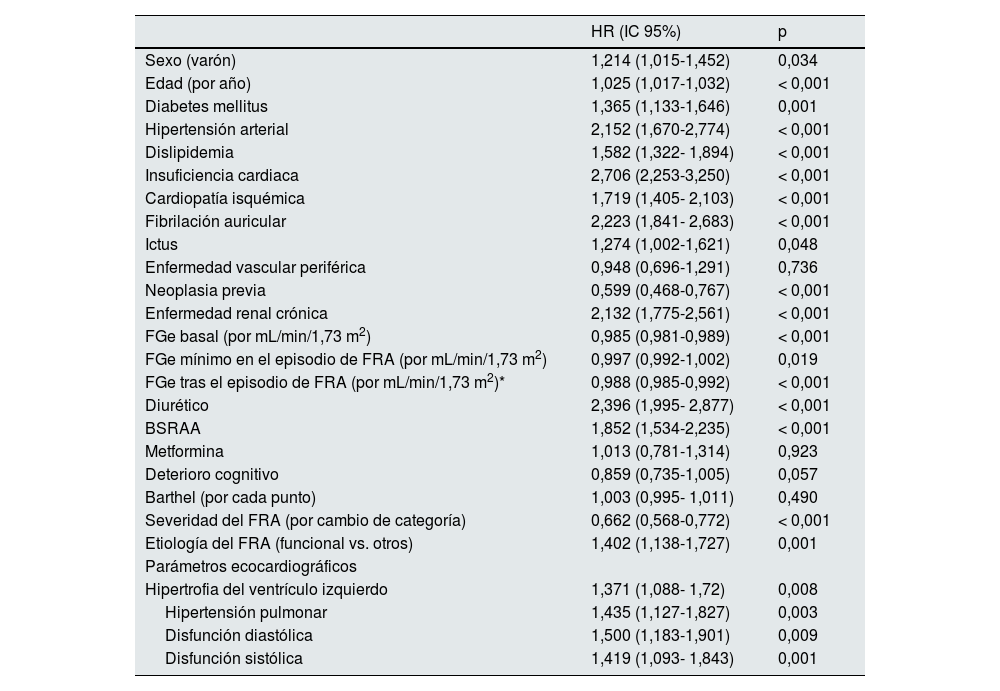
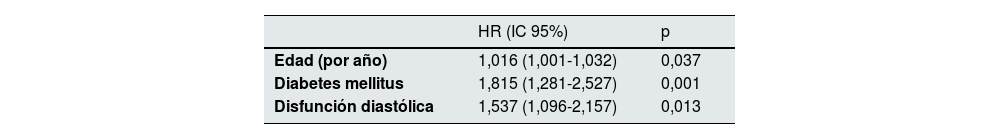
| Hipertrofia del ventrículo izquierdo | 1,371 (1,088- 1,72) | 0,008 |
| Hipertensión pulmonar | 1,435 (1,127-1,827) | 0,003 |
| Disfunción diastólica | 1,500 (1,183-1,901) | 0,009 |
| Disfunción sistólica | 1,419 (1,093- 1,843) | 0,001 |
BSRAA: bloqueantes del sistema renina angiotensina aldosterona; FGe: filtrado glomerular estimado por CKD-EPI; FRA: fracaso renal agudo; HR: hazard ratio; IC: intervalo de confianza.
En cuanto a los datos procedentes de los ecocardiogramas, la hipertrofia de ventrículo izquierdo, la hipertensión pulmonar, la disfunción sistólica y la disfunción diastólica presentaron una asociación significativa con el desarrollo de eventos cardiovasculares (tabla 2). Las curvas de supervivencia que se muestran en la figura 1, demuestran gráfica y analíticamente esta asociación.
Predictores independientes de eventos cardiovascularesRealizamos un modelo multivariable por regresión de Cox en el que se demostró que la edad (HR 1,016 IC 95% [1,001-1,032], p = 0,037), la diabetes mellitus (HR 1,815 IC 95% [1,281-2,527], p = 0,001) y la disfunción diastólica (HR 1,537 95% IC [1,096-2,157], p = 0,013) son predictores independientes de eventos cardiovasculares tras un episodio de FRA (tabla 3).
Regresión de Cox para determinar los predictores independientes de eventos cardiovasculares tras un episodio de fracaso renal agudo
| HR (IC 95%) | p | |
|---|---|---|
| Edad (por año) | 1,016 (1,001-1,032) | 0,037 |
| Diabetes mellitus | 1,815 (1,281-2,527) | 0,001 |
| Disfunción diastólica | 1,537 (1,096-2,157) | 0,013 |
HR: hazard ratio; IC: intervalo de confianza.
Modelo ajustado para sexo, hipertensión arterial, dislipemia, enfermedad renal crónica, disfunción sistólica, hipertensión pulmonar, hipertrofia de ventrículo izquierdo, neoplasia previa, deterioro cognitivo, índice de Barthel modificado, fibrilación auricular, ictus, severidad del fracaso renal agudo establecido por AKIN, tipo de FRA y filtrado glomerular tras el episodio de fracaso renal agudo.
Se determinó el área bajo la curva ROC de las probabilidades del modelo (estadístico C de Harrel), obteniéndose un modelo con buena discriminación (área bajo la curva 0,743, p < 0,0001). Asimismo, el modelo presentaba una buena calibración (prueba de Hosmer-Lemeshow 3,38, p = 0,640).
DiscusiónNuestro estudio demuestra que las alteraciones cardiacas, y concretamente la disfunción diastólica, predicen de manera independiente el desarrollo de ECV tras un episodio de FRA. Además, en los pacientes en los que estaban disponibles, los parámetros ecocardiográficos son una herramienta útil para estratificar el riesgo de presentar un ECV.
Dentro de las consecuencias clínicas del FRA se incluyen las complicaciones cardiovasculares20. Estudios prospectivos, como el recientemente publicado ASSESS-AKI, han demostrado que el solo hecho de presentar un episodio de FRA puede elevar el riesgo de presentar ulteriores episodios de insuficiencia cardiaca hasta un 68%, estableciendo un fenómeno de causa-efecto8. A pesar de la evidencia clínica, la explicación patogénica no carece de controversia en la literatura actual. En un reciente estudio experimental, basado en un modelo murino, los autores demuestran que un episodio de FRA conduce al desarrollo de disfunción diastólica persistente que podría ser considerado como el mecanismo desencadenante que condicione posteriores complicaciones cardiovasculares21.
La disfunción diastólica es una patología con incidencia creciente y que presenta como causas predominantes la hipertensión arterial, la diabetes y la cardiopatía isquémica, factores que, en su mayoría, también precipitan alteraciones renales en un intrincado mecanismo que se retroalimenta potenciando los efectos negativos sobre el eje cardiorrenal22. De hecho, nuestros datos confirman que la edad y la diabetes empeoran el pronóstico cardiovascular de los pacientes, siendo ambos factores promotores de un aumento de rigidez miocárdica e impulsores de la propia disfunción diastólica22.
La descripción de la disfunción diastólica en pacientes con nefropatía ha aumentado su interés exponencialmente en los últimos años. En aquellos con ERC, la prevalencia de disfunción diastólica aumenta con el deterioro de la función renal hasta incluso considerarse por algunos autores como virtualmente universal en quienes requieren hemodiálisis13,23. Además, el recientemente publicado estudio poblacional Atherosclerosis Risk in Communities Study establece una asociación independiente entre numerosas alteraciones ecocardiográficas y la incidencia de ERC, sugiriendo la necesidad de establecer una monitorización estrecha de la funcionalidad de ambos órganos24.
Por su parte, la relación entre la disfunción diastólica y el FRA presenta poca evidencia en el momento actual. Estudios clínicos transversales han sido capaces de demostrar que dicha alteración cardiaca, se asocia a un mayor riesgo de FRA durante una hospitalización, situación que se ha estudiado en poblaciones concretas como en cirróticos, en pacientes que se someten a un estudio con contraste, en el shock séptico o en ancianos con fractura de cadera25–28. Lo novedoso de nuestro estudio, más allá de confirmar que la disfunción diastólica se asocia a mayor gravedad del episodio de FRA (los pacientes con disfunción diastólica presentan un FGe más bajo tras el episodio) es la demostración de su impacto en la supervivencia libre de ECV tras el alta hospitalaria y a largo plazo. Sin duda, a falta de confirmación de estos datos en estudios prospectivos, el desafío consiste en establecer una monitorización más estrecha de los pacientes que presenten disfunción diastólica tras un FRA, pero sobre todo determinar estrategias terapéuticas concretas que mejoren el pronóstico.
La alteración de la relajación miocárdica también ha demostrado ser un predictor independiente de eventos cardiovasculares en poblaciones sin FRA, lo que debido a su detección cada vez más precoz y a su elevada prevalencia obligan a establecer medidas concretas que palien sus consecuencias29,30. Hasta la fecha, las únicas medidas recomendadas se han basado en el control de los factores de riesgo cardiovascular clásicos (diabetes, hipertensión arterial, dislipemia, obesidad) y no clásicos (inflamación, uremia, hiperuricemia, entre otros)31. Sin embargo, la publicación del estudio EMPEROR-Preserved, abre la puerta al primer tratamiento con potencial mejoría pronóstica, la empagliflozina32. Aunque los resultados de ese ensayo clínico se basan en pacientes diferentes a los que presentamos en nuestro trabajo, cabe hipotetizar su posible efecto beneficioso aquellos con mayor riesgo cardiovascular tras un episodio de FRA.
Además, tal y como demuestran nuestros datos, las diferentes alteraciones ecocardiográficas (disfunción sistólica, diastólica, hipertrofia de ventrículo izquierdo [HVI] y/o hipertensión pulmonar) son buenos marcadores para estratificar el riesgo de ECV en personas que sufren un FRA por lo que podrían ser herramientas que permitan establecer seguimientos más estrechos a determinados subgrupos de pacientes.
Nuestro estudio no está exento de limitaciones. En primer lugar, se trata de un estudio retrospectivo lo que acarrea los sesgos típicos de este tipo de análisis. A pesar de la pérdida de datos y de que, en ocasiones, estos no sean completamente homogéneos, el tamaño muestral que aportamos es suficientemente amplio como para valorar nuestros objetivos, pudiendo ajustar los modelos a numerosas variables. En este sentido, hemos aplicado el término FRA para definir el deterioro agudo de función renal, aunque actualmente se proponen clasificaciones adicionales que discriminan entre FRA (daño renal hasta de siete días) y enfermedad renal aguda (daño entre siete días y tres meses)33. En segundo lugar, al tratarse de un estudio en vida real, solo el 54% de los pacientes disponían de un ecocardiograma en los seis meses previos al episodio de FRA y en estos no siempre se describían todas las alteraciones que pretendemos estudiar. Para evitar que determinadas alteraciones pudieran pasar inadvertidas, decidimos acotar la validez de los ecocardiogramas a ese rango temporal asumiendo que un mayor número de pacientes no dispondrían de datos de estructura y función renal, pero consiguiendo mayor exactitud al estar más cercanos al episodio de FRA. Por último, la falta de un ecocardiograma tras el FRA no permite establecer la afectación de la disfunción renal aguda sobre la ecoestructura y función cardiaca por lo que nuestros datos podrían estar infraestimados. Sin embargo, para poder estudiar en profundidad esta última limitación se requerirá un estudio prospectivo con homogeneidad temporal en el seguimiento, al menos en la realización del ecocardiograma de control. En cualquier caso, consideramos que los datos aportados por este trabajo son suficientemente significativos como para poder establecer hipótesis que se puedan confirmar en estudios con un diseño más potente.
Como conclusión del estudio, podemos establecer que la disfunción diastólica predice la incidencia de ECV tras un episodio de FRA. Además, se puede estratificar el riesgo de presentar ECV con los parámetros basales que ofrecen los estudios ecocardiográficos, lo que permitiría establecer un manejo específico y estrecho de los pacientes con alteraciones estructurales o funcionales cardiacas.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.