A pesar de los avances en la fisiopatología de la sepsis publicados en la últimas décadas y su aplicación al tratamiento, su morbilidad y mortalidad continúan siendo elevadas. La sepsis, y más concretamente sus formas severas, continúan siendo una de las patologías más prevalentes en UCI con un aumento de su incidencia anual. Todo ello podría explicarse por el cambio progresivo de los criterios de ingreso (mayor edad o enfermos inmunodeprimidos), por el avance tecnológico para el soporte de la disfunción orgánica y por la mayor exigencia asistencial y del entorno familiar en la utilización de los recursos. Se puede deducir el enorme impacto económico que conlleva, tanto por las medidas destinadas al diagnóstico y tratamiento específico de la infección como por las derivadas de la disfunción multiorgánica (soporte respiratorio, técnicas de depuración extrarrenal, oxigenación extracorpórea, etc.).
El propósito de este artículo es mencionar las nuevas tendencias en el estudio de la fisiopatología de la sepsis, incidir en la importancia del diagnóstico y tratamiento precoz para conseguir una disminución de la mortalidad y, por último, comentar brevemente la insuficiencia renal aguda (IRA) como una entidad específica, la IRA séptica, que, como tal, tiene algunas peculiaridades tanto en la instauración como en la aplicación de las técnicas de depuración extrarrenal (TDE).
CRITERIOS DE REVISIÓN: Los criterios de revisión utilizados son la búsqueda en Medline de Sepsis, Microcirculación, Tratamiento de la sepsis, IRA séptica, Flujo sanguíneo renal y Técnicas de depuración extrarrenal, publicados en inglés y en castellano, y desde enero de 2000. Búsqueda dirigida de un artículo de 1996.
INTRODUCCIÓN
La sepsis es una respuesta inflamatoria sistémica ante una infección, y el shock séptico es una de las patologías más frecuentes en pacientes críticos. Se desarrolla como consecuencia de la reacción directa adversa de la infección, combinada con la mala adaptación del huésped a una inflamación sistémica. Es una causa importante de muerte intrahospitalaria en el adulto (entre el 20 y el 50%) y su incidencia ha aumentado en los últimos años1 debido a la mejoría global en la supervivencia de los pacientes con enfermedades crónicas, institucionalizados e inmunodeprimidos. El impacto económico es importante, y el coste por día se multiplica entre dos y 11 veces respecto al de otros pacientes hospitalizados. En nuestro país se calculan 350 casos/100.000 adultos hospitalizados al año (el 4,5% de los pacientes ingresados) y es la décima causa de muerte intrahospitalaria2. En un estudio prospectivo realizado en UCI alemanas se encontró que la prevalencia de la sepsis severa asociada con el síndrome de disfunción multiorgánica (SDMO) era de alrededor del 12%3,4, la mortalidad del 38-59%, y de los que sobrevivían, la calidad de vida estaba mermada en el siguiente año y medio.
Dado que la mayoría de los signos de respuesta inflamatoria sistémica (SIRS), incluida la fiebre, no excluye la infección, cuando ésta se sospecha es crucial la búsqueda del foco infeccioso y la instauración rápida del tratamiento antibiótico, ya que se trata de una e las pocas medidas de eficacia probada para disminuir la mortalidad.
DEFINICIONES
Existen múltiples definiciones de sepsis y, en ocasiones, una escasa precisión en la terminología de los conceptos relacionados con ella, por ello distintas Sociedades científicas han intentado realizar un consenso para conseguir criterios unificados, sobre todo, para que el tratamiento sea más homogéneo entre los distintos grupos 5. Todas representan estados del mismo proceso fisiopatológico, con una progresión hacia la disfunción y el fallo orgánico, que termina en la muerte sin el tratamiento adecuado. Así pues, es un proceso continuo que no sigue etapas bien definidas, lo que implica que la valoración debe ser permanente.
SIRS (dos o más). FC >90 lat/min, temperatura >38 ºC o <36 ºC, FR >20 rpm o PCO2 <32 mmHg, leucocitos >12.000 o <4.000/mm3.
Sepsis. Infección con manifestaciones sistémicas o SIRS por una infección.
Sepsis severa. Sepsis con hipoperfusión tisular y disfunción orgánica.
Shock séptico. Hipotensión persistente inducida por la sepsis a pesar de una adecuada resucitación de fluidos.
Shock refractario. Shock sin respuesta a la resucitación agresiva de fluidos ni a la administración de fármacos vasoactivos.
Parámetros de disfunción orgánica. Hipoxemia arterial (PaO2/FIO2 <300), diuresis <0,5 ml/kg/h x 2 horas, creatinina >2,0 mg/dl, INR >1,5 o aPTT >60 s, trombocitopenia (<100,000/mm3), bilirrubina total >2,0 mg/dl o 35 mmol/l.
Parámetros de perfusión tisular. Hiperlactatemia (>2 mmol/l), disminución del relleno capilar, hipotensión arterial (TA sistólica <90 mmHg o disminución de más de 40 mmHg respecto a la previa, TA media <70 mmHg o mayor de 2 DE de lo normal para la edad y en ausencia de otras causas de hipotensión).
RECONOCIMIENTO DE LA SEPSIS: SISTEMA PIRO
En el año 2001, en la Conferencia de Definiciones Internacionales de la Sepsis se identificaron determinadas características para determinar el riesgo basal de resultados adversos, y los pacientes que son potencialmente respondedores al tratamiento y que es conocido como sistema PIRO5.
P (predisposición): edad (menores de un año o mayores de 65), malnutrición, hipotermia, enfermedades crónicas, alcoholismo, tratamiento con inmunosupresores, procedimientos invasivos, presencia de algunos de los más de 30 genes que se han estudiado y cuyos polimorfismos están relacionados con la sepsis, infección severa o inflamación6.
Infección: búsqueda del foco y obtención de cultivos. Peor pronóstico si existen neumonía, peritonitis, cocos grampositivos, bacilos aerobios gramnegativos o bacteriemia primaria.
Respuesta: investigar los indicadores fisiológicos de la sepsis, la sepsis severa y el shock séptico que reflejan la reacción del paciente a la infección y la respuesta inflamatoria sistémica.
Disfunción Orgánica: la mortalidad se duplica si la afectación es de 2 órganos y se multiplica por tres o cuatro cuando afecta a más de cuatro.
FISIOPATOLOGÍA
La fisiopatología de la sepsis es un fenómeno complejo sometido a continuo estudio y que sigue sin entenderse en su totalidad. De manera simplificada podemos decir que es la culminación de interacciones complejas entre el microorganismo y las respuestas inmune, inflamatoria y de la coagulación del huésped.
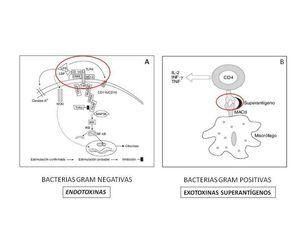
Los patógenos infecciosos poseen componentes estructurales que se denominan patrones moleculares asociados a patógenos (PMAP), como son los lipopolisacáridos de las bacterias gramnegativas y los péptidoglicanos de las positivas. Estas moléculas se unen a los receptores moleculares del huésped o patrones de reconocimiento celular que incluyen los receptores Toll-like de la superficie celular (TLR) y varios tipos de receptores citoplasmáticos7. El resultado es la activación de las vías intracelulares que llevan a múltiples respuestas, incluyendo el aumento de transcripción de las citoquinas, estimulación de la respuesta inmune humoral y celular y aumento de expresión de las moléculas de adhesión8 (figura 1).
La respuesta inflamatoria secundaria a la infección es un proceso normal y esencial para la supervivencia, ya que localiza y elimina al cuerpo extraño, poniéndose al mismo tiempo en marcha una respuesta antiinflamatoria sistémica. De ello podemos deducir que los procesos proinflamatorios y antiinflamatorios están presentes en las células, que los mediadores proinflamatorios y antiinflamatorios están en la circulación sistémica y que las células inmunes efectoras reciben mensajes mixtos.
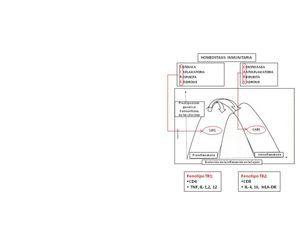
El término clave que describe los eventos fisiopatológicos en el shock séptico es el desajuste de la respuesta del huésped a la intensidad de los estímulos patógenos, y que como resultado final le ocasiona una lesión o disfunción orgánica, con o sin hipotensión. Según el perfil inmunológico, la respuesta puede ser predominantemente proinflamatoria (síndrome de respuesta inflamatoria sistémica [SIRS]) o antiinflamatoria (síndrome de respuesta antiinflamatoria compensatoria [CARS]). La naturaleza de las interacciones entre los patógenos y el huésped en los tejidos es compleja, resultando una excesiva inflamación o inmunosupresión, alteración de la coagulación y un flujo sanguíneo anormal con disfunción microcirculatoria, lo que provocará daño orgánico y muerte celular9 (figura 2 y tabla 1).
Microcirculación
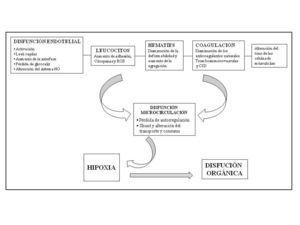
La microcirculación, lugar de intercambio de nutrientes en los tejidos, es el órgano diana en el proceso séptico. Su integridad y funcionamiento adecuado es esencial para el aporte del oxígeno. Es un sistema dinámico que interactúa con las células circulantes elaborando mediadores y contribuyendo al tono vascular. Existen una amplia variedad de mecanismos que contribuyen a la disfunción del aporte local de O210, incluyendo las alteraciones de la reactividad vascular que favorecen un shunt funcional, disrupción de la barrera local, trombosis de microvasos y alteraciones de las propiedades reológicas de los hematíes y leucocitos.
En los últimos años hay un creciente interés por la reactividad vascular y el concepto más general de parálisis vasomotora. En el shock distributivo, en el que está incluido el séptico, se produce una distribución anormal de un gasto cardiaco normal o elevado, secundario a la disfunción microcirculatoria. Se desvía la sangre del compartimento arterial al venoso, provocando hipoxia secundaria. La consecuencia funcional del shunt es que la PO2 de la microcirculación es menor que la venosa (PO2 gap), y su manifestación sistémica es un déficit en la extracción de O2 tisular, lo que explica la alta saturación venosa mixta característica de la sepsis.
La anormal distribución del flujo sanguíneo de la microcirculación y el desequilibrio entre el aporte y el consumo de oxígeno por los tejidos son el inicio del fracaso multiorgánico. En la sepsis severa la hipoperfusión general puede persistir después de la corrección de las variables hemodinámicas (TA). La disparidad entre la oxigenación sistémica y la regional tisular dificulta la monitorización y, por tanto, el logro de los objetivos de tratamiento. En la actualidad, existen nuevas técnicas que analizan la microcirculación, sobre todo sublingual, utilizando luz polarizada verde que es absorbida por la hemoglobina y reflejada por el resto de las estructuras. Entre ellas destacan las imágenes obtenidas por polarización espectral (OPS) y la videomicroscopia de luz polarizada (SDF: side dark field), que podrían ser útiles para dirigir la resucitación de la sepsis y corregir la disoxia tisular.
Las células endoteliales tienen un papel clave en el funcionamiento de la microcirculación, participando en la regulación del flujo sanguíneo, controlando la coagulación y la función inmune y liberando óxido nítrico en respuesta a las fuerzas de estrés e hipoxia. Por otra parte, los leucocitos activados por la inflamación séptica generan especies reactivas de O2 (ROS) que directamente alteran las estructuras microcirculatorias.
El papel del óxido nítrico (NO) en la microcirculación es la de mantener la integridad del flujo sanguíneo regulando el diámetro de los vasos de resistencia y participando en la interacción de los elementos sanguíneos, pared vascular y volumen sanguíneo. En la sepsis existe una alteración severa de este sistema existiendo áreas con sobreproducción del mismo y otras con deficiencia, lo que favorece el shunt microcirculatorio11. Se han hecho intentos, hasta ahora infructuosos, en el tratamiento de la sepsis actuando sobre el sistema del NO; por una parte, administrando donadores como la nitroglicerina y arginina y ,por otra, inhibiendo su producción.
En las células, la hipoperfusión afecta en primer lugar a la mitocondria y aparece precozmente en la sepsis12. En los no supervivientes hay menor cantidad de ATP y, a su vez, mayor predisposición a la disfunción multiorgánica (figura 3).
Coagulación
Una característica importante en la sepsis es el desarrollo de un estado procoagulante13. Las citoquinas inflamatorias activan la cascada de la coagulación y, además, inhiben la fibrinólisis. La coagulación intravascular diseminada (CID) es una complicación frecuente como resultado de lo anterior. Se produce la activación de la vía extrínseca, inhibición del sistema fibrinolítico, disminución de factores de la coagulación y trombocitopenia.
Mención especial, sobre todo por la implicación terapéutica que conlleva, merece la proteína C activada (PCA)14. Es una proteína sérica, vitamina K-dependiente, que desempeña un papel central en la anticoagulación endógena. Entre las funciones atribuibles a la PCA se encuentran la inhibición de la respuesta inflamatoria sistémica, la menor disfunción vascular originada por el NO, efecto antiapoptoico y citoprotector. Niveles reducidos de PCA en pacientes con sepsis se han correlacionado con un incremento en el riesgo de muerte. A pesar de las propiedades anteriores, su uso en la actualidad está restringido a los pacientes con sepsis severa y DMO de más de dos órganos (APACHE >25), debiendo iniciarse dentro de las primeras 24 horas. No se encuentra beneficio administrándose en sepsis menos grave (estudios DrottAA, PROWESS o ADDRESS)15,16.
Otros factores contribuyentes
Actualmente se reconoce que la sepsis lleva a un estado de inmunosupresión caracterizado por apoptosis de los linfocitos y susceptibilidad a infecciones nosocomiales. Asimismo, se conoce el desarrollo de edema tanto subcutáneo como en los órganos, lo que sugiere un aumento de la permeabilidad, que puede no ser benigno, dado que dificulta la difusión de oxígeno por aumento de la distancia y de la presión intersticial. Como se comentó anteriormente, está demostrado que la pérdida de la integridad del endotelio contribuye a la enfermedad y muerte asociada con la sepsis, por lo que la investigación de los mecanismos subyacentes pueden llevar a nuevas estrategias terapéuticas basadas en la reparación y regeneración endotelial17.
DATOS CLÍNICOS RELEVANTES
En un paciente con sepsis encontraremos los signos y síntomas propios de la infección (fiebre-hipotermia, postración, etc.), los específicos del foco que la produce (insuficiencia respiratoria, dolor abdominal, alteración de partes blandas, disuria, alteración del SNC, etc.) y aquellos relacionados con la propia fisiopatología de la sepsis. Como ilustración de estos últimos pueden mencionarse los siguientes18:
1. Hipotensión e hipovolemia relativa por vasodilatación secundaria a la disminución de las resistencias vasculares sistémicas. El óxido nítrico desempeña un papel esencial en ello.
2. Hipotensión y edema intersticial por alteración de la barrera endotelial (disrupción de las uniones intercelulares y pérdida de células endoteliales). Esta alteración provoca el paso de proteínas hacia el intersticio, es la responsable de la disminución del volumen intravascular y favorece la hipoxia celular.
3. Hipoperfusión tisular por oclusión de los capilares por microtrombos, leucocitos activados y agregados de eritrocitos, entre otros.
4. Alteración cardíaca: inicialmente existe un estado hiperdinámico en el que el corazón responde a la hipotensión arterial con un aumento del gasto cardíaco. En fases tardías y debido a la presencia de factores depresores en la circulación puede existir un gasto cardíaco bajo.
DIAGNÓSTICO
Es primordial realizar un diagnóstico precoz y, para ello, es preciso identificar si es un proceso séptico el responsable del síndrome de respuesta inflamatoria sistémica (SIRS). Una vez diagnosticada la sepsis es esencial reconocer aquellos datos, clínicos o analíticos, que nos indican la progresión hacia sepsis grave o shock séptico y que de manera esquemática podemos resumir de la siguiente forma:
1. Datos clínicos: signos de infección, hipotensión arterial, los derivados de la hipoperfusión tisular y la consiguiente disfunción orgánica.
2. Analítica: general y específica según la sospecha del foco, pruebas de imagen y estudios microbiológicos.
3. Marcadores biológicos: sirven para apoyar el diagnóstico clínico de sepsis, su origen (bacteriana, viral, SIRS de otra causa) y respuesta al tratamiento.
a) Proteína C Reactiva (PCR). Es producida por el hepatocito e inducida por IL-6. Su valor normal es <0,8 mg/l, descartando una infección bacteriana si es menor de 5 mg/l. Puede ser un indicador de buena respuesta terapéutica si se produce un descenso mayor del 25% en las primeras 4 horas.
b) Procalcitonina (PCT). Producida por las células parenquimatosas y más específica que la PCR. Es útil tanto para comprobar la progresión como para evaluar la finalización del tratamiento antibiótico19,20. Es muy sugerente de infección si el valor es mayor de 2,0 ng/ml.
c) Otros. Kinasewitz et al.21 identificaron 13 biomarcadores que correlacionaron con la severidad inicial de la sepsis (dímero-D, IL-6, proteína C, antitrombina, APTT, tiempo de protrombina, proteína S, inhibidor del activador del plasminógeno [PAI], inhibidor de la fibrinólisis trombina-activable [TAFI], trombomodulina soluble [sTM], IL-10, IL-8, y TNF-alfa), pero ninguno predijo el resultado.
4. Medidas de perfusión tisular global: la hipoxia tisular prolongada es una de las principales causas de disfunción orgánica, por lo que la optimización hemodinámica precoz está asociada con menor mortalidad y progresión de la enfermedad.
a) Índice de shock, definido como el cociente de la frecuencia cardíaca y TA sistólica (TAS). El valor normal es menor de 0,8 (FC/TAS) siendo un indicador más fiable de hipoperfusión que la TA.
b) Lactato. Su medición proporciona un marcador de hipoxia tisular global y es un valor pronóstico para predecir la supervivencia de los pacientes en shock. El hallazgo de un lactato sérico elevado (>4 mmol/l) se relaciona con un peor pronóstico y con una mayor mortalidad22.
c) Aclaramiento de lactato (lactato inicial – lactato a las 2-6 horas)/lactato inicial x 100). Mejor predictor independiente que el valor absoluto de la mortalidad hospitalaria. Un aclaramiento del más del 10% es tan fiable como la monitorización de ScvO2. En conjunto, estos datos demuestran la utilidad del lactato no sólo como un marcador pronóstico en la sepsis, sino también como una medida valiosa de la reanimación inicial23.
d) Saturación venosa mixta (SvO2) o venosa central (ScvO2) de O2. Ambas dependen, según el principio de Fick, del balance entre el aporte de O2 (DO2) y el consumo (VO2) tisular. Son un indicador del grado de extracción de O2 antes de que la sangre vuelva al corazón derecho. La hipoxia tisular lleva a un incremento en la extracción de O2 (por disminución en el aporte o aumento de las necesidades de los tejidos) y secundariamente a una caída de la SvO2. Ambas determinaciones han demostrado tener un significado diagnóstico, pronóstico y con utilidad terapéutica. Como medida complementaria se ha utilizado la diferencia venosa central y arterial de CO2, de manera que la presencia de un valor elevado (>6 mmHg) podría ser útil para identificar a los pacientes que permanecen inadecuadamente resucitados a pesar de ScvO2 >70%.
La saturación de oxígeno venosa mixta (SvO2) se mide en la arteria pulmonar y los rangos normales se encuentran comprendidos entre el 65 y el 75%. La saturación venosa central (en la cava superior) se correlaciona bien con la anterior (valores mayores de 5-18%) y el objetivo será mantenerla por encima del 70%. La clave es poder detectar y resolver la hipoxia tisular de manera precoz24.
5. Perfusión tisular regional: tonometría gástrica, capnografía sublingual, espectrometría de infrarrojos (Hb, O2-Hb, cit aa3), imagen espectral de polarización ortogonal (visualización de la microcirculación sublingual), tensión de oxígeno tisular por sondas polarográficas (pO2).
6. Predisposición genética: pendiente de desarrollar el cribado genético para determinar la predisposición a la sepsis.
7. Scores para el diagnóstico de SDMO: APACHE II, SAPS II, SOFA, MOD.
8. Formulario código sepsis: en la práctica clínica, y cada vez más extendido, se está intentando activar una serie de medidas para el diagnóstico precoz, así como una terapéutica guiada por objetivos, con el objetivo de reducir la mortalidad. Debe adaptarse a la idiosincrasia de cada hospital y modificarse dependiendo del personal al que va dirigido:
a) ¿Tiene el paciente dos o más síntomas sistémicos?: temperatura >38 ºC o <36 ºC, leucocitos >12.000 o < 4.000/mm3, FC >90 lat/min, FR >30 rpm, alteración de la conciencia.
- Si los tiene: diagnóstico de SRIS.
b) ¿Tiene el paciente un foco infeccioso probable?
- Si es afirmativo: probable sepsis.
- Realizar determinaciones específicas: PCR, ácido láctico, procalcitonina, cultivos.
c) ¿Tiene el paciente signos de hipoperfusión o fracaso de uno o más órganos?
- Diagnóstico probable: sepsis grave o shock séptico.
- Iniciar tratamiento inmediato.
TRATAMIENTO
El objetivo actual es mejorar el tratamiento de la sepsis y del shock séptico mediante la identificación precoz de los pacientes de alto riesgo. La demostración de que determinadas intervenciones podrían mejorar el resultado impulsó en el año 2002 a las distintas Sociedades de Cuidados Críticos a lanzar la campaña SSC (Surviving Sepsis Campaign) con la intención de reducir la mortalidad en un 25% en el 200925,26.
Los puntos más significativos fueron la concienciación del problema de la sepsis, el diagnóstico precoz, el inicio del tratamiento e intervenciones adecuadas tempranas, desarrollar programas de educación del personal médico en relación con el diagnóstico y tratamiento de la infección, mejorar la atención tras la salida de la UCI y el desarrollo de estándares de atención27.
Los objetivos que deben perseguirse son el control del foco infeccioso y la optimización hemodinámica: TAM >65 mmHg, PVC >8-12 mmHg, diuresis >0,5 ml/kg/h y SvcO2 >70%.
El protocolo de tratamiento dentro de las primeras primeras 6 horas consiste en:
1. Medir el lactato sérico, obtener cultivos, administrar antibióticos de amplio espectro en la primera hora en caso de sepsis severa y en las tres primeras en cualquier caso. Cada hora sin antibiótico aumenta la mortalidad un 7,6%.
2. Si hay hipotensión y el lactato se encuentra elevado (>4 mmol/l): administración de fluidos (20 ml/kg de cristaloides o equivalentes en coloides).
3. Si no hay respuesta, iniciar la perfusión de fármacos vasoactivos (dopamina o noradrenalina) para conseguir una TAM >65 mmHg.
4. Si hay persistencia de la hipotensión y lactato elevado:
a) Canalizar la vía central para la medición de PVC y mantenerla entre 8 y 10 mmHg.
b) Iniciar medidas para mantener ScvO2 >70% o SvO2 >65%: valorar iniciar la administración de inotrópicos y la transfusión sanguínea para mantener Hb >10 g/dl.
Dentro de las primeras 24 horas, y de acuerdo con la política de la UVI, se administrarán dosis bajas de esteroides para hipotensión refractaria, drotrecogin alfa según protocolo y control de glucemia.
Tratamiento de soporte. En él se incluyen ventilación protectora para el SDRA, oxigenación extracorpórea para hipoxemia refractaria (PaO2/FiO2 <100) y técnicas de tratamiento renal sustitutivo (TRS) entre las más significativas.
Después de una década de la publicación por parte de Rivers del tratamiento guiado por objetivos, han sido múltiples los trabajos publicados a favor de las medidas. Existen, por otra parte, estudios que demuestran el escaso cumplimiento de los grupos a esta terapia, e incluso que consideran que determinadas actuaciones, concretamente la transfusión y el uso de dobutamina puede ser perjudicial28.
Otros tratamientos basados en la disfunción vascular de la sepsis29
La mayoría no han demostrado su eficacia y otros están todavía en fase experimental. Entre estos tratamientos podemos destacar las inmunoglobulinas (bloquean la unión de los receptores TLR con las moléculas asociadas a patógenos (PAMP) e impiden la translocación nuclear); el interferón gamma y el factor estimulador de colonias (GM-CSF); citoquinas inmunoestimuladoras (IL-7, IL-15) para prevenir la apoptosis inducida por células efectoras inmunes; corticoides (bloquean la translocación nuclear) y que, a diferencia de la utilidad demostrada en la vasculitis, alergia y otras alteraciones mediadas por mecanismos inmunológicos, tiene un uso muy controvertido en la disfunción microvascular inducida por el shock séptico; no se aconsejan, salvo en el shock refractario, hasta conseguir la estabilización hemodinámica; ibuprofeno (inhibe la actividad de la COX-2 y secundariamente las citocinas proinflamatorias) no habiendo encontrado mejoría en la función orgánica ni en la supervivencia, y los inhibidores de la formación de NO por inhibición de la enzima NO sintetasa inducible (L-NMMA).
SEPSIS Y FRACASO RENAL AGUDO
La insuficiencia renal aguda (IRA) se produce en el 7% de los pacientes hospitalizados y en entre el 36 y el 67% de los enfermos críticos (según la definición que se aplique). El 5-6% de los pacientes ingresados en la UCI con fracaso renal agudo (FRA) van a requerir técnicas de sustitución renal, siendo la sepsis y el shock séptico la causa más frecuente (50%), con una tasa de mortalidad que varía dependiendo de la severidad entre el 21 y el 57%.
Los pacientes con IRA séptica tienen mayor gravedad, más repercusión hemodinámica, PaO2/FiO2 menor, mayor acidosis y más puntuación en la escala RIFLE que los que presentan IRA no séptica. Es frecuente que aparezca en las primeras 24 horas del ingreso en la UCI y se asocia con a una elevada mortalidad y con una hospitalización prolongada.
Patogenia
El mecanismo de lesión renal en la sepsis y su patogenia no está del todo claro, debido a la falta de estudios histopatológicos y porque los modelos experimentales en animales produciendo la lesión de isquemia-reperfusión o toxicidad por fármacos no son comparables con la IRA séptica. Por ello, a pesar de los avances en la resucitación en los últimos años, la incidencia del FRA en el seno de la sepsis continúa siendo alta. Intervienen en su instauración factores hemodinámicos, alteraciones inmunológicas y tóxicas y, por último, las reacciones inflamatorias que afectan a la microvasculatura y que provocan tanto necrosis como apoptosis o disfunción celular y exfoliación de las células tubulares30.
En modelos experimentales se ha objetivado una amplia variación del flujo sanguíneo renal (FSR), lo que demuestra que los mecanismos que participan en la iniciación y mantenimiento de la sepsis son complejos. En el 40-50% de los casos de la IRA, el FSR es normal, lo que no justificaría la importante caída en la tasa de filtrado glomerular (FG). Un aumento de FSR y una disminución de las resistencias vasculares renales31 pueden observarse en la fase inicial de la sepsis debido a la vasodilatación producida por las prostaglandinas (PGE2, PGI1) y/o óxido nítrico (NO), así como por el aumento de la actividad del sistema cinina-calicreína intrarrenal. La vasodilatación de la arteriola aferente y eferente provoca la caída de la presión glomerular, y secundario a ello, del filtrado glomerular (FG). Se produce una redistribución de flujo favoreciendo el segmento yuxtamedular en perjuicio del cortical. Se puede concluir que el shock hipodinámico (bajo gasto cardíaco) produce IRA por isquemia y que en el estado hiperdinámico (gasto cardíaco normal o elevado), la hipoperfusión renal o isquemia no es la norma.
La IRA hiperémica, es decir, la que se produce a pesar de un flujo sanguíneo renal normal o elevado, es una forma específica de FRA en la sepsis.
Independientemente de la condición hemodinámica sistémica, las endotoxinas pueden causar la vasoconstricción de las arteriolas renales disminuyendo la perfusión y deteriorando la función renal. La endotoxemia puede provocar la disminución del FG en presencia de una perfusión renal normal o disminuida con o sin mantenimiento de la TA sistémica.
En la fase inicial de la IRA por sepsis las lesiones tubulares son focales y mínimas y la morfología glomerular está conservada, apuntando como principal responsable a la inestabilidad hemodinámica. Existen, por otra parte, efectos directos e indirectos de la endotoxemia que tras la liberación de mediadores son los responsables de la disminución del FSR, FG y disfunción tubular. La presencia de productos bacterianos en la circulación sistémica activa las células inflamatorias que infiltran el tejido renal y liberan radicales libres, proteasas y citoquinas.
La NTA es la forma más común de IRA séptica. Histológicamente se pueden encontrar tanto apoptosis como necrosis celular.
En la IRA relacionada con la sepsis, la reabsorción de Na+ en los túbulos renales está alterada de manera bifásica. Durante la fase funcional, la EF Na+ es baja, y una vez instaurada hay un aumento por la lesión tubular; todo ello parece verse influido por el efecto de las citoquinas (natriuresis por IL-1). Los niveles de angiotensina I y II (responsables de la vasoconstricción de la arteriola eferente y células mesangiales) están disminuidos, provocando una caída de la presión glomerular, por vasodilatación de la arteriola eferente y, secundariamente, del FG. Se produce un descenso de la proliferación y regeneración celular y un aumento de la apoptosis.
Tratamiento
Entre las medidas más efectivas se encuentran el mantenimiento de la perfusión renal, la administración precoz de antimicrobianos y la prevención del daño renal secundario32.
Para optimizar la perfusión, se requiere una adecuada reposición de volumen, existiendo en la actualidad una estrategia más conservadora en relación con el SDRA33, inotrópicos o vasopresores. Una TAM >65 mmHg es generalmente suficiente, pero hay que tener en cuenta la pérdida de la capacidad de autorregulación renal en el fracaso renal establecido y que la perfusión puede ser dependiente de la TA variando con la edad y enfermedades subyacentes34.
En relación con la utilización de antibióticos de manera precoz (menos de una hora del diagnóstico de sepsis severa), se ha demostrado que mejora la supervivencia, y que el deterioro de la función renal está relacionado con la mayor duración de la hipotensión hasta recibir antimicrobianos35. La IRA es un indicador independiente del mal pronóstico y el empeoramiento de la función renal en las primeras 24 horas se asocia con mayor mortalidad.
Para prevenir el daño secundario debemos asegurar la volemia, controlar la glucemia y evitar nefrotóxicos (factor contribuyente de la IRA en el 25% de los casos).
Es necesario desterrar de nuestro arsenal terapéutico, tanto para la prevención como para el tratamiento, el uso de la dopamina como renoprotector; está demostrado que ni previene ni mejora la IRA y puede aumentar la mortalidad.
En cuanto a los diuréticos, específicamente los de asa por su amplio uso, tampoco han demostrado ser útiles ni en la prevención ni el tratamiento del fracaso renal, y por el contrario, pueden precipitarlo si no se ha realizado una adecuada precarga. En el FRA establecido no parece que acorten la duración, disminuyan la necesidad de diálisis ni mejoren la supervivencia, y sí que pueden favorecer el aumento de la mortalidad. Su uso ha de hacerse sólo cuando esté garantizada la repleción de volumen y en algunos casos específicos en los que por la edad o la patología de base estén contraindicadas las técnicas de depuración renal.
TRATAMIENTO RENAL SUSTITUTIVO
Una proporción significativa de pacientes con IRA séptica requieren técnicas de tratamiento renal sustitutivo (TRS). El 38% de los pacientes reciben tratamiento de depuración extrarrenal, y de éstos, en el 84% son técnicas continuas de depuración extracorpórea (TCDE). El tiempo de inicio, el método y la dosis continúan siendo inciertos.
Estas técnicas pueden ayudar a proporcionar el soporte de otros órganos en el SDMO tanto por el aclaramiento de los mediadores humorales como por la restauración de la homeostasis mejorando la microcirculación, por la eliminación del líquido intersticial y optimizando las presiones tisulares.
El tratamiento de la sepsis asociada a la IRA es un cambio emergente en las UCI debido a la incidencia y a la alta mortalidad. Durante la última década se ha postulado que la hemofiltración estándar es incapaz de mejorar la supervivencia por lo que nuevas aproximaciones terapéuticas están basadas en la fisiopatología de la sepsis y SDMO, y consisten en la capacidad de aclaramiento de moléculas entre 20 y 30 kD. En los últimos años se ha tomado conciencia de la importancia del inicio precoz de las técnicas de depuración, perdiendo progresivamente el miedo a empeorar el FRA y por tanto el pronóstico del enfermo séptico. Son múltiples los trabajos aparecidos, no todos con las mismas conclusiones, en relación el tiempo, método y dosis, aunque sí parece haber cierta unanimidad en el inicio precoz de la depuración extrarrenal en el enfermo con IRA séptica.
A pesar de la amplia utilización de las técnicas continuas y su más extendida utilización en la sepsis, no puede concluirse el beneficio sobre las intermitentes, considerando su eficacia equivalente. En la Tercera Conferencia de Consenso Internacional de ADQI del grupo de trabajo hemofiltración y hemoperfusión en sepsis consideran que los pacientes con sepsis y FRA deben recibir un tratamiento diferente y que la HFVVC puede ser fisiológicamente mejor que la intermitente en presencia de inestabilidad hemodinámica.
Ronco y Ricci, en un estudio sobre la fisiología de ambas técnicas36, concluyen que en el modo intermitente se produce un mayor cambio en las presiones transcelular e intersticial y se favorece el edema posdiálisis. Entre las ventajas de las técnicas continuas se encuentran que favorecen un adecuado aporte proteico mejorando la inmunomodulación, preservan la perfusión tisular por optimizar el paso de fluidos del intersticio al torrente circulatorio y puede conseguirse con ellas un mejor control ácido-base por depuración de los aniones no medidos, fosfatos y ácido láctico. Como efectos negativos señalan que pueden producir la activación de la cascada de la coagulación, complemento, plaquetas y leucocitos, precisar anticoagulación, producir según el ritmo de ultrafiltración pérdidas de aminoácidos (10%), vitaminas y oligoelementos, necesidad de ajuste del aclaramiento de antibióticos, posibilidad de pérdidas hemáticas y alteración de la temperatura, entre otros.
Las técnicas más específicas utilizadas en la sepsis tienen su fundamento en la depuración de mediadores en el torrente sanguíneo o en los tejidos. Destacan en la actualidad:
1. Hemofiltración de alto volumen (HVHF) continua o en pulsos. Definida por Ronco en el año 200037. El objetivo de la técnica es aumentar la posibilidad de eliminar algunas moléculas implicadas en la fisiopatología de la IRA y la sepsis. Su utilidad ha sido demostrada en modelos experimentales de animales con sepsis y aplicada posteriormente a pacientes en esta situación y en algunos tipos de intoxicaciones. La tasa de ultrafiltración es mayor de 35 ml/kg/h, habitualmente de 50-70 ml/kg/h (media de 45 ml/kg/h) si se realiza de manera continua o 100-120 ml/kg/h si es por pulsos (6-8 horas). En ambos casos se superan los 80 l/día de ultrafiltrado. Hay que tener en cuenta que se precisa un catéter que proporcione un alto flujo sanguíneo (300 ml/m), una membrana que lo permita, precisión técnica, sistema de calentamiento específico (>38 ºC) y personal entrenado. Es necesario enfatizar en la dosificación de fármacos y en el aporte nutricional (aminoácidos, vitaminas y fosfatos). Los que defienden la técnica explican la mejoría hemodinámica por una disminución de los mediadores en el compartimento sanguíneo, tisular e intersticial. Existen trabajos que cuestionan su beneficio39,40 concluyendo que el soporte intensivo no disminuye la mortalidad, no favorece la recuperación renal y no reduce la frecuencia de fallo orgánico no renal en comparación con técnicas menos intensivas.
2. Hemofiltración con membranas de alta permeabilidad. Específicamente diseñadas para el aclaramiento de mediadores proinflamatorios y antiinflamatorios según el pico de concentración. Su utilización parece que mejora la supervivencia si se compara con las membranas convencionales. Una de las desventajas es que por el aumento de diámetro del poro puede existir una pérdida significativa de proteínas.
3. Hemofiltración de alta adsorción. Se produce por la unión de moléculas de solutos sobre superficies sólidas, es específica para cada soluto y depende de la afinidad química (entre los solutos y membrana), la capacidad adsortiva y la superficie de la membrana. Puede realizarse de manera no selectiva (carbón, hemodiadsorción, adsorción, filtración plasmática acoplada [CPFA] y hemoperfusión) o selectiva (membranas con polimixina B o de polietilenimina).
CONCLUSIONES
La sepsis severa y el shock séptico son un problema de salud mayor que afecta a millones de personas cada año, siendo la hipoxia tisular uno de los factores más importantes en el desarrollo del síndrome de disfunción multiorgánica. La clave para un adecuado tratamiento en la sepsis es el reconocimiento y resucitación precoz. La administración urgente de antibióticos (menos de una hora) es una de las medidas que han demostrado que mejoran el curso clínico y la supervivencia. Recientes avances en la biología molecular han mejorado de forma significativa la investigación de la patogenia, lo que debería aplicarse a la mejora del tratamiento.
La IRA se asocia con frecuencia y de manera precoz con el shock séptico, incrementando la mortalidad. El tratamiento de la IRA séptica consiste en prevenirla, es decir, tratando agresivamente la sepsis y evitando el daño renal secundario. Con las evidencias actuales, y en relación con las técnicas de depuración extracorpórea, la hemofiltración continua estándar no parece que mejore la supervivencia comparada con las técnicas intermitentes. La utilización de técnicas más específicas (aumentando la tasa de ultrafiltración, membranas de alta permeabilidad y uso de adsorbentes) requiere de estudios posteriores bien diseñados.
PUNTOS CLAVE
1. El reconocimiento de la sepsis grave que puede amenazar la vida es prioritario.
2. La necesidad de un adecuado tratamiento urgente es mobligada.
3. El aumento de la tensión arterial (TA) no necesariamente conlleva una mejora en la perfusión tisular.
4. El objetivo terapéutico en la sepsis severa y en el shock séptico es la perfusión y no la TA.
5. La IRA séptica puede originarse independientemente del gasto cardiaco, siendo éste el único factor independiente del flujo sanguíneo renal.
6. La dopamina y los diuréticos no son una opción terapéutica para la prevención o el tratamiento del FRA.
7. Existen evidencias razonables del mejor pronóstico con la intervención temprana y el modo continuo de las TDE en los enfermos inestables, a pesar de la controversia en las publicaciones.
Figura 1.
Figura 2.
Tabla 1. Lista parcial del balance de mediadores inflamatorios tomada de Roco C, Bellomo R, Kellum J. Critical Care Nephrology (2.ª ed.).
Figura 3.