Las alteraciones del metabolismo óseo y mineral son complicaciones frecuentes de los pacientes de hemodiálisis que presentan una gran variabilidad geográfica.
ObjetivosEl objetivo del presente estudio fue evaluar por primera vez dichas alteraciones en pacientes de hemodiálisis de Perú.
MétodosEl estudio incluyó 1.551 pacientes de hemodiálisis de 55 centros concertados con el seguro social de salud de Perú, pertenecientes a la ciudad de Lima. De cada paciente se recogieron datos demográficos, comorbilidades, tratamientos y parámetros bioquímicos. Los valores de calcio, fósforo y PTH fueron categorizados según los rangos recomendados en las guías KDOQI y KDIGO.
ResultadosLa edad media de los pacientes fue de 59,5±15,6, con tiempo medio en hemodiálisis de 58,0±54,2 meses. Todos los pacientes se dializaban con una concentración de calcio en el líquido de diálisis de 3,5mEq/l y el 68,9% recibían captores de fósforo (98,4% carbonato de calcio). Se observó un alto porcentaje de pacientes con calcio sérico por encima y fósforo sérico por debajo de los rangos recomendados en las guías KDOQI (32,8% y 37,3% respectivamente). Más de la mitad de los pacientes tenían valores de PTH por debajo de los rangos recomendados, tanto en KDOQI como en KDIGO (56,4% y 51,6% respectivamente).
ConclusionesLos pacientes incluidos en el presente estudio se caracterizaron por ser más jóvenes que los de otros estudios y por tener hipofosforemia y PTH suprimida, probablemente debido a una excesiva sobrecarga de calcio a través del líquido de diálisis y el empleo de captores de fósforo con calcio.
Mineral and bone metabolism disorders are common complications in haemodialysis patients that present significant geographical variability.
ObjectivesThe objective of this study was to assess these disorders for the first time in haemodialysis patients from Peru.
MethodsThe study included 1551 haemodialysis patients from 55 centres affiliated with the Social Health System of Peru in the city of Lima. Demographic data, comorbidities, treatments and biochemical parameters were collected from each patient. Serum calcium, phosphorus and PTH levels were categorised according to the recommended ranges in the KDOQI and KDIGO guidelines.
ResultsThe mean age of the patients was 59.5±15.6 years, with a mean time on haemodialysis of 58.0±54.2 months. All patients were dialysed with a calcium concentration in the dialysis fluid of 3.5 mEq/l and 68.9% of patients were prescribed phosphate-binding agents (98.4% of them calcium carbonate). A high percentage of patients showed serum calcium above, and serum phosphorus below, the recommended ranges in the KDOQI guidelines (32.8% and 37.3%, respectively). More than half of the patients had serum PTH values below the recommended ranges of both the KDOQI and KDIGO guidelines (56.4% and 51.6%, respectively).
ConclusionsPatients included in this study were younger than those from other studies and showed both hypophosphataemia and suppressed PTH, probably due to an excessive calcium overload through dialysis fluid and the use of calcium-containing phosphate binding agents.
Las alteraciones del metabolismo óseo y mineral asociados a la enfermedad renal crónica (denominación anglosajona de Chronic Kidney Disease-Mineral Bone Disorder) hace referencia a un desorden que se manifiesta en forma de alteraciones bioquímicas, esqueléticas y/o calcificaciones extraesqueléticas1. En conjunto, numerosos estudios han mostrado asociación entre la presencia de estas alteraciones y un mayor riesgo de mortalidad2–12. Con objeto de homogeneizar y mejorar el manejo de todos estos trastornos se han desarrollado diferentes guías de práctica clínica como KDOQI13 de la National Kidney Foundation, KDIGO14 de la International Society of Nephrology y las guías de las sociedades española15 y argentina de nefrología16, entre otras.
Desde la aparición de estas guías se han publicado números estudios que han pretendido conocer la situación de estas alteraciones en distintos países y regiones; sin embargo, en Latinoamérica existen pocos estudios. Una excepción es el estudio CORES, publicado en 200817, que incluyó datos de 6 países latinoamericanos pero no de Perú.
El objetivo de este estudio transversal fue evaluar las características demográficas, comorbilidades, tratamientos y diferentes parámetros bioquímicos de pacientes con ERC5D tratados en 55 centros de hemodiálisis de carácter privado de la ciudad de Lima que tenían contrato con el seguro social de salud del país (EsSalud). Este primer estudio pretende dar un paso que ayude a conocer mejor la realidad de un grupo de centros de Lima con objeto de poner en marcha estrategias destinadas a mejorar el tratamiento de estos pacientes.
Pacientes y métodosEstudio observacional de corte transversal que incluye 1.551 pacientes en hemodiálisis de 55 centros privados de la ciudad Lima, Perú. Los datos fueron recopilados entre noviembre y diciembre de 2014. Los centros de hemodiálisis incluidos en este análisis fueron aquellos que habían obtenido mediante concurso en 2014 contrato con EsSalud para atención de hemodiálisis convencional con reutilización de pacientes asegurados por EsSalud que no podían ser atendidos por las unidades de hemodiálisis propias de este sistema nacional de salud. En dicho contrato se establecían unos estándares de calidad en cuanto a personal, instalaciones y condiciones del servicio (ver documento en material suplementario).
De cada paciente se recogieron los datos demográficos (edad, sexo y tiempo en diálisis), comorbilidades (diabetes, paratiroidectomía y trasplante previo), tratamientos (concentración de calcio en el baño de diálisis, horas de diálisis por semana, captores de fósforo y tipo, vitamina D activa y tipo, tratamiento con agentes estimulantes de la eritropoyesis) y parámetros bioquímicos (calcio, fósforo, PTH, fosfatasa alcalina, albúmina, hemoglobina). Todos los parámetros bioquímicos fueron medidos en un mismo laboratorio central. Para el calcio se utilizó un método colorimétrico (NM-BAPTA) y para el fósforo el método de punto final (molibdato de amonio), con un equipo P 800 Roche. El kit empleado para la determinación de PTH fue Elecsys 2010 de Roche (PTH Biointact 1-84) con un equipo Cobas 601 de Roche.
Los valores de calcio, fósforo y PTH fueron categorizados según los rangos recomendados en las guías KDOQI (calcio corregido por albúmina: 8,4-9,5mg/dl, fósforo: 3,5-5,5mg/dl y PTH: 150-300 pg/ml)13 y KDIGO (calcio: valores normales de 8,5-10,2mg/dl, fósforo: valores normales de 3,0-4,5mg/dl y PTH: 2 a 9 veces el valor máximo de la normalidad 130-585pg/ml)14. Además, se hicieron análisis específicos en los que se describió la población por cuartiles de PTH y fósforo y según el diagnóstico de diabetes, terciles de tiempo en diálisis, prescripción de captores de fósforo y utilización de vitamina D activa.
Para la descripción de la población se utilizó porcentaje, media y desviación estándar o mediana y rango intercuartil según las características de cada variable. La comparación entre distintos grupos se realizó mediante Chi cuadrado, test «t de Student», análisis de varianza de una vía y/o test de Wilcoxon. Todos los análisis estadísticos se realizaron con el software R versión 3.0.1 (R Foundation for Statistical Computing, Viena, Austria).
ResultadosLa edad media de los pacientes fue de 59,5±15,6, con tiempo medio en hemodiálisis de 58,0±54,2 meses; el porcentaje de pacientes diabéticos fue 30,4%. Las características demográficas y comorbilidades de la población se pueden observar en la tabla 1, de las que es importante destacar que todos los pacientes fueron dializados con una concentración de calcio en el líquido de diálisis de 3,5mEq/l. Al 68,9% se les prescribía captores de fósforo, en su mayoría de tipo cálcicos (98,4% carbonato de calcio y 1,6% sevelamer).
Descripción de los pacientes según sus características demográficas, comorbilidades, tratamientos y parámetros bioquímicos
| Edad (años) (n, media±SD) | 1.551 | 59,5±15,6 |
| Sexo (N, % hombres) | 1.549 | 53,9 |
| Tiempo en diálisis (meses) (n, media±SD) | 1.481 | 58,0±54,2 |
| Diabetes (n, %) | 1.545 | 30,4 |
| Paratiroidectomía (n, %) | 1.551 | 0,1 |
| Trasplante previo (n, %) | 1.551 | 1,4 |
| Horas de diálisis por semana (horas) (n, media±SD) | 1.551 | 10,5±0,2 |
| Concentración de calcio en el líquido de diálisis | 1.551 | 100 |
| 2,5mEq/l (n, %) | 0 | 0 |
| 3,0mEq/l (n, %) | 0 | 0 |
| 3,5mEq/l (n, %) | 1.551 | 100 |
| Prescripción de vitamina D activa (n, %) | 572 | 36,9 |
| Calcitriol (n, %) | 552 | 35,6 |
| Alfacalcidol (n, %) | 0 | 0 |
| Paricalcitol (n, %) | 20 | 1,3 |
| Prescripción de captores de fósforo | 1.069 | 68,9 |
| Calcio (n, %) | 1.051 | 67,8 |
| Sevelamer (n, %) | 17 | 1,1 |
| Lantano (n, %) | 1 | 0,1 |
| Calcio sérico (n, media±SD) (mg/dl) | 1.551 | 9,4±0,7 |
| Calcio sérico corregido por albúmina (mg/dl) (n, media±SD) | 1.551 | 9,3±0,7 |
| Fósforo sérico (mg/dl) (n, media±SD) | 1.551 | 4,2±1,7 |
| PTH (pg/ml) (n, mediana[IQR]) | 1.547 | 124,4[240,3] |
| PTH (pg/ml) (n, media±SD) | 1.547 | 262,9±411,0 |
| Fosfatasa alcalina (UI/L) (n, mediana[IQR]) | 1.551 | 114,0[73,0] |
| Fosfatasa alcalina (UI/L) (n, media±SD) | 1.551 | 153,6±128,4 |
| Albúmina (g/dl) (n, media±SD) | 1.551 | 4,0±0,4 |
| Hemoglobina (g/dl) (n, media±SD) | 1.551 | 10,9±1,9 |
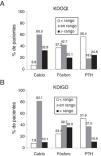
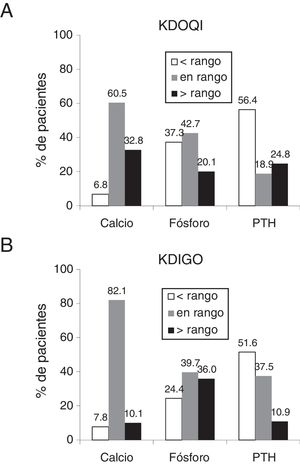
El porcentaje de pacientes que tenían calcio y fósforo sérico dentro de los rangos recomendados en las guías de práctica clínica KDOQI fue de 60,5% y 42,7% respectivamente (fig. 1A) y de 82,1% y 39,7% según las guías KDIGO (fig. 1B), mientras que los que tenían calcio sérico mayor y fósforo sérico menor del rango recomendado en KDOQI fue de 32,8% y 37,3% respectivamente (fig. 1A). Con respecto a la PTH más de la mitad de pacientes tenía valores por debajo de los rangos recomendados, tanto en KDOQI como en KDIGO (56,4% y 51,6% respectivamente [figs. 1A y B]). Los pacientes que tenían a la vez los 3 parámetros bioquímicos (calcio, fósforo y PTH) dentro de los rangos recomendados por las guías KDOQI y KDIGO representaban el 4,5% y 12,1% respectivamente.
Porcentaje de pacientes en los rangos recomendados por las guías KDOQI (A) y KDIGO (B).
Los rangos recomendados por las guías KDOQI son calcio corregido por albúmina: 8,4-9,5mg/dl, fósforo: 3,5-5,5mg/dl y PTH: 150-300 pg/ml13 y por las guías KDIGO, calcio: valores normales 8,5-10,2mg/dl, fósforo: valores normales 3,0-4,5mg/dl y PTH: 2 a 9 veces el valor máximo de la normalidad 130-585pg/ml14.
Las tablas 1 y 2 del material suplementario describen los pacientes según los cuartiles de PTH y fósforo. La edad y el porcentaje de hombres y diabéticos descendió a medida que aumentaba la PTH, mientras que el tiempo en diálisis aumentó (tabla 1 del material suplementario). No se observaron diferencias relevantes en los distintos cuartiles de fósforo sérico, excepto el aumento de los niveles de albúmina sérica con el fósforo (tabla 2 del material suplementario).
Los pacientes diabéticos eran mayores que el resto de pacientes (tabla 3 del material suplementario) con un tiempo en diálisis menor y valores de PTH menores en comparación con los no diabéticos. Los valores de calcio, fósforo y albúmina no mostraron diferencias entre ambos grupos (tabla 3 del material suplementario).
Los resultados relacionados con el tiempo en diálisis se detallan en la tabla 4 del material suplementario en la que se observa que los pacientes con mayor tiempo en diálisis eran más jóvenes, había menos hombres y diabéticos y mostraban niveles de PTH sérica más elevados.
Los pacientes con prescripción de vitamina D activa eran más jóvenes y tenían valores más elevados de PTH en comparación con aquellos a los que no se les prescribía vitamina D. Los valores de calcio, fósforo y albúmina no fueron diferentes entre ambos grupos (tabla 2).
Características de los pacientes según la prescripción o no de vitamina D activa
| Todos (n=1551) | No (n=979) | Sí (n=572) | Valor de p | |
|---|---|---|---|---|
| Edad (años) (media±DS) | 59,5±15,6 | 60,2±15,6 | 58,3±15,6 | 0,018 |
| Sexo (% hombres) | 53,9 | 55,5 | 51,2 | 0,1 |
| Diabetes (%) | 30,4 | 30,0 | 31,2 | 0,7 |
| Tiempo en diálisis (meses) (media±DS) | 58,0±54,2 | 59,6±53,5 | 55,3±55,1 | 0,1 |
| PTH (pg/ml) (mediana [IQR]) | 124,4 [240,2] | 113,7 [194,8] | 157,0 [278,8] | <0,001 |
| PTH (pg/ml) (media±DS) | 262,9±411,0 | 237,8±367,4 | 306,0±473,7 | 0,003 |
| Calcio (mg/dl) (Media±DS) | 9,4±0,7 | 9,3±0,7 | 9,4±0,7 | 0,6 |
| Calcio corregido (mg/dl) (Media±DS) | 9,3±0,7 | 9,3±0,7 | 9,3±0,7 | 0,8 |
| Fósforo (mg/dl) (Media±DS) | 4,2±1,7 | 4,2±1,7 | 4,2±1,7 | 0,8 |
| Fosfatasa alcalina (UI/l) (mediana [IQR]) | 114,0 [73,0] | 115,0 [72,3] | 114,0 [76,8] | 0,4 |
| Fosfatasa alcalina (UI/l) (media±DS) | 153,6±128,4 | 155,8±134,6 | 149,8±116,9 | 0,4 |
| Albúmina (g/dl) (media±DS) | 4,0±0,4 | 4,0±0,4 | 4,0±0,4 | 0,6 |
| Hemoglobina (g/dl) (media±DS) | 10,9±1,9 | 10,9±1,9 | 10,9±1,9 | 0,8 |
En la tabla 3 se muestran las características de los pacientes en función de la prescripción de captores de fósforo. Los pacientes a los que se les prescribía captores de fósforo eran más jóvenes, había un mayor porcentaje de diabéticos y habían estado menos tiempo en diálisis. No se observaron diferencias de fósforo sérico entre ambos grupos ni tampoco en los valores de calcio, PTH, fosfatasa alcalina y albúmina.
Características de los pacientes según la prescripción o no de captores de fósforo
| Todos (n=1.551) | No (n=482) | Sí (n=1.069) | Valor de p | |
|---|---|---|---|---|
| Edad (años) (media±DS) | 59,5±15,6 | 60,9±15,7 | 58,9±15,6 | 0,021 |
| Sexo (% hombres) | 53,9 | 57,8 | 52,2 | 0,046 |
| Diabetes (%) | 30,4 | 26,6 | 32,2 | 0,030 |
| Tiempo en diálisis (meses) (Media±DS) | 58,0±54,2 | 63,5±51,5 | 55,7±55,1 | 0,01 |
| PTH (pg/ml) (mediana [IQR]) | 124,4 [240,2] | 125,9 [260,3] | 123,8 [223,5] | 0,6 |
| PTH (pg/ml) (media±DS) | 262,9±411,0 | 262,9±355,9 | 262,9±433,7 | 1,0 |
| Calcio (mg/dl) (media±DS) | 9,4±0,7 | 9,4±0,7 | 9,3±0,7 | 0,4 |
| Calcio corregido (mg/dl) (media±DS) | 9,3±0,7 | 9,3±0,7 | 9,3±0,7 | 0,4 |
| Fósforo (mg/dl) (Media±DS) | 4,2±1,7 | 4,2±1,7 | 4,2±1,7 | 0,5 |
| Fosfatasa alcalina (UI/l) (mediana [IQR]) | 114,0 [73,0] | 116,0 [70,8] | 114,0 [77,0] | 0,5 |
| Fosfatasa alcalina (UI/l) (Media±DS) | 153,6±128,4 | 158,6±136,0 | 151,3±124,7 | 0,3 |
| Albúmina (g/dl) (media±DS) | 4,0±0,4 | 4,0±0,4 | 4,0±0,4 | 0,9 |
| Hemoglobina (g/dl) (media±DS) | 10,9±1,9 | 10,9±2,0 | 10,9±1,8 | 0,6 |
El presente estudio es el primero a gran escala (55 centros, 1.551 pacientes) que describe los hallazgos de una parte de la población de diálisis de Lima, Perú. Según datos del Ministerio de Salud de Perú de junio de 201518 en Perú había 12.773 pacientes en hemodiálisis de los que 5.400 (42%) pertenecían a su capital, Lima. Por tanto, los pacientes incluidos en el presente estudio (1.551) representan aproximadamente el 29% de la población de diálisis de Lima y el 12% del total del país. Como rasgos comunes generales relevantes hay que destacar que en este grupo de pacientes se observó un elevado porcentaje de pacientes con PTH suprimida e hipofosforemia.
Las alteraciones del metabolismo óseo y mineral de la enfermedad renal crónica están presentes en menor o mayor medida en todos los pacientes en hemodiálisis con una gran variabilidad geográfica, debido en parte a las diferentes posibilidades de acceso al tratamiento dialítico basado en aspectos económico-sociales y en distintos sistemas de cobertura de la salud. Todos estos factores tienen la capacidad de influir sobre los aspectos demográficos, etiopatogénicos y evolutivos de las alteraciones del metabolismo óseo y mineral. Los pacientes del presente estudio fueron más jóvenes que los de los estudios COSMOS (64,8±14,2)19 y DOOPS11 (61,7±14,5), pero similares a los de CORES8, este último realizado con pacientes de 6 países de Latinoamérica en el que no se incluyeron pacientes de Perú. Por el contrario, otros aspectos como el porcentaje de diabéticos (30,4%) fue similar a COSMOS19 (29,5%), DOOPS11 (35,1%) y el Observatorio Francés de Fósforo y Calcio (French Phosphate and Calcium Observatory [FPCO])20 (27,3%). También fue similar el tiempo en diálisis (58,0±54,2 meses), COSMOS19 (50,4±52,8 meses) y DOOPS11 (56,4±67,2 meses).
Una característica muy diferente de estos pacientes que probablemente haya tenido una gran influencia en los resultados observados radica en que fueron dializados en su totalidad con una concentración de calcio en el líquido de diálisis de 3,5mEq/l, muy superior al reportado en otras cohortes17,19,21. El empleo de concentraciones tan elevadas de calcio en el líquido de diálisis produce un balance neto positivo de calcio22,23 provocando elevaciones transitorias —no siempre detectables— de calcio y supresión de PTH, que son 2 de los hallazgos más llamativos del presente estudio. Además, la utilización de 3,5mEq/l de calcio en el líquido de diálisis se aleja de las recomendaciones de todas las guías de práctica clínica13–16 que oscilan entre 2,5 y 3,0mEq/l. Otra diferencia importante para interpretar los resultados radica en las horas de diálisis semanales de los pacientes de este estudio (10,5±0,2h), inferiores a los estándares habituales, no alcanzando de media las 4horas por sesión17,24.
El uso de captores de fósforo y vitamina D activa (68,9% y 36,9% respectivamente) fue también inferior al observado en otros estudios de Europa, Estados Unidos, Australia, Canadá y Japón (COSMOS24 —85,1% y 48%—, DOOPS11 —90,2% y 52%—, FPCO20 —80% y 48,2%—). Si se comparan los resultados obtenidos en los 55 centros de Lima con el estudio CORES de Latinoamérica, también hay diferencias, pero para esta comparación solo disponemos de datos de pacientes tratados con vitamina D activa (45,5%)8.
Si bien en todos los estudios internacionales ya mencionados el principal captor de fósforo utilizado fue también de tipo cálcico, el porcentaje de utilización del mismo era inferior, dado que en dichos estudios se utilizaban además de los captores cálcicos otros tipos de captores. Por el contrario, en este estudio de Lima prácticamente la totalidad de pacientes (98,4%) recibía captores con calcio. La elevada concentración de calcio en el líquido de diálisis y la utilización casi exclusiva de captores de fósforo cálcicos explica que el valor medio de calcio sérico observado en el presente estudio (9,4mg/dl) fuese mayor que el observado en los estudios FPCO (8,9mg/dl)20, COSMOS (9,1±0,7)5 y DOOPS (9,3±0,9mg/dl)11 y que por lo tanto el porcentaje de pacientes con calcio sérico superior a los rangos recomendados en KDOQI13 y KDIGO14 fuese mayor que el observado en COSMOS19.
Como ya se ha comentado, en este estudio se observó un elevado porcentaje de pacientes con PTH muy baja (figs. 1A y B), con valores medios muy inferiores a los observados en otros estudios11,17,19, probablemente debido a la llamativa supresión de PTH secundaria a la gran sobrecarga de calcio oral y a través de los líquidos de diálisis. Si bien los niveles de PTH se asociaron con factores tales como la edad, el sexo, el tiempo en diálisis y la diabetes (tabla 1 del material suplementario), estos no pueden explicar los bajos niveles observados en el presente estudio. La única diferencia relevante del presente estudio con respecto a otros fue una edad media más joven, lo que podría justificar PTH más elevada pero no más baja. La asociación de escasa actividad ósea coincidente con una permanente sobrecarga de calcio son 2 factores que favorecen las calcificaciones en tejidos blandos, especialmente arterias y válvulas cardiacas25.
El siguiente hallazgo muy llamativo de este estudio fue el elevado porcentaje de pacientes que presentaban fósforo sérico bajo, muy superior a los porcentajes observados en otros estudios8,11,19. La hiperfosforemia es habitual en hemodiálisis porque la diálisis no suele ser suficiente para eliminar el fósforo aportado por la dieta y por la movilización desde el hueso fundamentalmente en situaciones de PTH elevada26. En el presente estudio observamos lo contrario, y si bien no disponemos de datos de ingesta proteica, los niveles de fósforo observados podrían sugerir una baja ingesta proteica y un mayor grado de desnutrición de estos pacientes; de hecho, los niveles bajos de fósforo se asociaron con menores niveles de albúmina, único indicador nutricional del estudio (tabla 2 del material suplementario). En contra de esa posibilidad, los niveles medios de albúmina observados fueron incluso mayores que los observados en otros estudios. Esto nos permitiría especular que si bien la hipofosforemia suele ser responsable de niveles bajos de PTH también puede ocurrir lo contrario cuando existen importantes causas mantenidas de supresión de PTH, como las observadas en este estudio. La supresión mantenida de PTH, con el consecuente menor recambio óseo, disminuye la salida de fósforo del hueso, y esta reducción de aporte de fósforo al torrente sanguíneo puede llegar a tener la misma importancia que una dieta baja en fósforo en la génesis de hipofosforemia en este tipo de pacientes.
Como ya es conocido, la diabetes, al igual que la edad avanzada, está asociada a bajo remodelado y cursa con PTH disminuida. En este estudio la presencia de diabetes también se asoció con valores inferiores de PTH. Estos resultados coinciden con otros estudios como CORES (pacientes de Latinoamérica)8 y otros5,6 en los que también se ha observado un elevado porcentaje de diabéticos en pacientes con PTH bajas.
En esta cohorte de pacientes de Lima el porcentaje de pacientes que recibían VDRA (vitamina D activa) fue inferior a lo observado en otras cohortes17, por lo tanto no es posible adjudicar el elevado porcentaje de pacientes con PTH muy baja al exceso de utilización de VDRA. Por el contrario, los pacientes que recibían VDRA tenían valores más elevados de PTH y eran más jóvenes, al igual que lo observado en otros estudios17,27.
Por último, y en relación con el control de la hiperfosforemia, las guías aconsejan utilizar captores de fósforo para mantener los valores de fosforemia dentro de los rangos recomendados13,14, pero ninguna guía especifica el tipo de captor a utilizar. En general se aconseja evitar el uso de captores que contengan calcio cuando existen calcificaciones vasculares, hipercalcemia, enfermedad ósea adinámica o niveles de PTH persitentemente bajos. En el presente estudio, como era de esperar, debido a la elevada prevalencia de fosforemias normales y bajas, se prescribían captores de fósforo a menos del 70% de los pacientes en contraste con cifras de 80-95% en otros estudios21,24. En contra de lo esperable en este estudio los niveles de fósforo sérico no fueron más elevados en el grupo de pacientes con prescripción de captores de fósforo, hecho que difiere de lo observado en otros estudios21,24,28 y permite sospechar que los criterios de prescripción de captores de fósforo posiblemente no fueron homogéneos.
Los pacientes incluidos pertenecen a 55 centros privados que se dializaban con unos estándares de calidad comunes exigidos por el Sistema Nacional de Salud de Perú, pero solo son aproximadamente 1/3 de los pacientes que se dializan en Lima, y por tanto no representan a la población total de hemodiálisis de Lima ni a la de Perú en su conjunto, siendo esta una limitación del estudio. No obstante, una importante fortaleza del estudio es que los parámetros bioquímicos de los 1.551 pacientes fueron analizados de manera centralizada y con la misma metodología. Otro importante aspecto positivo es que este análisis representa el primer estudio a media-gran escala que intenta conocer y evaluar los parámetros de metabolismo óseo y mineral en una población de diálisis de Perú.
En resumen, los pacientes de esta muestra de pacientes de Lima se caracterizan por ser más jóvenes que otras poblaciones de pacientes en hemodiálisis estudiadas11,19,20, por dializarse con concentraciones de calcio en el líquido de diálisis elevadas, lo que unido al empleo casi exclusivo de captores de fósforo con calcio sugiere que están sometidos a una gran sobrecarga de calcio que justifica la elevada prevalencia de pacientes con PTH suprimida. Este último hecho justifica un remodelado óseo bajo que podría, junto a una posible baja ingesta de fósforo (en este estudio no probada), ser responsable de la elevada prevalencia de hipofosforemia observada en esta cohorte. El trabajo aporta información que corresponde aproximadamente a 1/3 de los pacientes de Lima y a poco más del 10% de pacientes de todo Perú, pero no nos permite generalizar los resultados a todo el país. Sin embargo, consideramos que representa una gran aportación al conocimiento del escenario actual de la hemodiálisis, al menos de una parte importante de los pacientes de Lima, que permite tener una base para revisar estrategias de manejo de pacientes en hemodiálisis con el objeto de disminuir las alteraciones del metabolismo óseo y mineral en hemodiálisis.
FinanciaciónEl Servicio de Metabolismo Óseo y Mineral del Hospital Universitario Central de Asturias recibe financiación del Instituto de Salud Carlos III (ISCIII), ISCIII Retic REDinREN (RD06/0016/1013, RD12/0021/1023 y RD16/0009/0017), ISCIII (ICI14/00107), Fondo Europeo de Desarrollo Regional (FEDER), Plan Estatal de I+D+I 2013-2016, Plan de Ciencia, Tecnología e Innovación 2013-2017 del Principado de Asturias (GRUPIN14-028) y Fundación Renal Íñigo Álvarez de Toledo (FRIAT).
Conflicto de interesesNinguno que pueda afectar a la objetividad del estudio.
A Sara Huamaní Cucchi y Angie Vanesa Cáceres Huamaní por su contribución al estudio, a todos los centros privados de hemodiálisis de la ciudad capital Lima-Perú y al Centro Nacional de Salud Renal-EsSalud. Centros de diálisis participantes en el estudio: Benedicto XVI, C.D. Callao, C.D. Comas SAC, C.D. Vida Renal, C.E. San Judas, C.N. Cipreses, Caminos del Inca, CD Jesús María, CD. Benedicto X, CD. Tingo María, CD. Zárate, Cenper SAC, Centro de Diálisis Vida Renal, Centro de Prevención de Enfermedad Renal SAC, Centro de Salu, Centro de Salud Renal S.A.C., Centro especializado de Enfermedades Renales, Centro Nefrológico S.A., Centro Nefrológico Villa Sur, Centro Renal San Marcelo S.A., CIA. de Servicios Múltiples, S.A.C. Nordial, Clínica de Enfermedades Renales Grau, Clínica del Riñón S.A.C., Clínica Integral Santa Elena E.I.R.L., CM Jesús María, Comas SAC, Cono Norte, Davita S.A, Instituto de Diálisis y Transplante S.A.C., Interdial, Inversiones Médicas Peruanas SAC, Nefro Continente, Nephro Care, Nordial, Om Dial SAC, Peruano América, Plus Vida Cañete, Plusvida, Pronefros S.A.C, Renal Care, Renexa, Riobranco Inversiones Médicas SAC, San Fernando, San Juan Masias, San Miguel, Santa Ana, Santa Ena, Santa Patricia, Santa Rosa, Santo Tomás de Aquino, Serv. de Apoyo Diag. y Terapéutico San Miguel SA, Servibendesa SA, Servicios Espec. San Camilo S.A.C., Ventanilla, Villa María.