Las manifestaciones renales más reconocidas de la actual pandemia COVID-19 son el fracaso renal agudo multifactorial, habitualmente prerrenal, asociado a los tratamientos utilizados en la enfermedad grave o a situaciones como la sepsis1,2. Además, a medida que transcurre la infección aparece un estado procoagulante que aumenta el riesgo de eventos tromboembólicos. Los más referidos son los embolismos pulmonares y cerebrales. Exponemos el caso de un paciente con infarto renal.
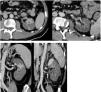
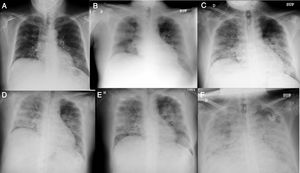
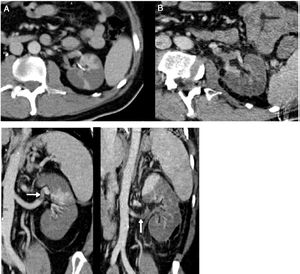
Varón de 56años y origen peruano que ingresó desde urgencias el 31/03/2020 por intensa astenia con malestar general, fiebre termometrada de 38,5°C, tos y diarrea de 5días de evolución. Padecía diabetes mellitus tipo 2 bien controlada, dislipemia mixta de un año de evolución y diverticulosis no complicada. Seguía tratamiento con dapaglifozina/metformina, plantago ovata y dieta baja en grasas. A la exploración mostraba febrícula de 37,5°C, normotensión, taquipnea moderada y escasos crepitantes bibasales. Talla de 174cm, peso de 94kg (IMC 31). Los principales datos analíticos se resumen en la tabla 1. Radiografía de tórax con infiltrados alvéolo intersticiales bilaterales parcheados. Inició tratamiento con hidroxicloroquina, azitromicina, ceftriaxona, enoxaparina 0,5mg/kg/día y soporte ventilatorio con gafas nasales a 2lpm. A las 24h se recibió el resultado positivo para SARS-CoV-2 mediante RT-PCR en exudado nasofaríngeo. La evolución fue desfavorable con mayor necesidad de oxígeno, fiebre continua y aumento de reactantes de fase aguda, por lo que al tercer día se iniciaron bolos de metilprednisolona i.v. 250mg/día durante 3días, continuando con 40mg/día, y al cuarto día tocilizumab 600mg i.v. en dosis única. Persistía el empeoramiento con progresión clínica, de laboratorio y radiológica (fig. 1). Al sexto día se aumentó la dosis de enoxaparina a 0,8mg/kg/día. Se mantuvo estable hasta el noveno día en que volvió a empeorar. El décimo día empezó con dolor intenso en fosa iliaca izquierda, no irradiado, continuo, sin síndrome miccional acompañante. Se sospechó perforación intestinal en relación con el tratamiento antiinterleucina y se realizó TC abdominal con contraste intravenoso (fig. 2). Se identificó diverticulitis aguda y en riñón izquierdo, áreas hipodensas con morfología en cuña, hallazgos compatibles con extenso infarto renal, que asociaba trombosis de la arteria renal izquierda (flecha). La función renal solo mostró un leve deterioro (Crs: 0,9 a 1,1mg/dL y FG estimado CKD EPI de mayor de 90 a 67mL/min/1,73m2) y el paciente, que 6 meses antes tenía una orina sin proteinuria ni hematuria y una microalbuminuria negativa, desarrolló microhematuria, proteinuria subnefrótica y microalbuminuria estadio A3. Ingresó en la unidad de cuidados intensivos, donde permanece a la hora de escribir este artículo. Ha precisado ventilación mecánica invasiva, tratamiento con noradrenalina y anticoagulación con heparina de bajo peso molecular. Diuresis espontánea mayor de 0,5mL/kg/h y anticoagulación con enoxaparina. Desde el punto de vista respiratorio, mejora con lentitud.
Evolución analítica
| Valores/día | Ingreso | 2 | 3 | 4 | 5 | 6 | 8 | 10 | 11 | 12 | 13 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Leucocitos | 6,13 | 5,77 | 6,71 | 8,97 | 9,28 | 11,95 | 13,52 | 12,27 | 13,27 | 24,89 | 22,14 | 11,9 |
| Linfocitos | 400 | 600 | 400 | 500 | 300 | 400 | 300 | 300 | 200 | 600 | 100 | 700 |
| Hb | 16,5 | 14,6 | 15,9 | 14,9 | 14,9 | 14,4 | 16,5 | 15,5 | 15,2 | 16,5 | 15,6 | 12,4 |
| Plaquetas | 181 | 196 | 218 | 249 | 287 | 356 | 400 | 310 | 281 | 321 | 173 | 212 |
| Activ. PT | 82,3 | 78 | 76 | 73 | 81,9 | 79,9 | 71,2 | 79,4 | 75 | 65,8 | 78 | 99,6 |
| TPTA | 27,4 | 28,7 | 30 | 28,8 | 24,4 | 21 | 22 | 21,9 | 21,5 | 23,4 | 27,4 | 27,7 |
| Fibrinógeno | >500 | >500 | >500 | >500 | >500 | 675 | 487 | 423 | 317 | 414 | 446 | >500 |
| Creatinina | 1,17 | 1,01 | 1,14 | 1,01 | 1,04 | 0,94 | 0,91 | 0,90 | 1,17 | 0,95 | 1,08 | 0,97 |
| FGe CKD EPI | 69 | 83 | 72 | 83 | 80 | >90 | >90 | >90 | 69 | 89 | 76 | 87 |
| Lactato | 2,47 | 2,06 | 3,49 | 2,44 | 3,09 | 1,62 | 1,68 | 0,99 | ||||
| CPK | 99 | 160 | 82 | 61 | 104 | 33 | 21 | |||||
| LDH | 245 | 248 | 311 | 405 | 418 | 450 | 552 | 698 | 1.718 | 461 | 1.975 | 773 |
| GPT (ALT) | 35 | 31 | 31 | 33 | 43 | 51 | 67 | 47 | 99 | 167 | 131 | 44 |
| GOT (AST) | 40 | 36 | 44 | 50 | 49 | 49 | 57 | 56 | 202 | 236 | 91 | 50 |
| PCR | 107,5 | 105 | 183 | 191 | 190 | 69 | 17 | 15 | 15 | 28 | 44 | 94 |
| Dímero D | 2.710 | 940 | 1.470 | 5.580 | 1.080 | 1.211 | 1.886 | 8.790 | 3.350 | |||
| Ferritina | 546 | 475 | 1.053 | |||||||||
| IL-6 | 99 | >1.000 | ||||||||||
| Ac AFL | Negativos | |||||||||||
| SO | Microhem, PRT 100mg/dL, leucocituria aislada | |||||||||||
| Orina espontánea: | MAu/Cru: 278CPC: 1870mg/gr Cr | |||||||||||
| TT | AZTHCQCEFTENOX 0,5mg/kg/d | MPRN 250×3 | TOC | ENOX 1mg/kg/12h | MPRN 40ANAK | MEROPLINEZ |
ANK: anakinra; AZT: azitromicina; CEFT: ceftriaxona; CPC: cociente proteína creatinina en orina; ENOX: enoxaparina; HCQ: hidroxicloroquina; LINEZ: linezolid; Mau/Cru: microalbuminuria/creatinina en orina; MEROP: meropenem; MICROHEM: microhematuria; MPRN: metal prednisolona; PRT: proteinuria; TOC: tocilizumab.
Unidades: leucocitos *10E3/μL; linfocitos *10E3/μL; hemoglobina g/dL; plaquetas 10E3/μL; APTT (T. Cefalina) seg; activ protrombina (Activ PT) seg; fibrinógeno derivado mg/dL; creatinina mg/dl; lactato mmol/L; CPK U/L; LDH U/L; GPT (ALT) U/L; GOT (AST) U/L; filtrado glomerular estimado [CKD-EPI] ml/min/1,73m2; proteína C reactiva (PCR) mg/L; dímero D mg/dL; ferritina mg/dL; interleucina 6 (IL-6) ng/mL; Ac SO: sistemático de orina, AFL: anticuerpos antifosfolípido (beta 2 glicoproteína 1 IgG UI/mL, beta 2 glicoproteína 1 IgM UI/mL, anticardiolipina IgG GPL/mL y anticardiolipina IgM MPL/mL).
Los infartos renales son lesiones infrecuentes que pueden verse en diversas situaciones: tras hematoma intrarrenal3, disección de arteria renal en procedimientos instrumentales, dislipemias4, vasculitis ANCA PR3 positivas5, displasia fibromuscular, enfermedad aterosclerótica, enfermedades del tejido conectivo, cardiopatías embolizantes (fibrilación auricular, valvulopatías, aneurismas ventriculares, infartos, miocardiopatías dilatadas), idiopáticos6 y trombofilias como en la disfibrinogenemia7.
En diversas series8,9 se reconocen como principales factores de riesgo: HTA, hábito tabáquico, fibrilación auricular, obesidad, enfermedad vascular periférica, evento tromboembólico previo, diabetes mellitus y terapia estroprogestínica. El tratamiento es controvertido entre la actitud conservadora con antiagregación y anticoagulación y la intervencionista con fibrinólisis y angioplastia.
El coronavirus puede infectar directamente las células endoteliales, plaquetas y megacariocitos al combinarse con su receptor CD1310,11 induciendo daño plaquetario, endotelitis y apoptosis, que pone en marcha el reclutamiento de macrófagos y granulocitos que sintetizarán citoquinas proinflamatorias. Si la infección no se controla, la inflamación progresa, agrava el daño tisular y microvascular, estimula la vía extrínseca de la coagulación e inhibe la fibrinólisis, lo que podría desencadenar una coagulopatía por consumo agravada por la hipoxia que induciría agregación plaquetaria, síntesis de trombopoyetina, fibrinógeno, VEFG y trombina y descenso de factores anticoagulantes como la antitrombina III y el inhibidor del activador del plasminógeno12–14. El aumento del dímero D y la trombocitopenia serían el reflejo analítico de este mecanismo. El medio tromboinflamatorio y procoagulante propiciado12 desencadenaría eventos trombóticos en los distintos territorios afectados, 4,5% a nivel cerebral, 11,4% pulmonar y 20% de trombosis venosas profundas. Nuestro paciente mantuvo en todo momento estabilidad del filtrado glomerular y fue tratado mediante dosis anticoagulantes de enoxaparina. En nuestro conocimiento, se trata del segundo caso descrito de trombosis de arteria renal en este contexto15.