Los índices plaquetas-linfocito (IPL) y neutrófilo-linfocito (INL) son marcadores emergentes de inflamación. La resistencia a la eritropoyetina está relacionada con una mayor morbimortalidad en los pacientes con enfermedad renal crónica y está influida, entre otros factores, por la inflamación. Por lo tanto, cabría esperar una relación entre estos marcadores y la resistencia a la eritropoyetina.
MétodosEstudio transversal-multicéntrico. Se estudiaron los registros de las sesiones de hemodiálisis de 534 pacientes pertenecientes a 4 de nuestros centros de diálisis. Se excluyó a 137 pacientes, por lo que el número final de pacientes estudiado fue de 397. Se calculó el INL, el IPL y, como medida de resistencia a la eritropoyetina, se calculó el índice de respuesta a la eritropoyetina (IRE).
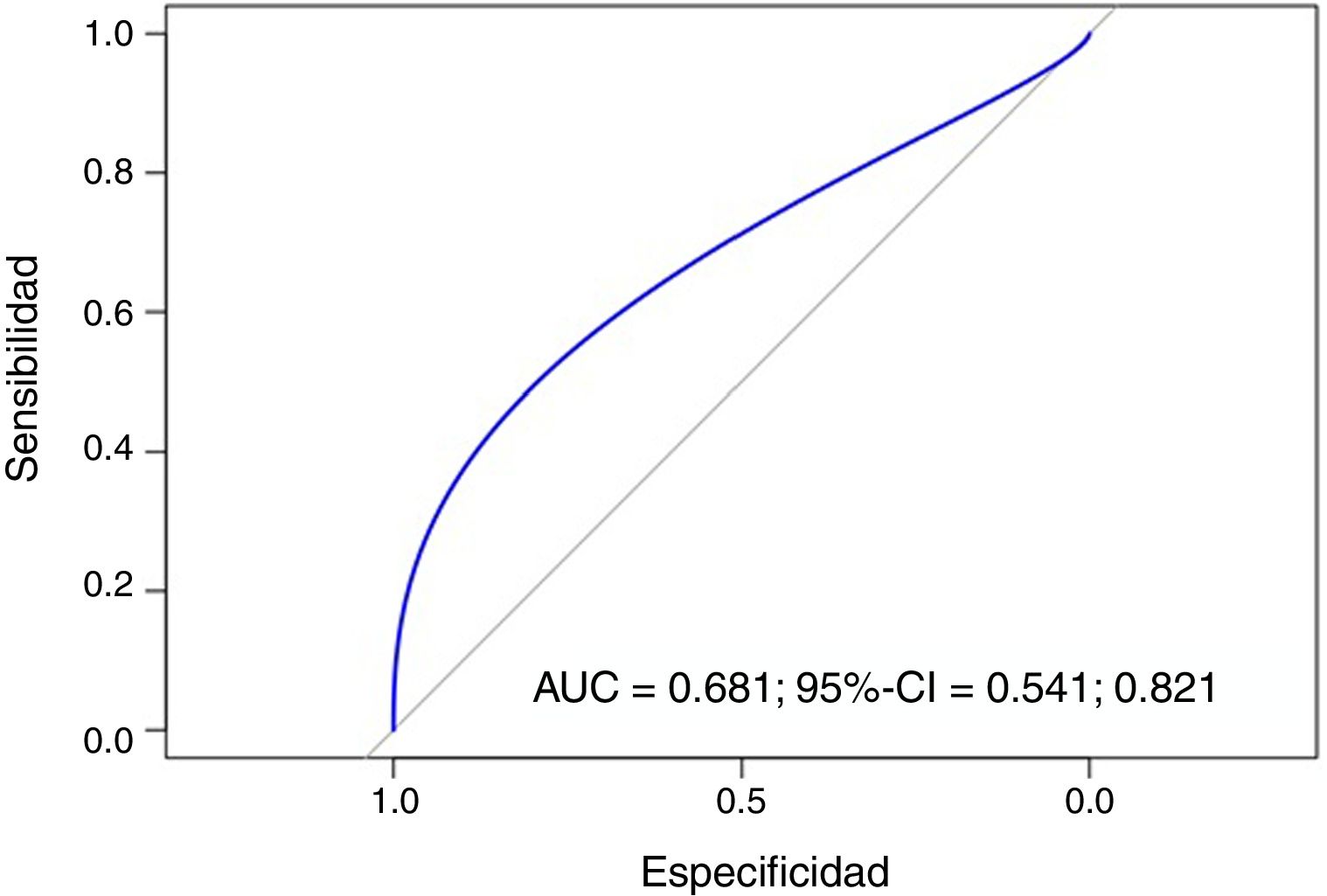
ResultadosSe dividió el IRE en cuartiles y se compararon con las medias de INL e IPL de los 4 grupos, siendo estas diferencias estadísticamente significativas (p=0,00058). En los análisis de regresión, el valor de INL pudo predecir el IRE de forma significativa (p<0,0001) (R2=0,029). Asimismo, el valor de IPL también predijo el IRE de forma significativa (p<0,0001) (R2=0,103). La capacidad del IPL para predecir resistencia a la eritropoyetina se midió con el área bajo la curva ROC (AUC=0,681) (IC 95%: 0,541-0,821). Un punto de corte de IPL de 125,5 resultaría en un 80,95% de sensibilidad y 42,82% de especificidad.
ConclusionesTanto el IPL como el INL podrían considerarse unos aceptables marcadores de resistencia a la eritropoyetina. El IPL resultó ser un mejor predictor que el INL para el IRE.
The platelet-to-lymphocyte (PLR) and neutrophil-to-lymphocyte (NLR) ratios are emerging markers of inflammation. Erythropoietin resistance is associated with increased morbidity and mortality in patients with chronic kidney disease and is influenced by inflammation, among other factors. Therefore, it would be reasonable to expect a relationship between these markers and erythropoietin resistance.
MethodsMulticentre cross-sectional study. The records of the haemodialysis sessions of 534 patients belonging to four of our dialysis centres were studied. 137 patients were excluded, so the final number of patients studied was 397. NLR, PLR and the erythropoietin resistance index (ERI) were calculated.
ResultsThe ERI was divided into quartiles and compared with the mean NLR and PLR of the four groups, with these differences being statistically significant (p=0.00058). In the regression analysis, the NLR value was able to predict ERI significantly (p<0.0001) (R2=0.029). The PLR value also predicted ERI significantly (p<0.0001) (R2=0.103). The ability of PLR to predict erythropoietin resistance was measured with the area under the ROC curve (AUC=0.681) (95% CI, 0.541-0.821). A PLR cut-off point of 125.5 would result in a sensitivity of 80.95% and 42.82% specificity.
ConclusionsBoth PLR and NLR could be considered acceptable markers of erythropoietin resistance. The PLR was a better predictor for the ERI than the NLR.
La anemia es una complicación frecuente en la enfermedad renal crónica y se encuentra asociada a una mayor comorbilidad y mortalidad1–4. Una de las causas más importantes es el déficit de secreción de eritropoyetina5,6. Por ello, dentro del manejo de la anemia en estos pacientes, se incluye el tratamiento con agentes estimulantes de la eritropoyesis (AEE)5,7–10.
La mayor parte de los pacientes con enfermedad renal crónica presentan un adecuado control de su anemia con dosis medias de estos fármacos7. Sin embargo, un porcentaje significativo de ellos (desde un 5% hasta un 10%, según algunos estudios)4,10,11 presentan requerimientos más altos de AEE debido a múltiples causas: ferropenia, hemólisis, neoplasia, infecciones, inflamación, deficiencias vitamínicas, tóxicos y diálisis inadecuada10,11.
Esta condición clínica, en su conjunto, se denomina «resistencia a la eritropoyetina», la cual está relacionada con un peor pronóstico en los pacientes en hemodiálisis12,13. Cabe destacar que es un concepto clínico difícil de definir. Una definición arbitraria, pero basada en datos, son las que aportan las guías europeas de 1999: «Fracaso en obtener los valores objetivo de hemoglobina recibiendo más de 300UI/kg/semana o 20.000UI/semana de eritropoyetina» y matizando «o una continua necesidad de esas dosis para mantener el objetivo de niveles de hemoglobina»14.
Por otro lado, se ha descrito la utilidad del índice de respuesta a la eritropoyetina (IRE) como un buen marcador de resistencia a la eritropoyetina y un factor asociado a ocurrencia de efectos adversos en hemodiálisis crónica11,15–18. Algunos grupos han establecido que un índice de respuesta a la eritropoyetina mayor de 9UI/kg/semana/g/dl se podría considerar como resistente19,20. En un estudio se demostró que valores de IRE por encima de 15UI/kg/semana/g/dl tenían mayor mortalidad15. De manera análoga, otros autores han planteado que los requerimientos de eritropoyetina mayores de 109UI/kg/semana, sin tomar en cuenta los valores de hemoglobina, son un signo de alerta de una posible resistencia a la eritropoyetina21.
Por otra parte, los índices plaquetas-linfocito (IPL) y neutrófilo-linfocito (INL) son marcadores biológicos emergentes de inflamación y disfunción endotelial11,22, inicialmente aplicados a pacientes cardiópatas22–24 y, más recientemente, en población con enfermedad renal crónica terminal11,25,26.
En el momento actual, existen pocos estudios sobre la relación entre estos índices y la resistencia a la eritropoyetina. Uno de los más representativos incluye una muestra de 104 pacientes pertenecientes a un solo centro11.
El objetivo de nuestro estudio es evaluar la relación entre estos índices y la resistencia a la eritropoyetina en nuestra población prevalente en hemodiálisis crónica.
Materiales y métodosDiseño y poblaciónEl protocolo del estudio fue diseñado de acuerdo con la Declaración de Helsinki. Los datos fueron recogidos en un registro que garantizó el anonimato de los participantes y conocido solamente por el equipo investigador.
Se trató de un estudio transversal realizado en 4 centros Avericum distribuidos en la provincia de Las Palmas (España). Se valoraron los registros de las sesiones de hemodiálisis de 534 pacientes prevalentes en junio de 2017. La prescripción de diálisis fue de 3,5-4h con un flujo de sangre entre 300-450ml/min, usando un concentrado de diálisis estándar de bicarbonato y filtros de hemodiálisis de alta permeabilidad (Modelo Elisio® - Nipro®) polietersulfona con una superficie mayor de 1,7m2 y un coeficiente de ultrafiltración mayor de 74ml/h/mmHg). El agente estimulante de la eritropoyesis utilizado en todos los pacientes fue la Epoetina Beta (Neorecormon® - Roche Farma AG®).
Los criterios de exclusión fueron el no estar recibiendo en el momento del estudio tratamiento con AEE (n=76) y condiciones clínicas que pudieran haber influido en el recuento de los números absolutos de plaquetas, linfocitos y hemoglobina: Ingreso en el hospital por causas infecciosas, oncológicas y hematológicas en los 3 meses anteriores (n=24). Transfusión en los últimos 3 meses (n=4). Enfermedades oncohematológicas activas (n=13) y pacientes con tratamiento esteroideo (n=26). Algunos de los pacientes cumplieron más de un criterio de exclusión (total de pacientes excluidos: n=137). Por lo tanto, después de aplicar los criterios, la muestra de estudio fue de 397 pacientes.
Se definió resistencia a la eritropoyetina a aquellos enfermos que tuvieron dosis de eritropoyetina semanales mayores de 20.000UI y valores de hemoglobina menores de 11g/dl14.
Para el cálculo del IPL se obtuvo el cociente entre el valor absoluto de las plaquetas y el valor absoluto de los linfocitos en el hemograma. Para la obtención del INL se calculó el cociente entre el valor absoluto de los neutrófilos y el valor absoluto de los linfocitos en el hemograma. Y, finalmente, el IRE se obtuvo calculando la dosis semanal de eritropoyetina (UI) dividida por el peso seco (kg) y dividida, a su vez, por los niveles de hemoglobina sérica (g/dl)11,15,16.
Otras variables analizadas fueron: albúmina, hierro sérico, ferritina, índice de saturación de transferrina (IST) y proteína C reactiva (PCR).
Análisis estadísticoPara el análisis estadístico se empleó el programa R versión 3.3.2 (2017) (R Foundation for Statistical Computing, Vienna, Austria. URL http://www.R-projet.org/). Los resultados fueron considerados estadísticamente significativos si el valor p fue menor que 0,05. Las variables continuas se han resumido en media± desviación típica (variables normales) o mediana y cuartiles (variables no normales). Las variables categóricas se han resumido en porcentajes. La normalidad de las variables se analizó mediante el test Shapiro-Wilk. Se usó el coeficiente de Pearson para las correlaciones. Para evaluar si existían diferencias significativas según el cuartil de IRE se utilizó el test de Kruskal-Wallis en el caso de las variables cuantitativas, y el test chi-cuadrado en el caso de variables categóricas.
Cuando se detectaron diferencias significativas entre cuartiles de IRE se llevaron a cabo los respectivos test post-hoc, utilizando el procedimiento de Tukey, cuando la transformación de la variable a escala logarítmica permitía conseguir normalidad y homocedasticidad, y utilizando el test de Dunn en caso contrario.
Para evaluar la capacidad predictiva del IPL y el INL sobre el IRE se ajustaron modelos de regresión en los que se utilizó log(IRE) como variable respuesta. Los modelos se ajustaron además por edad, sexo y peso del individuo. En el caso del INL, para evaluar el efecto particular de los valores de neutrófilos y linfocitos (que participan en la definición del INL), se introdujeron estas variables en el modelo de regresión y se aplicó un método paso a paso para seleccionar el conjunto de variables con mejor capacidad predictiva. Se procedió de modo análogo con el IPL, introduciendo en este caso las plaquetas y los linfocitos como variables adicionales para, a continuación, aplicar el procedimiento paso a paso.
Asimismo, para llevar a cabo un análisis de la capacidad del IPL para diagnosticar resistencia a la eritropoyetina se estimó un modelo de regresión logística, ajustado por edad y sexo. Se aplicó además un método paso a paso para simplificar el modelo y eliminar variables no explicativas. Se llevó a cabo el cálculo de la curva ROC cuando se utiliza solo IPL como criterio diagnóstico para predecir resistencia a la eritropoyetina.
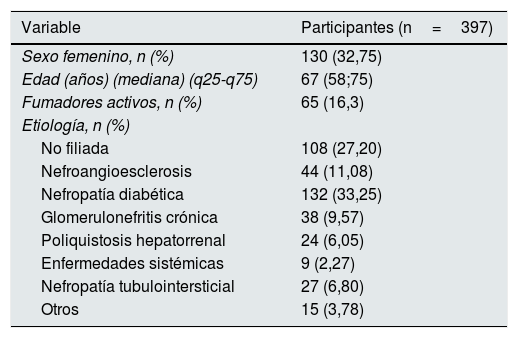
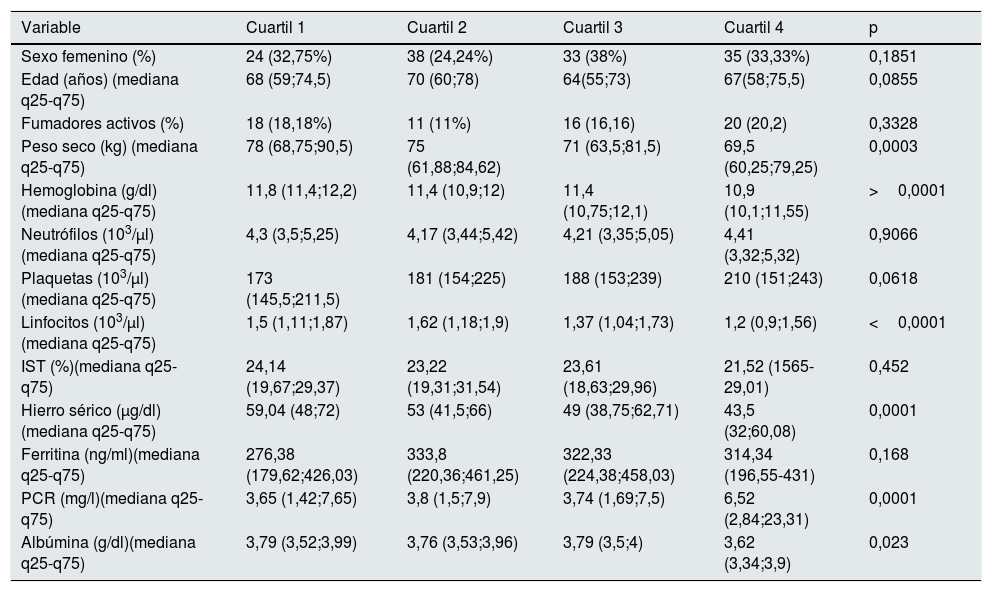
ResultadosCaracterísticas basales de la poblaciónLas características basales de los pacientes incluidos están descritas en la tabla 1. Se realizó una estratificación del IRE en cuartiles (Q1=0,59-4,08, Q2=4,08-7,04, Q3=7,04-12,55, Q4=12,55-80,65) y se compararon los valores de las distintas variables entre los grupos así definidos (tablas 2 y 3). El peso seco, los linfocitos, la hemoglobina, los niveles de hierro sérico, la albúmina y la proteína C reactiva mostraron diferencias significativas entre los cuartiles de IRE. La realización de los test post-hoc de Tukey (transformando previamente las variables a escala logarítmica) mostró, para todas estas variables (salvo la hemoglobina), que el primer, segundo y tercer cuartil no mostraron diferencias significativas entre sí, y que las diferencias significativas se produjeron con respecto al cuarto cuartil. En el caso de la hemoglobina, el test post-hoc de Dunn mostró que su valor es significativamente más alto en el primer cuartil de IRE, no mostró diferencias significativas entre el segundo y el tercero, y mostró un valor significativamente más bajo en el cuarto cuartil.
Características basales de la población
| Variable | Participantes (n=397) |
|---|---|
| Sexo femenino, n (%) | 130 (32,75) |
| Edad (años) (mediana) (q25-q75) | 67 (58;75) |
| Fumadores activos, n (%) | 65 (16,3) |
| Etiología, n (%) | |
| No filiada | 108 (27,20) |
| Nefroangioesclerosis | 44 (11,08) |
| Nefropatía diabética | 132 (33,25) |
| Glomerulonefritis crónica | 38 (9,57) |
| Poliquistosis hepatorrenal | 24 (6,05) |
| Enfermedades sistémicas | 9 (2,27) |
| Nefropatía tubulointersticial | 27 (6,80) |
| Otros | 15 (3,78) |
Características basales según cuartiles de IRE
| Variable | Cuartil 1 | Cuartil 2 | Cuartil 3 | Cuartil 4 | p |
|---|---|---|---|---|---|
| Sexo femenino (%) | 24 (32,75%) | 38 (24,24%) | 33 (38%) | 35 (33,33%) | 0,1851 |
| Edad (años) (mediana q25-q75) | 68 (59;74,5) | 70 (60;78) | 64(55;73) | 67(58;75,5) | 0,0855 |
| Fumadores activos (%) | 18 (18,18%) | 11 (11%) | 16 (16,16) | 20 (20,2) | 0,3328 |
| Peso seco (kg) (mediana q25-q75) | 78 (68,75;90,5) | 75 (61,88;84,62) | 71 (63,5;81,5) | 69,5 (60,25;79,25) | 0,0003 |
| Hemoglobina (g/dl) (mediana q25-q75) | 11,8 (11,4;12,2) | 11,4 (10,9;12) | 11,4 (10,75;12,1) | 10,9 (10,1;11,55) | >0,0001 |
| Neutrófilos (103/μl) (mediana q25-q75) | 4,3 (3,5;5,25) | 4,17 (3,44;5,42) | 4,21 (3,35;5,05) | 4,41 (3,32;5,32) | 0,9066 |
| Plaquetas (103/μl) (mediana q25-q75) | 173 (145,5;211,5) | 181 (154;225) | 188 (153;239) | 210 (151;243) | 0,0618 |
| Linfocitos (103/μl) (mediana q25-q75) | 1,5 (1,11;1,87) | 1,62 (1,18;1,9) | 1,37 (1,04;1,73) | 1,2 (0,9;1,56) | <0,0001 |
| IST (%)(mediana q25-q75) | 24,14 (19,67;29,37) | 23,22 (19,31;31,54) | 23,61 (18,63;29,96) | 21,52 (1565-29,01) | 0,452 |
| Hierro sérico (μg/dl)(mediana q25-q75) | 59,04 (48;72) | 53 (41,5;66) | 49 (38,75;62,71) | 43,5 (32;60,08) | 0,0001 |
| Ferritina (ng/ml)(mediana q25-q75) | 276,38 (179,62;426,03) | 333,8 (220,36;461,25) | 322,33 (224,38;458,03) | 314,34 (196,55-431) | 0,168 |
| PCR (mg/l)(mediana q25-q75) | 3,65 (1,42;7,65) | 3,8 (1,5;7,9) | 3,74 (1,69;7,5) | 6,52 (2,84;23,31) | 0,0001 |
| Albúmina (g/dl)(mediana q25-q75) | 3,79 (3,52;3,99) | 3,76 (3,53;3,96) | 3,79 (3,5;4) | 3,62 (3,34;3,9) | 0,023 |
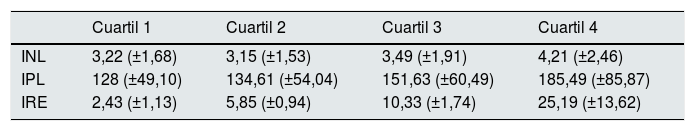
Cuartiles de IRE vs. medias de INL e IPL
| Cuartil 1 | Cuartil 2 | Cuartil 3 | Cuartil 4 | |
|---|---|---|---|---|
| INL | 3,22 (±1,68) | 3,15 (±1,53) | 3,49 (±1,91) | 4,21 (±2,46) |
| IPL | 128 (±49,10) | 134,61 (±54,04) | 151,63 (±60,49) | 185,49 (±85,87) |
| IRE | 2,43 (±1,13) | 5,85 (±0,94) | 10,33 (±1,74) | 25,19 (±13,62) |
Los valores de los índices no tienen unidades.
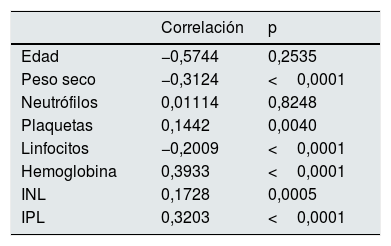
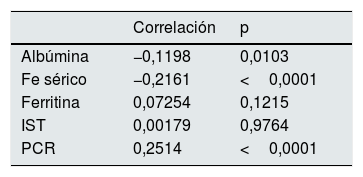
Se calculó la correlación entre las distintas variables del estudio y el valor de log(IRE) (tabla 4). La correlación es significativa para todas las variables salvo la edad y los neutrófilos.
Asimismo, se realizaron correlaciones entre distintos parámetros de inflamación y ferrocinética con el log(IRE) (tabla 5).
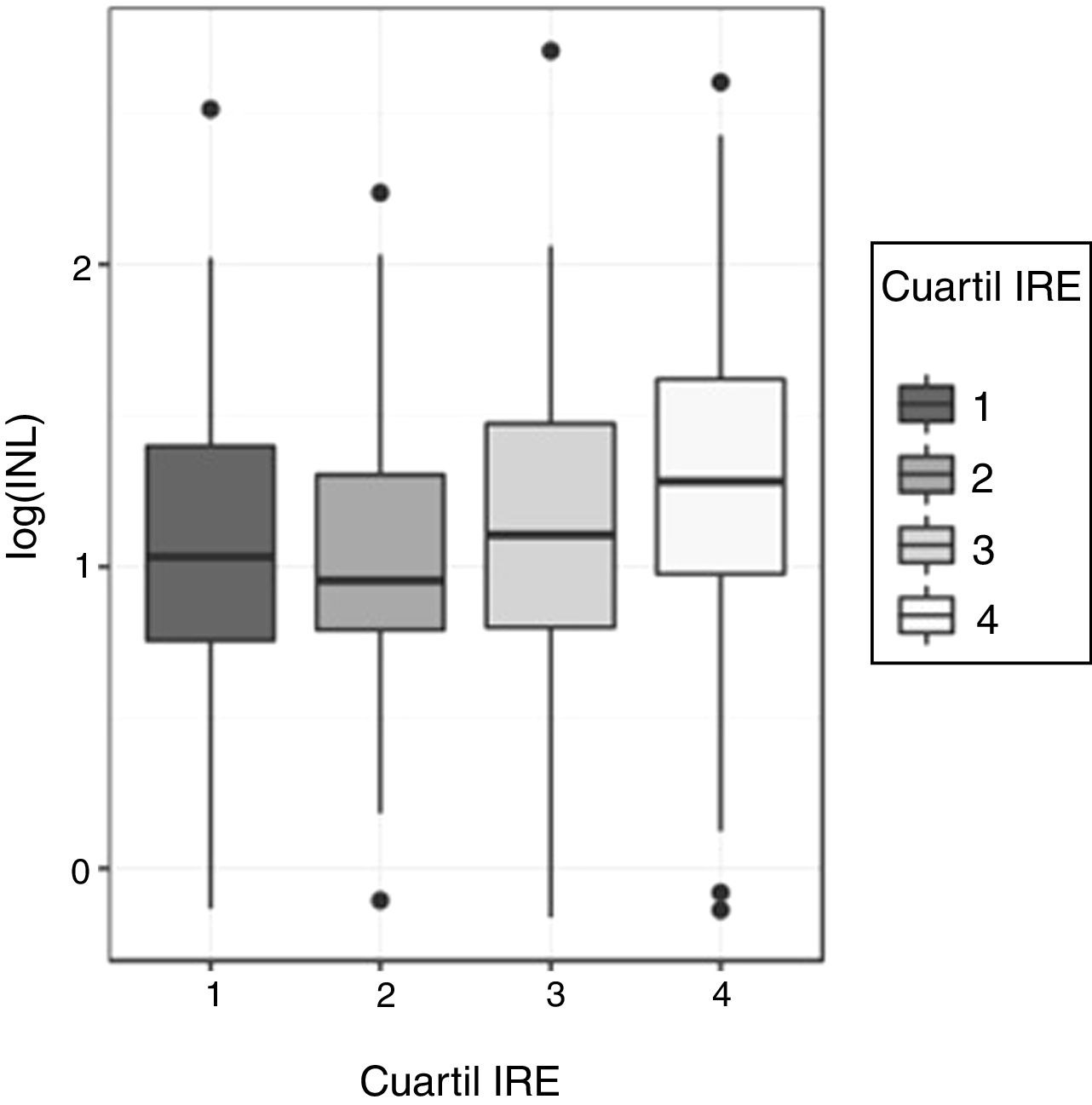
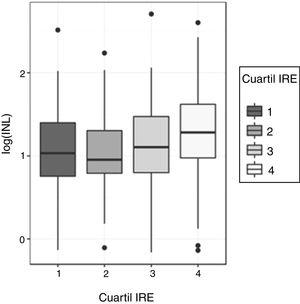
Relación entre el índice neutrófilo-linfocito (INL) y el índice de respuesta a la eritropoyetina (IRE)Dada la asimetría de la variable INL para cada cuartil de IRE, la comparación de los valores de INL entre los 4 cuartiles de IRE se realizó inicialmente mediante el test no paramétrico Kruskal-Wallis: este test mostró diferencias significativas en la distribución del IRE para los diferentes cuartiles de IRE (p=0,00058). Para determinar entre qué cuartiles se producen dichas diferencias se utilizó el ANOVA y un test post-hoc. Para ello, se corrigió la asimetría, transformando los valores de INL a escala logarítmica. El análisis de la varianza del log(INL) confirmó que existen diferencias significativas en los valores de log(INL) según los cuartiles de IRE (p=0,0004296). El test de Shapiro-Wilk no encontró evidencia de falta de normalidad en los residuos (p=0,3808) y el test de Levene no detectó heterocedasticidad entre grupos (p=0,4492), lo que valida la realización del ANOVA (fig. 1). Se empleó el test de comparaciones múltiples de Tukey para determinar entre qué cuartiles se encuentran las diferencias de INL: los valores de log(INL) para el cuarto cuartil de IRE difieren significativamente de los valores en el primer y segundo cuartil. El valor de log(INL) en el tercer cuartil de IRE no se diferencia de manera significativa de los demás.
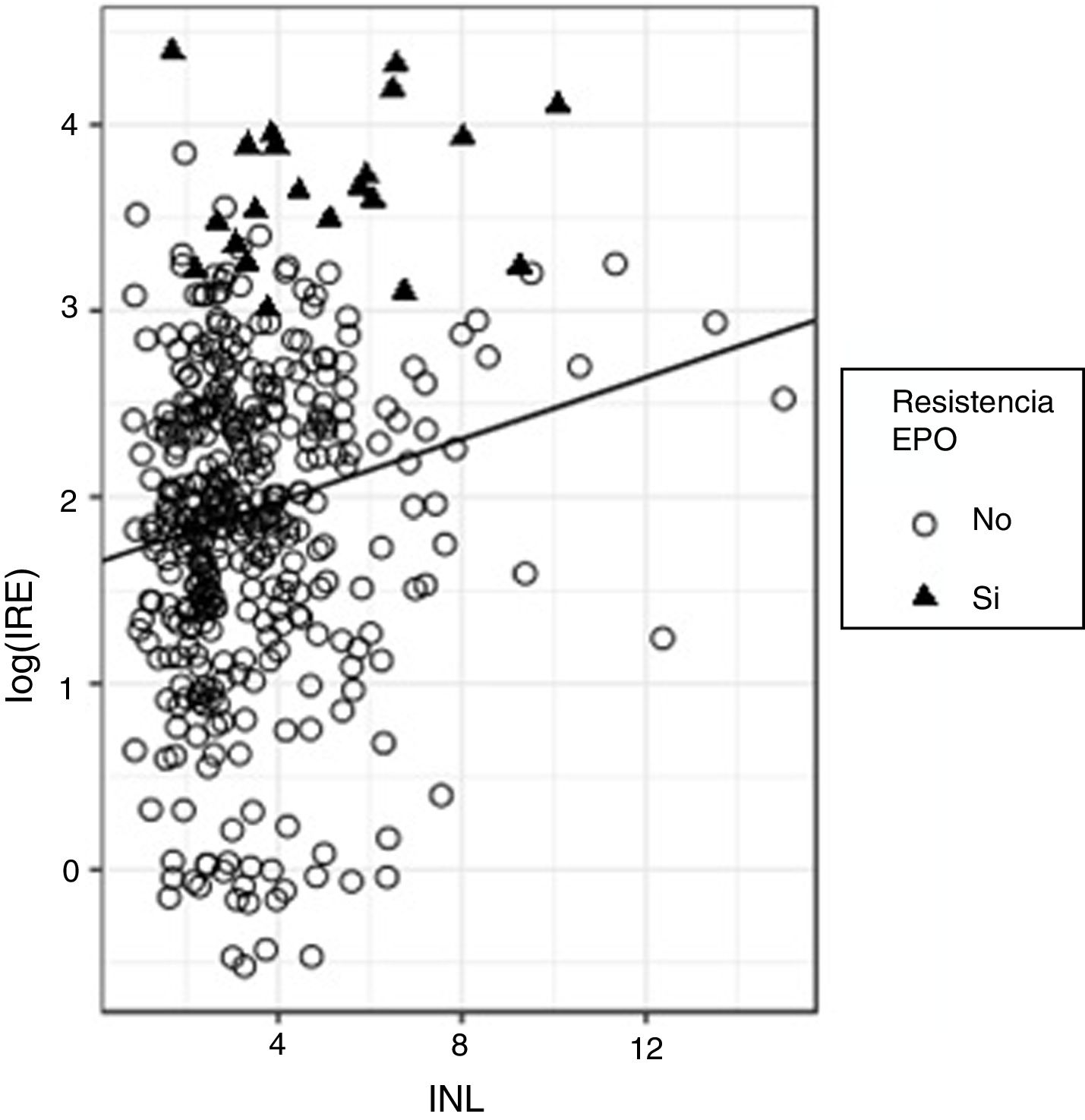
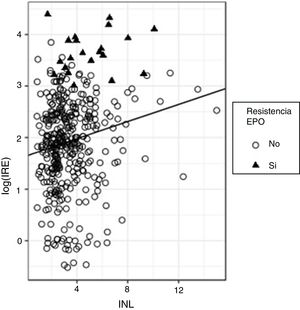
Para evaluar la capacidad predictiva del INL sobre el log(IRE) se ajustó un modelo de regresión; si bien el efecto de INL sobre log(IRE) resultó significativo (beta estandarizado=0,173, p<0,0001), el valor del R2 resultó muy bajo (R2=0,029), lo que indica que, si bien el valor de IRE tiende a crecer con el INL, la capacidad predictiva de esta última variable es escasa. La figura 2 muestra la recta de regresión global ajustada a todos los datos, en la que se aprecia la tendencia creciente del IRE con el INL en la que se aprecia la presencia de mucha variabilidad. Si analizamos con cuidado este gráfico podemos observar que, en particular, la mayor parte de los sujetos (el 90%) presentan valores de INL inferiores a 6; dentro de este grupo, solo un 3,9% tiene resistencia a la eritropoyetina; los sujetos con INL>6 son solo un 10% del total; pero dentro de ese grupo hay proporcionalmente más sujetos con resistencia a la eritropoyetina (un 18,9%). Dicho de otra forma, el riesgo de resistencia a la eritropoyetina es mayor entre los sujetos con valores de INL altos.
Ello invita a ajustar un modelo de regresión logística para predecir la resistencia a la eritropoyetina en función del INL. Con dicho modelo obtenemos que la OR de padecer resistencia a la eritropoyetina es de 1,32 (p<0,0001; IC 95%: 1,118-1,544) por cada unidad de incremento en INL.
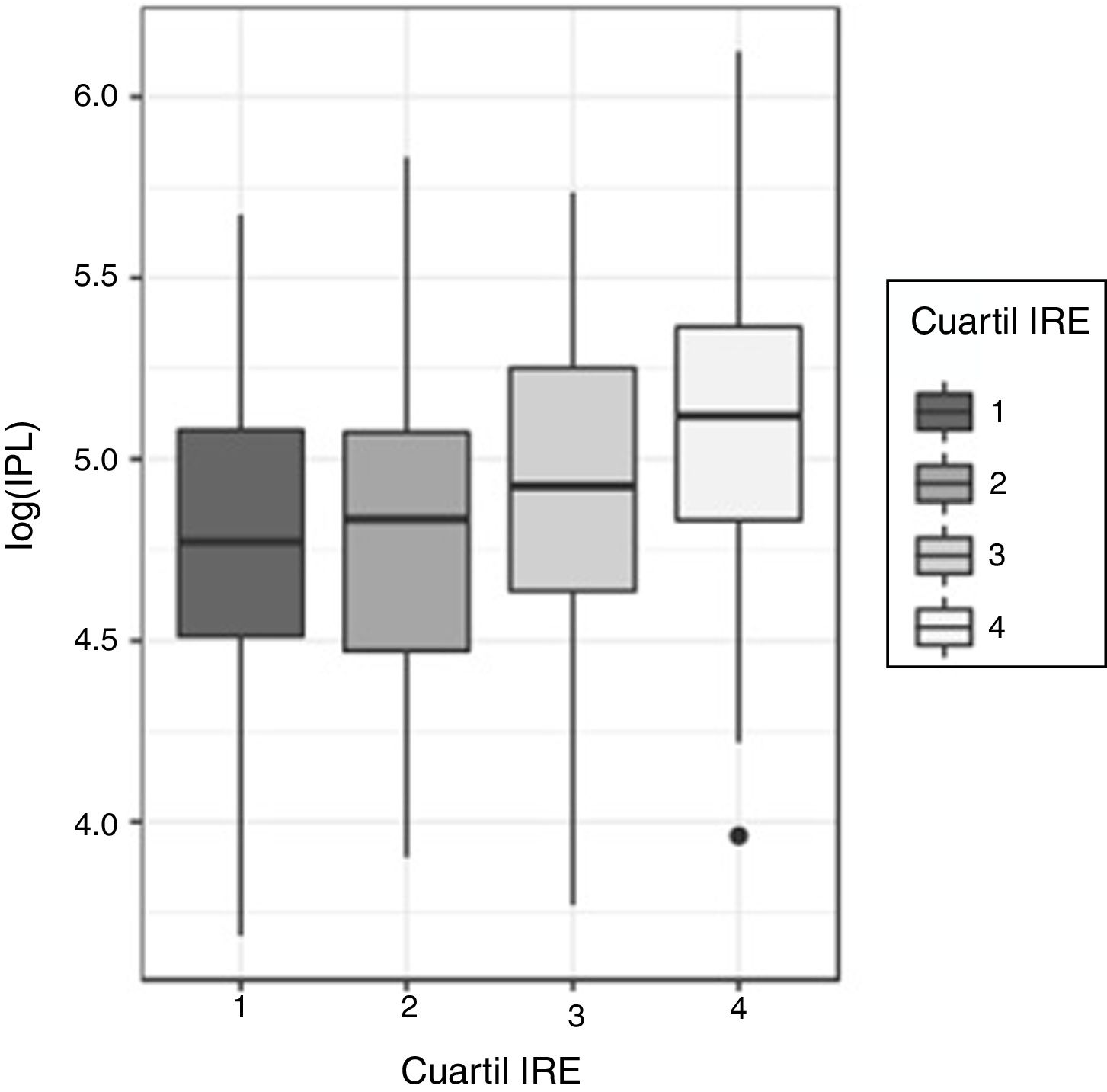
Relación entre el índice plaquetas-linfocito (IPL) y el índice de respuesta a la eritropoyetina (IRE)Al igual que con INL, la asimetría de las distribuciones de IPL para cada cuartil de IRE llevó a hacer las comparaciones de IPL según cuartiles de IRE utilizando el test de Kruskal-Wallis, resultando las diferencias estadísticamente significativas (p<0,00001) (fig. 3).
Igualmente, para decidir en qué cuartiles se producen dichas diferencias se realizó un ANOVA del log(IPL), siendo las diferencias significativas (p<0,0001). La normalidad de log(IPL) fue analizada con el test de Shapiro-Wilk (p=0,65) y la homocedasticidad con el test de Levene (p=0,737).
El test de Tukey indicó que las diferencias estuvieron en el cuarto cuartil de IRE respecto al resto. En los otros 3 cuartiles no se detectan diferencias significativas en la distribución del log(IPL).
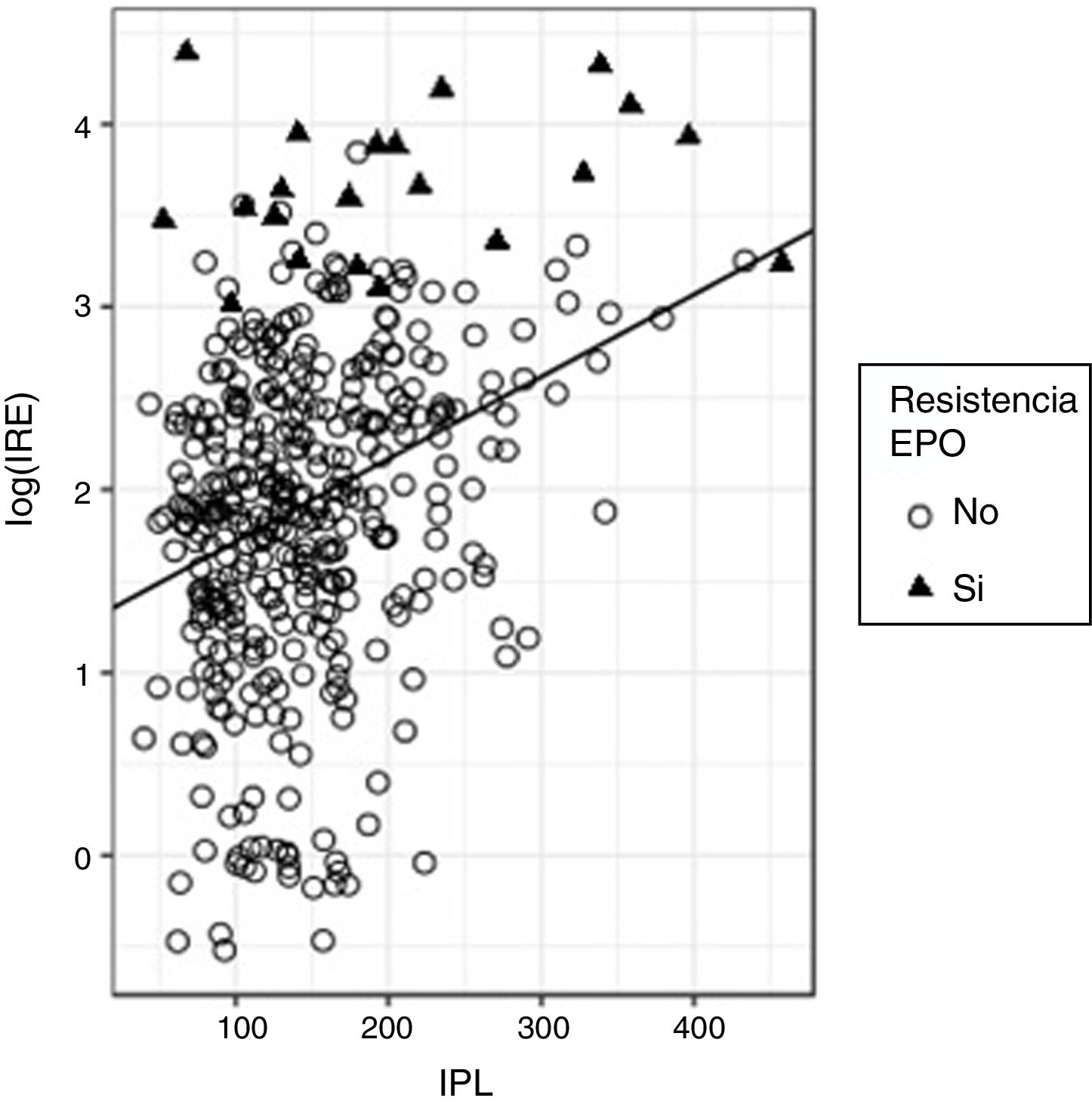
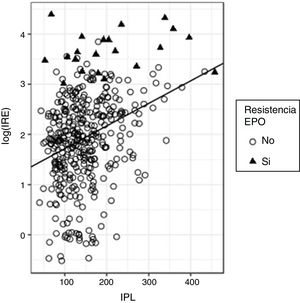
En el ajuste de la regresión para predecir el log(IRE) en función del IPL, se obtuvo una pendiente positiva significativa (beta estandarizado=0,32, p<0,0001), si bien, nuevamente el valor de R2 resultó bajo (R2=0,103) aunque mayor que el obtenido con INL, lo que quiere decir que la capacidad predictiva de IPL es mejor que la de INL (fig. 4).
Al igual que ya ocurrió con INL, se aprecia que el log(IRE) se incrementa con el valor de IPL; como en aquel caso, el 90% de los valores de IPL están por debajo de 233; en este grupo hay un 3,9% de pacientes con resistencia a la eritropoyetina; sin embargo, cuando la IPL está por encima de 233 son resistentes a la eritropoyetina el 17,5% de los sujetos; por tanto, el riesgo de ser resistente a la eritropoyetina se incrementa con el valor de IPL.
Para valorar este riesgo el modelo de regresión logística indica que un incremento de una unidad en el IPL se traduce en una OR de 1,011 (p<0,0001; IC 95%: 1,005-1,015) de presentar resistencia a la eritropoyetina. Un cálculo adicional permite estimar que la OR de padecer resistencia a la eritropoyetina se duplica por cada incremento de 67 unidades en el valor de IPL.
Por otro lado, se realizó un análisis de regresión múltiple que en el que se incluyeron variables como el IST, el hierro sérico, la proteína C reactiva y el IPL. La correlación de IPL con logIRE siguió siendo significativa (p<0,0001), siendo la capacidad predictiva total del modelo, medida en términos de R2, de un 17,26%.
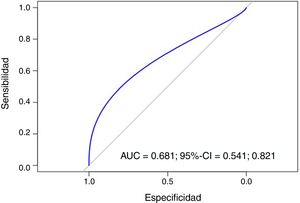
Para analizar la capacidad del IPL para predecir resistencia a la eritropoyetina se midió el área bajo la curva ROC (AUC=0,681) (IC 95%: 0,541-0,821). Un punto de corte de IPL de 125,5 resultaría en un 80,95% de sensibilidad y 42,82% de especificidad (fig. 5).
DiscusiónEl riesgo cardiovascular en los pacientes en hemodiálisis es ampliamente conocido1. Desde el punto de vista fisiopatológico, la inflamación corre un papel muy importante. Históricamente se han enumerado múltiples parámetros para medirla: proteína C reactiva, albúmina sérica, péptido natriurético tipo B, entre otros. Los índices INL e IPL han surgido en los últimos años como marcadores de inflamación y daño endotelial en diferentes tipos de pacientes. Dada su fácil obtención, bajo coste y su extracción rutinaria en los pacientes en hemodiálisis, constituyen un parámetro analítico muy interesante en este grupo de pacientes6,25,26.
Asimismo, el manejo de la anemia con agentes estimulantes de la eritropoyesis y hierro intravenoso se han erigido como los pilares del tratamiento de los pacientes en hemodiálisis desde hace muchos años5,10.
El IRE es un buen marcador de resistencia a la eritropoyetina y está relacionada tanto con procesos intercurrentes (neoplasias, infecciones, etc.) como con un peor pronóstico en los pacientes en hemodiálisis, por lo que es muy importante su detección y seguimiento10,11,15,16.
El objetivo de nuestro estudio fue determinar si la resistencia a la eritropoyetina está relacionada con los índices INL e IPL. Cabe destacar que en el estudio se descartaron los enfermos que cursaron ingreso hospitalario por causas infecciosas, oncológicas y hematológicas; los que recibieron transfusión sanguínea en los últimos 3 meses; los que presentaron comorbilidades oncohematológicas activas y los que estaban recibiendo tratamiento esteroideo. Todos estos factores que, a priori, podrían alterar el recuento de estas células sanguíneas.
A diferencia de un estudio previo, que encontró una asociación significativa del IRE solo con IPL (y no con INL)11, nuestro estudio ha encontrado asociación con ambos parámetros. Una explicación podría ser que el número bajo de linfocitos, el parámetro común de ambos índices, podría ser el factor más importante. De forma aislada, la disminución del número absoluto de linfocitos ha sido utilizada como marcador de cardiopatía isquémica27,28. Un factor a tener en cuenta, encontrado en nuestro trabajo, es que el cuartil cuarto tuvo los niveles de albúmina y peso seco más bajos. A pesar de que este resultado podría deberse a una influencia de la desnutrición, serían necesarios otros estudios para determinar, realmente, cuál de las causas de hipoalbuminemia es la que más influye en este hallazgo (por ejemplo: desnutrición, inflamación, hepatopatía, etc.).
Cabe destacar que el estrés fisiopatológico produce liberación de cortisol (no analizado en nuestro estudio) que disminuye los niveles de linfocitos. Esto podría traducirse en una respuesta inmunológica alterada que desembocaría en una resistencia a la eritropoyesis. Por otra parte, la linfocitopenia podría ser causada por apoptosis de dichas células en lesiones arterioescleróticas22.
Individualmente, las plaquetas están involucradas en la arterioesclerosis, en la activación de citocinas proinflamatorias y, al interaccionar con el endotelio, probablemente también estén relacionadas con la quimiotaxis leucocitaria y con la inflamación en la pared arterial29,30.
Los neutrófilos han demostrado un papel importante en la disfunción endotelial, aterogénesis y desestabilización de la placa. Los neutrófilos activados se adhieren y penetran la pared endotelial con facilidad y están involucrados en la generación y liberación de radicales libres, enzimas hidrolíticas y citocinas31.
En nuestro estudio, el IPL tiene una correlación significativa con el logIRE similar a la que presentan la proteína C reactiva y el hierro sérico, lo cual es coherente dado que las principales causas de resistencia a la eritropoyetina son la inflamación y la ferropenia14.
En cuanto al INL, la correlación con el logIRE es significativa pero menor que la encontrada con el IPL. Nuestros resultados mejoran aspectos vislumbrados por otros autores, probablemente, debido a que nuestro estudio contó con un mayor número de muestra32. Sin embargo, las razones de esta diferencia aún no se conocen, pero se postula que el IPL sería superior porque, a su vez, es un mejor marcador de inflamación que el INL11,25.
Sin embargo, dado el bajo valor de R2 en ambas correlaciones, el poder predictivo de estas asociaciones es bajo. Sin embargo, al juntarse con otras variables de inflamación y ferrocinética, el IPL sí aporta capacidad explicativa adicional.
Las fortalezas del estudio son su tamaño muestral, que fue mucho mayor que el de estudios previos, y su carácter multicéntrico25.
Dentro de las limitaciones del estudio se puede mencionar: su diseño transversal, el hecho de que la población reclutada pertenece a una sola provincia de España y que los resultados obtenidos si bien demuestran asociaciones estadísticamente significativas, tienen un limitado poder predictivo.
En vista de los resultados obtenidos, los valores de la media de los 2 índices podrían ser utilizados como puntos de corte para posteriores estudios que estimen necesaria la estratificación de estos parámetros.
En conclusión, los valores altos de los índices INL e IPL estuvieron asociados con mayores valores de IRE en una población de alto riesgo cardiovascular como son los pacientes prevalentes en hemodiálisis. Ambos índices pueden ser un buen marcador coste-efectivo para la monitorización de la resistencia a la eritropoyetina.
AutoríaDiseño del estudio: F.V.A, T.M.V.
Conducción del estudio: F.V.A, T.M.V, F.H.P, y G.A.
Recolección de datos: F.V.A, T.M.V, F.H.P, y G.A.
Análisis de los datos: F.V.A, T.M.V, F.H.P, A.S.D.P y G.A.
Interpretación de los resultados: F.V.A, T.M.V, F.H.P, y G.A.
Elaboración del manuscrito: F.V.A, T.M.V, F.H.P, A.S.D.P y G.A.
Revisión del contenido del manuscrito: F.V.A, T.M.V, F.H.P, A.S.D.P y G.A.
Aprobación de la versión final del manuscrito: F.V.A, T.M.V, F.H.P, A.S.D.P y G.A.
F.V.A, A.S.D.P y G.A aceptan la responsabilidad de la integridad del análisis de los datos.
Conflicto de interesesLos autores declaran que no existen conflictos de intereses.