La cistinosis es un error innato del metabolismo cuyas características clínicas incluyen compromiso renal severo y formación de cristales de cistina en la córnea, especialmente en la presentación adulta de la enfermedad. Es una enfermedad tratable, por lo cual establecer el diagnóstico de forma oportuna es fundamental para iniciar la terapia. Para la confirmación bioquímica de la enfermedad se requiere determinar las concentraciones intracelulares de cistina, para lo cual se han reportado diferentes métodos tanto para el aislamiento de las células como para la cuantificación del aminoácido. Con el objetivo de mejorar el diagnóstico bioquímico confirmatorio en nuestro medio establecimos un protocolo de cuantificación intraleucocitaria de cistina.
MétodosSe implementó un método de cuantificación de cistina en polimorfonucleares por cromatografía líquida de alta resolución, evaluando el mejor anticoagulante a utilizar, la estabilidad de la muestra a 4̊C y estableciendo valores de referencia para nuestra población.
ResultadosSe determinó que la muestra para cuantificación intraleucocitaria de cistina debe ser anticoagulada mediante la adición de ácido cítrico-dextrosa como anticoagulante. La muestra debe ser procesada inmediatamente, dada su baja estabilidad incluso en refrigeración. Con 50 individuos sanos se estableció como punto de corte para nuestra población 0,34nmol 1/2 cistina/mg.
ConclusiónLa adaptación realizada del método de cuantificación de cistina utiliza el número más alto de muestras control hasta ahora reportado en la literatura. Nuestros resultados dan cuenta de la necesidad de implementar el método a nivel local y reafirman la conveniencia de que cada laboratorio establezca sus propios valores de referencia para proporcionar una mayor confiabilidad a la hora de interpretar los resultados.
Cystinosis is an inborn error of metabolism, clinically characterised by severe renal involvement and development of corneal cystine deposits, especially in the adult form of the disease. Cystinosis is a treatable condition. Therefore, an early diagnosis is necessary to start therapy. For biochemical confirmation of the condition it is necessary to quantify intracellular cystine concentrations. For this, different methods have been described with variations in cell isolation strategies and the amino acid quantification techniques used. In order to improve confirmatory biochemical diagnosis in our setting, a protocol for intraleukocitary cystine quantification was established.
MethodsA high performance liquid chromatography based method for cystine quantification in polymorphonuclear cells was implemented. Evaluation of the best anticoagulant to use and temperature stability of the sample at 4̊C were performed. In addition, we established reference values for our population.
ResultsIt was determined that intraleukocitary cystine quantification must be performed in blood samples containing acid-citrate-dextrose as anticoagulant. Samples must be processed immediately due to their poor stability even when refrigerated. Based on the results from 50 healthy individuals, the cut-off point established for our population was 0.34nmol 1/2 cystine/mg.
ConclusionThe adaptation performed to the cystine quantification method here presented the highest control population that has been reported in the literature so far. Our results highlight the need for making available a cystine quantification method locally and confirm the convenience for each laboratory to establish its own reference values to provide greater reliability for interpreting results.
La cistinosis es un error innato del metabolismo ocasionado por la deficiencia de la enzima lisosomal cistinosina, un transportador de cistina/H (+) encargado de transportar la cistina desde el interior de los lisosomas al citoplasma celular1; la enzima es codificada por el gen CTNS, localizado en 17p13.22. Esta enfermedad es la causa más común de ocurrencia del síndrome de Fanconi en el primer año de vida. Clínicamente puede presentarse también de forma tardía en la niñez o en la adolescencia como síndrome moderado de Fanconi o solamente con proteinuria aislada, e incluso en la edad adulta, cuya manifestación principal es el compromiso ocular representado por la formación de cristales de cistina que se depositan en la córnea2.
La gran heterogeneidad clínica de la enfermedad dificulta en muchos casos el diagnóstico y requiere de un alto nivel de experiencia y conocimiento por parte del personal de salud. Es por esto que, aunque es posible realizar el diagnóstico de forma temprana, en muchos casos este puede retrasarse incluso hasta el estadio final de la falla renal en las presentaciones infantiles y hasta el compromiso ocular severo en la forma adulta. En cualquiera de los casos, el diagnóstico bioquímico que acompaña a la impresión clínica debe ser la demostración del acúmulo de cistina dentro del lisosoma de las células polimorfonucleadas2. Realizar un diagnóstico rápido es indispensable, ya que se dispone de un tratamiento eficaz para lograr la depleción de cistina intralisosomal, lo que redundará en un impacto positivo en el progreso y el pronóstico de la enfermedad2,3.
Una vez establecida la sospecha clínica, la cuantificación de cistina intraleucocitaria permite realizar el diagnóstico final confirmatorio de la cistinosis, tras lo cual puede iniciarse el tratamiento específico de la entidad mediante el uso del fármaco análogo de la proteína alterada3–5. Sin embargo, dicha técnica no es regularmente realizada, ni siquiera en laboratorios especializados en enfermedades metabólicas, debido principalmente a la dificultad de obtención de fracciones limpias de células polimorfonucleadas6,7. Con la disponibilidad de realizar terapia en esta enfermedad3,4,8,9 aumentó la necesidad de disponer de un diagnóstico rápido y preciso de esta, para lograr un impacto positivo en la calidad de vida, minimizando el compromiso renal.
La cromatografía de alta resolución ha sido el método tradicional para cuantificar aminoácidos en fluidos biológicos, aunque para el caso de la cistina intraleucocitaria, en la literatura se encuentran múltiples variaciones de los métodos empleados tanto para el aislamiento de las células como para la cuantificación del aminoácido5,10,11. Teniendo en cuenta lo anterior y sabiendo que la implementación de un método específico puede mostrar variaciones entre laboratorios, es importante establecer las condiciones específicas de cada laboratorio que desee realizar la cuantificación de cistina, así como determinar los valores de referencia de cada población, para evitar sesgos en la interpretación. Por tanto, en este trabajo se presenta la estandarización de un método de cuantificación de cistina en polimorfonucleares utilizando HPLC y el establecimiento de valores de referencia para población colombiana.
MetodologíaMuestraLa muestra utilizada fue sangre venosa, obteniéndose un mínimo de 6ml (un tubo). Para la toma de la muestra no se requirió ayuno ni condiciones especiales. Teniendo en cuenta que los principales anticoagulantes utilizados en la literatura son heparina y ácido cítrico-dextrosa (ACD)7,12–14, se compararon estos 2 anticoagulantes utilizando tubos Vacutainer conteniendo heparina de sodio o ACD solución B. Adicionalmente, se evaluó la estabilidad de la muestra de sangre total conservada a 4̊C durante 8 y 24h.
Separación de polimorfonuclearesSe estandarizó un protocolo de aislamiento de polimorfonucleares a partir de sangre total basado en lo descrito por Levtchenko et al. y las recomendaciones del programa de la European Research Network for evaluation and improvement of screening, Diagnosis and treatment of Inherited disorders of Metabolism7,15. Brevemente, el método consiste en un esquema de separación secuencial utilizando primero dextrano al 5% y posteriormente Ficoll 1119, seguido de la eliminación de glóbulos rojos presentes en la muestra mediante lisis osmótica. El botón obtenido finalmente se resuspendió en una solución de N-etilmaleimida (Sigma 04259) 5,2mM en agua destilada, la cual debe procesarse inmediatamente.
Cuantificación de la cistina intraleucocitariaAntes del análisis por cromatografía el botón celular obtenido se somete a rotura por ultrasonido aplicando 4 ciclos de 15s, cada uno a intensidad baja (20%). Posteriormente, la muestra fue desproteinizada mediante adición de solución de ácido sulfosalicílico al 12%. La cuantificación de cistina se realizó mediante cromatografía líquida de alta resolución utilizando un analizador de aminoácidos Biochrom 30. La cuantificación se realiza utilizando como estándar una solución comercial de aminoácidos que contiene cisteína en una concentración de 125μM (Sigma A6282). El control de corrida se realiza utilizando como estándar interno N-leucina (Sigma N6877). El equipo realiza la separación por intercambio aniónico y derivatización poscolumna con ninhidrina realizando lecturas a 537nm. Teniendo en cuenta que se cuantifican las moléculas de cisteína liberadas de los leucocitos, el informe se realiza en nmol 1/2 cistina y se normaliza por la concentración de proteína de la muestra.
Cuantificación de proteínaEl pellet obtenido después de la desproteinización de la muestra se resuspende en NaOH 0.1N y se cuantifica la proteína total utilizando el método de Folin-Lowry frente a la curva de calibración de albúmina sérica bovina (Sigma A2153) entre 0,125 y 3mg/ml16.
Establecimiento de valores de referencia para población localCon el fin de establecer valores de referencia en nuestra población, se seleccionaron mediante convocatoria abierta 50 voluntarios sanos adultos sin perjuicio de edad o género, a quienes antes del consentimiento informado se les tomó una muestra de sangre para cuantificar la cistina intraleucocitaria empleando el método establecido. Adicionalmente se validaron los resultados utilizando muestras de 4 pacientes con diagnóstico confirmado de cistinosis.
Resultados y discusiónSelección del anticoagulanteEn los análisis realizados se observó que utilizando como anticoagulante ACD se obtiene una mejor recuperación de los picos cromatográficos y una mejor resolución de fases en la etapa del gradiente de dextrano. Con base en estos resultados, se seleccionó ACD como anticoagulante para el desarrollo del proceso de cuantificación.
Estabilidad de la muestraSe evaluó la estabilidad de la conservación de la muestra de sangre en 2 condiciones de almacenamiento: 8 y 24h a 4̊C. Los resultados muestran que el almacenamiento de las muestras lleva a falsas disminuciones de la cisteína, la cual se torna indetectable en la mayoría de los casos (tabla 1). Solo la muestra 1, que es la que presenta una concentración más alta de cisteína, mostró valores detectables después de 30h de almacenamiento.
Resultados de los ensayos de estabilidad
| Tiempo de almacenamiento | Muestra 1 | Muestra 2 | Muestra 3 | Muestra 4 | ||||
|---|---|---|---|---|---|---|---|---|
| PT(mg/vial) | Cis(μMol/vial) | PT(mg/vial) | Cis(μMol/vial) | PT(mg/vial) | Cis(μMol/vial) | PT(mg/vial) | Cis(μMol/vial) | |
| 0 | 0,45 | 5,51 | 0,97 | 1,232 | 0,61 | ND | 0,56 | 1,072 |
| 8h | NR | NR | 0,68 | ND | 0,47 | ND | 0,4 | ND |
| 24h | 0,05a | 1,52a | 0,67 | ND | 0,87 | ND | 0,59 | ND |
Cis: cisteína; ND: no detectable; NR: no realizado; PT: proteína total.
Adicionalmente, en algunas muestras se observó una pérdida en la calidad de la misma, evidenciada por una disminución de la cantidad de proteína total (tabla 1).
Los resultados obtenidos permiten concluir que la muestra de sangre total no es estable, por lo cual debe ser tomada en el lugar donde se realizará el proceso.
Separación de polimorfonuclearesPara confirmar la obtención de células polinucleares vs. mononucleares en el paso del ficol se llevó a cabo la cuantificación de fracciones celulares mediante citometría con un equipo DxH 800 de Beckman Coulter, evidenciándose que en la fracción de trabajo para cuantificación la población de células polimorfonucleadas supera el 90% del total celular (91,35-99,44; n=4).
Cuantificación de cistinaUtilizando el método estándar de cuantificación por HPLC se procesaron estándares de cisteína comercial con concentraciones entre 0 y 0,5mM, rango que cubre incluso las concentraciones de individuos afectados (nivel nmol). La curva final de calibración obtenida muestra una correlación de 99,84% entre concentración de cistina real (preparada) y cistina calculada por HPLC, lo que valida la capacidad de HPLC para detectar con exactitud la concentración de cistina presente en una muestra.
Establecimiento de valores de referencia para población localUna vez determinada la concentración de cistina de los voluntarios sanos, se estableció el histograma de frecuencia y se consideró el percentil 90 para establecer como punto de corte 0,34 nmol 1/2 cistina/mg. La dispersión observada es comparable con lo reportado previamente por Gertsman et al., quienes trabajaron con una muestra de 10 pacientes14 (fig. 1A). Adicionalmente, los valores reportados en diferentes estudios oscilan entre 0 y 0,2nmol 1/2 cistina/mg prot aproximadamente, lo que coincide con los resultados de alrededor del 70% de nuestra población2,3,6,15. Es de importancia resaltar que los reportes en literatura en general utilizan poblaciones con muy bajo número de individuos (entre 2 y 30, aproximadamente), lo cual disminuye la probabilidad de encontrar los valores altos vistos en este estudio y que corresponden a solo el 10% de nuestra población.
Una vez establecido el protocolo de cuantificación, se determinó la concentración de cistina intraleucocitaria en 4 individuos afectados, un individuo con sospecha de estar afectado y otro individuo heterocigoto (uno de los padres de uno de los pacientes incluidos en el estudio).
Como se muestra en la figura 1B, mientras los niveles de la población sana llegan hasta 0,7nmol 1/2 cistina/mg prot, los valores de los pacientes están por encima, encontrándose niveles entre 1 y 12nmol 1/2 cistina/mg prot. Estos resultados son comparables con lo observado en otros estudios6,7,14,17. Vale la pena aclarar que el paciente cuyo valor fue 1 se encuentra en tratamiento, es más, estos valores son similares a lo reportado por otros autores en pacientes tratados7,17.
Por su parte, la muestra del individuo heterocigoto procesado mostró valores intermedios (1,06nmol 1/2 cistina/mg prot), los cuales caen en la zona gris establecida según los valores de referencia previamente establecidos. Esto concuerda con lo reportado en la literatura, donde los heterocigotos pueden presentar valores que oscilan entre la normalidad y valores que superan hasta 5 veces los puntos de corte, siendo aun así valores más bajos que los observados en pacientes (usualmente más de 10 veces por encima del punto de corte). Finalmente, el individuo en estudio de cistinosis arrojó resultados considerados como normales.
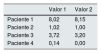
De forma adicional se comprobó la validez de la metodología propuesta, realizando de forma simultánea la determinación de cistina en muestras procesadas por nosotros (laboratorio 1) y por un laboratorio de referencia comúnmente usado para la remisión de muestras desde nuestro país (laboratorio 2). Los resultados que se presentan en la tabla 2 muestran una buena concordancia entre laboratorios, lo que valida el método empleado.
Reproducibilidad de la cuantificación de cistina intraleucocitaria interlaboratorios
| Valor 1 | Valor 2 | |
|---|---|---|
| Paciente 1 | 8,02 | 8,15 |
| Paciente 2 | 1,02 | 1,00 |
| Paciente 3 | 3,72 | 3,20 |
| Paciente 4 | 0,14 | 0,00 |
Valor 1: cuantificación laboratorio 1; Valor 2: cuantificación laboratorio 2.
Todas las concentraciones se expresan como nmol/2 cist/mg prot.
La cistinosis es un error innato del metabolismo y una de las causas de enfermedad renal en la infancia que puede comprometer la vida del paciente si no se diagnostica y se trata a tiempo. Es por esto que es esencial realizar un diagnóstico rápido y eficiente, para lo que es necesario contar con el método diagnóstico ?la cuantificación de cistina intraleucocitaria? a nivel local. La adaptación realizada del método de cuantificación, por HPLC, de cistina en células sanguíneas polimorfonucleares utiliza el número más alto de muestras control hasta ahora reportado en la literatura. El protocolo establecido emplea un volumen de sangre considerado adecuado para individuos desde temprana edad; es importante tener en cuenta que otros análisis de laboratorio general, como los estudios de inmunología y citometría, así como la determinación de ácido láctico, suelen emplear volúmenes de sangre incluso superiores al empleado por nosotros. Aun así, sería conveniente en futuros trabajos adaptar el método a volúmenes reducidos de sangre, para hacerlo más aplicable a lactantes menores.
La implementación de esta técnica es de gran importancia para el diagnóstico de la cistinosis en Colombia y da cuenta de la necesidad de implementar el método a nivel local, dada la inestabilidad de la muestra. Adicionalmente, se observan algunas diferencias con respecto a otros valores reportados, reafirmando la conveniencia de que cada laboratorio establezca sus propios valores de referencia para proporcionar una mayor confiabilidad a la hora de interpretar los resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen el apoyo económico de la compañía Recordati Rare Diseases, mediante financiamiento del proyecto ID # 7350, Pontificia Universidad Javeriana, Bogotá (Colombia).