El único método actual definitivo para el diagnóstico de rechazo en el paciente trasplantado renal es mediante la biopsia del injerto. La introducción del ADN libre derivado del donante (ddcfDNA) ha emergido como un biomarcador no invasivo más preciso para cuantificar esta lesión y diagnosticar el rechazo, en comparación con biomarcadores clásicos. Aquí evaluamos nuestra experiencia tras su implementación en nuestro centro.
Materiales y métodosEstudio transversal unicéntrico con extracción de cell-free DNA en sangre y cuantificación mediante ensayo AlloSeqcfDNA (CareDx) del ddcfDNA en el momento de realización de biopsias «por protocolo» o «por indicación» entre diciembre de 2020 y diciembre de 2023.
ResultadosEn total se incluyeron 172 biopsias de injerto (59 por protocolo y 113 por indicación) en 112 receptores de trasplante renal. Entre las biopsias, se identificaron 19 rechazos borderline, 11 rechazos mediados por células T y 30 rechazos mediados por anticuerpos. La mediana de ddcfDNA en cada grupo diagnóstico fue: 0,40% (0,23-0,82%) en el borderline, 0,60% (0,23-1,91%) en el celular y 1,48% (0,77-3,4%) en el mediado por anticuerpos (p<0,001). En las 112 biopsias sin datos de rechazo, la mediana de ddcfDNA fue de 0,33% (0,17-0,54%) (p<0,001). Los casos con DSA positivos y rechazo presentaron niveles de ddcfDNA más elevados en comparación con los DSA positivos sin rechazo (p=0,010) y los niveles de ddcfDNA mostraron una asociación significativa con la inflamación microvascular y la positividad de C4d. El área bajo las curvas ROC del ddcfDNA para discriminar cualquier tipo de rechazo de la ausencia de rechazo fue de 0,74 (0,65-0,82), y excluyendo el rechazo borderline del análisis, de 0,80 (0,72-0,89), superando a otros marcadores de función renal.
ConclusionesLa implementación del análisis ddcfDNA en nuestro centro como herramienta asistencial ha demostrado ser valiosa para distinguir el rechazo agudo comprobado por biopsia, especialmente el mediado por anticuerpos, superando a otros marcadores clásicos de función renal. Su implementación hospitalaria favorece un diagnóstico oportuno y preciso, mejorando la gestión y pronóstico del trasplante.
The introduction of donor-derived free DNA (ddcfDNA) has emerged as an accurate non-invasive biomarker to diagnose rejection, compared to classical ones. Here we evaluate our experience after its implementation in our center as an in-house technique.
Materials and methodsSingle-center cross-sectional study with extraction of cell-free DNA in blood and quantification of the ddcfDNA using the AlloSeqcfDNA assay (CareDx) at the time of performing biopsies ‘per protocol’ or ‘per indication’ between December 2020 and December 2023.
Results172 graft biopsies were included (59 for protocol and 113 for cause) in 112 kidney transplant recipients. Among the biopsies, 19 borderline rejections, 11 T-cell mediated rejections, and 30 antibody-mediated rejections were identified. The median ddcfDNA in each diagnostic group was: 0.40% (0.23%-0.82%) in borderline, 0.60% (0.23%-1.91%) in cellular, and 1.48% (0.77%-3.4%) in antibody-mediated rejection (p<0.001). In the 112 biopsies with no signs of rejection, the median ddcfDNA was 0.33% (0.17%-0.54%) (p<0.001). Cases with positive DSAs and rejection showed higher levels of ddcfDNA than positive DSAs without rejection (p=0.010), and ddcfDNA levels were significantly associated with microvascular inflammation and C4d positivity. The area under the ROC curves of ddcfDNA to discriminate any type of rejection from the absence of rejection was 0.74 (0.65-0.82) and, excluding borderline rejection from the analysis, 0.80 (0.72-0.89), outperforming other markers of renal function.
ConclusionsImplementing ddcfDNA analysis at our center as a clinical tool has proven valuable for distinguishing biopsy-confirmed acute rejection, particularly antibody-mediated rejection, outperforming classic renal function markers. Its hospital-based implementation supports timely and accurate diagnosis, improving transplant management and prognosis.
El rechazo mediado por anticuerpos (ABMR, de sus siglas en inglés: antibody mediated rejection) sigue siendo el desafío más relevante para garantizar la supervivencia a largo plazo del injerto renal. El diagnóstico precoz es esencial, ya que los tratamientos son ineficaces cuando el rechazo agudo progresa a una forma crónica1. Lamentablemente, los biomarcadores utilizados, como la creatinina o la proteinuria, se elevan tardíamente, una vez establecido el rechazo y los anticuerpos específicos contra el donante (DSA, por su acrónimo en inglés: donor-specific antibodies) no son altamente sensibles, ya que casi la mitad de los casos de ABMR ocurren sin DSA detectables2.
Un biomarcador recientemente introducido que podría transformar la práctica clínica es el ADN libre derivado del donante (ddcfDNA, por su acrónimo en inglés: donor-derived cell-free DNA). El ddcfDNA se libera de las células del donante por apoptosis o necrosis y constituye un porcentaje del ADN libre circulante del receptor. Cuando ocurre un daño en el injerto, el porcentaje de ddcfDNA en sangre aumenta significativamente, siendo útil como marcador sensible de daño3. Sin embargo, no es un biomarcador específico de rechazo, sino de daño celular del injerto, pues niveles elevados se observan en otras circunstancias como la necrosis tubular aguda (NTA)4 o la infección por el virus BK5.
La capacidad diagnóstica del ddcfDNA ha sido destacada en varios estudios1,6–9. La prueba es realizada por diferentes proveedores de servicio de análisis clínicos, quienes lo ofrecen mediante el envío de muestras a un laboratorio centralizado o implementando su realización en el mismo centro hospitalario (in-house) usando técnicas de secuenciación masiva (NGS). En el Hospital Clínic de Barcelona, se implementó la detección in-house de ddcfDNA a finales de 2020.
El objetivo de este estudio es analizar la experiencia del centro en la implementación de esta técnica, así como los resultados clínicos obtenidos desde ese momento.
Material y métodosDiseño y población del estudioEste es un estudio transversal unicéntrico desarrollado en el Hospital Clínic de Barcelona, donde se analizaron muestras sanguíneas e histológicas de pacientes trasplantados renales a los que se les realizó una biopsia del injerto entre diciembre de 2020 y diciembre de 2023, determinándose paralelamente el porcentaje de ddcfDNA en sangre. Se incluyeron biopsias realizadas tanto por indicación clínica, debido a deterioro analítico (alteraciones en creatinina, disminución en la tasa de filtrado glomerular estimada [TFGe] mediante ecuación CKD-EPI o empeoramiento de la proteinuria), acompañado o no del desarrollo de DSA de novo, como biopsias realizadas por protocolo. En nuestro centro, estas se realizan rutinariamente a los 3 y 12 meses postrasplante, independientemente de la función del injerto. Se han recopilado y analizado datos demográficos, clínicos, analíticos e inmunológicos de los pacientes incluidos. Todas las biopsias fueron evaluadas por el Servicio de Anatomía Patológica del Hospital Clínic de Barcelona, siguiendo la clasificación de Banff 2019. Para asegurar la validez interna de los resultados, se excluyeron aquellos pacientes que habían recibido trasplantes de múltiples órganos, evitando posibles interferencias derivadas de otros injertos.
Cuantificación del ADN libre derivado del donante (ddcfDNA) por secuenciación masivaEn cada paciente, se llevó a cabo la extracción en 2 tubos Streck de 10ml (Streck, La Visa, NE, EE. UU.), que se mantuvieron a temperatura ambiente y se centrifugaron dentro de los 7 días posteriores a la recolección de la muestra. El plasma obtenido de la centrifugación (la primera a 1.600g durante 20 minutos, y la segunda a 16.000g durante 10min) se almacenó a −80°C hasta su posterior análisis. Se extrajo ADN libre de células desde 5ml de plasma utilizando el kit QiAmp circulating nucleic acid kit (Qiagen, Dusseldorff, Alemania) siguiendo las instrucciones del fabricante. La cantidad relativa de ADN libre de células procedente del donante en el receptor de trasplante de riñón se evaluó mediante la secuenciación masiva de 202 polimorfismos de un solo nucleótido (SNP, por su acrónimo en inglés: single nucleopide polimorfism). Las bibliotecas se prepararon utilizando el ensayo AlloSeq cfDNA Assay (CareDx, San Francisco, CA, EE. UU.) siguiendo el protocolo del fabricante y la secuenciación se realizó en un instrumento MiSeq utilizando los kits de 300 ciclos MiSeq Micro v2 o 150 ciclos MiSeq v3(Illumina, San Diego, CA, EE. UU.) según cantidad de muestras a procesar. El análisis de datos se realizó con el software AlloSeq cfDNA v2.2.1 (CareDx) usando el análisis blind el cual no requiere de la genotipación de ninguna muestra genómica, y el ddcfDNA se midió como el porcentaje de todo el cfDNA disponible en la muestra.
Análisis estadísticoLa normalidad de las variables continuas se evaluó mediante la prueba de Kolmogorov-Smirnov. Los datos de variables cuantitativas con distribución normal se presentan como media y desviación estándar (DE), mientras que para las de distribución no normal se usa la mediana y el rango intercuartílico (RIC), calculado con el método de Tukey. Las variables cualitativas se describen con frecuencias absolutas y relativas.
Según la naturaleza de los datos, se utilizó la prueba t de Student para comparar variables con distribución normal, mientras que para variables con distribución no normal se aplicaron las pruebas de U de Mann-Whitney o Kruskal-Wallis. En el análisis de datos categóricos, se aplicaron pruebas de Chi-cuadrado o de Fisher, según correspondiera. Para el análisis multivariante, se realizó una regresión logística binaria.
El área bajo las curvas ROC (AUC) se empleó para evaluar el rendimiento del ddcfDNA, los DSA, el TFGe y el cociente proteína/creatinina en orina (UPCR, de sus siglas en inglés: Urine Protein Creatinine Ratio) en el diagnóstico de rechazo. Los resultados de la AUC incluyen su intervalo de confianza al 95%.
El análisis estadístico se realizó con el software IBM SPSS Statistics versión 21.0 (SPSS, Inc; Chicago, Illinois) para Windows, y las representaciones gráficas se diseñaron con GraphPad versión 9.5.1 (GraphPad Software, La Jolla, CA, EE. UU.). Se aplicaron pruebas de significación estadística de dos colas y se estableció un nivel de significacióna de p<0,05.
ResultadosEste estudio incluyó un total de 172 biopsias renales, realizadas a 112 receptores de trasplante renal, de las cuales 59 (34,3%) fueron biopsias de protocolo y 113 (65,7%) biopsias por indicación clínica realizadas a las 24 (4-68) semanas postrasplante.
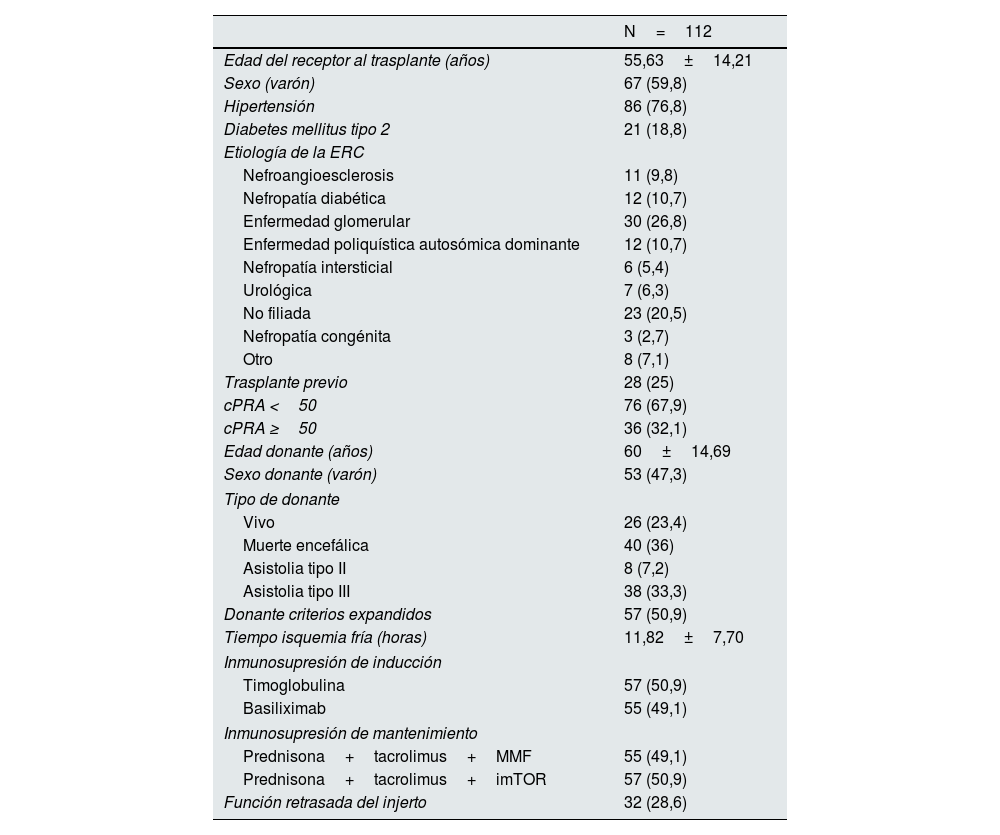
Entre los 112 receptores, 26 (23,4%) recibieron un injerto de donante vivo, 40 (36%) de donante en muerte encefálica, 38 (33,3%) de donante en asistolia tipo III y 8 (7,2%) en asistolia tipo II. La media de edad fue de 58,78±13,45 años y el 59,8% de los pacientes fueron varones. En cuanto a los trasplantes previos, 87 pacientes (77,7%) recibían su primer trasplante, 13 (11,6%) el segundo, 6 (5,4%) recibían el tercero, 4 (3,6%) el cuarto y 2 pacientes (1,8%) recibían su quinto trasplante. Las principales características basales de los pacientes se resumen en la tabla 1.
Principales características basales de los pacientes incluidos
| N=112 | |
|---|---|
| Edad del receptor al trasplante (años) | 55,63±14,21 |
| Sexo (varón) | 67 (59,8) |
| Hipertensión | 86 (76,8) |
| Diabetes mellitus tipo 2 | 21 (18,8) |
| Etiología de la ERC | |
| Nefroangioesclerosis | 11 (9,8) |
| Nefropatía diabética | 12 (10,7) |
| Enfermedad glomerular | 30 (26,8) |
| Enfermedad poliquística autosómica dominante | 12 (10,7) |
| Nefropatía intersticial | 6 (5,4) |
| Urológica | 7 (6,3) |
| No filiada | 23 (20,5) |
| Nefropatía congénita | 3 (2,7) |
| Otro | 8 (7,1) |
| Trasplante previo | 28 (25) |
| cPRA <50 | 76 (67,9) |
| cPRA ≥50 | 36 (32,1) |
| Edad donante (años) | 60±14,69 |
| Sexo donante (varón) | 53 (47,3) |
| Tipo de donante | |
| Vivo | 26 (23,4) |
| Muerte encefálica | 40 (36) |
| Asistolia tipo II | 8 (7,2) |
| Asistolia tipo III | 38 (33,3) |
| Donante criterios expandidos | 57 (50,9) |
| Tiempo isquemia fría (horas) | 11,82±7,70 |
| Inmunosupresión de inducción | |
| Timoglobulina | 57 (50,9) |
| Basiliximab | 55 (49,1) |
| Inmunosupresión de mantenimiento | |
| Prednisona+tacrolimus+MMF | 55 (49,1) |
| Prednisona+tacrolimus+imTOR | 57 (50,9) |
| Función retrasada del injerto | 32 (28,6) |
Los datos se expresan como media±desviación estándar o número absoluto y porcentaje.
cPRA: porcentaje de reactividad contra panel calculado; imTOR: inhibidores de mTOR; MMF: micofenolato mofetilo.
En cuanto a los hallazgos histopatológicos, se identificó la presencia de rechazo en 60 (34,9%) de las 172 biopsias, siendo la mayoría por indicación clínica (52, 86,7%) frente a las biopsias de protocolo (8, 13,3%), p<0,001. Entre las 112 biopsias sin rechazo, 61 (54,5%) fueron solicitadas por indicación clínica y 51 (45,5%) por protocolo.
De los 60 casos con rechazo, se identificaron 19 (31,67%) casos de rechazo borderline, 11 (18,33%) casos de rechazo mediado por células T (TCMR, de sus siglas en inglés: T cell mediated rejection) y 30 (50%) casos de ABMR. En cuanto a la clasificación de los TCMR, se identificaron 4 casos de rechazo de tipo IA, 2 de tipo IB, 2 de tipo IIA y 3 casos de rechazo crónico-activo. En el caso del ABMR, 21 eran rechazos agudos y 9 rechazos crónicos-activos. La presencia DSA se detectó en 19 de los 30 casos de ABMR (63,3%).
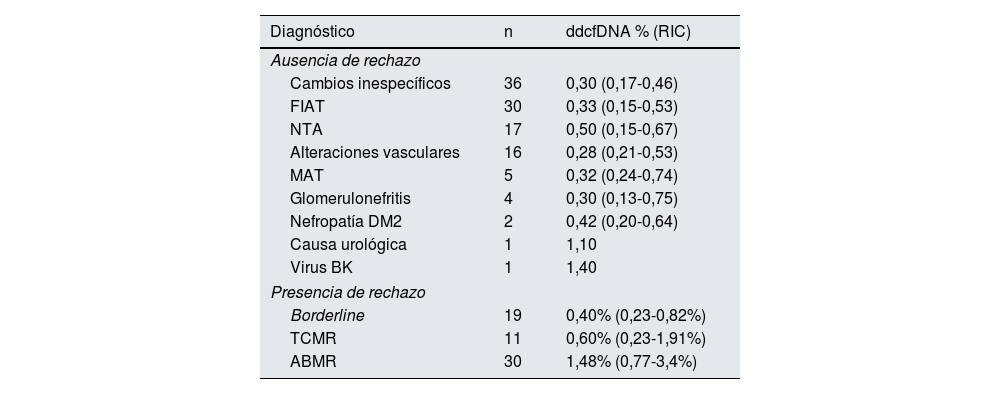
Entre las biopsias sin rechazo, los diagnósticos más comunes fueron cambios inespecíficos (36 casos, 20,9%), fibrosis intersticial y atrofia tubular leve a moderada (30 casos, 17,4%), NTA (17 casos, 9,9%) y alteraciones vasculares (16 casos, 14,3%). Otros diagnósticos incluyeron microangiopatía trombótica (5 casos, 2,9%), glomerulonefritis (4 casos, 2,3%), complicaciones relacionadas con diabetes tipo 2 (2 casos, 1,2%), causa urológica (1 caso, 0,6%) e infección por virus BK (1 caso, 0,6%). La tabla 2 muestra la mediana de ddcDNA en cada diagnóstico.
Valores de ddcDNA en los casos de ausencia o presencia de rechazo
| Diagnóstico | n | ddcfDNA % (RIC) |
|---|---|---|
| Ausencia de rechazo | ||
| Cambios inespecíficos | 36 | 0,30 (0,17-0,46) |
| FIAT | 30 | 0,33 (0,15-0,53) |
| NTA | 17 | 0,50 (0,15-0,67) |
| Alteraciones vasculares | 16 | 0,28 (0,21-0,53) |
| MAT | 5 | 0,32 (0,24-0,74) |
| Glomerulonefritis | 4 | 0,30 (0,13-0,75) |
| Nefropatía DM2 | 2 | 0,42 (0,20-0,64) |
| Causa urológica | 1 | 1,10 |
| Virus BK | 1 | 1,40 |
| Presencia de rechazo | ||
| Borderline | 19 | 0,40% (0,23-0,82%) |
| TCMR | 11 | 0,60% (0,23-1,91%) |
| ABMR | 30 | 1,48% (0,77-3,4%) |
Los datos se expresan como mediana (RIC: rango intercuartílico).
ABMR: rechazo mediado por anticuerpos; ddcfDNA: ADN libre derivado del donante; DM2: diabetes mellitus tipo 2; FIAT: fibrosis intersticial y atrofia tubular; MAT: microangiopatía trombótica; NTA: necrosis tubular aguda; TCMR: rechazo mediado por células T.
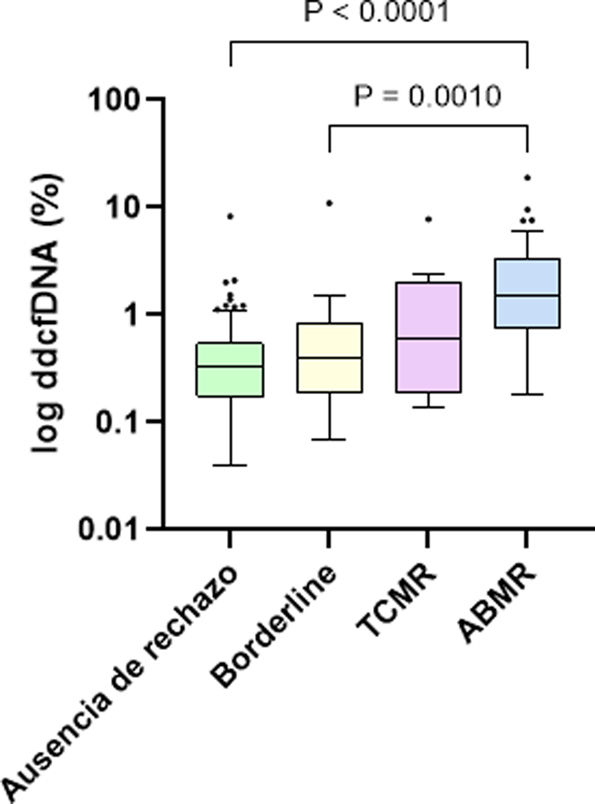
En cuanto a los niveles de ddcfDNA, se observó una diferencia significativa entre los pacientes con y sin rechazo, con una mediana de 0,88% (0,34-2,08%) en los casos de rechazo y 0,33% (0,17-0,54%) en ausencia de rechazo (p<0,001). Específicamente, la mediana de ddcfDNA fue de 0,40% (0,23-0,82%) en los casos borderline, 0,60% (0,23-1,91%) en los TCMR y 1,48% (0,77-3,4%) en los ABMR, evidenciando valores significativamente superiores en los pacientes con ABMR en comparación con los pacientes sin rechazo (p<0,001) y los pacientes con rechazo borderline (p=0,0010) (fig. 1). Dentro de los TCMR, no hubo diferencias significativas en los niveles de ddcfDNA entre los rechazos IA y ≥IB (p=0,788). Tampoco hubo diferencias significativas entre ABMR agudos y crónicos-activos (1,59% frente a 0,97%, p=0,108).
Los casos con DSA positivos y datos de rechazo en la biopsia (19 ABMR y 2 TCMR) mostraron niveles significativamente mayores de ddcfDNA en comparación con los casos con DSA positivos pero sin rechazo (n=8), con una mediana de 2,13% (1,2-4,8%) frente a 0,69% (0,28-1,23%) (p=0,010). Además, los 19 casos con DSA positivos y ABMR en la biopsia también presentaron una mediana de ddcfDNA significativamente superior (2,34%; 1,28-5,47%) en comparación con los 11 casos de ABMR sin DSA (0,97%; 0,52-1,24%), con un valor p de 0,010.
Respecto al TFGe y UPCR, no se observaron diferencias significativas entre los pacientes con y sin rechazo (30,31±16,98mL/min/1,73m2 vs. 36,18±19,64mL/min/1,73m2, p=0,135; 522mg/g vs. 359mg/g, p=0,171, respectivamente).
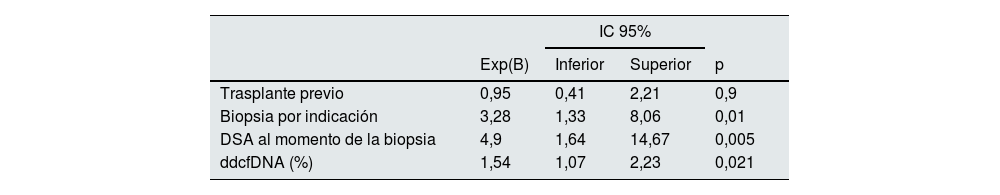
En el análisis univariante, las variables significativamente asociadas con el rechazo fueron la biopsia de indicación (p<0,001), la presencia de DSA (p<0,001), el trasplante previo (p=0,023) y los niveles de ddcfDNA (p<0,001). En el análisis multivariante, la biopsia de indicación (p=0,010), los DSA al momento de la biopsia (p=0,005) y los niveles de ddcfDNA (p=0,021) mantuvieron su asociación, mientras que el trasplante previo (p=0,9) la perdió (tabla 3).
Análisis multivariante de las variables asociadas con rechazo
| IC 95% | ||||
|---|---|---|---|---|
| Exp(B) | Inferior | Superior | p | |
| Trasplante previo | 0,95 | 0,41 | 2,21 | 0,9 |
| Biopsia por indicación | 3,28 | 1,33 | 8,06 | 0,01 |
| DSA al momento de la biopsia | 4,9 | 1,64 | 14,67 | 0,005 |
| ddcfDNA (%) | 1,54 | 1,07 | 2,23 | 0,021 |
ddcfDNA: ADN libre derivado del donante; DSA: anticuerpos específicos contra el donante.
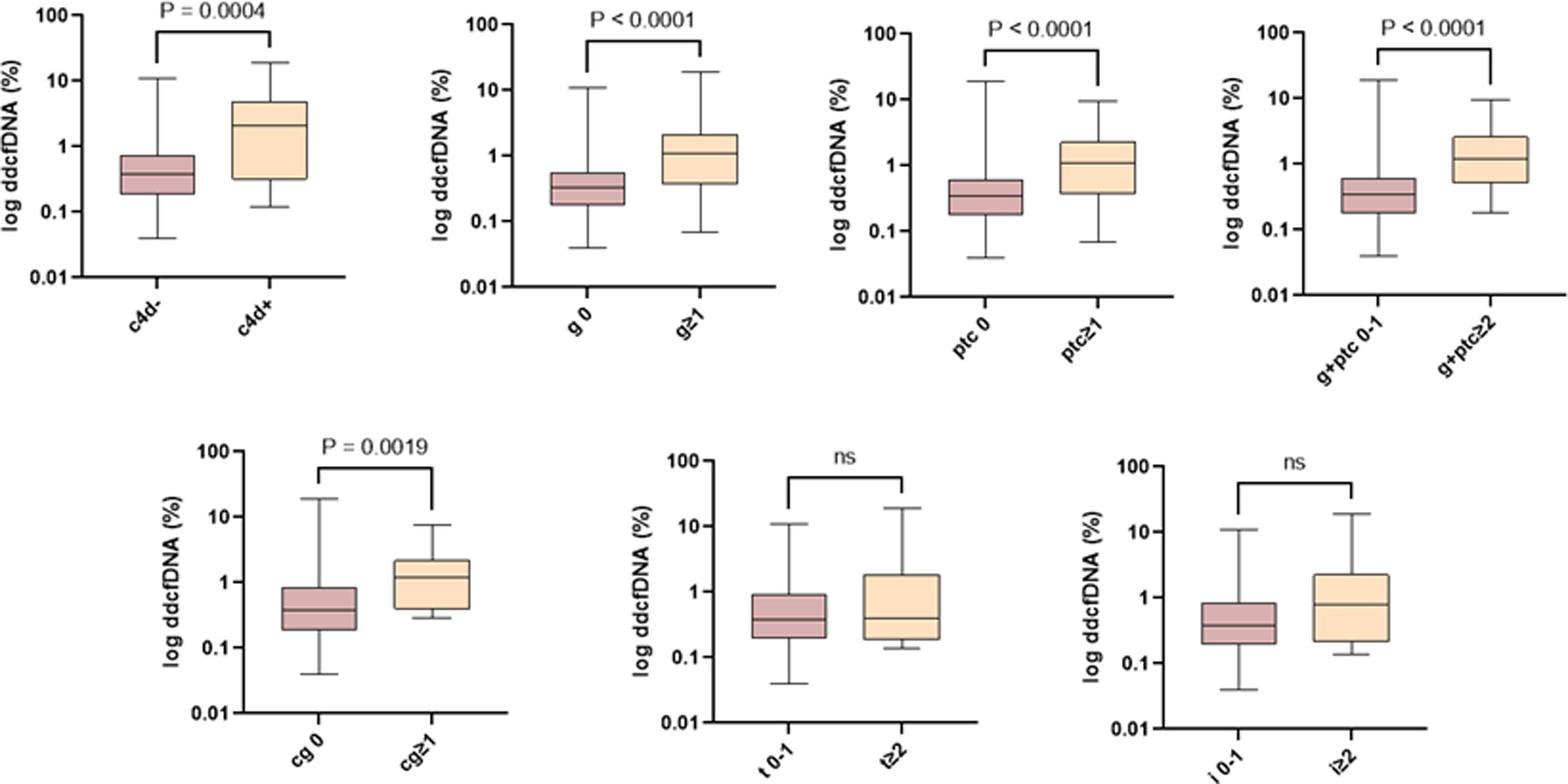
En el análisis de asociación del ddcfDNA con los scores individuales de la clasificación de Banff, se observó una correlación significativa con la inflamación microvascular y la presencia de C4d positivo, pero no con la inflamación tubulointersticial (fig. 2).
Asociación de los niveles de ddcfDNA con los scores individuales de la clasificación de Banff. El ddcfDNA se correlaciona con la gravedad de las lesiones individuales asociadas con una lesión aloinmune. ddcfDNA: ADN libre derivado del donante; cg: glomerulopatía del trasplante; g: glomerulitis; i: inflamación intersticial; ptc: capilaritis peritubular; t: tubulitis.
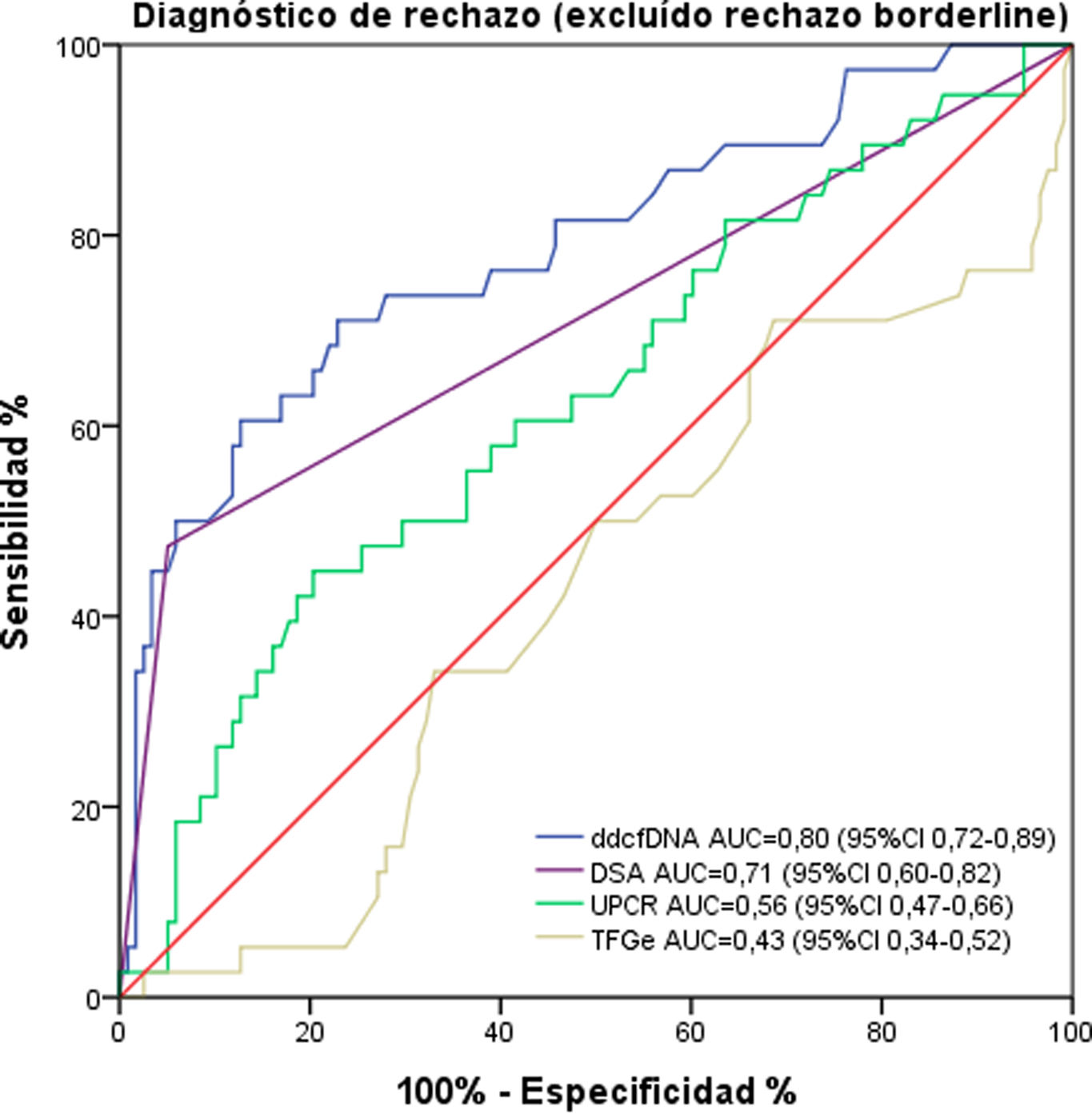
Para evaluar el rendimiento diagnóstico del ddcfDNA en la discriminación entre presencia y ausencia de rechazo, se calculó el AUC. Su resultado para discriminar cualquier tipo de rechazo (incluido el borderline) de la ausencia de rechazo fue de 0,74 (0,65-0,82). Excluyendo el rechazo borderline del análisis, el AUC fue de 0,80 (0,72-0,89) (fig. 3). Para la discriminación de ABMR o TCMR exclusivamente frente a la ausencia de rechazo, el ddcfDNA exhibió un AUC de 0,84 (0,77-0,92) y 0,59 (0,40-0,77), respectivamente. Si solo se compara el rechazo borderline versus la ausencia de rechazo, se observó un AUC todavía más bajo de 0,49 (0,36-0,62).
Curva ROC para el ddcfDNA, la presencia de DSA en el momento de la biopsia, el UPCR y la TFGe. El ddcfDNA discrimina el diagnóstico de rechazo (excluido el rechazo borderline en el análisis) con mejor rendimiento en comparación con otras medidas de la función del injerto renal. ddcfDNA: ADN libre derivado del donante; DSA: anticuerpos específicos contra el donante; UPCR: cociente proteína/creatinina en orina; TFGe: tasa de filtrado glomerular estimada.
La presencia de DSA mostró un AUC de 0,71 (0,60-0,82), mientras que el TFGe y el cociente proteína/creatinina en orina tuvieron AUC de 0,43 (0,34-0,52) y 0,56 (0,47-0,66), respectivamente (fig. 3).
DiscusiónLos resultados de este estudio respaldan la implementación del ddcfDNA como herramienta diagnóstica en la monitorización postrasplante renal. Nuestros datos muestran una diferencia estadísticamente significativa en los niveles de ddcfDNA entre pacientes con y sin rechazo, siendo considerablemente mayores en aquellos con rechazo, especialmente en los casos mediados por anticuerpos. Estos hallazgos sugieren que este biomarcador podría ser más sensible en la detección de ABMR en comparación con TCMR o el rechazo borderline, y son consistentes con estudios previos8–10, subrayando el potencial del ddcfDNA para identificar el rechazo de manera no invasiva.
En contraste con otros estudios que han reportado niveles de ddcfDNA más elevados en rechazos TCMR severos (≥IB)11,12, nuestra cohorte no mostró diferencias significativas entre los diferentes subtipos de TCMR (p=0,788). Esto podría atribuirse a la heterogeneidad en la presentación y severidad del rechazo, a que el ddcfDNA no refleje el daño tisular o a que los mecanismos fisiopatológicos no generen cantidades detectables de ADN en circulación, además del tamaño muestral reducido de pacientes con TCMR (n=11).
Este estudio también respalda observaciones previas sobre el comportamiento del ddcfDNA en el ABMR13–15, evidenciando niveles significativamente más altos en pacientes con ABMR que en aquellos con DSA positivo pero sin daño en la biopsia.
Específicamente, los pacientes con ABMR y DSA positivo presentaron una mediana de ddcfDNA de 2,34%, notablemente mayor que la de los pacientes con ABMR sin DSA (0,97%; p=0,010). La integración de estos dos tipos de información (ddcfDNA y presencia o ausencia de DSA) nos permitiría discernir si el fenómeno inmunológico estaría causando o no un daño en el injerto.
En cuanto a su capacidad diagnóstica, el ddcfDNA mostró un AUC de 0,74 para discriminar entre cualquier tipo de rechazo (incluido el rechazo borderline) y la ausencia de rechazo. Y en concreto, su rendimiento fue más robusto al diferenciar ABMR de la ausencia de rechazo, con un AUC de 0,84. Estos datos reflejan que el ddcfDNA podría tener limitaciones en la detección de rechazo borderline (AUC de 0,49)9,16,17, aunque en estos casos podría ayudar a identificar pacientes con peor pronóstico en términos de función renal y progresión del rechazo11.
Comparativamente, el rendimiento diagnóstico del ddcfDNA fue superior al de otros marcadores de función renal como la TFGe y el UPCR, que presentaron AUC de 0,43 y 0,56, respectivamente. Esto reafirma el valor del ddcfDNA como un marcador más sensible y específico para el rechazo agudo en receptores de trasplante renal.
Y en cuanto al análisis del ddcfDNA en relación con los scores individuales de la clasificación de Banff, respalda su utilidad para evaluar el ABMR, ya que se observó una asociación significativa con la inflamación microvascular y la positividad de CD4, mientras que no se observó una asociación con la inflamación tubulointersticial18-20.
A pesar de estos resultados positivos, nuestro estudio tiene algunas limitaciones. Primero, la falta de seguimiento longitudinal de los niveles de ddcfDNA tras la biopsia y el tratamiento del rechazo impide evaluar su utilidad como biomarcador dinámico, pronóstico o de respuesta al tratamiento. Estudios previos sugieren que los cambios en los niveles postratamiento podrían indicar la respuesta terapéutica y la recuperación del injerto, lo cual no se evaluó en este estudio8,16,18. Además, la heterogeneidad del rechazo en nuestra muestra pudo influir en la interpretación de los resultados. Por último, con el método actual para medir ddcfDNA no podemos diferenciar la proporción correspondiente a injertos previos no funcionantes. Sin embargo, en nuestra cohorte, solo un paciente presentó niveles de ddcfDNA superiores al 1% sin datos de rechazo (presentó NTA) y era portador de un injerto previo20.
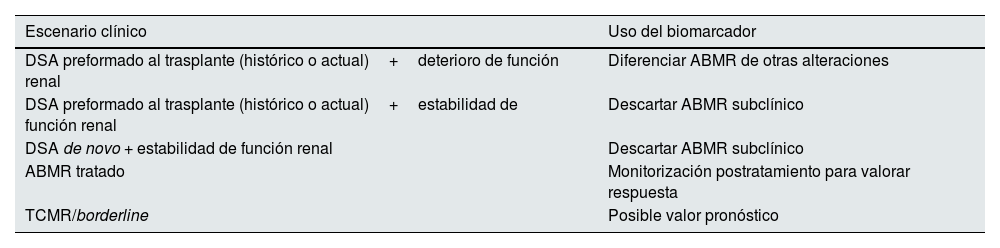
Este conocimiento generado nos permite discernir el área de uso del biomarcador en los diferentes escenarios clínicos11,16,18,21 y que presentamos en la tabla 4.
Propuesta sobre el uso del ddcfDNA según el diferente escenario clínico
| Escenario clínico | Uso del biomarcador |
|---|---|
| DSA preformado al trasplante (histórico o actual)+deterioro de función renal | Diferenciar ABMR de otras alteraciones |
| DSA preformado al trasplante (histórico o actual)+estabilidad de función renal | Descartar ABMR subclínico |
| DSA de novo + estabilidad de función renal | Descartar ABMR subclínico |
| ABMR tratado | Monitorización postratamiento para valorar respuesta |
| TCMR/borderline | Posible valor pronóstico |
ABMR: rechazo mediado por anticuerpos; ddcfDNA: ADN libre derivado del donante; DSA: anticuerpos específicos contra el donante; TCMR: rechazo mediado por células T.
Finalmente, la implementación de la prueba en el propio hospital ofrece flexibilidad en la obtención de resultados, adaptándose a las necesidades clínicas específicas al permitir procesar un número variable de muestras en cada análisis. Además, el contacto directo entre el nefrólogo y el especialista de laboratorio facilita la discusión y resolución de dudas en pacientes complejos, lo que favorece una comprensión más profunda del uso del biomarcador. Esto, a su vez, contribuye a evitar biopsias innecesarias, lo cual no solo reduce los costes, sino que también optimiza la eficiencia en el manejo clínico.
En conclusión, este estudio evidencia el valor del ddcfDNA en la detección de rechazo agudo en trasplante renal. La diferencia significativa en sus niveles en ABMR destaca su potencial como herramienta diagnóstica y su ventaja sobre otros marcadores de función renal. La implementación hospitalaria de la prueba facilita su integración clínica, promoviendo un diagnóstico oportuno y preciso del rechazo para optimizar la gestión y el pronóstico de los pacientes trasplantados.
FinanciaciónEl presente trabajo no ha recibido ningún tipo de financiación. Elena Cuadrado ha recibido una beca de investigación «Emili Letang - Josep Font» por parte del Hospital Clínic de Barcelona.
Conflicto de interesesDC y FD han recibido honorarios por parte de CareDx en calidad de relatores a simposios nacionales e internacionales.