La hiperoxaluria secundaria es un trastorno metabólico caracterizado por un aumento en la excreción urinaria de oxalato. La etiología puede deberse a un aumento de la ingesta de oxalato o sus precursores, una disminución en la eliminación a nivel digestivo o un aumento en la excreción renal. Recientemente, se ha descubierto el papel del transportador solute carrier family 26 member 6 (SLG26A6) la etiopatogenia de esta enfermedad, presente tanto a nivel intestinal como renal, su mecanismo de acción se ve alterado en situaciones de inflamación sistémica y síndrome metabólico, lo que podría explicar el aumento creciente de los casos de hiperoxaluria secundaria en las últimas décadas. El tratamiento incluye medidas higiénico dietéticas, así como fármacos orientados a disminuir su absorción a nivel intestinal aumentando la excreción fecal. Diferentes fármacos inmunomoduladores, modificadores del microbioma y los inhibidores del cotransportador de sodio-glucosa-2 (iSGLT2) podrían constituir nuevas dianas terapéuticas. En el momento actual no disponemos de tratamientos específicos para la hiperoxaluria secundaria, por lo que el diagnóstico precoz y las medidas orientadas a prevenir el avance de la insuficiencia renal son actualmente las principales herramientas terapéuticas.
Secondary hyperoxaluria is a metabolic disorder characterized by an increase in urinary oxalate excretion. The etiology may be due to an increase in the intake of oxalate or its precursors, a decrease in elimination at the digestive level, or an increase in renal excretion. Recently, the role of the SLC26A6 transporter in the etiopathogenesis of this disease has been discovered. It is present at both the intestinal and renal levels. Its mechanism of action is altered in situations of systemic inflammation and metabolic syndrome, which could explain the growing increase in cases of secondary hyperoxaluria in recent decades. Treatment includes hygienic dietary measures, as well as drugs aimed at reducing its absorption at the intestinal level by increasing fecal excretion. Different immunomodulatory drugs, microbiome modifiers and SGLT2 inhibitors could constitute new therapeutic targets. At present, we do not have specific treatments for secondary hyperoxaluria, so early diagnosis and measures aimed at preventing the progression of kidney failure are currently the main therapeutic tools.
Presentamos el caso clínico de un varón de 69 años que ingresa por un fracaso renal agudo Acute Kidney Injury Network (AKIN 3) en el contexto de un cuadro diarreico.
El paciente presenta antecedentes personales de hipertensión y diabetes mellitus tipo 2 de más de 20 años de evolución con afectación micro-macro vascular, con buen control metabólico en tratamiento con insulina; enfermedad renal diabética estadio 3bA1 (creatinina basal de 1,5mg/dL y filtrado glomerular estimado de 35mL/min/1,73m2) y obesidad tratada mediante cirugía bariátrica en 2013. Además, en las semanas previas al ingreso es diagnosticado de un mieloma múltiple de inmunoglobulina G (IgG) kappa, en tratamiento con daratumumab, bortezomib, melfalán y prednisona.
En el momento del ingreso, el paciente había recibido su segundo ciclo de quimioterapia, consiguiendo una remisión hematológica parcial. Tras la administración de dicho ciclo, presenta un cuadro diarreico profuso, objetivándose una lesión renal aguda con creatinina pico de 6mg/dL y urea de 200mg/dL, inicialmente atribuida a etiología funcional. Puesto que el melfalán podría ser responsable tanto del cuadro diarreico como de causar daño renal directo, se decide suspender este fármaco. Tras la resolución del cuadro, el paciente es dado de alta con una creatinina de 1,9mg/dL.
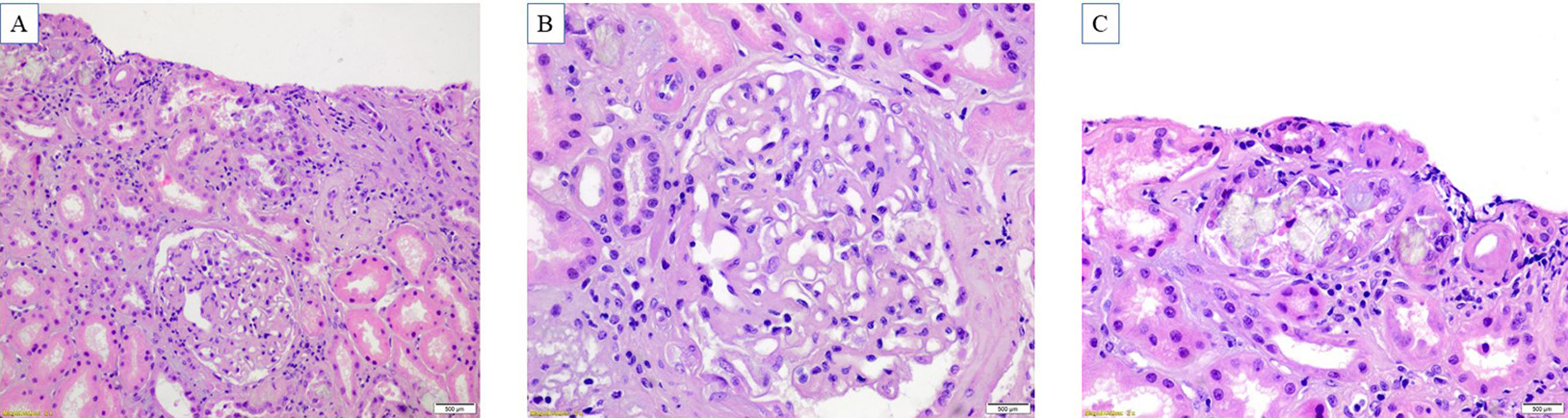
Seis meses después, presenta un nuevo episodio de lesión renal aguda de etiología desconocida (creatinina pico de 5,1mg/dL), sin mejoría a pesar del ajuste de volemia y llegando a precisar terapia sustitutiva renal. Descartada la progresión o afectación renal de la patología hematológica, se decide realizar una biopsia renal que muestra aumento de la matriz mesangial glomerular, que sugiere nefropatía diabética incipiente, así como la presencia de estructuras cristalinas transparentes localizadas en la luz de los túbulos proximales, birrefringentes, que no mostraban depósitos en el estudio de inmunofluorescencia, compatibles con afectación por cristales de oxalato (fig. 1).
Hallazgos histopatológicos. A) La evaluación histológica se realiza en un cilindro renal con un promedio de seis glomérulos, de los cuales dos presentan esclerosis global y dos tienen fibrosis pericapsular. El intersticio presentó moderada fibrosis (40%) acompañado de atrofia tubular (20%). B) Glomérulo con incremento difuso de la matriz mesangial y engrosamiento de pared capilar, sin hipercelularidad mesangial. Arterioloesclerosis hialina. C) Cristales de contornos irregulares y translúcidos, ubicados en la luz tubular y dentro del citoplasma de las células epiteliales tubulares. El epitelio tubular mostró signos de daño tubular agudo con cambios regenerativos. En el intersticio se identificó infiltrado inflamatorio crónico. Los cristales eran marcadamente birrefringentes con la luz polarizada.
Dada la irreversibilidad de las lesiones, el paciente se encuentra actualmente en programa de hemodiálisis crónica.
IntroducciónLa hiperoxaluria es un trastorno metabólico con incidencia creciente en el que se produce un aumento de la excreción de oxalato urinario. El exceso de este puede ser debido a defectos enzimáticos hereditarios que conducen a una sobreproducción hepática de oxalato (hiperoxaluria primarias) o a un aumento de la absorción intestinal de oxalato (hiperoxaluria secundaria). El oxalato se elimina sin metabolizar por vía renal, por lo que, en la hiperoxaluria, el riñón es el primer órgano afectado dando lugar a la aparición de nefrocalcinosis, litiasis e insuficiencia renal. Puede además depositarse en todos los órganos y tejidos a excepción del hígado, lo que recibe el nombre de oxalosis1–7.
El objetivo de la presente revisión es analizar, en profundidad y guiados por un caso clínico, la situación actual de la hiperoxaluria secundaria como forma más habitual de hiperoxaluria.
FisiopatologíaEl ácido oxálico (C2O4H2) (peso molecular 90 Da) es un anión sin función aparente en el organismo humano que, en el mundo vegetal, realiza la función de soporte al formar parte del exoesqueleto8. Su principal fuente es endógena, derivado del metabolismo del ácido ascórbico y el ácido glioxílico o glioxilato, aunque una pequeña parte procede directamente de la dieta9.
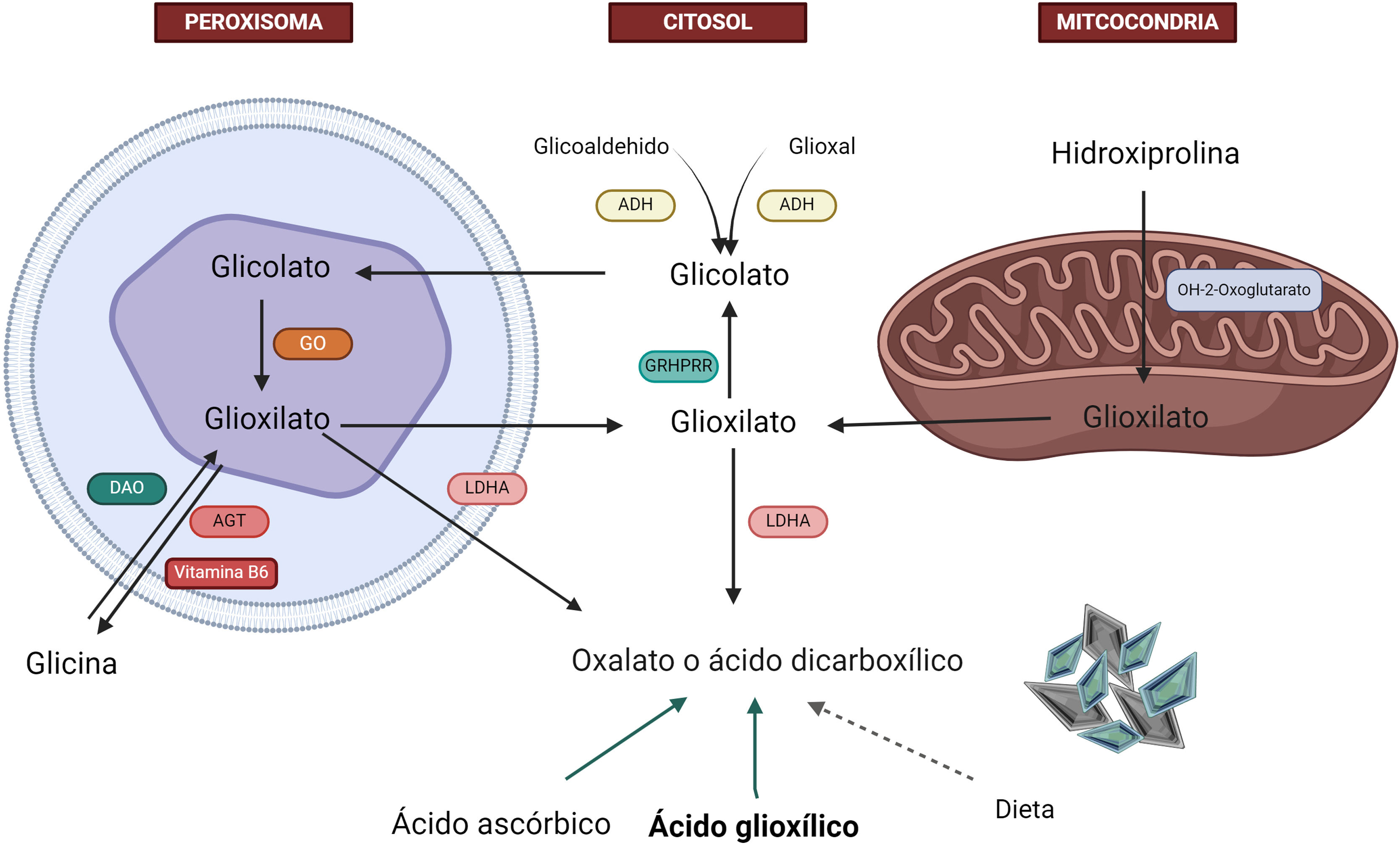
El glioxilato es una molécula generada en el metabolismo intermedio de la glicina, hidroxiprolina y glicolato, cuya detoxificación se realiza principalmente por la alanina-glioxilato aminotransferasa (AGT) en el peroxisoma del hepatocito humano, convirtiendo el glioxilato en glicina. En esta reacción, la vitamina B6 actúa como cofactor. En sujetos sanos, solo parte del glioxilato es transformado en oxalato por la lactato deshidrogenasa (LDHA), siendo el resto metabolizado por la glioxilato reductasa-hidroxipiruvato reductasa (GRHPR) en glicolato1,8,10,11 (fig. 2).
Metabolismo hepático del oxalato. La glicina es metabolizada por la enzima alanina-glioxilato aminotransferasa (AGT) en glioxilato en el hepatocito humano. En sujetos sanos, la mayor parte del glioxilato es metabolizada en el citosol en glicolato a través de la enzima glioxilato reductasa-hidroxipiruvato reductasa (GRHPR); solo una pequeña parte es metabolizada por la lactato deshidrogenasa (LDHA) en oxalato.
ADH: alcohol deshidrogenasa; AGT: alanina-glioxilato aminotransferasa; DAO: D-aminoácido oxidasa; GO: glicolato oxidasa; GRHPR: glioxilato reductasa-hidroxipiruvato reductasa; LDHA: lactato deshidrogenasa.
Creado por Biorender.com.
El ácido ascórbico o vitamina C es un precursor del oxalato que se metaboliza parcialmente en el hígado a ácido dehidroascórbico en un proceso reversible. Cuando se ingiere en cantidades excesivas, sin embargo, el ácido ascórbico se excreta ampliamente y de forma inalterada en la orina. Otra posible fuente exógena es el etilenglicol, presente principalmente en los anticongelantes de los motores, que es metabolizado a ácido glicólico, pudiendo desarrollar crisis hiperoxalúricas graves1.
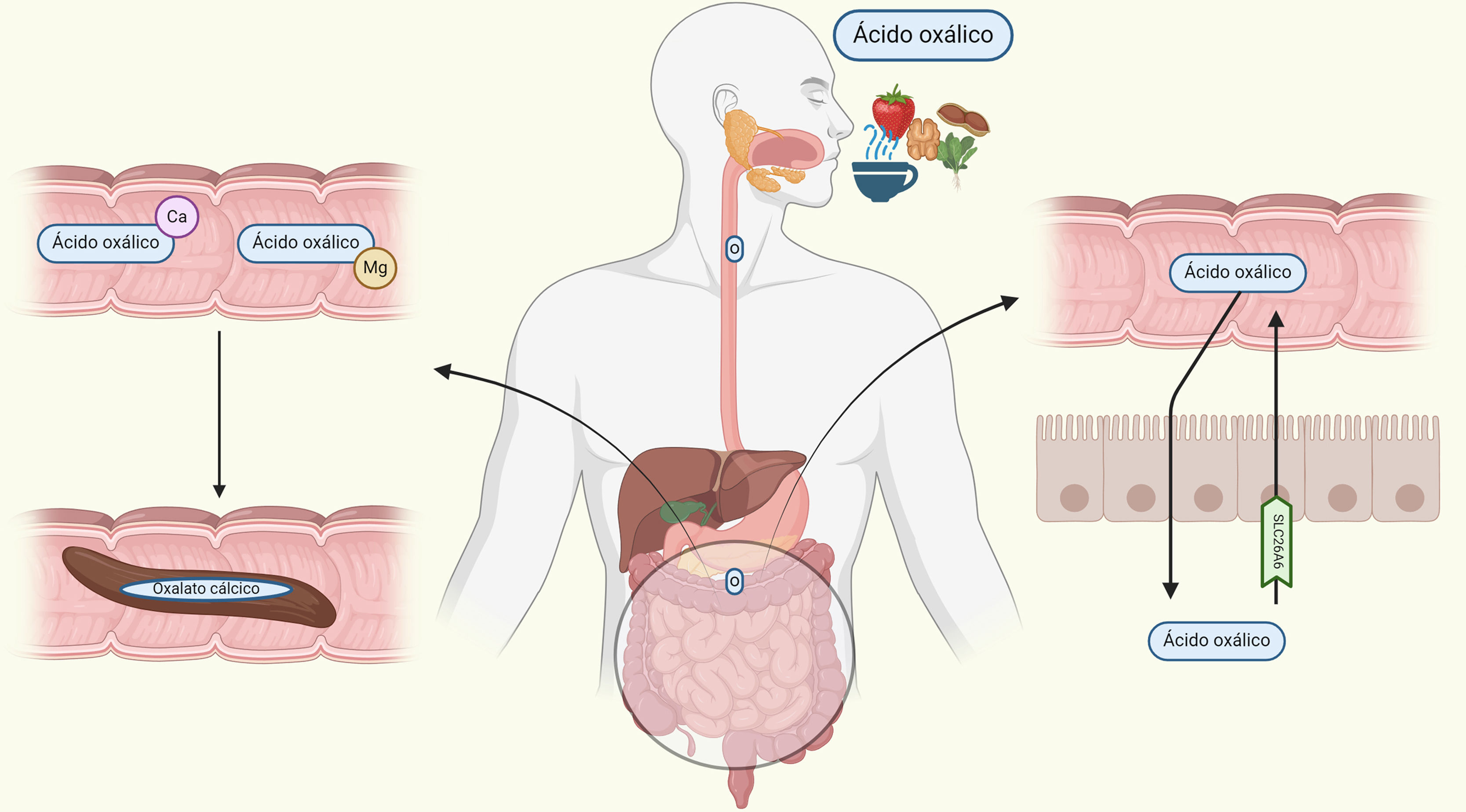
Si bien es conocido que la principal fuente de oxalato del organismo proviene del metabolismo endógeno, existe un porcentaje procedente de la dieta; este es absorbido a lo largo de prácticamente todo el tubo digestivo12. El oxalato es una base conjugada ionizada, por lo que a nivel intestinal tiende a la formación de complejos con cationes divalentes como magnesio y calcio13. Sin embargo, el oxalato libre es absorbido desde la luz, principalmente a través de difusión pasiva paracelular, y se secreta a través del transportador de aniones intestinal SLC26A6 según gradiente de concentración, siendo un receptor saturable. Por tanto, en condiciones de un bajo aporte de calcio en la dieta, el ácido oxálico sería soluble en la parte líquida del quimo intestinal y, en situaciones de alteración o saturación del canal SLC26A6, se absorbería de manera masiva al torrente sanguíneo con una consecuente menor pérdida por tubo digestivo14–16 (fig. 3).
Absorción intestinal de oxalato. El oxalato se conjuga con el calcio y el magnesio para ser eliminado por vía fecal. En condiciones de aumento del aporte de oxalato o baja concentración de estos cationes, el oxalato libre es absorbido por vía paracelular y nuevamente secretado a través del transportador solute carrier family 26 member 6 (SLG26A6). Este transportador es saturable.
Ca: calcio; Mg: magnesio; O: ácido oxálico.
Creado por Biorender.com.
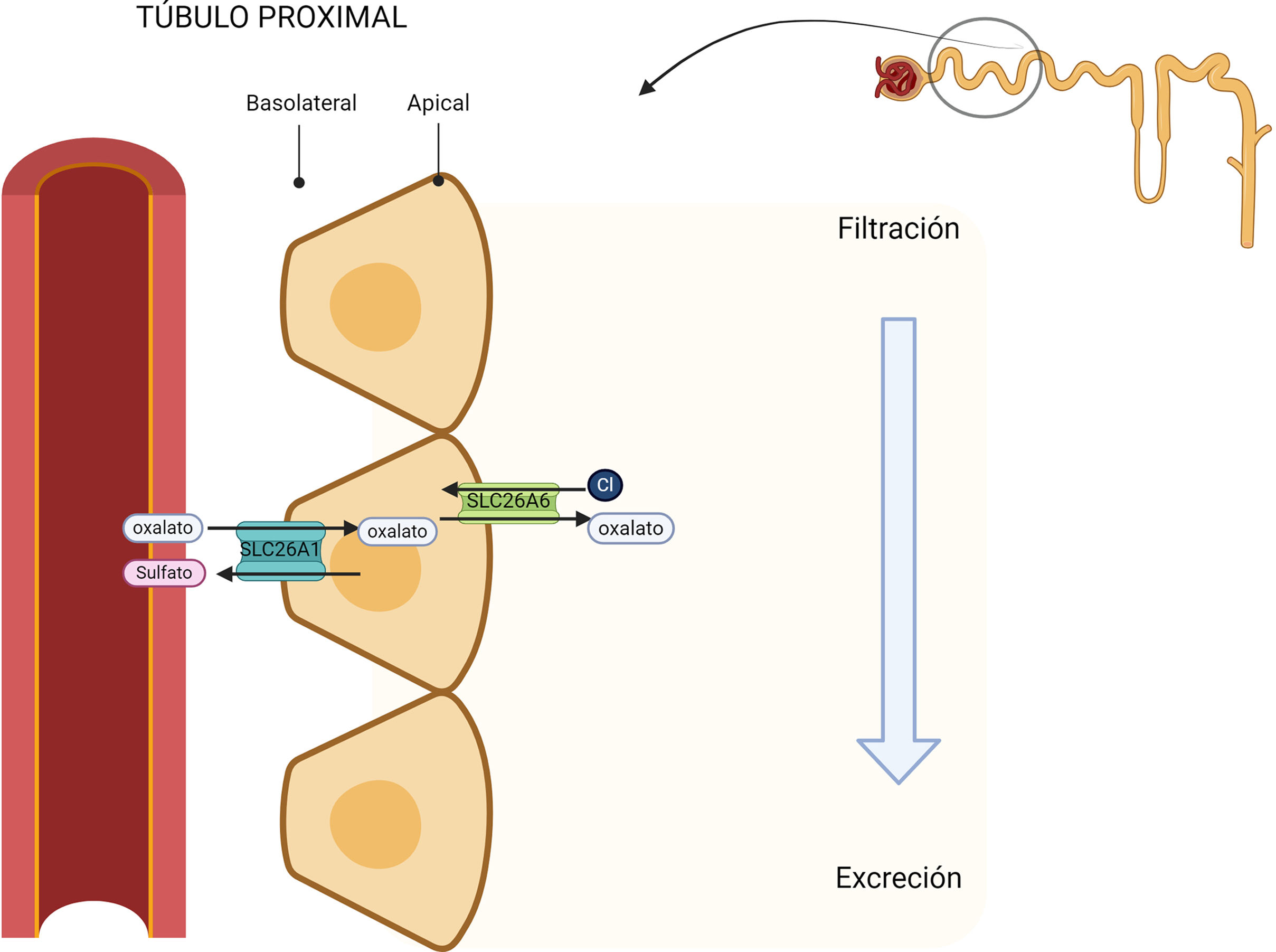
Tras su paso por el torrente hepático se produce la filtración glomerular, que depende asimismo de su concentración plasmática15,17. El transporte tubular proximal S1 y S2 está mediado por el canal SLC26 (SLC26A1), proteína que se encuentra en la membrana basolateral de la célula, que capta el oxalato intercambiándolo por sulfato18,19. En el lado apical de la célula se encuentra el intercambiador SLC26A6 de cloruro-oxalato, que reabsorbe cloruro y secreta oxalato (fig. 4). Los niveles plasmáticos elevados del oxalato requerirán una mayor excreción renal, lo que conlleva un aumento en el riesgo de precipitación con el calcio en forma de cristales de oxalato cálcico y, consecuentemente, de litiasis renal1.
Reabsorción en el túbulo proximal. En la membrana basolateral el transportador SLC26A1 capta el oxalato intercambiándolo por sulfato. Este es excretado a la luz tubular a través del intercambiador SLC26A6 de cloruro-oxalato situado en la cara apical celular.
SLC26A6: solute carrier family 26 member 6; Cl: cloro.
Creado por Biorender.com.
El oxalato forma un complejo soluble con el sodio y el potasio, pero en presencia de calcio forma cristales insolubles de oxalato de calcio, con mayor predisposición con pH urinarios relativamente bajos (< 7,2). El magnesio y el citrato, dada su capacidad de unirse al calcio urinario, constituyen los principales inhibidores de la cristalización20.
Independientemente de su papel como transportador de oxalato, SLC26A6 podría ser un modificador importante del riesgo de formación de cálculos debido a su capacidad para interactuar e inhibir la proteína cotransportadora sodio/dicarboxilato 1 (NaDC1) (también conocido como SLC13A2). Paradójicamente, se ha observado que la ausencia de SLC26A6 en ratones knockout provoca un mayor riesgo de nefrolitiasis cálcica, dado que conduce a una mayor actividad de NADC1 y, por tanto, mayor reabsorción de citrato filtrado y reducción de la excreción de citrato urinario21.
EtiologíaLa hiperoxaluria secundaria es una causa mucho más frecuente de aumento de oxalato que la primaria, y se produce por un aumento de aporte exógeno de oxalato o por un déficit en su metabolismo o eliminación. Atendiendo a las bases fisiopatológicas, la hiperoxaluria obedece a tres etiologías predominantes22. En primer lugar, el aumento de ingesta de alimentos ricos en oxalato (espinacas, col, remolacha, nueces o té), de vitamina C (> 1.000mg/día) o dietas bajas en calcio23. En segundo lugar, las alteraciones en la eliminación a nivel digestivo (insuficiencia pancreática o pancreatitis crónica, la enfermedad celiaca, la enfermedad inflamatoria intestinal o la cirugía bariátrica)24,25. Dentro de este subgrupo, la microbiota intestinal podría tener un papel en la degradación de oxalato o incluso en la regulación del pH intestinal que regula la permeabilidad intestinal26,27. Asimismo, ciertos alimentos, como el octreótido o el orlistat podrían interferir en la absorción de oxalato a nivel intestinal28. En tercer lugar, el exceso de excreción urinaria, siendo la enfermedad renal crónica la causa principal, que agrava esta situación por su característico ambiente proinflamatorio29.
Presentación clínica y diagnósticoEl primer paso en la aproximación diagnóstica a esta entidad es la determinación urinaria de oxalato, considerándose patológica una oxaluria superior a 45mg/día (> 0,5 mmol/1,73 m2/día), en, al menos, dos muestras de orina de 24 horas30. La hiperoxaluria entérica suele presentarse de forma particularmente grave, habitualmente con niveles de 2-3 superiores al máximo de excreción de oxalato diario, con un calcio urinario inferior a 100mg/día e incluso hipocitraturia31.
Podemos encontrar dos tipos de cristales de oxalato cálcico en orina: monohidratado y dihidratado, descritos como en forma de mancuerna y pirámide, respectivamente, siendo los primeros típicos de las hiperoxalurias primarias32, y ambos en las formas secundarias.
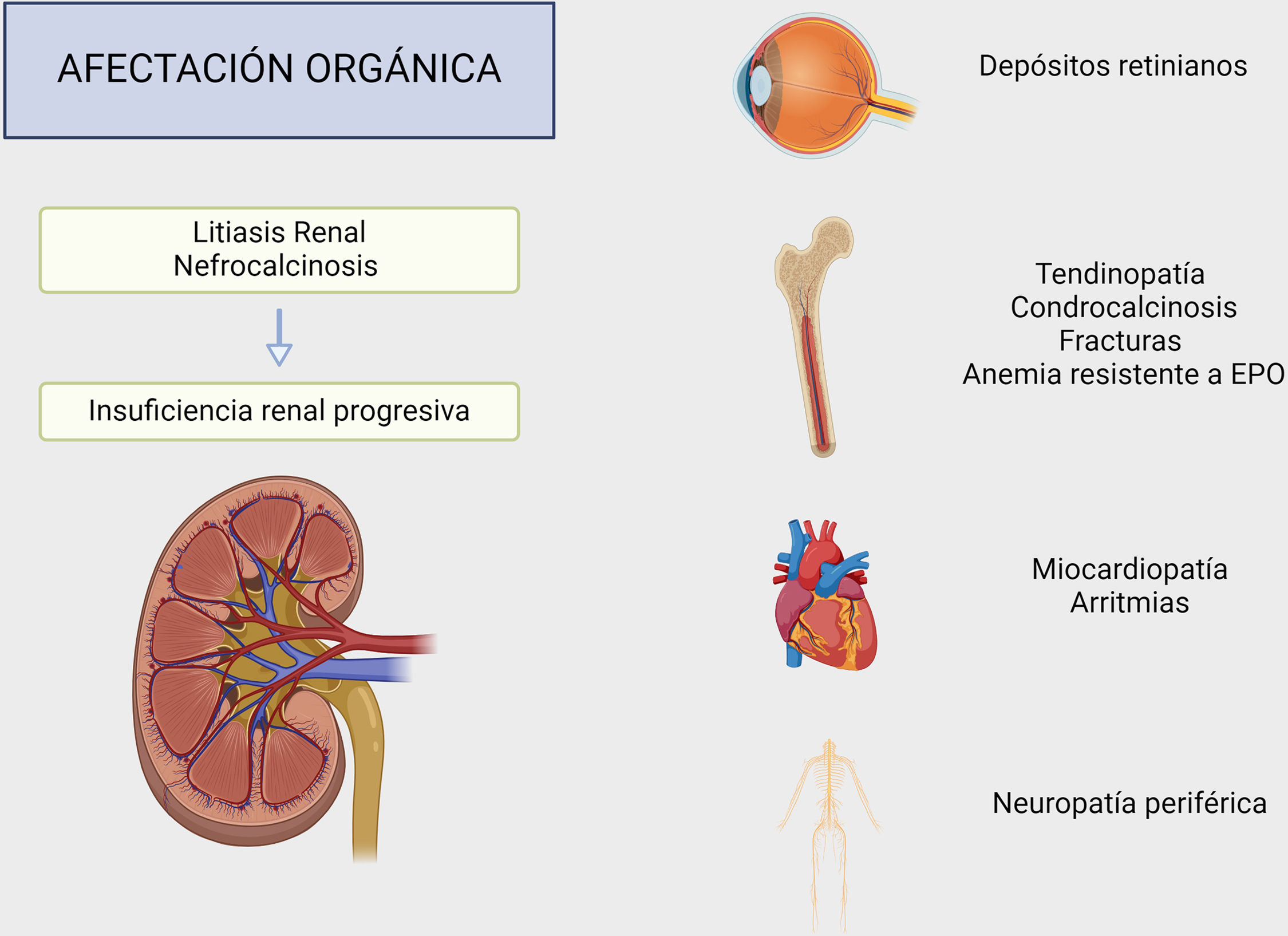
A nivel clínico, el principal órgano afectado es el riñón, siendo las manifestaciones más habituales la nefrolitiasis por oxalato cálcico y la nefrocalcinosis19. Ambas entidades conducen a inflamación del parénquima y daño intersticial crónico, lo que puede derivar en insuficiencia renal progresiva y en enfermedad renal terminal hasta en el 50% de los casos y que se correlaciona con los niveles de oxalato en orina9,33.
El aumento de oxalato en sangre genera cristalización de los tejidos conduciendo a la oxalosis, forma sistémica de la hiperoxaluria9,33. Los depósitos de oxalato pueden aparecer en los diferentes órganos a excepción del hígado. Uno de los primeros signos evidentes de oxalosis sistémica son los depósitos retinianos34. La afectación ósea es la más incapacitante, ya que la osteopatía por oxalatos produce dolor, fracturas espontáneas, y generalmente se asocia con tendinopatía y condrocalcinosis. La desmineralización difusa y el depósito de tofos intraóseos y granulomas reemplazan la médula ósea, pudiendo desencadenar una anemia resistente a agentes estimuladores de la eritropoyetina. A nivel cardiaco los cristales de oxalato generan miocardiopatía con alteraciones en la conducción cardiaca; a nivel del sistema nervioso periférico provocan neuropatía y a nivel vascular lesionan la capa media de las arterias ocasionando lesiones isquémicas como úlceras o incluso gangrenas (fig. 5)31.
HistologíaLos cristales de oxalato de calcio son translúcidos o ligeramente basófilos con la tinción de hematoxilina-eosina y tienen forma irregular. Se ubican principalmente en la luz tubular y/o dentro de las células epiteliales tubulares proximales o distales de la corteza renal, y con menos frecuencia a nivel intersticial. Tienen gran birrefringencia con la luz polarizada y con otras tinciones complementarias conservan la translucidez35,36.
El diagnóstico diferencial debe realizarse con los cristales 2,8-dihidroxiadenina, producidos por el déficit congénito de adenina fosforribosiltransferasa, en los que se observa depósito de cristales de coloración marronácea-verdosa con birrefringencia positiva; y los cristales de ácido úrico, en los que con la tinción de hematoxilina-eosina solo se identifican los espacios vacíos donde estuvieron los cristales previamente, encontrándose generalmente a nivel medular34,35.
En la histopatología renal de la hiperoxaluria se puede apreciar además fibrosis, daño tubular inflamatorio e, incluso, glomérulos atubulares.
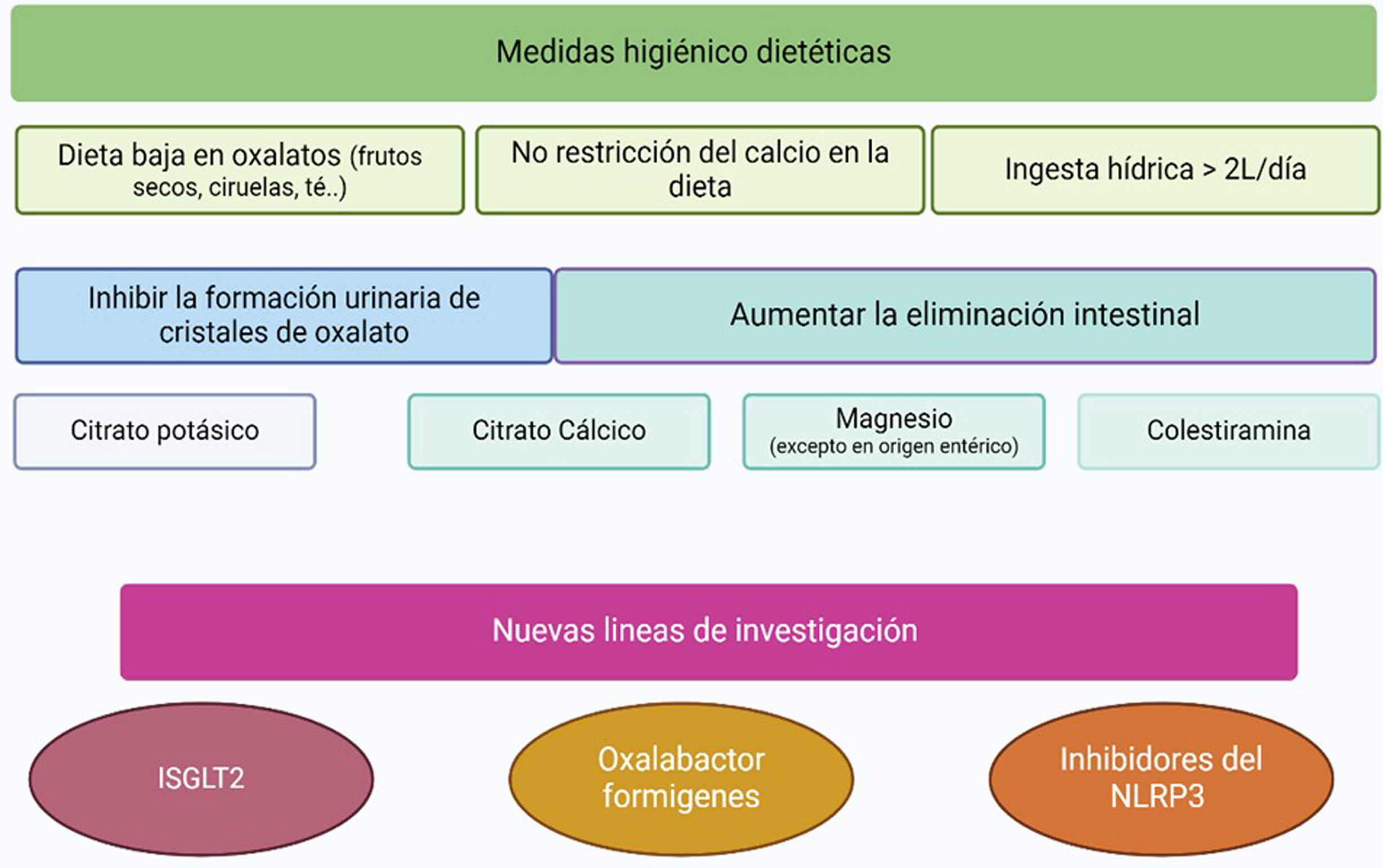
Prevención y tratamientoEl enfoque terapéutico de la hiperoxaluria secundaria se clasifica en tres grupos: disminuir el aporte de oxalato y sus precursores, aumentar la eliminación renal evitando la precipitación de cristales de oxalato a nivel tubular, y medidas dirigidas a disminuir la absorción de oxalato y aumentar su eliminación intestinal (fig. 6).
En cuanto a las recomendaciones dietéticas, los frutos secos, ciruelas, chocolate, te, coca cola, remolacha y las fresas son algunos de los alimentos que poseen un alto contenido en oxalato, por lo que una reducción en su consumo podría ser beneficioso para disminuir la absorción intestinal. Sin embargo, algunos estudios apuntan a la limitación en la eficacia de esta medida, ya que la mayor fuente de oxalato proviene de la fuente endógena. La vitamina C es un potencial precursor del oxalato, por lo que igualmente se recomienda evitar la ingesta excesiva, especialmente en pacientes en diálisis. Una dieta baja en calcio aumentaría la absorción de oxalato, por lo que se desaconseja1,12,37.
El aumento del aporte de líquidos y el empleo de inhibidores urinarios de la cristalización ayudan a disminuir la saturación urinaria de oxalato38,39. La hiperoxaluria de origen entérico se asocia con frecuencia a episodios de diarrea, por lo que asegurar una adecuada volemia cobra especial importancia19.
Un pH urinario inferior a 7,2 favorece la agregación y cristalización de calcio y oxalato, por lo que se aconseja estabilizarlo entre 6,2-6,8. El citrato potásico aumenta la pérdida de bicarbonato y, por tanto, la alcalinización de la orina, siendo además uno de los principales inhibidores en la formación de oxalato cálcico, por lo que se recomienda su prescripción hasta alcanzar unos niveles de citraturia entre 250 y 300mg/L o 500-600mg/día40. En pacientes con insuficiencia renal, el citrato potásico puede ser sustituido por citrato sódico.
Los suplementos de citrato de calcio son útiles dada su doble función41: el aporte de calcio proporciona un aumento de sustrato para la unión de oxalato a nivel intestinal, y consigue una corrección de la hipocitraturia42. Los quelantes de fósforo de base cálcica están desaconsejados en pacientes con enfermedad renal crónica en estadios 3a-5 debido al mayor riesgo de mortalidad cardiovascular43. Se han investigado otros quelantes de fosfato no cálcicos, como el hidrocloruro de sevelámero, consiguiendo una reducción no significativa del oxalato urinario en un estudio abierto44, o el carbonato de lantano, ensayo que actualmente se encuentra en fase III con resultados alentadores45.
Los suplementos de magnesio consiguen reducir la absorción de oxalato dada su capacidad de unirse a este a nivel intestinal. Su principal efecto secundario es la diarrea, por lo que su uso se ve muy limitado en pacientes con hiperoxaluria entérica46. El hierro se puede utilizar como agente aglutinante de oxalato alternativo o complementario, aunque con una efectividad inferior a la del calcio. El aluminio también consigue un efecto quelante de oxalato, pero el riesgo de toxicidad limita su uso. Debe prestarse especial atención al empleo de análogos de la vitamina D, ya que aumentan la absorción intestinal de calcio, disminuyendo el tiempo que está disponible para unirse al oxalato a nivel intestinal1.
La colestiramina es una resina de intercambio aniónico intestinal que se une a los ácidos biliares de colesterol y evita su absorción47, aumentando la disponibilidad de calcio combinable con oxalato. Además, se une al oxalato intestinal y ayuda a reducir la diarrea48, lo que la convierte en un fármaco particularmente útil en la hiperoxaluria entérica40. Como efectos secundarios puede ocasionar acidosis hiperclorémica, ya que libera cloruro, e interfiere en la absorción de otros medicamentos, principalmente vitaminas y diuréticos tiazídicos.
En esta línea, un estudio de química cuántica de 2021 sugirió que los cationestrivalentes, como el hierro, el aluminio o el lantano, así como el elemento neodimio, podrían ser candidatos interesantes para la unión a oxalato49.
El efecto del microbioma sobre la homeostasis del oxalato se ha evaluado ampliamente en modelos animales y en algunos estudios en humanos. Recientemente, se han desarrollado varias formulaciones terapéuticas que profundizan en la capacidad de determinadas bacterias para degradar el oxalato. La más relevante es el Oxalobacter formigenes, que demostró una reducción del oxalato urinario en modelos de hiperoxaluria en roedores44, induciendo un aumento en la secreción de oxalato a nivel intestinal por un mecanismo, por el momento, desconocido44.
Varios investigadores han propuesto la suplementación directa con oxalato descarboxilasa, enzima utilizada por O. formigenes para degradar el oxalato. Un ensayo cruzado, controlado, aleatorio y doble ciego en individuos sanos mostró una reducción del 24% del oxalato urinario en comparación con el placebo50.
Se han investigado las transferencias microbianas completas como posibles enfoques para modular el metabolismo del oxalato. En ratas, un trasplante fecal de un mamífero herbívoro (microbioma adaptado para degradar grandes cantidades de oxalato) condujo a niveles más bajos de oxalato en orina y heces prolongado durante al menos nueve meses en comparación con la ingestión de aislados que degradan el oxalato51,52. De manera similar, un trasplante fecal de ratas convencionales, que tienen un microbioma intestinal similar al de los humanos, a ratones libres de gérmenes redujo el oxalato urinario53. Esta transferencia provocó una reducción en la expresión de SLC26A6 en el riñón y el colon y una mayor expresión en el ciego. Hasta la fecha, ningún estudio ha evaluado el efecto de la transferencia comunitaria de microbiomas en humanos.
Otras especies como el Bifidobacterium y Lactobacillus también han demostrado una reducción del oxalato urinario en animales. Las cepas bacterianas que actualmente se están investigando en ensayos en etapa inicial incluyen Nov-001, UBLG-36 y SYNB8802. Nov-001 es un producto combinado microbiano diseñado terapéuticamente que incluye NB1000S, una bacteria que degrada el oxalato, y NB2000P, una molécula de control prebiótica utilizada para controlar la abundancia de NB1000S. Actualmente, un ensayo de fase II está reclutando pacientes con hiperoxaluria entérica después de un alentador estudio de fase I52. UBLG-36, una cepa de Lactobacillus paragasseri, es muy eficaz para degradar el oxalato in vitro. Finalmente, SYNB8802, una cepa sintética de Escherichia coli Nissle que degrada el oxalato, administrado por vía oral, muestra una reducción significativa del oxalato in vitro e in vivo; el modelo in silico predice una reducción del 71% del oxalato urinario en los pacientes con hiperoxaluria entérica. El estudio en ratones y primates han demostrado la capacidad de esta molécula de consumir el exceso de oxalato intestinal, consiguiendo una reducción significativa en los niveles de oxalato urinario en estos modelos animales54.
Se ha postulado la producción de citocinas y varias moléculas inflamatorias como agentes etiopatogénicos de la hiperoxaluria secundaria, por lo que la modulación inmunitaria se ha erigido como una de las líneas posibles de investigación. La inhibición de la activación del inflamoasoma nucleotide-binding, leucin-rich-repeat, pyrin domain containing 3 (NLRP3) podría reducir la escisión de las citocinas proinflamatorias interleucina 1 beta (IL-1β) e interleucina 18 (IL-18) a través de la caspasa 1 e inhibir la muerte celular inflamatoria55. En un estudio de ratas hiperoxalúricas, la inhibición del canal vanilloide 1 potencial del receptor transitorio, mitigó la activación de NLRP3 inducida por especies reactivas de oxígeno y la nefropatía inducida por oxalato de calcio, aunque no redujo la hiperoxaluria56. Otros inhibidores de NLRP3 con resultados murinos prometedores in vivo incluyen el CP-456773 basado en diarilsulfonilurea, que reduce la fibrosis renal inducida por cristales57.
Los inhibidores del cotransportador de sodio-glucosa-2 (iSGLT2) son una revolucionaria familia terapéutica de antidiabéticos que han demostrado efectos más allá del control metabólico, reduciendo el riesgo de eventos cardiovasculares y renales47,49,58-60. En el campo de la hiperoxaluria, son capaces de disminuir la producción de osteopontina, una glicoproteína secretada en las células tubulares, que es considerada una de las proteínas del núcleo más importantes en la matriz de los cálculos de oxalato cálcico61. Desde el punto de vista mecanístico, la administración de ácido glioxílico, un precursor del oxalato, a ratones con deficiencia del cotransportador de sodio-glucosa-2 (SGLT2) desencadenó un elevado depósito de cristales de oxalato cálcico y un aumento en la expresión de osteopontina, cluster de diferenciación 44 (CD44), factor de crecimiento transformante beta-1 (TGF beta-1), fibronectina 1 (Fn1) y actin alpha 2 (Acta2) en comparación con el grupo control de ratones salvajes tratados con el mismo precursor60. De hecho, un estudio observacional japonés recientemente publicado observó una menor prevalencia de nefrolitiasis en paciente diabéticos tratados con iSGLT2 frente a otros tratamientos62. Por tanto, la inhibición específica de SGLT2 podría atenuar la formación de cálculos de oxalato cálcico en el riñón, pudiendo convertirse en un enfoque terapéutico prometedor en este grupo de patologías.
ConclusionesLa hiperoxaluria secundaria es una enfermedad probablemente infradiagnosticada. Está asociada a diferentes patologías en las que se genera un estado proinflamatorio que conduce a una disfunción del transportador SCLA26A, piedra angular en la fisiopatología de esta entidad. El aumento en la prevalencia de enfermedades endocrino-metabólicas se ha acompañado de un incremento correlativo de casos de hiperoxaluria, dada la implicación de estas en su etiopatogenia. En el momento actual no disponemos de un tratamiento específico, por lo que el diagnóstico precoz y la prevención son la mejor herramienta pronóstica.
- -
La hiperoxaluria secundaria es una patología con una incidencia creciente en las últimas décadas y cuyo diagnóstico queda a menudo oculto entre otras entidades concomitantes.
- -
Puede deberse a tres causas fundamentales: aumento de la ingesta de productos con alto contenido en oxalato (espinacas, nueces, té), o de sus precursores (vitamina C); aumento en la absorción intestinal generalmente producido por una disminución en la absorción de ácidos grasos a nivel intestinal (insuficiencia pancreática o pancreatitis crónica, la enfermedad celiaca, la enfermedad inflamatoria intestinal o la cirugía bariátrica); o a un aumento en la excreción renal de oxalato.
- -
El creciente aumento de los casos se produce de forma paralela al grupo de entidades que englobamos dentro del síndrome metabólico, dado que la inflamación crónica produce una alteración en el transportador SLC26A6, presente tanto a nivel intestinal como renal, y clave en la etiopatogenia de esta enfermedad.
- -
El principal órgano afectado en la hiperoxaluria secundaria es el riñón, pudiendo producir desde nefrocalcinosis o litiasis renal hasta insuficiencia renal terminal. Sin embargo, se pueden observar depósitos de oxalato cálcico en otros órganos, como la retina, el corazón y el sistema nervioso periférico, siendo característica la ausencia de depósitos a nivel hepático.
- -
El tratamiento y la prevención van enfocados a disminuir el aporte de oxalato y sus precursores, a fomentar la eliminación renal evitando la precipitación de cristales de oxalato a nivel tubular, y a instaurar medidas dirigidas para disminuir la absorción de oxalato y aumentar su eliminación intestinal.
Borja Quiroga es vocal de la S.E.N. y ha recibido pagos por ponencias y financiación para asistir a cursos y congresos por parte de Vifor-Pharma, Astellas, Amgen, Bial, Ferrer, Novartis, AstraZeneca, Sandoz, Laboratorios Bial, Esteve, Sanofi-Genzyme y Otsuka en los ultimos 36 meses. El resto de los autores no tienen conflictos de interés.