La vía de suplementación óptima (intravenosa vs. oral) de hierro en pacientes con enfermedad renal crónica (ERC) no en diálisis es controvertida. Recientemente se ha desarrollado una preparación oral (hierro liposomal, FeSu) con elevada biodisponibilidad y baja incidencia de efectos secundarios. El objetivo fue evaluar la eficacia del FeSu en pacientes con ERC estadio 3 y limitación digestiva a la ferroterapia oral convencional.
Material y métodosEstudio observacional prospectivo con pacientes con ERC estadio 3 estable e intolerancia digestiva a la ferroterapia oral convencional. Se administró una dosis de FeSu de 30mg/día oral durante 12 meses. El objetivo primario fue el aumento de la hemoglobina a los 6 y 12 meses. También se evaluó la adherencia terapéutica y efectos adversos.
ResultadosSe incluyeron 37 pacientes de 72,6±14,7 años y un filtrado glomerular estimado de 42±10mL/min/1,73m2. Treinta y dos pacientes habían recibido tratamiento previo con formulaciones orales convencionales, manifestando el 73% intolerancia digestiva con una adherencia del 9,4%. Tras 6 meses con FeSu se objetivó un incremento de las cifras de hemoglobina respecto a la basal, manteniéndose a los 12 meses (0,49±0,19 y 0,36±0,19g/dL, respectivamente, p<0,05), y pese a un descenso significativo del filtrado glomerular estimado de 3,16±1,16 y 4,20±1,28mL/min/1,72 m2 a los 6 y 12 meses, respectivamente. Ningún paciente presentó reacciones adversas que obligaran a suspender el tratamiento. La adherencia fue del 100% en ambos momentos analizados.
ConclusionesEl FeSu es eficaz en una cohorte de pacientes con ERC estadio 3 de características extrapolables a la población general de pacientes con ERC moderada, con una baja tasa de reacciones adversas y excelente tolerabilidad.
The optimal iron supplementation route of administration (intravenous vs oral) in patients with chronic kidney disease (CKD) not on dialysis is a hot topic of debate. An oral preparation (liposomal iron, FeSu) has recently been developed with high bioavailability and low incidence of side effects. The objective was to evaluate the efficacy of FeSu in patients with stage 3 CKD and gastrointestinal intolerance to conventional oral iron therapy.
Material and methodsProspective observational study of patients with stable stage 3 CKD and gastrointestinal intolerance to conventional oral iron therapy. An oral 30mg/day dose of FeSu was administered for 12 months. The primary outcome measure was haemoglobin increase at 6 and 12 months. Treatment adherence and adverse effects were also evaluated.
Results37 patients aged 72.6±14.7 years and with an estimated glomerular filtration rate (eGFR) of 42±10ml/min/1.73m2 were included. 32 patients had received previous treatment with conventional oral formulations, 73% of which exhibited gastrointestinal intolerance with treatment adherence of 9.4%. After 6 months with FeSu, an increase in haemoglobin was observed versus baseline, which was sustained at 12 months (0.49±0.19 and 0.36±0.19g/dl, respectively, P<.05), despite a significant eGFR decrease of 3.16±1.16 and 4.20±1.28ml/min/1.73 m2 at 6 and 12 months, respectively. None of the patients experienced adverse reactions that required the treatment to be suspended. Adherence was 100% at both 6 and 12 months.
ConclusionsFeSu is effective in a cohort of patients with stage 3 CKD with similar characteristics to the general population of moderate CKD patients, with a low rate of adverse reactions and excellent tolerability.
La enfermedad renal crónica (ERC) constituye una de las patologías de primer orden a nivel mundial y se asocia a una elevada morbimortalidad, fundamentalmente a expensas de patología cardiovascular1. En España, la ERC afecta aproximadamente a un 10% de la población adulta2.
La ERC lleva implícitas un conjunto de complicaciones potencialmente graves, dentro de las cuales una de las más frecuentes es la anemia3. Esta complicación se ha vinculado con una mayor morbimortalidad, progresión y empeoramiento de la calidad de vida de los pacientes con ERC4.La presencia de anemia se objetiva ya en estadios precoces de ERC (estadio 3) y su prevalencia aumenta a medida que la ERC progresa a estadios más avanzados5. Así, del estudio MICENAS I se desprende que hasta un 36-60% de los pacientes con ERC atendidos en consultas externas de nefrología presentan déficit de hierro y anemia4. Esta ferropenia está, en muchos casos, infratratada4,6,7.
La anemia asociada a la ERC es multifactorial. Además del déficit relativo de eritropoyetina se suman otros factores, entre los que destaca el déficit de hierro, ya sea funcional, ya absoluto8,9. De acuerdo con esta etiología múltiple, el manejo de la anemia en el paciente con ERC se basa en corregir todos y cada uno de los factores causantes de anemia y, solo posteriormente, valorar el inicio de agentes estimuladores de la eritropoyesis10–12. En este sentido, la ferropenia constituye la causa más frecuente de resistencia al tratamiento con agentes estimuladores de la eritropoyesis13, por lo que el suplemento con hierro constituye un pilar fundamental en el manejo de la anemia en el paciente con ERC.
En la actualidad los objetivos y la estrategia más adecuados para la ferroterapia en la ERC no son homogéneos10,11. Otro de los puntos controvertidos lo constituye la vía óptima de administración del hierro. Mientras que en los pacientes con ERC en diálisis se ha demostrado un mayor beneficio de la ferroterapia intravenosa frente a la oral14, en los pacientes con ERC no en diálisis no existe una evidencia tan amplia acerca de ello. Si bien estudios recientes indican que la ferroterapia intravenosa podría ser superior en eficacia y tolerabilidad a la vía oral clásica, especialmente con las nuevas formulaciones de hierro parenteral15–18.
Una de las principales limitaciones que presenta la ferroterapia oral clásica en el paciente con ERC es la mala tolerancia gastrointestinal y, como consecuencia, el bajo cumplimiento terapéutico19. Recientemente se ha desarrollado una preparación de pirofosfato férrico recubierto por una membrana de fosfolípidos asociada con ácido ascórbico (hierro sucrosomado o liposomal) que asocia una elevada biodisponibilidad con baja incidencia de efectos secundarios y que ha demostrado ser no inferior a una estrategia de dosificación típica con gluconato de hierro intravenoso en pacientes con ERC no en diálisis14,20. Sin embargo, una limitación de este estudio fue la alta selección de los pacientes de ambos grupos comparados, lo que limita la extrapolación de los resultados a la población de pacientes con ERC14.
El objetivo del presente estudio fue evaluar el efecto del hierro sucrosomado en el manejo de la anemia por déficit de hierro en pacientes con ERC moderada (estadios 3a y 3b), limitación digestiva a la ferroterapia oral convencional y con unos criterios de selección más amplios que facilitaran la extrapolación de los resultados a la población de pacientes con ERC moderada.
Material y métodosPacientesSe reclutaron pacientes que se encontraban bajo tratamiento y seguimiento en consultas externas del Hospital Clínic de Barcelona. Los criterios de inclusión predeterminados fueron: a) la presencia de ERC moderada estable (estadios 3a y 3b, definidos según las guías KDIGO 2012) y b) la existencia de limitación o intolerancia digestiva previa a la ferroterapia oral.
El Comité Ético de Investigación Médica del Hospital Clínic de Barcelona aprobó el presente estudio observacional con la referencia HCB-2016-0520.
Diseño del estudioEl objetivo primario del presente estudio fue evaluar la eficacia del tratamiento con pirofosfato férrico sucrosomado (FeSu) en pacientes con ERC estadio 3, analizada como aumento de las cifras basales de hemoglobina (Hb) a los 6 y 12 meses de tratamiento. Además, se analizaron otros parámetros relativos al metabolismo del hierro, así como la tolerancia y la adherencia terapéutica al nuevo preparado. También se evaluó la función renal de los pacientes incluidos.
Con la finalidad de valorar la repercusión terapéutica sobre la anemia y el metabolismo del hierro, se realizó una medición analítica de la Hb, volumen corpuscular medio, hemoglobina corpuscular media y el porcentaje de hematíes hipocromos. Además, también se midieron ciertos parámetros inherentes al metabolismo férrico, como son la ferritina sérica, la transferrina y el índice de saturación de transferrina (IST). Otro aspecto evaluado durante el seguimiento fue la adherencia terapéutica y la aparición de efectos adversos, así como la satisfacción terapéutica (mediante una escala Likert). La mala adherencia terapéutica fue definida como la omisión voluntaria de al menos un comprimido de hierro oral durante 3 o más días a la semana.
El seguimiento y evolución de la función renal se realizó mediante la medición del filtrado glomerular estimado (FGe) mediante la fórmula CKD-EPI (Chronic Kidney Disease-Epidemiology Collaboration), cociente albúmina/creatinina en orina, albúmina sérica y parathormona (PTH) intacta sérica. El estado inflamatorio de los pacientes se monitorizó mediante la proteína C reactiva y la albúmina sérica.
Tras el reclutamiento se administró a los pacientes incluidos una dosis de FeSu de 30mg/día por vía oral durante un período de 12 meses. Durante este período se realizó un seguimiento y una medición de los parámetros clínicos y analíticos antes enumerados, así como de la adherencia terapéutica, en 3 momentos: al inicio del estudio (tiempo cero o T0), a los 6 meses (T1) y a los 12 meses de tratamiento (T2). Finalmente se llevó a cabo un estudio comparativo de los valores de estas variables a los 6 y 12 meses con respecto a sus valores basales previos al inicio de tratamiento.
Análisis estadísticoLas variables cualitativas se describieron utilizando frecuencias y porcentajes. Las variables cuantitativas se expresaron como media y desviación estándar. Para estudiar la evolución de las pruebas de laboratorio, se aplicó el método de la ecuación de estimación generalizada. Además, se asumió una estructura de correlación intercambiable para las observaciones intrapaciente. La matriz de varianza-covarianza de los coeficientes de regresión se estimó mediante un sólido estimador de varianza de tipo sándwich. El nivel de significación se fijó en 0,05. El análisis se realizó utilizando el programa R v.3.0.5 (R Foundation for Statistical Computing, Viena, Austria).
ResultadosDatos basalesEn la tabla 1 se recoge una síntesis de las características basales de los pacientes incluidos.
Características basales de los pacientes incluidos en el estudio
| Pacientes incluidos | (n=37) |
|---|---|
| Sexo, n (%) | |
| Hombres | 12 (32) |
| Mujeres | 25 (68) |
| Edad, media±DE, años | 72,6±14,7 |
| FGe, media±DE, mL/min/1,73 m2 | 42±10 |
| Causas de ERC, n (%) | |
| Nefroangioesclerosis | 21 (57) |
| Nefropatía diabética | 2 (5) |
| Monorreno | 5 (14) |
| Otras | 9 (24) |
| Comorbilidad, n (%) | |
| Digestiva | 17 (46) |
| Diabetes mellitus | 14 (38) |
| Insuficiencia cardíaca | 10 (27) |
| Ferroterapia oral previa, n (%) | 32 (86) |
| Un tipo | 26 (70) |
| ≥2 tipos | 6 (16) |
| Tiempo libre de tratamiento (>6 meses) | 9 (28%) |
| Intolerancia digestiva, n (%) | 27 (73) |
| Estreñimiento | 8 (22) |
| Diarrea | 8 (22) |
| Pirosis | 13 (35) |
| Malabsorción | 1 (3) |
| Adherencia terapéutica al hierro oral prescrito antes del estudio, n (%) | 3 (9,4%) |
ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado.
Se incluyeron un total de 37 pacientes (25 mujeres y 12 hombres) con una edad media de 72,6±14,7 años y con diagnóstico previo de ERC en estadio 3 (FGe medio 42±10mL/min/1,73 m2), siendo la causa más frecuente de ERC la nefroangioesclerosis (57%). Entre los sujetos incluidos en el estudio se documentó una alta tasa de comorbilidades: 17 pacientes (46%) referían comorbilidad digestiva, 14 pacientes (38%) presentaban diabetes mellitus y 10 (27%) se encontraban diagnosticados de insuficiencia cardíaca.
De los 37 pacientes incluidos, 32 pacientes (86%) habían recibido tratamiento previo con hierro oral con sales de hierro y/o ferrimanitol ovoalbúmina: 26 pacientes (70%) habían sido tratados con un solo tipo de hierro oral y 6 (16%) con 2 o más tipos. De los 32 pacientes tratados previamente con hierro oral, 9 (28%) presentaron un intervalo libre de tratamiento (antes del inicio del estudio) superior a 6 meses.
Del total de pacientes incluidos en el estudio, 27 (73%) manifestaban algún tipo de limitación o intolerancia digestiva al tratamiento con ferroterapia oral estándar, ya sea en forma de estreñimiento (8 pacientes, un 22%), diarrea (8, un 22%), pirosis (13 pacientes, un 35%) o malabsorción (un paciente, 3%). La adherencia terapéutica de los pacientes con prescripción previa de hierro oral fue del 9,4% antes del inicio del estudio.
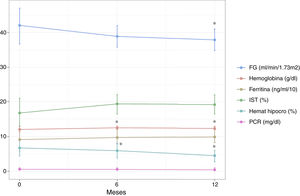
Variación de los parámetros analizados durante el seguimientoTras 6 meses de tratamiento se objetivó un incremento significativo de las cifras de Hb con respecto al valor basal, incremento que se mantuvo a los 12 meses de tratamiento (0,49±0,19 y 0,36±0,19g/dL para T1 y T2, respectivamente) (tabla 2 y fig. 1). Asociado a este aumento tuvo lugar un incremento estadísticamente significativo de la hemoglobina corpuscular media a los 6 meses que se mantuvo hasta los 12 meses (aumento de 0,72±0,26 y 0,48±0,25pg para T1 y T2, respectivamente). El porcentaje de hematíes hipocromos no se redujo de forma significativa a los 6 meses, aunque sí se apreció una disminución significativa a los 12 meses de tratamiento (reducción de 0,79±1,13% y 2,18±1,03% para T1 y T2, respectivamente). El resto de parámetros hematológicos y del metabolismo férrico analizados (ferritina, IST, transferrina, hematocrito, plaquetas y volumen corpuscular medio) no mostraron variaciones significativas respecto al valor basal en los 2 momentos analizados, si bien en el caso de la ferritina y el IST se registró un incremento no significativo a los 6 y 12 meses (tabla 2 y fig. 1).
Valor de los parámetros analizados al inicio del estudio y durante el seguimiento
| Parámetro | T0 | T1 | T2 | Variación a T1 | Variación a T2 |
|---|---|---|---|---|---|
| Hb (g/dl) | 12 (1,40) | 12,5 (1,63) | 12,4 (1,61) | 0,49 (0,19)* | 0,36(0,19)* |
| Ferritina (ng/ml) | 91 (104) | 95,5 (87,4) | 97,2 (82,5) | 5,92 (9,75) | 7,93 (9,05) |
| Ferritina, ng/ml/10 | 9,10 (10,4) | 9,5 (8,74) | 9,72 (8,25) | ||
| IST (%) | 16,8 (6,21) | 19,4 (7,87) | 19,4 (6,86) | 2,60 (1,34) | 2,48 (1,25) |
| H. hipoc. % | 6,70 (6,39) | 6,01 (5,33) | 4,23 (4) | −0,79 (1,13) | −2,18 (1,03)* |
| Transferrina (g/L) | 2,65 (0,52) | 2,63 (0,48) | 2,67 (0,44) | −0,02 (0,05) | 0,03 (0,05) |
| Hematocrito (%) | 37,5 (4,21) | 38 (5,27) | 38,5 (4,92) | 0,52 (0,52) | 0,97 (0,53) |
| Plaquetas (/L) | 239.568 (79.554) | 245.595 (76.054) | 246.081 (71.629) | 6.027,03 (7.922,51) | 6.513,51 (7.671,17) |
| VCM (fl) | 90,8 (4,77) | 91,5 (4,37) | 91,7 (4,88) | 0,74 (0,56) | 0,98 (0,70) |
| HCM (pg) | 29,1 (1,92) | 29,8 (1,60) | 29,5 (1,96) | 0,72 (0,26)* | 0,48 (0,25)* |
| FGe (ml/min/1,73m2) | 42,1 (10,4) | 38,9 (12,6) | 37,9 (12) | −3,16 (1,16)* | −4,20 (1,28)* |
| CAC (mg/g) | 202 (309) | 184 (294) | 245 (395) | −7,30 (25,36) | 43,24 (60,88) |
| PTH (pg/mL) | 115 (62,2) | 124 (64,7) | 136 (69,9) | 9,73 (7,77) | 20,68 (9,43)* |
| Albumina (g/dL) | 4,27 (0,38) | 4,14 (0,79) | 4,25 (0,33) | −0,13 (0,13) | −0,02 (0,05) |
| PCR (mg/dL) | 0,56 (0,76) | 0,54 (0,75) | 0,42 (0,49) | −0,03 (0,13) | −0,14 (0,10) |
CAC: cociente albúmina/creatinina en orina; FGe: filtrado glomerular estimado; H. hipoc.: hematíes hipocromos; Hb: hemoglobina; HCM: hemoglobina corpuscular media; IST: índice de saturación de transferrina; PCR: proteína C reactiva; PTH: parathormona; T0: inicio del estudio (basal); T1: 6 meses tras inicio del tratamiento con hierro sucrosomado; T2: 12 meses tras inicio del tratamiento con hierro sucrosomado; VCM: volumen corpuscular medio.
Los parámetros se encuentran expresados en media (DE).
Variación de los principales parámetros hematológicos y del FG a lo largo del seguimiento tras el inicio del tratamiento (6 y 12 meses). FG: filtrado glomerular estimado; Hemat hipocro: hematíes hipocromos; IST: índice de saturación de transferrina; PCR: proteína C reactiva. *p<0,05 respecto a valor basal (T0).
A lo largo del seguimiento se objetivó una disminución discreta del FGe, aunque significativa, siendo de 3,16±1,16 y 4,20±1,28mL/min/1,73m2 para T1 y T2, respectivamente. La PTH no mostró una variación significativa a los 6 meses, aunque sí se apreció un aumento significativo de sus cifras a los 12 meses de tratamiento. Otros parámetros como la albúmina, cociente albúmina/creatinina en orina y proteína C reactiva no presentaron variaciones significativas tras el período de seguimiento (tabla 2 y fig. 1).
Reacciones adversas y adherencia terapéuticaNinguno de los pacientes incluidos en tratamiento con FeSu presentó reacciones adversas ni limitación digestiva que obligaran a interrumpir el tratamiento, tanto a los 6 como a los 12 meses de su inicio.
La tasa de cumplimiento terapéutico fue del 100% en los 2 momentos analizados (6 y 12 meses tras el inicio del tratamiento). Los resultados de la escala Likert fueron de muy de acuerdo, 1, o de acuerdo, 2, con la satisfacción terapéutica en el conjunto de los pacientes.
DiscusiónEl suplemento con hierro constituye un pilar fundamental para el tratamiento de la anemia del paciente con ERC. En los pacientes con ERC en diálisis, la ferroterapia intravenosa ha demostrado claramente su eficiencia con respecto a la vía oral14. En los pacientes con ERC no en diálisis la superioridad de la vía intravenosa respecto a la vía oral es contradictoria, si bien algunos estudios han demostrado que la ferroterapia intravenosa es superior a la oral a la hora de conseguir una mayor repleción de los depósitos de hierro y también, aunque en menor medida, un mayor aumento de las cifras de Hb15–18, en esta condición es un estándar oro la preservación del árbol vascular.
La teórica menor efectividad de la vía oral respecto a la vía intravenosa se justifica por su menor biodisponibilidad y la baja adherencia terapéutica relacionada con los efectos secundarios, fundamentalmente gastrointestinales, que conlleva su administración14,19.
Con la finalidad de tratar de superar estas dificultades se ha comercializado el denominado hierro liposomal o sucrosomado, un compuesto de hierro oral de nueva generación que, por su diseño farmacológico al incorporar una envoltura fosfolipídica, exhibe una mayor biodisponibilidad que los preparados orales convencionales. Además de una tasa de efectos adversos gastrointestinales notablemente inferior14,20. Recientemente, Pisani et al.14 llevaron a cabo un ensayo clínico aleatorizado en el que el hierro liposomal demostró ser no inferior al hierro intravenoso en términos de aumento de cifras de Hb al cabo de 3 meses de tratamiento, aunque este último demostró ser superior a la hora de conseguir un mayor grado de repleción de los depósitos de hierro (ferritina, IST) y un aumento más rápido y mantenido de las cifras de Hb al finalizar el tratamiento.
Una de las principales limitaciones del estudio de Pisani et al.14 fue el alto grado de selección de los pacientes incluidos en cada uno de los 2 grupos de estudio, hecho que compromete en gran medida su validez externa y, por tanto, la extrapolación de los resultados a la población de pacientes con ERC no en diálisis. En este sentido se diseñó el presente estudio, cuyo objetivo primario fue evaluar la eficacia del hierro liposomal en términos de aumento de las cifras basales de Hb, así como también el grado de tolerancia y adherencia terapéutica en pacientes con ERC estadio 3, con unos criterios de inclusión menos estrictos.
El tratamiento con hierro liposomal o sucrosomado en nuestra cohorte de pacientes se asoció con un aumento significativo de las cifras de Hb, ya detectable a los 6 meses (aumento de 0,49±0,19g/dL respecto al basal) y que se mantuvo a los 12 meses de tratamiento (aumento de 0,36±0,19g/dL). Estos resultados concuerdan con los objetivados por Pisani et al.14, si bien en dicho estudio el seguimiento fue tan solo de 3 meses. Sin embargo, los parámetros de repleción de los depósitos de hierro no experimentaron una variación significativa respecto a sus valores basales, como ocurrió en el presente estudio. Este fenómeno se ha atribuido al ácido ascórbico asociado al hierro liposomal, que favorece la liberación del hierro asociado a la ferritina y lo moviliza desde el sistema reticuloendotelial hacia su transporte por la transferrina21. El análisis del estado inflamatorio de la cohorte de pacientes tratados, medido a partir de las cifras de proteína C reactiva y albúmina, no mostró cambios significativos a lo largo del seguimiento que potencialmente pudiesen repercutir sobre la absorción del hierro oral y su biodisponibilidad mediada por la hepcidina y consecuentemente sobre las cifras de Hb.
Ningún paciente ha requerido iniciar tratamiento con agentes estimuladores de la eritropoyesis a pesar de que la función renal ha descendido de forma significativa en el período estudiado (disminución del FGe respecto al valor basal de 3,16±1,16 y 4,20±1,28ml/min/1,72 m2 a los 6 y 12 meses, respectivamente). Asociado a dicha reducción del FGe, se objetivó un aumento significativo de las cifras de PTH a los 12 meses del tratamiento. Se ha descrito la potencial influencia negativa sobre la función renal de los preparados de hierro intravenoso, especialmente en términos de daño tubular y proteinuria22–24. Estos efectos no han sido descritos en estudios que han empleado el hierro oral como tratamiento de la anemia en pacientes con ERC14. En el presente estudio, la potencial comorbilidad de los pacientes incluidos podría influir en la progresión de la ERC que, por otro lado, es lenta (menor a 5ml/min/año). En este sentido, el aumento de las cifras de PTH y el empeoramiento del FGe pueden haber actuado como factores de confusión minimizando el efecto del hierro liposomal sobre las cifras de Hb25.
Uno de los aspectos clave que ha demostrado el presente estudio es la excelente tolerancia del tratamiento oral con hierro liposomal o sucrosomado, de forma similar a lo comunicado por Pisani et al.14. Una de las principales limitaciones que presenta el tratamiento oral clásico es la elevada frecuencia de reacciones adversas que conducen a una elevada tasa de abandono terapéutico19. Esta mala adherencia terapéutica conlleva, en última instancia, una baja eficacia del tratamiento oral19. En nuestra cohorte de pacientes que habían recibido previamente suplementación oral con hierro se registró una adherencia terapéutica extremadamente baja (9,4%) al tratamiento con compuestos clásicos de hierro oral. Sin embargo, con el inicio del tratamiento con hierro liposomal la adherencia terapéutica fue del 100% a los 6 y a los 12 meses, sin que se reportaran reacciones adversas que comprometieran el cumplimiento terapéutico. La ausencia de reacciones adversas asociadas al hierro liposomal comporta una clara ventaja respecto al resto de compuestos orales, pero también respecto a los preparados intravenosos, que no están exentos de complicaciones asociadas a su infusión14,19.
Si bien los resultados obtenidos en el presente estudio acerca de la efectividad del hierro liposomal son prometedores en esta población de pacientes, deben tenerse en cuenta las limitaciones del mismo, siendo la principal el pequeño número de pacientes incluidos, hecho que obliga a interpretar los resultados con cautela. A pesar de estas limitaciones, el presente trabajo ofrece una evidencia preliminar que debe servir para la realización futura de estudios aleatorizados, controlados y con un mayor número de pacientes, que aporten una evidencia más sólida de la efectividad y efectos adversos del hierro liposomal en los pacientes con ERC moderada.
En conclusión, el presente estudio demuestra la eficacia del hierro liposomal o sucrosomado en términos de aumento de las cifras de Hb en una cohorte de pacientes con ERC estadio 3 de características extrapolables a la población general de pacientes con ERC moderada. La baja tasa de reacciones adversas y la excelente tolerabilidad al hierro liposomal sitúan a este compuesto como una herramienta de primera línea en el tratamiento de la anemia del paciente con ERC, especialmente en aquellos pacientes con intolerancia al tratamiento oral clásico. Sin embargo, como se ha señalado previamente, más estudios son necesarios para evaluar, de forma aleatorizada y controlada, la eficacia del hierro liposomal respecto a los compuestos clásicos, así como también respecto a la terapia intravenosa.
AutoríaPA y RA han diseñado y contribuido activamente al proyecto que fue aprobado por el Comité Ético de Investigación Médica del Hospital Clínic como estudio observacional con la referencia HCB-2016-0520.
Todos los autores han contribuido a la redacción del manuscrito, aprobando la versión final y el envío para publicación en Nefrología.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados preliminares a los 6 meses de tratamiento se presentaron en el 5th International Multidisciplinary Course on Iron Anemia. Firenze 31.3-1.4.2017.