El trasplante renal (TX) representa el tratamiento de elección de la mayoría de los pacientes con enfermedad renal crónica, pero estos enfermos presentan una elevada mortalidad con respecto a la población general, a pesar de los nuevos tratamientos inmunosupresores y del mejor manejo clínico de estos pacientes. Este hecho justifica que los excelentes resultados obtenidos a corto plazo no lleven una trayectoria paralela a más largo plazo. Esta preocupante situación se debe, probablemente, a una alta prevalencia de entidades cardiovasculares y de procesos infecciosos y tumorales que concurren en esta población en el marco del tratamiento inmunosupresor. Asimismo, existe interacción entre estos procesos, los cuales comparten factores causales y mecanismos patogénicos comunes, incrementando la mortalidad. Por tanto, identificar las causas de muerte y los factores de riesgo, aplicar modelos predictivos de morbilidad y mortalidad e intervenir sobre los factores causales pueden ser algunas de las estrategias para mejorar los resultados de trasplante renal en términos de supervivencia. En esta revisión se analizan algunas de las evidencias que condicionan esta elevada mortalidad tras el TX, así como los aspectos terapéuticos y pronósticos relacionados con la comorbilidad: 1) Magnitud del problema y causas de muerte de estos enfermos; 2) Identificación de los factores de riesgo de mortalidad; 3) Estrategias terapéuticas para disminuir la mortalidad pos-TX; y 4) Predicción de la mortalidad y la enfermedad isquémica cardíaca.
Renal transplantation (TX) is the treatment of choice in the majority of patients with chronic kidney disease. But, these patients have a high mortality rate with respect to the general population despite new immunosuppression treatments and improved clinical management. This justifies that the excellent results obtained in the short terms do not have a parallel clinical benefit in the long term. This worrying situation is probably due to a high prevalence of cardiovascular conditions and infectious and neoplastic entities amongst this population against a backdrop of immunosuppression treatment. Furthermore, there is interaction between these processes, which share causal factors and common pathogenic mechanisms. Mortality thus increases. Therefore, identifying the causes of death and the risk factors, applying morbidity and mortality predictive models and intervening in causal factors could constitute some of the strategies for improving renal transplantation results in terms of survival. This review analyses some of the evidence conditioning this high mortality rate following TX, as well and the therapeutic and prognostic aspects associated with co-morbidity: 1) Magnitude of the problem and causes of death among sufferers; 2) Identification of mortality risk factors; 3) Therapeutic strategies for decrease post-TX mortality and; 4) Prediction of mortality and ischaemic heart disease.
INTRODUCCIÓN
Aunque el trasplante renal (TX) es el tratamiento de elección para los pacientes con enfermedad renal crónica avanzada, la muerte con injerto funcionante constituye la segunda causa de pérdida de los injertos procedentes de donante cadáver. Una situación similar se observa en las mejores condiciones de partida como el TX con donante vivo1. Esto puede justificar que los excelentes resultados a corto plazo no lleven una trayectoria paralela a medio y largo plazo en términos de supervivencia2,3. Asimismo, esta mortalidad con injerto funcionante ha permanecido estable a lo largo de los años a pesar de las nuevas estrategias terapéuticas y de la optimización del manejo clínico de estos pacientes1,4. Por tanto, prolongar la supervivencia del paciente tras el TX representa en la actualidad una prioridad clínica. De ahí que conocer las causas de muerte, identificar los factores de riesgo, aplicar modelos predictivos de mortalidad y comorbilidad e intervenir sobre los factores causales pueden ser algunas de las estrategias para optimizar los resultados del TX. Pero cabe preguntarse: ¿conocemos con exactitud la relación causal entre los factores de riesgo y la mortalidad?; ¿estamos aplicando correctamente los tratamientos oportunos para prolongar la supervivencia?, y ¿podemos predecir la mortalidad?
A lo largo de esta revisión abordaremos las evidencias etiopatogénicas asociadas a esta elevada mortalidad y los aspectos terapéuticos y pronósticos de la comorbilidad inherente al TX, profundizando en los siguientes puntos clínicos: 1) Magnitud del problema y causas de muerte de esta población; 2) Identificación de los factores de riesgo de mortalidad; 3) Estrategias terapéuticas que pueden minimizar la mortalidad; y 4) Predicción de la mortalidad y la cardiopatía isquémica.
1. MAGNITUD DEL PROBLEMA Y CAUSAS DE MUERTE
Estudios observacionales de cohortes han demostrado que la mortalidad cardiovascular de los enfermos con TX es significativamente superior a la de la población general de similar edad y sexo5. En efecto, datos recientes del registro australiano nos muestran que, aunque el TX renal mejora la supervivencia con respecto a la diálisis, estos enfermos presentan una elevada mortalidad global con respecto a la población general4. Concretamente, la tasa de mortalidad global anual de estos enfermos oscila entre 5-7 % y estas cifras se incrementan en la población de > 65 años (10 %). Esto se traduce en que la mortalidad precoz (durante el primer año) representa aproximadamente el 20 % de las pérdidas de los injertos, mientras que la mortalidad tardía, más allá del primer año, constituye el 40 % de estas.
Pero ¿cuáles son las causas de esta mortalidad? Datos recientes del registro americano nos confirman que la enfermedad cardiovascular (ECV) representa la primera causa de muerte (30 %) en la población trasplantada, seguida muy de cerca por las causas de origen infeccioso (21 %)1. De manera similar, un estudio observacional con datos del registro australiano nos muestra que, si bien la ECV continúa siendo la primera causa de muerte (40 %), la mortalidad de origen infeccioso (34 %) se va incrementando paulatinamente a lo largo de los años6. En esta misma línea, un estudio observacional multicéntrico español con 2600 pacientes trasplantados entre 2000 y 2002 confirma que la causa más frecuente de muerte es de origen cardiovascular, especialmente cardiopatía isquémica7. Finalmente, una revisión de varios estudios observacionales muestra resultados similares8. La ECV es la primera causa de mortalidad en estos enfermos (30-48 %), seguidas por las causas infecciosas (17-30 %) y las neoplasias (8-18 %). Con todo, existen diferencias significativas entre las tasas de mortalidad de diferentes países. Concretamente, en un estudio observacional hispanoamericano el riesgo de muerte de los pacientes españoles con TX fue significativamente inferior al de los enfermos americanos, lo que deja entrever que factores ambientales o raciales pudieran justificar tales diferencias9.
2. IDENTIFICACIÓN DE LOS FACTORES DE RIESGO DE MORTALIDAD
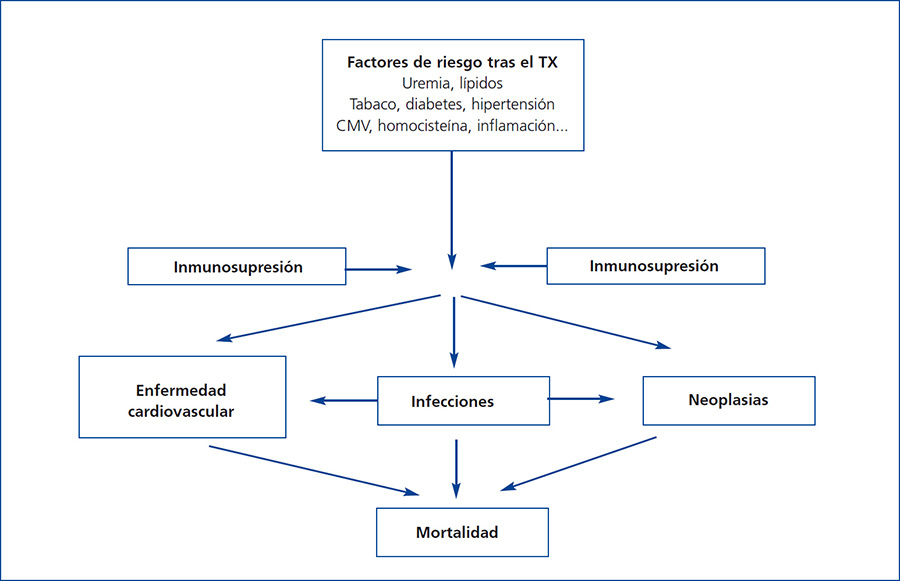
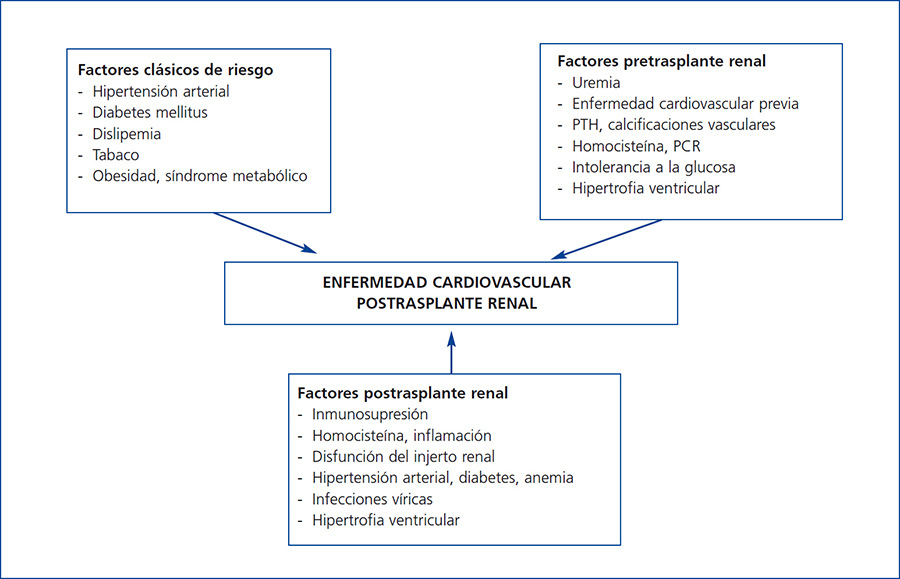
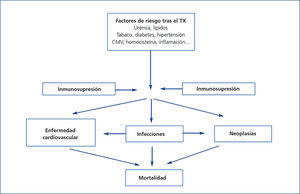
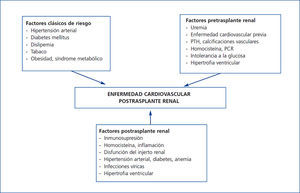
Es muy posible que este exceso de mortalidad en la población con TX se deba a la interacción entre una gran comorbilidad cardiovascular y los procesos infecciosos y neoplásicos, los cuales comparten factores causales comunes en el marco del tratamiento inmunosupresor (figura 1). Centrándonos en la ECV, en pocas entidades clínicas se suman tantos factores de riesgo como en el TX. Aunque se han identificado factores de riesgo pre-TX e inherentes al propio trasplante (figura 2), los factores que más contribuyen a este riesgo cardiovascular son la diabetes, la hipertensión arterial y la dislipemia en pacientes que reciben tratamiento inmunosupresor. Estudios de cohortes de largo seguimiento en población europea han observado un incremento en la incidencia de eventos cardiovasculares y una mayor mortalidad en relación con la diabetes pre-TX y pos-TX, donde esta entidad constituyó un factor de riesgo independiente para el desarrollo de complicaciones cardiovasculares10. Es muy posible que esto se deba a un peor perfil metabólico y vascular de los pacientes con diabetes pos-TX frente a los enfermos sin diabetes reflejado por una mayor cifra plasmática de colesterol y de triglicéridos, así como un mayor incremento en la presión arterial sistólica y diastólica11. Al mismo tiempo, la hipertensión arterial es muy prevalente durante el seguimiento (80 %) y puede condicionar una peor supervivencia en estos pacientes. En efecto, la hipertensión incrementa significativamente el riesgo de muerte y pérdida del injerto ajustando para otras variables de confusión, como el rechazo agudo o la función renal, entre otros12. La dislipemia puede también condicionar un mayor riesgo de progresión de la ateromatosis y desarrollo de ECV en estos enfermos13. Paralelamente, los fármacos inmunosupresores pueden magnificar los efectos deletéreos de los factores de riesgo cardiovascular contribuyendo de esta manera a la elevada morbilidad y mortalidad cardiovascular de esta población8. Globalmente, estos factores pueden justificar que hasta un 40 % de los enfermos con TX sufra algún evento cardiovascular en los primeros diez años pos-TX, como se ha podido demostrar en estudios observacionales europeos de largo seguimiento14.
En cualquier caso, los factores tradicionales de riesgo vascular no explican suficientemente bien la elevada mortalidad cardiovascular. Por un lado, existen factores de riesgo compartidos entre la ECV y el desarrollo de procesos infecciosos y neoplásicos, como la inmunosupresión, el hábito tabáquico o la diabetes, entre otros. Por otra parte, existe una alta prevalencia de factores de riesgo emergentes, como la proteinuria, la inflamación, la disfunción renal o la presencia de calcificaciones vasculares, que condicionan una relación atípica entre el TX y la ECV. A título de ejemplo, un estudio observacional del Kasiske et al. mostró que la puntuación de riesgo del score de Framinghan infraestimaba el riesgo cardiovascular de la población trasplantada15. Concretamente, el riesgo de cardiopatía isquémica asociada a diabetes, hipertensión arterial o dislipemia era significativamente mayor en la población trasplantada con respecto a la población general utilizando este sistema de puntuación.
La proteinuria constituye un factor de riesgo de primera magnitud para la supervivencia del injerto y la mortalidad a través de la lesión continuada que provoca en el injerto renal y la disfunción endotelial, como se ha podido demostrar en estudios observacionales16-18. Asimismo, una gran proporción de pacientes (60 %) presentan precozmente disminución del filtrado glomerular (< 60 ml/min/1,73 m2). Esta alteración es un importante factor de riesgo cardiovascular que incrementa la mortalidad en esta población19-22. En un estudio reciente de cohortes de pacientes con TX se observó que la combinación precoz (tercer mes) de albuminuria de baja cuantía (100-1000 mg/día) más disfunción del injerto renal (30-60 ml/min/1,73 m2) incrementaba significativamente el riesgo de muerte y de pérdida del injerto, posiblemente por un efecto sinérgico de ambas alteraciones23. La hipertrofia ventricular izquierda es muy frecuente en estos enfermos. Un 60 % de los pacientes con TX presentan esta alteración, donde una peor función del injerto renal y no usar inhibidores de la enzima de conversión de la angiotensina constituyen factores de riesgo independientes para el mantenimiento de dicha alteración24. La inflamación puede jugar un papel crucial en el desarrollo de lesiones vasculares ateromatosas. Niveles elevados de proteína C reactiva, un biomarcador del proceso inflamatorio relacionado a la ateromatosis en pacientes renales, se asocian independientemente con la mortalidad, lo cual puede representar un predictor muy útil en estos enfermos25,26. En esta línea, un estudio transversal en pacientes urémicos con diabetes tipo 1 demostró un incremento de citocinas proinflamatorias, quimiocinas, moléculas de adhesión y del factor nuclear kB (NFkB) en la arteria epigástrica inferior, obtenida en el momento del TX27. Sin duda, esto avala el potencial papel de las moléculas proinflamatorias en el desarrollo de la ECV en estos enfermos.
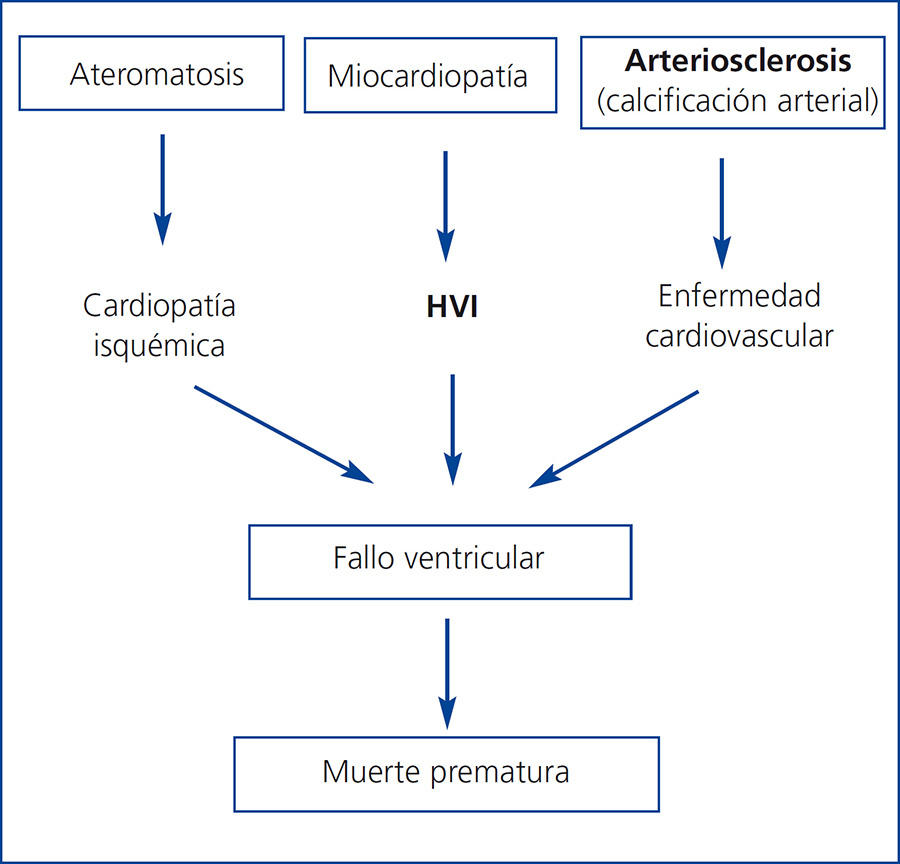
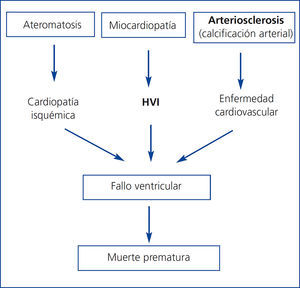
Patogénicamente, estos factores de riesgo confluyen en 3 procesos que están interrelacionados (figura 3). En primer lugar, un proceso de ateromatosis acelerada, que condiciona una enfermedad isquémica cardíaca. En segundo lugar, un fenómeno de remodelación cardíaca anómalo, que conduce al crecimiento ventricular izquierdo (concéntrico o excéntrico) y disfunción ventricular. Por último, La calcificación de la capa media de las arterias o arteriosclerosis, un proceso frecuente en la enfermedad renal crónica, que no suele revertir tras el TX y que incrementa la comorbilidad. La consecuencia final es un fallo ventricular con caída del gasto cardíaco y muerte prematura en estos pacientes durante el seguimiento. En efecto, la cardiopatía isquémica es muy prevalente tras el TX. La incidencia acumulativa de infarto agudo de miocardio tras los primeros tres años del TX es del 11 % y este hecho incrementa en 2,6 el riesgo de muerte pos-TX28. Asimismo, los enfermos con hipertrofia ventricular izquierda o calcificaciones vasculares pre-TX, evaluadas por una radiografía simple de abdomen, presentan una mayor mortalidad que aquellos sin estas alteraciones cardíacas o vasculares, independientemente de otros factores de riesgo cardiovascular29,30.
Al mismo tiempo, las infecciones pos-TX por virus inmunomoduladores, como el citomegalovirus (CMV), herpes virus, el virus de Epstein-Barr, los virus hepatotropos o el virus de la inmunodeficiencia humana, pueden alterar la expresión de mediadores inflamatorios y citocinas aumentando la susceptibilidad a contraer infecciones oportunistas graves. Al mismo tiempo, este hecho puede también incrementar el riesgo de disfunción crónica del injerto y la aparición de tumores y otras enfermedades metabólicas o vasculares que conducen, en última instancia, a una disminución de la supervivencia del paciente. En este sentido, la infección por CMV se ha relacionado con enfermedad arterial isquémica periférica, especialmente cuando se asocia a otros factores de riesgo cardiovascular, como el hábito tabáquico31.
La seropositividad para el virus de Epstein-Barr representa un factor de riesgo de primera magnitud para el desarrollo de linfomas pos-TX, principalmente en pacientes jóvenes que reciben inducción con anticuerpos antilinfocíticos OKT3 o timoglobulina32. En un estudio observacional americano donde se reclutaron 89.485 enfermos, la seronegatividad para el CMV o el virus de Epstein-Barr, así como el hecho de haber recibido inducción con anticuerpos antilinfocíticos o anti-CD25, incrementaba significativamente el riesgo de procesos linfoproliferativos pos-TX, lo cual, a su vez, confiere diecisiete y cinco veces más riesgo de muerte y de pérdida de injertos, respectivamente, frente a aquellos que no desarrollaron un trastorno linfoproliferativo33.
Por último, existe una mayor incidencia de tumores en la población trasplantada con respecto a la población general, y la inmunosupresión y ciertas infecciones virales juegan un papel patogénico decisivo en su aparición34. Un informe del registro americano que agrupó a más de 175.000 pacientes demostró que la incidencia estandarizada de cáncer en la población trasplantada doblaba a la de la población general, y esto incluía neoplasias relacionadas y no relacionas con los procesos infecciosos35.
3. ESTRATEGIAS TERAPÉUTICAS QUE PUEDEN MINIMIZAR LA MORTALIDAD
Con este escenario, nos deberíamos plantear cómo prevenir esta gran comorbilidad vascular, infecciosa y tumoral en el paciente con TX en la era de la moderna inmunosupresión. Dada la alta prevalencia de trastornos metabólicos y vasculares en esta población, el control de la presión arterial, la dislipemia, las alteraciones del metabolismo hidrocarbonado y posiblemente la administración de antiagregantes pudieran minimizar la comorbilidad de estos enfermos y, en teoría, mejorar la supervivencia. El bloqueo farmacológico del sistema renina-angiotensina reduce la presión arterial y disminuye la proteinuria y la masa ventricular. Esto pudiera traducirse en una mejoría de la supervivencia. Estudios observacionales han demostrado que el empleo de estos fármacos se asocia a una reducción de la mortalidad, utilizando análisis de propensión y modelos marginales estructurales para evitar la confusión por indicación36-38. Asimismo, un ensayo clínico controlado en pacientes con TX demostró que el uso de fluvastatina se asociaba a una reducción de las cifras de colesterol LDL y de los eventos cardiovasculares, frente a los que recibieron placebo39. Con todo, el empleo de medicación cardioprotectora y renoprotectora, como estatinas, beta-bloqueantes o aspirina, es muy variable y relativamente escaso durante el primer año pos-TX en estos pacientes, como se ha podido identificar en estudios observacionales multicéntricos40,41. Esta circunstancia puede justificar, en parte, esta elevada mortalidad cuando concurren factores tradicionales y no tradicionales de riesgo cardiovascular.
El tipo de inmunosupresión y su intensidad pueden contribuir a una elevada mortalidad de origen cardiovascular, infeccioso o tumoral tras el TX. Dados los efectos negativos del tratamiento inmunosupresor, la individualización de la inmunosupresión puede ser una de las estrategias que mejoren los resultados del TX en términos de supervivencia42. La retirada de esteroides o el hecho de evitar su uso se asocia a un ligero aumento de la tasa de rechazo agudo, pero mejora notoriamente el riesgo cardiovascular y la incidencia de trastornos lipídicos y del metabolismo hidrocarbonado. Sin duda, esto puede contribuir a disminuir el riesgo de mortalidad, como se ha demostrado en estudios controlados y observacionales43-46. La ciclosporina (CsA) produce más hipertensión e hiperlipemia que el tacrolimus. De hecho, la conversión de CsA a tacrolimus mejora estos trastornos, lo que se traduce en una reducción del score de riesgo de Framinghan en los enfermos que reciben tacrolimus, tanto en tratamiento de inducción como en pautas de reconversión47.
Tacrolimus es más diabetógeno que la CsA48, pero pautas terapéuticas con minimización de esteroides e individualización de los fármacos inhibidores de la calcineurina pudieran disminuir el riesgo de diabetes pos-TX, especialmente en los enfermos con mayor predisposición a padecer esta entidad. Ensayos clínicos controlados darán respuesta a estas cuestiones.
Dadas las propiedades antiproliferativas de los fármaco anti-mTOR (mamalian target of rapamycin), sirolimus y everolimus pueden revertir las lesiones vasculares ateromatosas y disminuir la masa ventricular izquierda, tal como se ha demostrado en el modelo animal o en estudios longitudinales de pacientes con TX49,50. En esta línea, un estudio controlado y aleatorizado demostró que la administración de everolimus más dosis reducida de CsA disminuía significativamente la masa ventricular frente a dosis convencionales de CsA, donde el tratamiento con everolimus constituyó un factor independiente asociado a la regresión de la masa ventricular izquierda51. Pautas de conversión de un fármaco inhibidor de la calcineuirna a un anti-mTOR se asocian también a una mejoría de la función renal52. Esto, en teoría, puede contribuir también a disminuir la morbilidad y mortalidad en estos enfermos.
En el terreno de la patología tumoral, la conversión de CsA a sirolimus es capaz de frenar la progresión del sarcoma cutáneo de Kaposi, un tumor asociado a infección por el herpesvirus 8 en pacientes con TX53. Estudios controlados, aleatorizados, de pacientes en riesgo para el desarrollo de cáncer cutáneo no melanocítico por haber presentado previamente una neoplasia cutánea, han demostrado que el empleo de sirolimus reduce significativamente el riesgo de aparición de una segunda neoplasia cutánea frente a continuar tomando un inhibidor de la calcineurina54,55.
El empleo de fármacos no nefrotóxicos, como belatacept, pudiera también ayudar a minimizar el riesgo cardiovascular de esta población. Estudios controlados han demostrado que el uso de este fármaco se asocia a corto y medio plazo con una menor incidencia de diabetes pos-TX, mejora el perfil lipídico y optimiza la función renal frente al empleo de CsA, sin menoscabo de su potencia inmunológica56-58.
Finalmente, otras medidas, como la profilaxis de las enfermedades infecciosas, especialmente la infección por CMV con valganciclovir, la reducción o modulación de la inmunosupresión, el screening periódico de las neoplasias y el empleo de los anti-mTOR en enfermos con riesgo de neoplasias no cutáneas o enfermedades víricas, puede contribuir a reducir la mortalidad infecciosa y tumoral pos-TX, pero se necesitan estudios controlados que lo confirmen.
4. PREDICCIÓN DE LA MORTALIDAD Y LA CARDIOPATÍA ISQUÉMICA
Predecir la mortalidad y la comorbilidad puede ser crucial para establecer las medidas terapéuticas más oportunas y disminuir la mortalidad y comorbilidad en estos enfermos. Por tanto, en los pacientes con TX se necesitan, inexcusablemente, la aplicación de índices pronósticos que incluyan factores de riesgo comórbidos y medidas subordinadas de la supervivencia, para estimar con mayor precisión la supervivencia, en aras de tomar las decisiones terapéuticas dirigidas más acertadas.
Pero ¿cómo se cuantifica la comorbilidad y para qué sirven los índices pronósticos? De una manera individual, cualquier variable de riesgo (predictiva) o subordinada puede determinar el pronóstico o el desenlace de una determinada entidad clínica. Sin embargo, la capacidad de predicción se puede optimizar usando múltiples variables predictivas o medidas subordinadas agrupadas en lo que llamamos índices pronósticos de comorbilidad.
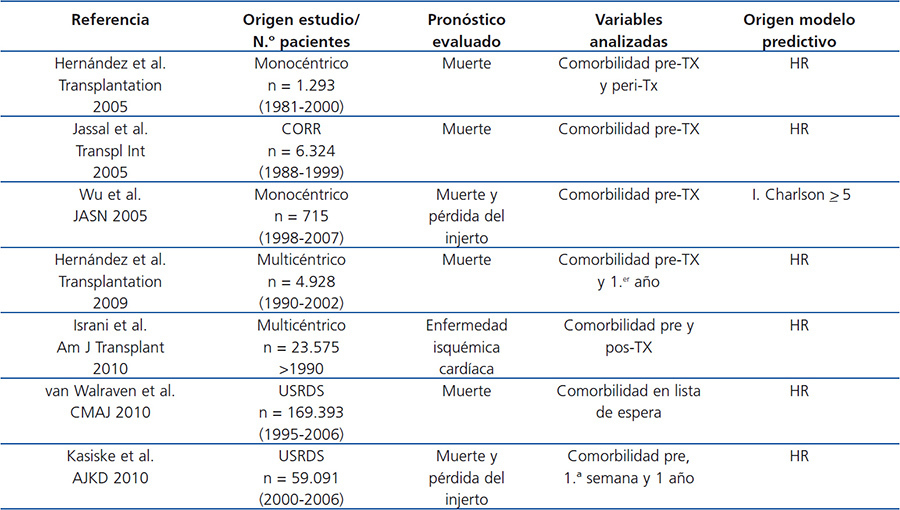
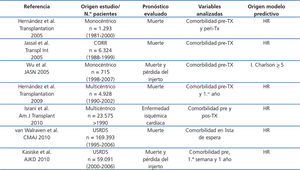
Durante los últimos años se han elaborado diferentes índices pronósticos de mortalidad y comorbilidad en los pacientes con TX. Algunos han sido realizados a partir de índices de riesgo aplicados en la población general, como el índice de Charlson59. Otros han sido generados a partir de variables pre-TX y pos-TX procedentes de registros multicéntricos o estudios monocéntricos (tabla 1). Todos predicen el riesgo de muerte o de comorbilidad (principalmente cardiopatía isquémica) con un alto nivel de concordancia y todos han sido validados interna o externamente en otras poblaciones. Veamos brevemente algunos ejemplos que se han centrado en la mortalidad y la cardiopatía isquémica. Utilizando la base de datos del Registro Canadiense de TX se comparó la capacidad predictiva de mortalidad de 4 índices pronósticos validados en población general y urémica, observándose que el índice de Charlson fue el más útil en predecir el desenlace final en estos pacientes60. No obstante, un alto número de pacientes no mostraba una gran comorbilidad en el momento del TX y no incluyeron condiciones inherentes al propio TX, lo cual pudiera cuestionar los resultados. Un estudio ulterior de cohortes que incluyó 715 pacientes trasplantados entre 1998 y 2003 demostró que, en efecto, el índice de Charlson era una buena herramienta clínica para la evaluación de la morbilidad. Los pacientes con puntuación > 5 presentaron un mayor riesgo de muerte y de pérdida de injertos que aquellos con puntuación < 5, pero de nuevo no emplearon factores inherentes al TX para predecir el pronóstico61. En un estudio de cohortes monocéntrico se elaboró y validó un índice de mortalidad a partir del peso estadístico (coeficiente beta) de todas las variables pre-TX y peri-TX (durante el ingreso hospitalario) que se asociaron significativamente con la supervivencia en la población modelo. Con ello se generó una puntuación sumatoria que fue dividida en terciles de riesgo. Estos terciles de riesgo incluían la combinación de estos factores clásicos de riesgo y factores perioperatorios inherentes al TX (edad, factores clásicos de riesgo, hipertrofia ventricular, calcificaciones vasculares, obesidad, diabetes, tiempo en diálisis, función del injerto, primer o segundo TX y presencia de función renal retrasada del injerto), de manera que, a medida que aumentaba el riesgo, disminuía significativamente la supervivencia62. En esta misma línea, a partir de la base de datos americana de enfermos renales se ha elaborado una puntuación de riesgo de muerte para tres grupos de pacientes: enfermos en lista de espera, pacientes con TX de donante fallecido y enfermos con TX de donante vivo63. Tras la aleatorización de la muestra en 2 subpoblaciones (población modelo y población de validación), se obtuvo una puntuación para cada variable que en el análisis multivariante de Cox se asoció con la mortalidad en la población modelo. De esta manera, se obtuvo una puntuación sumatoria para cada enfermo que se relaciona exponencialmente con la mortalidad a los 5 años. Aunque este índice muestra datos comparativos con las distintas modalidades de tratamiento sustitutivo, no tiene en cuenta factores inherentes a la propia evolución del TX. En efecto, la mayoría de los índices pronósticos aplicados en el TX solo consideran factores de riesgo basales (de partida) y no incluyen factores de riesgo emergentes evolutivos. Con esta premisa, y partiendo de la base de datos del Grupo Español de Nefropatía Crónica del injerto, que incluyó a 4928 pacientes que fueron trasplantados en cuatro años diferentes (1990, 1994, 1998 y 2002), se desarrolló un índice predictivo de mortalidad a partir de la combinación de factores de riesgo basales y factores evolutivos pos-TX64. Los coeficientes beta de las variables de la población modelo que en el análisis de Cox se asociaron a mortalidad se emplearon para generar una puntuación sumatoria de riesgo, que fue dividida en cuartiles. Esta puntuación se empleó para calcular la probabilidad de muerte en los primeros tres años de seguimiento a partir de siguiente fórmula: P(muerte) = 1- 0,993964837exp(score points/100). La probabilidad de muerte incrementó desde < 1 % para el más bajo cuartil (score 40) hasta > 5 % en el más alto cuartil (score 200) y esta probabilidad estimada de mortalidad fue similar a la mortalidad observada en las dos subpoblaciones estudiadas (modelo y validación) con una aceptable discriminación (C-index 0,75 y 074). Con un diseño similar, se ha elaborado una puntuación de riesgo para el desarrollo de cardiopatía isquémica en el pos-TX inmediato, a la semana del TX y después del primer año de evolución pos-TX, a partir de aquellas variables que se asociaron con el evento primario durante los momentos estudiados en el análisis multivariante65. De esta forma, también se obtuvo una relación exponencial entre la puntuación de riesgo sumatoria y la probabilidad de un evento isquémico cardíaco.
CONCEPTOS CLAVE
1. La muerte del paciente continúa siendo en la actualidad la segunda causa de pérdida de los injertos renales a pesar de la mejoría en el manejo clínico de estos pacientes, especialmente de la población más longeva.
2. La ECV representa la causa más frecuente de mortalidad pos-TX en la era de la moderna inmunosupresión, seguida por los procesos infecciosos y tumorales.
3. Existe interacción y mecanismos patogénicos comunes entre las entidades cardiovasculares, los procesos infecciosos y tumorales, que puede incrementar la mortalidad en estos enfermos.
4. Los factores de riesgo emergentes durante la evolución pos-TX pudieran perpetuar la elevada mortalidad pos-TX, a pesar de la optimización en el manejo clínico de esta población y de los nuevos inmunosupresores.
5. Un escaso uso de medicación cardio y renoprotectora en estos enfermos puede justificar, en parte, esta elevada mortalidad pos-TX.
6. La individualización de la inmunosupresión podría mejorar el pronóstico de estos enfermos.
7. Existen herramientas muy útiles para predecir la mortalidad en esta población y, en consecuencia, establecer estrategias terapéuticas dirigidas que mejoren los resultados en estos enfermos.
Agradecimientos
Este estudio ha sido financiado en parte por la Consejería de Salud del Gobierno de Andalucía (PI-0499/2009) y por el Ministerio Español de Ciencia e Innovación (Instituto de Salud Carlos III, FIS PI10/01020), REDINREN RD12/0021/0015.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Modelos predictivos de mortalidad y comorbilidad en pacientes con trasplante renal
Figura 1. Potencial interacción entre factores de riesgo, comorbilidad y mortalidad tras el trasplante renal
Figura 2. Factores de riesgo para enfermedad cardiovascular postrasplante renal
Figura 3. Mecanismos patogénicos potenciales de enfermedad cardiovascular en pacientes con trasplante renal