Guía clínica de la Sociedad Española de Nefrología para la prevención y tratamiento de la infección peritoneal en diálisis peritoneal
Más datosLas infecciones peritoneales siguen constituyendo una complicación muy relevante de la diálisis peritoneal, por su incidencia todavía elevada y por sus importantes consecuencias clínicas, en términos de mortalidad, fracaso de la técnica y costes para el sistema sanitario. Las prácticas de prevención y tratamiento de esta complicación muestran una notable heterogeneidad derivada, entre otros factores, de la complejidad del problema y de la escasez de evidencia clínica que permitan responder de manera clara a muchas de las dudas planteadas. El propósito de este documento es proporcionar una revisión completa y actualizada de los métodos de diagnóstico, prevención y tratamiento de estas infecciones. El documento se ha elaborado tomando como referencia de partida la guía más reciente de la Sociedad Internacional de Diálisis Peritoneal (2016). Mientras que para el capítulo diagnóstico se ha adoptado una estructura más narrativa, el análisis de las medidas de prevención y tratamiento ha seguido una metodología sistemática (Grading of Recommendations, Assessment, Development and Evaluation [GRADE]), que especifica el nivel de evidencia y la fuerza de las sugerencias y recomendaciones propuestas, y facilita actualizaciones futuras de la guía. La gran extensión y numerosas recomendaciones o sugerencias emanadas de la revisión ponen de manifiesto la complejidad y gran número de facetas a tener en cuenta para un adecuado abordaje de esta importante complicación de la diálisis peritoneal.
Peritoneal infections still represent a most feared complication of chronic peritoneal dialysis, due to their high incidence and relevant clinical consequences, including direct mortality, technique failure and a significant burden for the health system. The practices for prevention and treatment of this complication show a remarkable heterogeneity emerging, among other factors, from the complexity of the problem and from a paucity of quality evidence which could permit to respond clearly to many of the raised questions. The purpose of this document is to provide a complete and updated review of the main methods of diagnosis, prevention and treatment of these infections. The document has been elaborated taking as a reference the most recent guidelines of the International Society of Peritoneal Dialysis (2016). The diagnostic considerations are presented in a narrative style while, for prevention and therapy, we have used a systematic methodology (Grading of Recommendations, Assessment, Development and Evaluation [GRADE]), which specifies the level of evidence and the strength of the proposed suggestions and recommendations and facilitates future updates of the document. The length of the document and the many suggestions and recommendations coming out of the review underline the large number and the complexity of the factors to be taken into consideration for an adequate approach to this complication of peritoneal dialysis.
A pesar de su ya larga trayectoria y de tratarse de una modalidad de tratamiento renal sustitutivo (TRS) totalmente asentada, la práctica clínica y los resultados de la diálisis peritoneal (DP) siguen siendo muy variables, como queda de manifiesto en los diferentes registros nacionales e internacionales1–5. Las causas de esta variabilidad son complejas y diferentes en distintas partes del mundo, e incluyen factores sociales y sanitarios como el nivel general de desarrollo, la calidad general y universalidad de la asistencia, las políticas sanitarias, los recursos asignados, las diferencias entre poblaciones y el papel que se asigna a la propia DP en la planificación del TRS de cada país6. Desde una perspectiva puramente clínica, la escasez de evidencia robusta (ensayos clínicos aleatorizados, multicéntricos y suficientemente potenciados) en el campo de la DP resulta llamativa, lo que ha contribuido en gran medida a generar prácticas locales, apoyadas en experiencias observacionales y no controladas.
En este contexto tan poco favorable para el éxito de una técnica de TRS, han surgido en las últimas décadas numerosas guías de práctica clínica de la DP, tanto a nivel nacional como internacional. Idealmente, solo una evidencia de calidad daría valor a estas guías, pero la escasez de esta evidencia las hace aún más necesarias, por dos razones principales:
- -
Para el profesional menos experimentado que no puede recurrir a las conclusiones de ensayos de diseño y resultados solventes, la opinión formal de comités de expertos debidamente constituidos resulta de gran ayuda.
- -
Resulta muy conveniente unificar y asentar criterios y prácticas comunes, permitiendo que los resultados puedan ser evaluados adecuadamente.
En general, las guías de práctica clínica en DP se suelen centrar en la selección de pacientes, la adecuación, la prescripción y las complicaciones de la técnica, con una atención preferente a las infecciones. Lo habitual es la presentación focalizada a cuestiones concretas7–16 con la idea subyacente, en casos como las normas de la Sociedad Internacional de Diálisis Peritoneal (ISPD) o del entorno Asia-Oceanía (CARI), de ir construyendo un cuerpo general de recomendaciones. Solo algunas guías, incluyendo las españolas de 200517–19, han mostrado vocación global.
La prevención y manejo de las infecciones peritoneales (IP) han sido objeto de atención preferente por parte de las principales guías de DP, bien como capítulos de guías generales17–19 como en forma de documentos específicos. ISPD (https://ispd.org/ispd-guidelines/) y CARI (http://www.cari.org.au/Dialysis/dialysis%20peritonitis/dialysis_peritonitis.html) han sido especialmente activos en este aspecto. El documento ISPD de 201614 se mantiene como la referencia más actualizada, con algunas rectificaciones posteriores20.
Propósito y alcance de la guíaJustificaciónEn general, el grupo de trabajo en DP de la Sociedad Española de Nefrología (S.E.N.) acepta las guías ISPD14 como documento de referencia para esta cuestión. Sin embargo, consideramos que es conveniente una renovación de las vigentes guías DP de la S.E.N., adaptándolas a nuestro entorno y actualidad. Los motivos fundamentales para esta revisión son:
- 1.
La vocación de la S.E.N. de disponer de un cuerpo de recomendaciones propias para el mayor número de ámbitos posibles de la Nefrología.
- 2.
El tiempo transcurrido desde las guías DP de la S.E.N. de 2005, que se realizaron en un formato narrativo y de revisión no sistemática de la literatura, lo que no se corresponde con las metodologías actuales de abordaje de estas cuestiones.
- 3.
Aunque la amplia mayoría de las recomendaciones de las guías ISPD 2016 se basan mayoritariamente en opinión más que en evidencias, algunas han resultado polémicas en mayor o menor grado, y es conveniente dar una visión de estas desde nuestro propio entorno.
- 4.
Las guías ISPD 2016 tienen una vocación internacional, y parte de sus recomendaciones están condicionadas por factores económicos y sociosanitarios no aplicables a nuestro entorno.
- 5.
La recogida de información para las guías ISPD 2016 finalizó en los últimos meses de 2015. Aunque el plazo transcurrido no es prolongado, una actualización 2021 puede ser de interés.
El objetivo de esta guía es proporcionar a sus destinatarios recomendaciones actualizadas y centradas en nuestro entorno sociosanitario, para la prevención y tratamiento de las IP en DP, tomando como punto de partida y referencia las recomendaciones de las guías de práctica clínica ISPD 201614.
Población a la que va dirigida- –
Esta guía va dirigida primordialmente a:
- –
Miembros de la S.E.N. en general.
- –
Nefrólogos españoles, iberoamericanos y de habla hispana, en general.
- –
Médicos residentes en Nefrología.
- –
Personal de enfermería de DP.
También incluye entre sus objetivos de formación a:
- –
Médicos de otras especialidades con interés de cualquier naturaleza en el campo de las infecciones, en general, y de las infecciones asociadas a DP, en particular.
- –
Profesionales, organizaciones y particulares con interés en el tema, incluyendo a las personas con enfermedad renal y sus asociaciones.
El grupo de desarrollo de la guía de práctica clínica en DP se constituyó bajo los auspicios de la Junta Directiva de la S.E.N. y el Grupo Coordinador de Guías de Práctica Clínica y Documentos de Consenso de la S.E.N. Se organizó a partir de un Comité de Expertos designado por estos organismos, compuesto por nueve profesionales de reconocido prestigio en el campo, siendo designado coordinador Miguel Pérez Fontán. Este comité estableció el programa, cronograma y desarrollo de la guía, procediendo a designar subcomités para la realización de los diferentes capítulos. La adopción de la metodología Grading of Recommendations, Assessment, Development and Evaluation (GRADE) obligó a la contratación, por parte de la Sociedad, de una empresa externa (InMusc®), con el fin de proporcionar soporte metodológico y formación reglada en la metodología citada a los miembros del comité de expertos. Desde fases precoces del proyecto se hicieron patentes las limitaciones metodológicas y financieras del proyecto, por lo que se decidió fraccionarlo, dando prioridad a los aspectos considerados de mayor interés para los destinatarios de la guía (selección de pacientes, valoración de la membrana peritoneal, prescripción y adecuación e IP).
En lo relativo a la Guía para la prevención y tratamiento de la infección peritoneal, la elaboración se ha estructurado en cuatro escalones:
- 1.
La redacción básica de la guía ha correspondido a los tres panelistas citados al inicio del documento, con la colaboración fundamental del Dr. Carlos Quereda por parte del Grupo Metodológico de la S.E.N.
- 2.
En un segundo escalón, el capítulo fue sometido al escrutinio del Grupo de Expertos de la guía de práctica clínica en DP.
- 3.
En un tercer paso, se sometió el documento al escrutinio externo de un grupo de profesionales, incluyendo nefrólogos, especialistas en enfermedades infecciosas y personal de enfermería de DP, pulsando también la opinión de la principal asociación de personas con enfermedad renal (Alcer).
- 4.
Por último, el documento se abre al escrutinio general de la S.E.N. a través de su página web, antes de proceder a su cierre.
La metodología aplicada en la generación de este documento ha seguido, en sus principios generales, el sistema GRADE, resumido en el documento-guía correspondiente de la S.E.N., y reconocible en otros documentos S.E.N. de la misma naturaleza21–23.
Un aspecto particular y fundamental en la elaboración de la guía de IP ha sido la existencia de una guía relativamente reciente (2016) sobre el mismo tema, elaborada por un Comité de Expertos de la ISPD14. El Grupo de Expertos de la S.E.N. reconoce el alto grado de validez de la citada guía, con las salvedades expuestas en el capítulo de Propósitos de este documento. Por ello, se decidió tomar el documento ISPD como base y referencia de la presente guía, como se podrá constatar por las continuas referencias a ella durante su desarrollo. Algunas cuestiones relevantes son tratadas por otras guías y documentos ISPD, que también nos han servido de referencia11,24,25.
En resumen, los pasos seguidos han sido:
- 1.
Elaboración y revisión de preguntas clínicas. Estas preguntas se centraron en los aspectos fundamentales y potencialmente polémicos (prevención y tratamiento), Para las cuestiones generales y relacionadas con el diagnóstico de la IP se aplicó un formato descriptivo.
- 2.
Estrategia de búsqueda bibliográfica. Una vez definidas por los expertos las preguntas de interés en las que se basaron las recomendaciones, se procedió a:
- a.
Una revisión exhaustiva de la guía ISPD de referencia14, identificando y analizando solamente los artículos que proporcionan a las preguntas formuladas bases de evidencia particularmente relevantes
- b.
Un proceso de búsqueda sistemática de publicaciones sobre el tema, que pudieran ser posteriores a la citada guía ISPD (2015-2019).
- c.
Antes de la liberación del capítulo, se realizaron búsquedas exhaustivas (no sistemáticas) de publicaciones hasta marzo del 2021, con potencial interés para la guía.
- d.
Se elaboraron tablas PICO21,26 correspondientes a cada pregunta clínica, con el fin de concretar los criterios para la estrategia de búsqueda bibliográfica, definiendo los siguientes aspectos:
- –
P = Población objeto del estudio (pacientes con enfermedad renal crónica estadío 5d, tratados con DP)
- –
I = Intervención que se propone estudiar (medidas de prevención o tratamiento de la IP)
- –
C = Parámetro de comparación (otra medida o tratamiento alternativo o placebo o no tratamiento)
- –
O = variables de resultado (outcome), clasificados por importancia clínica (tasas de infección, riesgo acumulado, tasas de mortalidad o fracaso de la técnica ligadas a la infección etc.).
Se incluyeron en la estrategia de búsqueda los diseños metodológicos adecuados (revisiones sistemáticas-metaanálisis, ensayos clínicos aleatorizados y controlados, estudios observacionales de cohortes prospectivas o retrospectivas, estudios de casos y controles). El proceso de búsqueda bibliográfica fue realizado por dos documentalistas en colaboración con el comité médico, diseñando una estrategia de búsqueda de acuerdo con las indicaciones explicitadas en las preguntas PICO y realizadas sobre las bases bibliográficas MEDLINE (PubMed), Cochrane Library y EMBASE. Todo el proceso fue supervisado por metodólogos expertos en revisiones sistemáticas y guías de práctica clínica (InMusc).
- 3.
Selección de artículos. Los artículos encontrados fueron sometidos a un proceso independiente de análisis por dos observadores para seleccionar los trabajos publicados que cumplían los criterios clínicos de inclusión-exclusión, intervenciones y grupos de comparación, variables de resultado, métodos de estudio y calidad metodológica. Las diferencias entre observadores se resolvieron por consenso en los artículos en los que inicialmente no existía acuerdo.
- 4.
Estimación de la calidad de la evidencia. Se realizó un resumen estructurado de los resultados de los estudios relevantes que respondían a cada pregunta clínica. Para cada variable de desenlace se evaluó la calidad de la evidencia según los criterios estandarizados, definidos en el sistema GRADE21, que califican la calidad de la evidencia como alta (A), moderada (B), baja (C) y muy baja (D).
Se consideraron los siguientes factores que pueden modificar la confianza en los resultados: riesgo de sesgo, consistencia entre los resultados de los estudios disponibles, disponibilidad de evidencia directa y precisión de los estimadores del efecto. En el caso de los estudios observacionales se tuvieron en cuenta: tamaño del efecto, relación dosis-respuesta y el posible impacto en los resultados de los factores de confusión27,28.
Cada pregunta clínica se acompaña de un resumen de los hallazgos derivados de la revisión de la literatura, sintetizados al final de cada pregunta en una sección denominada «Resumen de la evidencia».
La búsqueda sistemática rindió un total de 673 posibles entradas entre octubre del 2015 y septiembre del 2019, pero solo 52 publicaciones cumplían plenamente los criterios requeridos. A ellas se sumaron otras 43 publicaciones recogidas de manera no sistemática entre octubre del 2019 y marzo del 2021. Los artículos finalmente seleccionados por pregunta y las fichas elaboradas para análisis según los criterios GRADE se pueden ver en los anexos.
- 5.
Estructura para la edición. Esta revisión conlleva una vocación docente que obliga a desarrollar aspectos descriptivos o conceptuales (definiciones, clasificaciones, convenios, aspectos organizativos, sistemática diagnóstica etc.) que se resuelven utilizando las estructuras narrativas tradicionales.
La edición de resultados generados en repuesta a las preguntas formuladas con metodología GRADE, se resuelven con el siguiente esquema narrativo apoyado con gráficos y tablas:
- -
Introducción. Cuando procede, breve definición del problema clínico y su contexto.
- -
Síntesis o resumen de la evidencia. En este apartado se incluyen las cuestiones y soporte bibliográfico extraído de la guía ISPD14 que responden a las preguntas formuladas por los panelistas expertos, seleccionando los artículos en los que se apoya, y señalando la calidad de la evidencia de los artículos siguiendo metodología GRADE23,27,28.
A la evidencia recogida en la guía ISPD, se añadió la «nueva evidencia» aportada por nuestro programa de búsqueda, selección y jerarquización de los artículos que responden a las preguntas planteadas, señalando los procedentes de la guía previa y los nuevos resultantes de nuestra búsqueda y describiendo brevemente su calidad y pertinencia. Este proceso fue completado con búsquedas manuales en PubMed (MEDLINE), en la Cochrane Library y en listas bibliográficas de artículos valiosos de reciente publicación.
- De la evidencia a la recomendación y formulación de recomendaciones. El equipo redacta las recomendaciones para cada pregunta calificándolas como 1 (fuerte = recomendamos), 2 (débil = sugerimos); no procede o no graduado21,22,29. En este apartado se explica el proceso que conduce a las recomendaciones sustentadas por la evidencia existente y otras consideraciones clínicas y sociológicas.
Como ya se ha mencionado, las recomendaciones del grupo de trabajo se valoran de forma ciega por parte de todo el grupo de expertos de la guía; resolviendo las discrepancias mediante encuesta Delphi a dos vueltas.
Índice de abreviaturasBGN Bacilos gramnegativos
CARI Caring for Australasians with Renal Impairment
DP Diálisis peritoneal
DPA Diálisis peritoneal automatizada
DPCA DP continua ambulatoria
ECN Estafilococo coagulasa-negativo
ERC Enfermedad renal crónica
IAC Infección asociada a catéter
IP Infección peritoneal/peritonitis
ISPD International Society of Peritoneal Dialysis
PCR Reacción en cadena de la polimerasa
PDG Productos de degradación de glucosa
S.E.N. Sociedad Española de Nefrología
TRS Tratamiento renal sustitutivo
Preguntas clínicas estructuradasPrevenciónP1 ¿Reducen las estrategias estructuradas de prevención, incluyendo la mejora continua de la calidad (MCC), las tasas de peritonitis/IP?
P2 ¿Cómo influyen la experiencia del entrenador y la sistemática de entrenamiento sobre la incidencia de peritonitis/IP?
P3 ¿Existen medidas relacionadas con la inserción del catéter peritoneal que reduzcan el riesgo ulterior de peritonitis/IP?
P4 ¿Influye el tipo de cuidados tras la implantación del catéter peritoneal sobre el riesgo de peritonitis/IP?
P5 ¿Reduce el diagnóstico y tratamiento de portadores de Staphylococcus aureus la incidencia de peritonitis/IP por grampositivos?
P6 ¿Qué medidas son especialmente importantes durante el intercambio peritoneal para reducir el riesgo de peritonitis/IP?
P7 ¿Influye el tipo de sistema de DP en la incidencia de peritonitis/IP?
P8 ¿Reduce la DP automatizada la frecuencia de peritonitis/IP?
P9 ¿Reduce el uso de soluciones de diálisis tamponadas con bicarbonato y bajas en productos de degradación de glucosa (PDG) («biocompatibles») la incidencia de peritonitis/IP?
P10 ¿Reduce la profilaxis antibiótica el riesgo de peritonitis/IP tras una desconexión accidental?
P11 ¿Qué medidas de prevención de peritonitis/IP deben aplicarse en los pacientes en DP que vayan a ser sometidos a procedimientos endoscópicos digestivos, ginecológicos o bacteriémicos?
P12 ¿Reduce la profilaxis antifúngica el riesgo de peritonitis/IP fúngica en pacientes en DP que son tratados con antibacterianos de amplio espectro o por tiempo prolongado?
P13 ¿Reduce el tratamiento con vitamina D el riesgo de peritonitis/IP?
TratamientoT1 ¿Cuál es el antibiótico o asociación antibiótica más apropiada para el tratamiento empírico de una IP?
T2 ¿Cuál es el efecto de los lavados peritoneales y de la adición de heparina sobre la evolución de las IP en DP?
T3 ¿Cuál es la vía de administración de antibiótico más apropiada para el tratamiento de una IP?
T4 ¿Existe diferencia en resultados entre los tratamientos intermitentes y continuos para la IP?
T5 ¿Existen diferencias en cuanto al régimen más apropiado de administración de antibióticos entre pacientes tratados con DP continua ambulatoria (DPCA) y DP automatizada?
T6 ¿Cuál debe ser la duración del tratamiento en una IP? ¿Cuándo se debe prolongar?
T7 ¿Cuándo está indicado administrar una asociación antibiótica para el tratamiento de una IP?
T8 ¿Cuál es el tratamiento más apropiado para las IP por diferentes tipos de bacterias en DP?
T9 ¿Cuál es el tratamiento antibiótico más apropiado en la IP por hongos en DP?
T10 ¿Está indicada la retirada de catéter peritoneal en la IP por micobacterias en DP?
T11 ¿Cuál debe ser el tratamiento de una IP de curso atípico?
T12 ¿Cuál es el tratamiento de una IP asociada a infección simultánea del túnel/orificio de salida del catéter peritoneal por el mismo germen?
T13 ¿Cuánto tiempo debe transcurrir entre la retirada de un catéter peritoneal por IP y la implantación de un nuevo catéter? ¿Es factible la retirada e implantación simultánea, en este contexto?
Desarrollo de la guíaPreámbuloLas IP constituyen la complicación más conocida de la DP y han representado durante décadas el principal obstáculo para su desarrollo. Actualmente, siguen siendo una fuente de preocupación en las unidades de DP por su frecuencia todavía indeseablemente alta, a lo que se suman:
- –
Desde el punto de vista clínico, aumentan la morbilidad y pueden ocasionar el abandono de la técnica de diálisis2,30–35, e incluso el fallecimiento de los pacientes5,36,37. Cada episodio de IP asocia un incremento en el riesgo de muerte en los meses siguientes38,39, y la sucesión de infecciones puede desencadenar fallo de membrana y/o esclerosis peritoneal.
- –
Desde el punto de vista económico, el tratamiento y las complicaciones de las IP suponen un coste añadido importante para los sistemas de salud.
- –
Por último, el temor a las IP es uno de los factores que influyen en el rechazo de algunos pacientes a la DP.
Alcanzar tasas muy reducidas de IP en un programa de DP es posible si se valoran correctamente los factores de riesgo (tabla D1) y características del paciente (tabla D2), y se aplican las guías de prevención y terapéutica. Respecto a estas últimas, hay que destacar que la prevención, diagnóstico precoz y tratamiento de las infecciones son objetivos primarios en los protocolos actuales de entrenamiento y seguimiento de los pacientes en DP11,24,40,41.
Factores de riesgo generales para infección peritoneal*
| No modificables | Edad avanzada |
| Sexo femenino | |
| Raza | |
| Diabetes | |
| Enfermedad abdominal (diverticulosis, enfermedad inflamatoria intestinal, colelitiasis) | |
| Inmunosupresión | |
| Trasplante renal previo | |
| Hemodiálisis previa | |
| Función renal residual escasa/ausente | |
| Bajo nivel socioeconómico | |
| Modificables | Tabaquismo |
| Mascotas y animales domésticos | |
| Lejanía de Unidad de Diálisis | |
| No educación prediálisis | |
| Inicio no programado | |
| Selección negativa de DP | |
| Hepatitis C | |
| Obesidad | |
| Depresión | |
| Malnutrición | |
| Hipocalemia | |
| Niveles bajos de vitamina D | |
| Tratamiento con inhibidores de la secreción ácida gástrica | |
| Estado de portador de Staphylococcus aureus | |
| Procedimientos médicos invasivos |
No se incluyen los asociados con el propio procedimiento de diálisis peritoneal.
DP: diálisis peritoneal.
Modificado de Cho et al.45.
Factores relacionados con las condiciones del paciente que pueden favorecer un menor riesgo de infección peritoneal
| Elección libre e informada de la técnica de diálisis peritoneal |
| Motivación para el autocuidado |
| Capacidad de aprendizaje (el paciente entiende y retiene) |
| Destreza y fuerza manual |
| Buena capacidad visual |
| Autonomía (no dependencia de cuidadores) |
| Buen entorno sociofamiliar |
| Disponibilidad de una zona limpia para realizar los intercambios |
| Disponibilidad para almacenar material |
Las últimas tres décadas han contemplado una disminución progresiva en la incidencia de IP en DP42. Sin embargo, solo los centros del entorno Anzdata han mantenido un descenso acentuado en la incidencia en los últimos años, lo que se atribuye a la aplicación sistemática de estrategias integrales y estructuradas43 de prevención y mejora continua en la calidad5,44–46.
Las principales razones a las que se atribuye el descenso en las tasas de infección se reflejan en la tabla D3. Algunas de ellas (las mejoras en conectología) han tenido un impacto incuestionable47–49, mientras que la relevancia de otras, como la introducción de las soluciones bajas en productos de degradación de la glucosa, y parcial o totalmente tamponadas con bicarbonato (en adelante biocompatibles) es más controvertida50-52.
rincipales factores que pueden haber contribuido al descenso en la incidencia de infección peritoneal
| Mejoras en la selección de pacientes para diálisis peritoneal |
| Identificación y actuación sobre factores de riesgo modificables |
| Sistematización de los protocolos de entrenamiento |
| Mejoras en la monitorización (visitas domiciliarias, reentrenamientos) |
| Avances en conectología |
| Soluciones biocompatibles |
| Manejo de portadores de Staphylococcus aureus |
| Mejoras en las técnicas de inserción del catéter peritoneal |
| Mejoras en los cuidados del catéter peritoneal |
| Tratamiento profiláctico en situaciones de riesgo |
| Estrategias integrales de prevención (mejora continua en la calidad) |
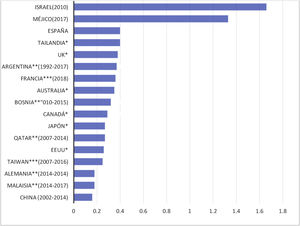
A nivel internacional, existe una amplia variabilidad en las incidencias medias de IP (figura D1) Esta variabilidad se aprecia también internamente en los registros nacionales. Así, el registro USRDS reporta tasas tan bajas como 0,06 episodios por paciente y año en algunos centros, vs. 0,77 en otros. En la actualidad, no es infrecuente observar centros con tasas de infección menores de 0,2 episodios por paciente y año. Algunas de estas diferencias pueden explicarse por los distintos criterios de inclusión de pacientes en DP, o diversas formas de cuantificar la incidencia de IP. La ISPD considera inadecuadas tasas superiores a 0,5 episodios por paciente y año14.
A nivel español, también hay una importante variabilidad, pero la mayoría de los centros presenta tasas aceptables, según los estándares vigentes2.
Cuantificación de la incidenciaDada la gran variabilidad en la epidemiología de las IP, la ISPD recomienda que cada programa de DP registre, al menos anualmente, su tasa global de IP, del número de pacientes libres de infección, de la tasa de infección según los agentes causantes y de la susceptibilidad antimicrobiana de los gérmenes más habituales.
Para una comparación eficaz entre registros se debe cuantificar y monitorizar las IP de la misma forma en todos los centros53. Se han descrito distintas fórmulas o métodos de cuantificación, pero una mayoría de expertos recomienda expresar las tasas de infección en forma de episodios/paciente-año. Los parámetros más utilizados para el control y registro de IP en un programa de DP se describen en la tabla D4.
Métodos de cuantificación de la incidencia de infección peritoneal
| Parametro | Fórmula | Estándar | Desventajas |
|---|---|---|---|
| Tasa de incidencia | Numerador: n.° de episodios de peritonitis registradosDenominador: sumatorio de tiempo de exposición a riesgo de todos los pacientes (en años) | < 0,5 | No refleja la variabilidad entre pacientes y asume una distribución homogénea de las peritonitis en el intervalo de tiempo evaluado |
| Tasa específica por paciente | Numerador: n.° de episodios de peritonitis en un paciente concretoDenominador: sumatorio de tiempo de exposición a riesgo de ese paciente (en años) | — | No aplicable si el seguimiento es muy corto o menor que el intervalo de tiempo estudiado |
| Meses entre episodios | Numerador: Sumatorio de meses de exposición a riesgo de todos los paciente (en meses)Denominador: n.° de episodios de peritonitis registrados | > 24 meses | |
| Porcentaje de pacientes libres de infección | Numerador: n.° de pacientes que han sufrido algún episodio de peritonitis × 100Denominador: total de pacientes en programa de DP expuestos en el período a analizar | > 85% | |
| Tasa infección por germen determinado | Numerador: n.° de episodios de peritonitis causados por el germen evaluadoDenominador: sumatorio de tiempo de exposición a riesgo de todos los pacientes (en años) | ECN < 0,03Staphylococcus aureus < 0,03 | |
| Porcentaje de infección por germen determinado | Numerador: n.° de episodios de peritonitis causados por el germen evaluado x 100 Denominador: n.° total de episodios de peritonitis | Grampositivos: 60-70%,Gramnegativos: 10-30%Hongos: < 5% | |
| Porcentaje de infecciones con cultivo negativo | Numerador: n.° de infecciones con cultivo negativo × 100Denominador: n.° total de infecciones | Aceptable < 15%Ideal < 10% | |
| Porcentaje de curación | Numerador: n.° episodios curados × 100Denominador: n.° total de episodios de peritonitis | > 80% |
ECN: estafilococos coagulasa negativos.
Además, existen criterios adicionales que deben ser respetados, por razones de estandarización:
- 1.
Es criterio dominante (pero no unánime) de este comité que el periodo de riesgo debe empezar a contabilizarse desde el inicio del entrenamiento.
- 2.
El periodo de riesgo debe finalizar en el momento del trasplante renal, transferencia permanente a hemodiálisis o defunción.
- 3.
En caso de transferencia temporal a hemodiálisis, el periodo de tratamiento con esta técnica no debe ser contabilizado.
- 4.
Las infecciones repetidas o recurrentes, pero no las recaídas, deben contabilizarse como nuevos episodios.
La IP se define por la invasión de la cavidad peritoneal (incluyendo la membrana peritoneal, tejidos adyacentes y el propio dializado) por agentes infecciosos, y la respuesta inflamatoria consiguiente, que es la que habitualmente hace visible el problema y conduce al diagnóstico.
Es posible la presencia de microorganismos en el espacio peritoneal sin respuesta clínica evidente. Esta circunstancia puede responder, teóricamente, a un estado de colonización no invasiva, a una fase de remisión clínica (pero no bacteriológica) de una infección tratada, o a la incapacidad del paciente para desarrollar una respuesta inflamatoria. La contaminación de la muestra es una posibilidad siempre presente, en estos casos.
De forma estandarizada y ratificada por las guías más recientes14 el diagnóstico de IP en DP requiere la presencia de al menos dos de los siguientes criterios:
- 1.
Presencia de signos y/o síntomas clínicos de inflamación peritoneal, incluyendo dolor abdominal, signo de rebote positivo, náuseas, vómitos, diarrea o fiebre.
- 2.
Presencia de drenado peritoneal turbio, con la condición de que la turbidez sea debida a un recuento elevado de leucocitos en el dializado, estandarizado a un mínimo de 100 por mL y > 50% de polimorfonucleares. Sin embargo, estos límites deben ser individualizados. Así:
- –
En ocasiones, el dolor precede en algunas horas a la respuesta celular en el efluente.
- –
En el caso de muestras obtenidas tras permanencias cortas, la presencia de > 50% de polimorfonucleares ya es un signo de IP, aunque el recuento total de leucocitos no supere los 100 por mL.
- –
En algunas infecciones concretas (sobre todo por micobacterias)54 o en pacientes ya tratados con antibióticos en el momento de diagnosticarse la infección, la respuesta leucocitaria observada puede ser predominantemente monocitaria.
El estudio de la celularidad peritoneal es de gran ayuda en el proceso diagnóstico de la IP y, junto con otros rasgos clínicos o bioquímicos, facilita el diagnóstico diferencial en presencia de un drenado peritoneal turbio (tabla D5).
- 3.
Confirmación microbiológica: visualización de microorganismos mediante tinción Gram directa, su aislamiento mediante cultivo de dializado o su detección mediante otros métodos validados (p. ej., detección de ácido nucleico microbiano por reacción en cadena de la polimerasa [PCR]).
Diagnóstico diferencial de un efluente peritoneal turbio
| Plazo de aparición | Intensidad del dolor | Aspecto del efluente | Celularidad | Clavesdiagnósticas | |
|---|---|---|---|---|---|
| Infección peritoneal | Variable (incluye DP inactiva) | +/++++ | Turbio | 100/ > 25.000 leucocitos/mL> 50% polimorfonucleares | CultivoCelularidadDiagnóstico por defecto |
| Peritonitis eosinófila | Precoz | 0/+ | Turbidez leve(a menudo intermitente) | < 500 leucocitos/mL> 10% eosinófilos< 50% polimorfonucleares | PlazoCelularidad |
| Peritonitis asociada a icodextrina | Variable | 0/++ | Turbidez leve a moderadaA veces intermitente | 100-1.000 leucocitos/mLMonocitosis | IcodextrinaCurso en brotesCelularidad |
| Quiloperitoneo | Variable | 0 | LechosoTurbio si leve | << 100 leucocitos/mL | AspectoTriglicéridos en efluenteEstudio de sobrenadante |
| Hemoperitoneo | VariableRecurrente | 0/++ | HemáticoTurbio si leve | Hematíes< 100 leucocitos/mL | Celularidad |
| Efluente rico en fibrina | Variable | 0 | TurbioFormación de trombos tras reposo | << 100 leucocitos/mL | Reposo de la bolsaCelularidad |
| Neoplasia | VariablePrecoz | 0 | Turbidez leve | VariableAtipias | Celularidad (citología) |
| Peritonitis química | Variable | 0/++++ | Turbio | 100/ > 10.000 leucocitos/mLpolimorfonucleares variables | Agente lesivo |
| Peritoneo vacío | Variable | 0 | Turbidez leve | 100-200 leucocitos/mL Monocitos | Inicio DPDPI nocturnaCelularidad |
| Pigmentos | Variable | 0 | Claro coloreado | << 100 leucocitos/mL | IctericiaMedicación |
En un porcentaje reducido de pacientes, la IP se puede manifestar inicialmente con dolor abdominal, pero con efluente claro. En estos casos es conveniente repetir los intercambios con una permanencia mínima de dos horas, vigilando el aspecto del dializado. En caso de duda o sospecha siempre debe iniciarse el estudio diagnóstico.
Nomenclatura de las infecciones peritonealesExiste una serie de definiciones específicas que categorizan, de manera estandarizada, algunas IP, de acuerdo con su contexto de aparición y evolución clínica. Se recogen en la tabla D6.
Nomenclatura básica de las infecciones peritoneales
| Infección repetida o reincidente | Episodio que aparece después de cuatro semanas tras completar el tratamiento de un anterior episodio provocado por el mismo germen |
| Recaída o recidiva | Episodio que aparece antes de cuatro semanas tras completar el tratamiento de un anterior episodio provocado por el mismo germen (o cultivo negativo) |
| Infección recurrente* o nueva infección peritoneal | Episodio que aparece antes de cuatro semanas tras completar el tratamiento de un anterior episodio provocado por un germen distinto |
| Infección de resolución lenta | Episodio que muestra clara tendencia a mejoría clínica y citológica (con cultivos de control negativos), pero mantiene signos de actividad tras cinco días de tratamiento antibiótico apropiado |
| Infección refractaria | Episodio que no muestra signos de resolución tras cinco días de tratamiento antibiótico apropiado |
| Infección entérica | Episodio en el que se demuestre un foco infeccioso gastrointestinal o hepatobiliar subyacenteEpisodio con aislamiento de al menos dos microorganismos entéricos (enterobacterias, enterococos y/o anaerobios intestinales)Episodio con aislamiento de un microorganismo anaerobio intestinal(Se discute si el aislamiento de un solo germen entérico establece per se el mismo diagnóstico) |
| Infección catéter-dependiente | Episodio que coincide con infección del orificio de salida o infección del túnel provocada por el mismo microorganismo |
Se mantiene al estar avalado por las guías ISPD, aunque en castellano recurrente es sinónimo de repetido.
Adaptado de Li et al.14.
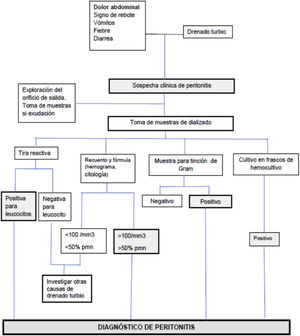
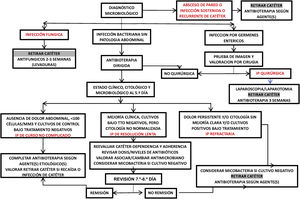
El proceso diagnóstico de la IP (figura D2) comienza habitualmente tras consultar el paciente por alguna de sus manifestaciones cardinales (dolor abdominal y/o aparición de efluente turbio).
Los objetivos iniciales ante una probable IP son:
- 1.
Establecer el diagnóstico.
- 2.
Recabar información que oriente a su etiopatogenia (vía de contaminación y probable tipo de microorganismo causal).
- 3.
Detectar factores agravantes.
- 4.
Valorar el estado clínico del paciente.
La aplicación del método clínico es el instrumento más apropiado para iniciar la valoración:
- –
Anamnesis que recabe antecedentes remotos o recientes de interés: edad, comorbilidad, procesos abdominales padecidos, infecciones previas (peritoneales o relacionadas con el catéter), antibioterapia reciente.
- –
Antecedentes inmediatos del evento, mediante entrevista no inculpatoria: manifestaciones premonitorias, quiebras de la técnica, posibles procedimientos bacteriémicos, etc.
- –
Exploración física general, con especial atención a los signos de afectación del estado general (sepsis), irritación peritoneal e infección asociada al catéter.
- –
Inspección de la bolsa. El paciente con sospecha de IP suele acudir al centro con el abdomen lleno, bien de dializado fresco (introducido en el abdomen tras detectar el drenado turbio), o tras permanencia variable, cuando la clínica abdominal los ha llevado consultar sin realizar el intercambio. En el primer supuesto, conviene analizar tanto la bolsa que trae de domicilio con dializado turbio como del dializado que se drenará ya en el centro. La doble muestra aumenta la posibilidad de un diagnóstico rápido y permite ver la evolución inicial.
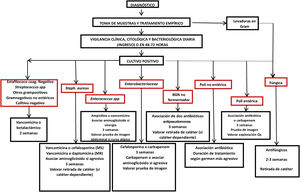
La correcta obtención y procesado de las muestras es esencial para conseguir una alta tasa de resultados positivos:14,55.
Obtención/recogida- -
Se extraerá con técnica aséptica suficiente cantidad de dializado (> 50 mL).
- -
La muestra se transportará en contenedor estéril y sin conservante.
- -
Una parte de la muestra extraída se inoculará en frascos de hemocultivo (5-10 mL/bote aerobio y anaerobio). Se reservará un tubo para tinción de Gram directa de la muestra.
- -
En tanto las muestras no son remitidas al laboratorio deberán conservarse a menos de 4°C (excepto los frascos de hemocultivo, que se conservarán a temperatura ambiente).
- -
Siempre que sea posible, las muestras deben ser procesadas en un plazo inferior a seis horas. Un retraso superior a 12 h puede reducir la fiabilidad del resultado.
- -
Desde el punto de vista práctico, varios estudios han demostrado que la inoculación directa de muestra del dializado en frascos de hemocultivo simplifica el procedimiento y consigue una elevada tasa de resultados en un tiempo corto.
- -
En centros con tasas altas de cultivo negativo se pueden mejorar los resultados centrifugando el efluente y cultivando el sedimento resultante, tanto en medios sólidos como inoculados en frascos de hemocultivo.
Si los cultivos son negativos después de tres a cinco días usando frascos de hemocultivo, pero la clínica es altamente sugestiva de IP, se deben hacer subcultivos en placas de agar incubadas a 37°C en atmósfera con 5-10% de CO2 y en atmósfera anaerobia, durante tres a cuatro días adicionales, con el fin de identificar microorganismos de crecimiento difícil.
AnálisisLas muestras de efluente peritoneal se procesan en dos sentidos (figura D2):
– Estudio de celularidad-recuento de leucocitos: El análisis de recuento de leucocitos en dializado requiere que la muestra haya tenido una permanencia mínima de 2 h14. No existe evidencia de que la obtención de muestras tras permanencias muy largas dé lugar a sobrediagnóstico, pero es conveniente individualizar la interpretación de la celularidad de muestras obtenidas de peritoneos vacíos o con volúmenes muy bajos. Un recuento bajo de leucocitos en presencia de turbidez marcada sugiere la presencia asociada de fibrina, otras proteínas, linfa o hemoperitoneo (tabla D5).
La fórmula leucocitaria es de utilidad en situaciones en las que las condiciones de recogida del dializado son subóptimas: por escasa permanencia, o por usar una muestra diluida. En estos supuestos, la presencia de > 50% de polimorfonucleares apoya el diagnóstico. Un recuento relativo de eosinófilos superior al 10% establece el diagnóstico de peritonitis eosinofílica. Se pueden observar esporádicamente grados leves-moderados de eosinofilia en IP56, sobre todo en infecciones fúngicas o por parásitos, así como en relación con irritantes químicos (vancomicina), o con el uso de icodextrina. Sin embargo, la presencia de eosinofilia marcada no sugiere un origen infeccioso del cuadro.
Las tiras reactivas habitualmente utilizadas para el análisis de orina pueden ser de ayuda para el diagnóstico precoz de IP57. Estas tiras detectan la presencia de leucocitos, aunque en términos cualitativos y sin permitir un recuento diferencial, con una sensibilidad cercana al 100%, una especificidad del 95-97% y un valor predictivo positivo aproximadamente del 95%. Entre sus ventajas, destacan su inmediatez y bajo coste. El estudio del sedimento del efluente peritoneal mediante hemograma automático modificado goza de mucha aceptación, ya que es fiable, rápido y barato. La citología convencional (tinciones Giemsa y Papanicolau) es aún más fiable, y permite categorizar cuadros atípicos (neoplasias), pero su coste económico es alto, y solo procede bajo indicación específica.
- Estudio bacteriológico. El estudio de una muestra de dializado con tinción de Gram es muy recomendable, pese a su baja sensibilidad (que puede aumentarse si se re-suspende el sedimento obtenido tras centrifugación de la muestra original) porque resulta muy orientativa si es positiva14. En particular, la presencia de levaduras suele ser fácil de detectar, con este método58.
El cultivo microbiológico identifica al microorganismo causante y orienta sobre la opción terapéutica más adecuada.
Métodos diagnósticos complementarios en infección peritonealPruebas de imagen: las técnicas de imagen aportan poco en la evaluación de las IP en DP, y en la mayoría de los casos, no es necesario realizarlas para confirmar el diagnóstico. Sin embargo, pueden ser necesarias cuando se sospecha un proceso intraabdominal subyacente. Las circunstancias más habituales son:
- -
Identificación de flora mixta, bien al inicio del proceso diagnóstico (tinción de Gram), bien por aislamiento en cultivo en los días sucesivos.
- -
Presentación clínica agresiva, especialmente en presencia de signos de sepsis. La intensidad del dolor es, en general, menos fiable, al ser una manifestación subjetiva. Algunas infecciones de curso banal pueden presentarse inicialmente con dolor intenso59.
- -
Presencia de signos de localización a la exploración física.
- -
Antecedentes clínicos que sugieran una alta probabilidad de origen secundario de la infección (colecistitis aguda reciente).
Pruebas de laboratorio: La tabla D7 muestra los principales métodos complementarios propuestos para mejorar la eficacia diagnóstica de la IP60–67. De todos ellos, la detección de micobacterias por PCR en efluente peritoneal es el único que ha sido consagrado por la práctica clínica.
Otros procedimientos para el diagnóstico de infección peritoneal
| Prueba diagnóstica | Utilidad | Referencia |
|---|---|---|
| Detección de fragmentos de ADN microbiano | Predictor de recaída | 60 |
| Secuenciación de ARN ribosómico | Permite detectar presencia de gérmenes ocultos adicionales al aislamiento principal | 61 |
| Detección por técnicas PCR | Complemento a cultivos microbiológicos. Micobacterias | 62 |
| Cociente dializado/plasma (D/P) de óxido nítrico | Gravedad de la infección y respuesta al tratamiento | 63 |
| Determinación de niveles MMP-9 | Equivalente de leucocitosis peritoneal | 64 |
| Huellas inmunes (Immune fingerprints) | Identificación precoz del patógeno causal | 65 |
| Determinación de adipoquinas en efluente peritoneal | Diagnóstico de peritonitis | 66 |
| Determinación de endotoxinas | Infección de curso atípico | 67 |
MMP: metaloproteinasa de la matriz; PCR: reacción en cadena de la polimerasa.
Se deben seguir los criterios generales en DP. Sin embargo, los pacientes en DPA presentan circunstancias particulares que pueden dificultar un diagnóstico precoz:
- -
Los intercambios nocturnos frecuentes, con permanencias cortas, generan un efecto de lavado peritoneal que puede atenuar la expresión clínica, reducir el recuento de células en el dializado y diluir la concentración de microorganismos. Por el contrario, la larga permanencia del intercambio diurno puede generar recuentos relativamente elevados de células que pueden suscitar dudas, aunque, en este caso, el predominio de monocitos ayuda a excluir la presencia de IP.
- -
Puede haber un retraso en el diagnóstico ya que, en algunos casos, no se observa la turbidez del drenado hasta la mañana siguiente.
- -
El tipo de contenedor del dializado drenado puede interferir también en el diagnóstico. Las cicladoras suelen drenar el efluente directamente al sistema de aguas residuales, o bien a bidones colectores, en cuyo interior es difícil valorar el aspecto del drenado (además, los restos de detergentes usados para su limpieza pueden provocar turbidez sin causa infecciosa). En caso de sospecha, las bolsas colectoras transparentes (diseñadas a ese efecto) son las que mejor facilitan la observación del dializado.
Se mantiene el principio general de conveniencia de tomar las muestras de dializado tras una permanencia mínima de dos horas, siempre que sea posible. Sin embargo, el paciente en DPA plantea varios escenarios posibles:
- –
El paciente presenta manifestaciones clínicas de sospecha al inicio de la sesión nocturna. En este caso conviene recoger una muestra del efluente del cambio largo en la bolsa de recogida de muestras correspondiente, que el paciente trasladará a su centro para su procesamiento. Si los indicios de infección son claros, el paciente puede optar por acudir directamente a su centro.
- –
Si las manifestaciones clínicas aparecen durante el procedimiento, lo más habitual es completar la sesión y acudir al centro una vez finalizada, para confirmar la sospecha diagnóstica, tomar muestras e iniciar el manejo. Si la clínica de comienzo es agresiva, es conveniente interrumpir la sesión y acudir directamente al centro de referencia.
- –
Si aparecen manifestaciones durante el periodo diurno, el paciente debe realizar un intercambio manual y, si se confirma la turbidez, acudir con la bolsa drenada a su centro. Si el paciente no ha sido entrenado para efectuar cambios manuales, debe acudir directamente a su centro.
Una vez diagnosticada la IP e iniciado el tratamiento, es fundamental monitorizar evolutivamente el curso de la infección. Si el paciente no ingresa, se debe programar una revisión clínica, preferentemente presencial, 48-72 horas después del inicio del episodio, y revisiones ulteriores con la misma frecuencia hasta que haya constancia clara de mejoría clínica. Estas revisiones deben incluir estudios de celularidad. Mientras que todo el panel de expertos considera necesario tomar cultivos de control en presencia de una mala evolución clínica, la decisión sobre esta medida en IP que evolucionan sin incidencias suscita división (el 50% no lo considera necesario vs. un 41% que sí), por lo que esta guía no emite recomendación al respecto. El seguimiento y valoración de las pruebas diagnósticas permite la detección y abordaje específico de las infecciones de naturaleza o curso atípico (tabla D6).
Si al quinto día de tratamiento específico no se aprecia una respuesta favorable deberá repetirse el cultivo del dializado, ampliando la búsqueda a gérmenes poco habituales. La tasa de IP no resueltas o complicadas es muy elevada en aquellos casos en los que el recuento de células sigue elevado tras cinco días de tratamiento (IP de resolución lenta o refractaria).
Es conveniente revisar periódicamente los resultados de los cultivos basales y de seguimiento, ya que puede haber crecimientos tardíos (anaerobios, levaduras, hongos filamentosos) y se pueden generar enmascaramientos (la erradicación de un microorganismo puede desvelar un segundo germen subyacente).
Conclusiones relativas al diagnóstico y terminología de las infecciones peritoneales (no graduadas)- 1.
Se debe sospechar IP en presencia de dolor abdominal y/o efluente peritoneal turbio. El diagnóstico se ha de confirmar mediante estudio citológico y microbiológico del efluente.
- 2.
La presencia de una concentración anormalmente elevada de leucocitos (> 100/mL) con presencia dominante de polimorfonucleares (> 50%) en el efluente es altamente sugestiva de IP.
- 3.
El diagnóstico de IP se debe individualizar en relación con las circunstancias clínicas, partiendo de los criterios descritos en los apartados anteriores.
- 4.
Una valoración inicial cuidadosa, con una correcta recogida y manejo de muestras, es fundamental para asegurar el éxito en el manejo de la IP.
- 5.
Es muy recomendable realizar un análisis microbiológico sistemático del efluente mediante tinción de Gram, dentro del proceso diagnóstico inicial de la IP.
- 6.
Cada centro debe disponer de información evolutiva y actualizada de sus tasas de IP, globales y por agentes causales, utilizando estimadores estandarizados, al menos con periodicidad anual.
- 7.
Los parámetros monitorizados deben incluir, idealmente, la tasa global de IP, las tasas de IP por microorganismos específicos, el porcentaje de pacientes/año que permanecen libres de IP, y las resistencias antimicrobianas de los gérmenes causales.
- 8.
La mejor forma de comunicar las tasas de IP es en forma de número de episodios por paciente y año.
- 9.
Se deben aplicar criterios diagnósticos similares de IP en pacientes tratados con DP manual o automatizada.
- 10.
Es esencial monitorizar la IP de manera sistemática, mediante controles clínicos, citológicos y microbiológicos, hasta que haya signos claros de una evolución favorable.
La prevención de las IP es un objetivo fundamental en DP, dado su gran impacto clínico, que afecta a la supervivencia de los pacientes y de la técnica, la calidad de vida, el coste económico y la propia imagen de la técnica. A lo largo de los últimos 40 años se han propuesto gran cantidad de medidas orientadas a la prevención de estas infecciones. Para analizar estas medidas desde una perspectiva actualizada, puede ser de utilidad clasificarlas en función del impacto que tienen en las principales vías reconocidas de contaminación que culminan en IP:
- –
Por contacto (vía intraluminal).
- –
Relacionadas con el catéter (vías intra y periluminal).
- –
Por vía hematógena (bacteriémica).
- –
Por contigüidad (vías entérica, biliar y ginecológica).
Así, podemos establecer los siguientes tipos de medidas de prevención, que iremos analizando en los siguientes apartados:
- 1.
Medidas de impacto múltiple o general:
- a.
Adherencia a las recomendaciones de las guías de práctica clínica.
- b.
Estrategias estructuradas de prevención.
- c.
Entrenamiento de pacientes.
- d.
Manejo de portadores.
- 2.
Medidas orientadas a prevenir la infección asociada a catéter (IAC):
- a.
Diseño de catéteres.
- b.
Técnica de inserción y manejo inmediato.
- c.
Cuidados del orificio de salida.
- 3.
Medidas de prevención de la contaminación por contacto:
- a.
Conectología.
- b.
Técnicas automatizadas.
- 4.
Mejora de los mecanismos de defensa antiinfecciosa peritoneal.
- 5.
Situaciones especiales y prevención secundaria.
La conveniencia de una adherencia estricta a las recomendaciones de esta u otras guías de práctica clínica frente a la IP es discutible, debido a la escasez de evidencia concluyente que responda a la mayoría de las cuestiones planteadas. Muchas recomendaciones emanan de la opinión (aunque sea colegiada y fundamentada) de grupos de expertos, tan falibles como cualquier otro grupo de expertos que se pueda constituir. Puede resultar difícil convencer a un equipo con amplia experiencia en DP de que siga recomendaciones de profesionales no más experimentados que ellos y que responden a las cuestiones bajo premisas clínicas y sociosanitarias que pueden ser diferentes a las de ese entorno en particular. Además, no existen evidencias de que un estricto seguimiento de todas y cada una de las recomendaciones de las guías mejore los resultados del programa, aunque sí hay indicios claros, procedentes sobre todo del entorno Anzdata44,68, de que actuaciones estructuradas basadas en los principios recogidos en las guías ayudan a mejorar el control de las IP, y existen iniciativas orientadas a confirmar estos indicios69.
En conjunto, este comité expresa las siguientes opiniones (no graduadas):
- 1.
Cualquier guía clínica de prevención de la IP con criterios de calidad (dirigida por grupos de expertos reconocidos y con metodología estandarizada) proporcionará orientación útil para la prevención y manejo de la IP.
- 2.
La fuerza de las recomendaciones emana de la calidad de la evidencia, pero también de la consistencia en los resultados de estudios previos sobre el tema. En general, las recomendaciones basadas en evidencia de calidad y/o recomendación fuerte deben ser atendidas.
- 3.
Las sugerencias, más basadas en opinión que en evidencia, deben ser atendidas por los centros que no tengan experiencia clara en la cuestión, mientras que los grupos experimentados deben tener más libertad para adaptarse a sus circunstancias particulares.
- 4.
El máximo beneficio de las guías de práctica clínica se espera de su seguimiento global, más que de la adherencia a recomendaciones concretas.
En los últimos años ha habido un interés creciente en la aplicación de estrategias de mejora continua en la calidad a la práctica sanitaria, y la DP no ha sido una excepción43,70,71. Estas estrategias implican una aproximación global y continua a los problemas (los resultados generales de un programa de DP, en nuestro caso), identificando y corrigiendo los puntos débiles, para así poder detectar y corregir las debilidades del sistema. Ese proceso debe seguir una serie de pasos que incluyen: la correcta definición de objetivos, el diseño de protocolos claros y concisos, la adaptación a los recursos disponibles y, de manera fundamental, la monitorización de resultados71. En el caso concreto de las IP, cualquier iniciativa de mejora dependería críticamente de un conocimiento detallado y actualizado de la incidencia de esta complicación. La ISPD recomienda monitorizar los eventos de manera estandarizada e iterativa o continua11. Este enfoque permite comparar cíclicamente los resultados e identificar prácticas eficaces de prevención para una mejora continua en los resultados.
La guía ISPD 2016 trata de manera limitada el efecto de las estrategias de mejora continua en la calidad sobre la incidencia de IP en DP14. La causa aparente es la escasez de estudios al respecto, que eran además de carácter observacional y no controlado, y con un riesgo evidente de sesgo de publicación. Aun así, los estudios coinciden en detectar disminuciones muy significativas en las tasas de IP72,73. Otros estudios, con un diseño prospectivo y más ortodoxo han ratificado estos resultados70,74.
Desde la publicación de la guía ISPD 201614, se ha aportado escasa evidencia adicional. En un documento de iniciativa Anzdata68 se analizan las medidas potenciales para reducir de manera consistente la incidencia de IP en DP, con un enfoque de mejora continua en la calidad. En particular, el documento destaca la conveniencia de:
- 1.
Facilitar el conocimiento de los malos resultados cuando se produzcan en comparación con otras unidades,
- 2.
Identificar las variaciones innecesarias de las buenas prácticas actualizadas, y
- 3.
Adaptar las guías de práctica clínica para mejorar las áreas con malos resultados.
Además, se recomienda que sociedades científicas, de pacientes y las instituciones públicas colaboren para:
- 1.
Definir y establecer indicadores de funcionamiento y resultados de las unidades de DP.
- 2.
Establecer auditorias periódicas.
- 3.
Comparar resultados y prácticas entre unidades para adoptar y difundir las mejores.
- 4.
Favorecer la existencia de registros, y que estos incluyan datos que reflejen el grado de calidad en la atención de las unidades de DP.
- 5.
Establecer unos estándares profesionales mínimos.
- 6.
Favorecer programas de formación, especialmente para residentes y para las enfermeras de DP.
- 7.
Identificar los déficits de evidencia en la práctica clínica y emprender iniciativas para resolverlos.
Makhija et al.75 han publicado recientemente un análisis de los beneficios económicos aportados por un programa de mejora continua en la calidad, obtenidos esencialmente a través de la reducción en las tasas de IP. Sus estimaciones, basadas en datos reales, incluyeron un retorno de la inversión del 169% (coste de llevar adelante el programa menos ahorro de gasto por la disminución en número de eventos). El proceso de mejora continua en la calidad incluyó como medidas principales mejorar la tasa enfermera/paciente, protocolos de cuidado del orificio de salida, guías estandarizadas para el entrenamiento del paciente, formación continuada y certificación de las enfermeras de DP, apoyo y visitas domiciliarias y monitorización de los resultados, con acciones correctivas cuando fueran necesarias. Este estudio muestra la necesidad de que la organización y las autoridades sanitarias estén motivadas para invertir económicamente en las acciones de mejora43.
Otro estudio, también procedente de Colombia76, ha analizado la incidencia de IP precoz (primeros 90 días) en una estructura nacional (3.525 pacientes procedentes de 49 unidades), en la que se ha organizado la atención en torno a prácticas muy estandarizadas y basadas en la evidencia. El estudio mostró tasas de infección muy aceptables (0,23 episodios por paciente y año), que los autores atribuyen a las estrategias integrales y estandarizadas de prevención. El diseño retrospectivo, la ausencia de unos objetivos previos bien definidos y la falta de grupo control restan significado a las conclusiones del estudio.
Esta cuestión ha sido abordada de manera sucinta por la guía ISPD 201614. En esencia, las recomendaciones se basan en una evidencia escasa y de baja calidad, así como en documentos de análisis de la estrategia. Con posterioridad a la guía ISPD 2016 no ha surgido evidencia adicional de calidad, aunque sí análisis de coste-eficiencia de cierto interés sanitario75.
De la evidencia a la recomendación
Este comité apoya las recomendaciones reflejadas en la guía ISPD 201614.
Recomendaciones
Recomendamos que cada Unidad de DP desarrolle un programa de MCC para reducir la tasa de IP (1C).
Sugerimos que los equipos multidisciplinares responsables del programa de MCC tengan reuniones periódicas de análisis de resultados (2C).
La guía ISPD 2016 se remite a otras guías de la misma Organización11,77 y, sobre todo, a una actualización del mismo año 201624 para extraer sus recomendaciones relativas al papel del entrenamiento y la monitorización de pacientes en DP. Aunque estas recomendaciones son generales, la prevención de infecciones sigue siendo el objetivo principal de estas actuaciones. Las recomendaciones más importantes se refieren a:
- –
La conveniencia de que el entrenamiento y la monitorización los lleven a cabo personal de enfermería formado tanto en el campo de la DP como de la educación a pacientes.
- –
La necesidad de protocolos estandarizados de entrenamiento, bien enfocados a sus objetivos (en este caso, prevención de infecciones). Estos protocolos están, en la práctica, muy centrados en la prevención de las IP asociadas a IAC y a contaminaciones por contacto.
- –
La importancia de comprobar las habilidades adquiridas por el paciente durante el proceso de entrenamiento.
- –
La conveniencia de que el personal que entrena efectúe, al menos, una visita al domicilio del paciente. Este tipo de actividad permite detectar situaciones de riesgo, inconsistencias y roturas de protocolo no apreciables en el centro, y se considera de utilidad, a pesar de que la evidencia de sus beneficios en términos de reducción de la tasa de IP es débil78. La capacidad de la televisita para sustituir a la visita presencial, cuando esta no es factible, no ha sido establecida.
- –
La utilidad del reentrenamiento de los pacientes para corregir errores, desviaciones del protocolo y problemas de adherencia. Dependiendo en parte de los recursos disponibles, algunos centros solo actúan en circunstancias concretas (hospitalización prolongada, IAC o IP, cambios en las condiciones físicas del paciente, cambios de suministrador o interrupción de DP por tiempo prolongado)14, mientras que otros centros se decantan por reentrenamientos periódicos programados. Nuevamente, la evidencia disponible sobre los beneficios de esta medida en relación con el riesgo de IP era débil en el momento de emitir la guía79,80.
Uno de los aspectos más interesantes es el impacto de la experiencia de los educadores y el tiempo dedicado al entrenamiento de los pacientes. Un estudio retrospectivo del grupo multicéntrico BRAZPD 81 analizó el entrenamiento de 2.243 pacientes, y demostró que dedicar al entrenamiento de los pacientes más de una hora diaria y más de 15 horas en total se asociaba con menor riesgo de IP. Similar beneficio se observaba en los centros con mayor experiencia en pacientes tratados, y si se inicia el entrenamiento antes incluso de la inserción del catéter. Por el contrario, el número de personas entrenadas (incluyendo cuidadores) no influía en el riesgo observado. En la misma línea, la experiencia del grupo PDOPPS5 sugiere un beneficio significativo al prolongar el entrenamiento más de seis días. Una encuesta del Registro Francés sobre 5.017 pacientes de 127 unidades82 mostró que los centros con personal de enfermería dedicado a la DP y la realización de visitas domiciliarias antes del inicio de diálisis asociaba tasas más bajas de IP, mientras que la actividad de la unidad no tenía efecto aparente. Curiosamente, otra encuesta posterior del mismo registro83 sobre 1.035 pacientes de 94 unidades sí mostró que las unidades con mayor experiencia (más de 10 pacientes prevalentes) tienen menor incidencia de IP, y también que basarse para el entrenamiento solo en textos escritos o, por el contrario, exclusivamente en la práctica del intercambio, asocia mayor riesgo de infección.
En un ensayo controlado84 no se observó beneficio global del reentrenamiento más frecuente sobre el riesgo de IP, aunque sí se objetivó una marcada reducción del riesgo en pacientes ancianos.
Un ensayo más reciente procedente de China85 aleatorizó 150 pacientes a reentrenamiento con inspección directa del personal, reentrenamiento por encuesta oral o no reentrenamiento. El grupo bajo inspección directa evidenció tasas más bajas de IP (0,13 episodios/paciente/año) que cualquiera de los otros dos (0,19 y 0,17 episodios/paciente/año, respectivamente) (p < 0,005).
Un tercer ensayo86, multicéntrico y más potenciado, aleatorizó a 671 pacientes a reentrenamientos periódicos (en cada visita programada, en caso de IP o tras interrupción de DP por más de seis semanas), que incluían tests prácticos, o control sin reentrenamiento. El riesgo de IP no fue distinto en ambos grupos
Existen iniciativas orientadas a establecer qué prácticas de entrenamiento son más eficaces, buscando protocolos unificados87–89.
Esta cuestión es abordada de manera sucinta por la guía ISPD 201614, que remite a otras guías de la misma organización11,24,77. Las recomendaciones emitidas se basan, con pocas excepciones, en opinión. Con posterioridad, han surgido varios estudios destacables. Los estudios observacionales, la mayoría de registros, sugieren mayoritaria, pero no unánimemente, que la experiencia adquirida (estimada mediante el número de pacientes tratados) y el tiempo dedicado al entrenamiento tienen efecto positivo sobre el riesgo ulterior de IP5,81,83, que el personal de enfermería especializado consigue mejores resultados82 y que la visita domiciliaria antes de iniciar el tratamiento aporta beneficios similares82. Por otra parte, los resultados de ensayos aleatorizados han sido decepcionantes respecto a la eficacia del reentrenamiento para reducir las tasas de IP84,86, aunque un ensayo reciente83 ha mostrado beneficio si este se lleva a cabo bajo inspección directa.
De la evidencia a la recomendación
La evidencia reciente no permite modificar los puntos de vista vigentes para la ISPD14,24, que este comité apoya.
Recomendaciones
Recomendamos adoptar los principios de entrenamiento y monitorización de los pacientes propuestos por los documentos de la ISPD para reducir las tasas de IP (1C).
Recomendamos que el personal de enfermería que realiza las tareas de entrenamiento y monitorización de los pacientes sea especializado (1C).
Sugerimos que las visitas al domicilio del paciente, a ser posible iniciadas antes de comenzar el tratamiento con DP, pueden ayudar a reducir el riesgo de IP (2C).
Sugerimos que el reentrenamiento por indicación podría ayudar a reducir la incidencia de IP en situaciones de riesgo (2C).
Con base en la evidencia disponible, este comité no avala los reentrenamientos programados para reducir la incidencia de IP (2B).
La prevalencia del estado de portador nasal de S. aureus en la población general es variable, pero se puede estimar que en torno al 20% son portadores persistentes, un 30% son portadores intermitentes, y un 50% son resistentes a la colonización por esta bacteria89. El porcentaje es, probablemente, similar entre los pacientes en DP90–92. Se sabe desde los primeros estudios publicados sobre el tema93,94 que la eficacia de la aplicación de mupirocina intranasal para la prevención de IP por S. aureus es menos consistente que la observada para la aplicación en el orificio de salida del catéter (ver después). Dos recientes metaanálisis95,96 han mostrado que esta medida específica no disminuye el riesgo de IP. No obstante, asumiendo la suposición de que una reducción en la incidencia de IAC debe asociar una disminución del riesgo de IP, los beneficios de esta estrategia en pacientes en hemodiálisis97, y la escasez y potencia limitada de los estudios en DP no permiten descartar un efecto beneficioso de esta medida. La guía ISPD 201725 sugiere que la mupirocina intranasal se aplique a los portadores nasales de esta bacteria, aunque con el objetivo de prevenir la IAC.
Prevención de la infección peritoneal asociada a infección del catéter peritonealLas IAC constituyen una complicación relevante de la DP25, y se asocian con un riesgo significativo de IP98,99. Esta relación puede ser de naturaleza patogénica (cuando la IAC progresa hacia la cavidad peritoneal a través de la luz o por vía pericatéter), o bien representar un estado general de predisposición a las infecciones (en pacientes frágiles, con mala adherencia a la técnica, o portadores de S. aureus). La prevención de las IAC ha sido objeto de un reciente documento de la ISPD25, y su revisión va más allá de los objetivos de la presente guía. Partiendo del principio de que cualquier medida que reduzca el riesgo de IAC proporcionará, en mayor o menor grado, protección frente a la IP, en este capítulo nos centraremos en el papel potencial de algunas medidas específicas de prevención de la IP relacionadas con la inserción y cuidados del catéter.
Medidas relacionadas con el diseño y la inserción del catéter peritonealAún en ausencia de evidencia directa al respecto, parece razonable asumir que una correcta inserción y cuidados precoces del catéter peritoneal reducirán el riesgo ulterior de IAC y, por tanto, de IP. Es conveniente seleccionar cuidadosamente las zonas de inserción y salida cutánea del catéter (evitando pliegues o zonas de roce), preparar el campo quirúrgico de acuerdo con principios quirúrgicos generales, y respetar medidas de asepsia durante la inserción. Se han ideado estrategias alternativas para pacientes en los que la inserción en zonas convencionales supone un problema (obesidad extrema, estomas); estas estrategias hacen viable la DP, pero los beneficios en términos de prevención de infecciones son poco alentadores100.
La forma de construcción del orificio cutáneo del catéter es otra cuestión de relevancia potencial. El orificio debe ser relativamente ajustado al propio catéter, y situarse al menos a 1 cm (preferiblemente a 2-4 cm) del dacrón superficial (en catéteres de dos manguitos). Algunas experiencias101 han llevado a sugerir que orientar hacia abajo la salida del catéter y evitar los puntos de sutura cercanos al orificio reduce el riesgo de IAC y de IP secundaria11,25, pero la evidencia al respecto es poco concluyente102,103.
Diseño del catéterLa guía ISPD 2016 no emite ninguna recomendación específica en relación al impacto del tipo de catéter sobre el riesgo de IP14. Ni la morfología interna (recto vs. cola de cerdo), ni la intraparietal (recto vs. cuello de cisne), ni el número de anillas de dacrón (una o dos) tienen influencia aparente sobre esta complicación. Cabe destacar que para esta cuestión existe un número significativo de ensayos aleatorizados (referenciados en la guía14).
Tras la publicación de la guía han surgido algunas publicaciones de interés. En un ensayo clínico, Sánchez Canel et al. aleatorizaron a 78 pacientes a dos tipos de catéteres con una anilla de dacron, uno de ellos recto simple y otro autoposicionante104 sin que se observase diferencia en el riesgo de IP. Los ensayos aleatorizados de Ouyang et al.105, Banin et al.106, y Chow et al.107 con catéteres de porción intraperitoneal recta o en cola de cerdo no observaron diferencias en el riesgo de IP, aunque la primera infección se detectó más precozmente en los pacientes con catéter recto (media 6,5 meses) que cola de cerdo (11,7 meses) (p = 0,007) en el estudio de Ouyang105. Los estudios recientes avalan, pues, la información previa, aunque hay que destacar que en todos ellos el riesgo de IP era una variable resultado secundaria, y que la mayoría ni siquiera detallan los resultados sobre ese aspecto.
Técnica de inserción del catéter peritonealLa guía ISPD 2016 dedica un espacio limitado a la influencia de la técnica de inserción del catéter sobre el riesgo ulterior de IP. Aunque la evidencia disponible hasta el momento era de calidad razonable, los resultados poco concluyentes impedían emitir recomendación alguna respecto a las posibles ventajas de la inserción laparoscópica vs. abierta, el abordaje medial vs. paramedial, la inserción preesternal vs. abdominal o el enterramiento del catéter por el método Moncrief108 respecto al manejo convencional14,109.
Con posterioridad a la guía 2016, se han publicado varias revisiones sistemáticas y metaanálisis110–114 dirigidos principalmente a aclarar las posibles ventajas de la inserción laparoscópica del catéter frente a la realizada por punción o por técnica abierta (minilaparotomía). En general, no han mostrado diferencias, en términos de riesgo de IP. El análisis más extenso y completo quizá sea el realizado por Htay et al.113 Este estudio no mostró diferencias en el riesgo de IP en relación con la técnica de inserción (laparoscópica vs. abierta), el enterramiento del catéter o la zona de inserción (medial vs. paramedial).
Profilaxis antibiótica previa o simultánea a la inserción del catéter peritonealLa guía ISPD 2016 destaca los beneficios de la profilaxis antibiótica para la inserción del catéter peritoneal, en términos de riesgo de IP14. Se basa para ello en un cuerpo significativo de estudios que, con alguna excepción115 muestra que diferentes pautas de profilaxis antibiótica son superiores a no tratamiento116–118. El uso de profilaxis antibiótica fue posteriormente refrendado por una revisión sistemática de 2004, que mostró su beneficio sobre el riesgo de IP, pero no de IAC119,120. Respecto a la comparación entre diferentes pautas, un ensayo aleatorizado mostró superioridad de vancomicina sobre cefazolina118, aunque esta última se sigue utilizando con frecuencia.
Desde la publicación de la guía ISPD 2016 han surgido escasas evidencias adicionales sobre la cuestión. En un ensayo clínico, Velioglu et al.121 compararon cefuroxima oral (500 mg cada 12 h comenzando preinserción y continuando durante tres días) e intravenosa (dosis única de 750 mg preinserción). La tasa acumulada de infección a las dos semanas fue de 9,0 y 8,1%, respectivamente (p = 0,578). El estudio incluyó un análisis de costes, algo mayor para la vía intravenosa, pero asequible en ambas ramas. Una reciente revisión actualizada sobre prevención de infecciones en DP122 no ha aportado evidencia adicional, en lo relativo a profilaxis pre o perioperatoria. Los resultados del estudio prospectivo PDOPPS5 han confirmado que los centros que administran profilaxis antibiótica para la inserción del catéter presentan una menor incidencia de IP (riesgo relativo 0,83, IC 95% 0,69-0,99).
Esta cuestión ha sido adecuadamente abordada por la Guía ISPD 201614, basándose en estudios aleatorizados que, a pesar de sus resultados negativos, aportan un grado suficiente de evidencia, apoyado por varias revisiones sistemáticas y metaanálisis110–114 posteriores. Ensayos aleatorizados recientes han venido a proporcionar información confirmatoria, sobre todo en cuando a la comparación entre catéteres con distintos diseños de la porción intraperitoneal104–107.
De la evidencia a la recomendación
Este comité apoya las conclusiones reflejadas en la guía ISPD 201614.
Recomendaciones
Recomendamos administrar profilaxis con antibióticos sistémicos inmediatamente antes de la inserción del catéter peritoneal (1A).
Sugerimos que cada programa de DP elija su propia pauta de profilaxis antibiótica, teniendo en cuenta el espectro de incidencia y sensibilidad antibiótica local (2D).
Sugerimos que vancomicina puede ser una opción preferente, pero una cefalosporina de primera o segunda generación puede aportar resultados equivalentes (2B).
Recomendamos que el riesgo de IP no sea una consideración a la hora de determinar qué técnica de inserción o qué diseño de catéter peritoneal se va a utilizar en un paciente en DP (1A).
El riesgo de IAC y, secundariamente, de IP, puede depender también de los cuidados posteriores a la inserción, tanto a corto como a largo plazo.
Cuidados del orificio de salidaLa guía ISPD no dedica espacio a esta cuestión, más allá de una recomendación genérica de higiene meticulosa. Este tema ha sido abordado posteriormente y mucho más en profundidad por la guía ISPD sobre prevención de IAC25. Esta última guía emite como única recomendación al respecto que la cura del orificio se ha de hacer al menos dos veces por semana, y siempre que el paciente se duche. Esta recomendación no está apoyada por evidencia controlada. En opinión de una amplia mayoría del panel de expertos de esta guía (81%), la cura diaria debe ser la norma. Otras opciones consideradas, pero no objeto de recomendación específica por falta de evidencia, incluyen25 la adecuada inmovilización del catéter para reducir los traumatismos por tracción, los ciclos cortos de antibioterapia local o sistémica para orificios traumatizados y el uso de dispositivos de aislamiento (específicos o simples bolsas de colostomía) para los pacientes que practican la natación123. Tampoco está bien definido el tipo de cura más apropiado para el orificio cutáneo del catéter, incluyendo sistemas de cobertura genéricos o específicos para DP, sin que exista evidencia que demuestre superioridad de algún modelo específico. Se desconoce el impacto que cualquiera de estas medidas pueda tener sobre el riesgo de IP. Tiene interés un ensayo aleatorizado reciente124 que ha comparado la conveniencia de una cura con o sin apósito del orificio cutáneo, en un entorno de baja incidencia de infección. La tasa de IP fue similar en ambos grupos, pero, notablemente, el grupo de cura descubierta mostró plazos más prolongados al primer episodio de IP (250 días) que el de cura cerrada (98 días) (p = 0,03). Hay que destacar que el estudio se realizó en un entorno de clima cálido y húmedo, no totalmente extrapolable al español. Un estudio retrospectivo con nivel bajo de evidencia125 mostró tasas de IP hasta nueve veces más altas tras cura cerrada que descubierta del orificio del catéter peritoneal.
No está claramente establecido el efecto de permitir una adecuada tunelización del catéter tras su inserción. Ya hemos comentado que el enterramiento del catéter por técnica de Moncrief108 no parece reducir el riesgo ulterior de IP. Un ensayo aleatorizado reciente126 comparó la incidencia de complicaciones mecánicas e infecciosas según se inicie DP una, dos o cuatro semanas tras la inserción del catéter peritoneal. El estudio, con potencia estadística limitada, no detectó diferencias en la tasa de IP.
Uso de desinfectantes y antibióticos profilácticosTanto la guía ISPD 2016 de IP14 como la de 2017 de infección de catéter25 dedican amplio espacio a esta cuestión. Los aspectos más destacables, bastante coincidentes en ambas guías, son:
- –
No hay evidencia que apoye la superioridad de alguno de los diferentes desinfectantes usados para la cura rutinaria del catéter peritoneal (agua oxigenada, suero salino hipertónico, jabones o antisépticos), en lo que respecta al riesgo de IAC o, secundariamente, de IP48.
- –
El uso de mupirocina en la cura del orificio reduce el riesgo de infección de catéter y, seguramente, de IP por S. aureus. Aunque poco ortodoxa, esta estrategia está apoyada por importante evidencia, incluyendo ensayos aleatorizados y metaanálisis95. La reducción del riesgo de IP por este microorganismo ronda el 70%, siendo del 41% para la tasa general de IP127. Sin embargo, no se ha podido establecer todavía el régimen óptimo de administración, aunque existen datos que sugieren que la administración intermitente favorece más la emergencia de resistencias.
- –
No se emite recomendación específica para los pacientes en DP colonizados por S. aureus resistentes a meticilina, debido a la escasez de información sobre el tema128. Aunque un metaanálisis129 mostró una prevalencia relativamente baja en estos pacientes (1,3% vs. 7,1% en hemodiálisis, p = 0,01), no se pudo analizar la asociación de esta condición con el riesgo de IP. La relación entre resistencia a meticilina y a mupirocina es poco consistente91.
- –
La crema de gentamicina aplicada al orificio de salida puede ser una alternativa a la mupirocina, con mayor eficacia potencial para prevenir IAC e IP por gérmenes gramnegativos92, aunque no ha demostrado superioridad en otros estudios130, y la emergencia de resistencias es una amenaza potencial mayor que en el caso de la mupirocina91,131.
- –
Otras opciones de cuidados tópicos, como ciprofloxacino132, aceite de árbol del té, miel antibacteriana133 o asociaciones antibióticas134 no han mostrado superioridad, y sí algunos inconvenientes, al compararlas con las mencionadas anteriormente. Tampoco estrategias más antiguas, como la rifampicina oral, parecen tener lugar en los protocolos actuales. Un ensayo aleatorizado más reciente resaltó la utilidad de la polihexamida en este contexto, aunque el grupo control fue tratado con suero salino y povidona yodada135.
Se hace hincapié, sobre bases de sentido común, en la importancia de tratar precozmente las IAC, como medio de impedir su progresión a IP.
No se ha generado evidencia relevante con posterioridad a la publicación de las guías ISPD. Cabe reseñar algunos metaanálisis confirmatorios95,96 y un ensayo aleatorizado que ha mostrado que alternar mupirocina y gentamicina asocia mayores tasas de IP por gérmenes gramnegativos y hongos que monoterapia con gentamicina136. Por otra parte, un metaanálisis137 ha confirmado la impresión preexistente de que el riesgo de IP es similar tras cura local del orificio del catéter con gentamicina o mupirocina (riesgo relativo 1,03, IC 95% 0,72-1,47).
Este comité asume las recomendaciones ISPD, aunque desea hacer algunas consideraciones adicionales:
- –
Consideramos que la vigilancia y cura diaria del orificio cutáneo del catéter es una opción más recomendable que establecer un mínimo de dos veces por semana, ya que permite una vigilancia más estrecha y unas curas de mayor calidad. La higiene de base diaria debe ser recomendada a todos los pacientes.
- –
Aunque el sentido común sugiera la conveniencia de identificar a los portadores nasales y pericatéter de S. aureus y tratar solo a estos pacientes con mupirocina, no existe evidencia de que esta estrategia sea superior a la de tratamiento directo a todos los pacientes, tanto en términos de prevención de infecciones como de desarrollo de resistencias. Hay que recalcar que la recolonización precoz o tardía, es la norma tras el tratamiento de portadores93,138. Además, la identificación mediante frotis periódicos de los portadores genera un importante gasto económico, que puede reducir el coste-eficiencia de la terapia. Sometida esta cuestión al panel de expertos, se hizo patente la falta de un criterio unificado al respecto, aunque la práctica mayoritaria del grupo (57%) es la de monitorizar las recolonizaciones como guía para indicar el tratamiento.
- –
Consideramos que, si se dispone de los medios adecuados, es conveniente monitorizar la sensibilidad de las cepas de S. aureus a mupirocina. Sin embargo, hay que resaltar que la llamada resistencia de bajo grado, mucho más frecuente, no suele asociar riesgos clínicos, y no es predictora de resistencia de alto grado (que sí tiene repercusión clínica), ya que surge por distintos mecanismos patogénicos91.
Esta cuestión es abordada de manera sucinta por la Guía ISPD 201614, por lo que es conveniente tomar como referencia la guía 201725 de prevención de infección de catéter. No obstante, las recomendaciones o comentarios de ambas guías están mayoritariamente apoyadas en opinión (cura de orificio al menos dos veces por semana, inmovilización del catéter, los ciclos cortos de antibioterapia local o sistémica para orificios traumatizados, uso de dispositivos de aislamiento para los pacientes que practican la natación), mientras que algunas cuestiones relevantes (cura abierta vs. descubierta, tipo de antiséptico/desinfectante más apropiado, conveniencia de permitir un plazo de tunelización del catéter tras la inserción antes de usarlo) no pueden ser contestadas por la escasez o baja calidad de la evidencia disponible. Tampoco hay evidencia posterior a las guías citadas, ya que el único ensayo relevante que compara cura abierta y descubierta124 se realizó en un entorno muy diferente al español.
El uso de antibacterianos tópicos sobre el orificio cutáneo del catéter para la prevención de la IP se trata en la pregunta estructurada 5.
De la evidencia a la recomendación
Este comité apoya las conclusiones reflejadas en las guías ISPD 201614 y 201725, con algunos matices esencialmente basados en opinión.
Recomendaciones
Recomendamos la vigilancia y cura regular del orificio cutáneo del catéter peritoneal, a ser posible con periodicidad diaria, como forma indirecta de prevenir la IP (1C).
Recomendamos el tratamiento precoz de las IAC, para prevenir su progresión a IP (1C).
Sugerimos la conveniencia de usar dispositivos de inmovilización que eviten las tracciones repetidas sobre el catéter peritoneal, al menos durante la fase de cicatrización postimplantación (2C).
Sugerimos que cada centro decida el tipo de jabón o antiséptico tópico para la cura del orificio del catéter de acuerdo con las condiciones de cada paciente (2C).
Sugerimos que cada centro decida el tipo de cura o apósito del orificio del catéter (descubierta o cerrada), con respecto a las condiciones de cada paciente, al no haber evidencia que apoye un tipo específico de forma general para prevenir la IAC y la IP (2C).
Esta cuestión es abordada de manera extensa por las guías ISPD 2016 de IP14 y 201725 de prevención de infección de catéter. La evidencia disponible apoya el uso de antibacterianos tópicos para la prevención de infecciones en DP. El beneficio es más evidente para la IAC, pero se extiende a las IP. La mupirocina es el antibacteriano de referencia, aunque la gentamicina muestra probablemente eficacia similar, y puede ofrecer ventajas en centros con alta incidencia de infecciones por gérmenes gramnegativos. Destaca la escasez de información que aclare la conveniencia o no de diagnosticar a los portadores de S. aureus, así como de qué regímenes de tratamiento (solo pericatéter o también nasal, administración continua vs. intermitente) son más apropiados. Desde la publicación de las guías ISPD ha surgido poca información adicional, aunque sí algunos metaanálisis confirmatorios. Un estudio aleatorizado136 sugiere que la estrategia de alternar mupirocina y gentamicina puede ser contraproducente.
De la evidencia a la recomendación
Este comité avala las recomendaciones ISPD, con algún matiz.
Recomendaciones
Recomendamos la administración de mupirocina o gentamicina tópicas durante el proceso de cuidados del orificio cutáneo del catéter peritoneal, como forma de reducir el riesgo de IAC e IP (1B).
Sugerimos la conveniencia de monitorizar periódicamente la posible emergencia de resistencias bacterianas a mupirocina o gentamicina entre la flora bacteriana (sobre todo S. aureus) que coloniza las fosas nasales y el área pericatéter (2B).
Este comité no emite recomendación sobre la conveniencia de la administración diaria vs. intermitente de los citados antibacterianos (no graduado).
Este comité considera que la evidencia no sustenta el tratamiento de portadores nasales de S. aureus para reducir el riesgo directo de IP, aunque puede ser beneficioso a través de la reducción del riesgo de IAC (2B).
La guía ISPD 2016 no dedica gran espacio a los detalles de la asepsia durante el intercambio peritoneal, remitiendo a documentos previos sobre el tema11. Existe un acuerdo general entre los profesionales de la DP sobre la conveniencia de una higiene adecuada de manos durante el intercambio. También se admite que esta medida es a menudo descuidada progresivamente por los pacientes, lo que constituye un estímulo para los programas de visita domiciliaria y reentrenamiento78,85,86. Aunque los distintos componentes de una adecuada higiene de manos para el intercambio han sido revisados en profundidad139, existe muy poca información controlada sobre cuál es el impacto específico de diferentes factores (momento y duración de la higiene, tipo de jabón más apropiado, forma de secado de manos, papel de los antisépticos o uso de guantes, entre otros) sobre el riesgo de IP. Algunos puntos a recordar incluyen:
- –
La duración del lavado debe ser de al menos 15 segundos140,141, que algunos grupos extienden a un mínimo de 30 segundos.
- –
La posibilidad de contaminación y transmisión aumenta cuando las manos se dejan mojadas142, y se ha mostrado en pacientes de DP que las manos mojadas contienen hasta cien veces más bacterias que las secadas con una toalla de tela durante 15 segundos143,144. El método de secado ideal (con toalla de tela, papel o aire caliente) no ha sido establecido. Cuando se usa una toalla, el secado debe durar idealmente unos 15 segundos, que se extienden a 45 segundos si se usa aire caliente.
- –
Mantener los anillos durante el lavado reduce su eficacia de manera significativa145.
- –
Tanto las uñas nativas largas145 como las artificiales146 disminuyen la eficacia del lavado, por lo que se deben evitar, en lo posible.
- –
Los jabones habituales no contienen agentes antimicrobianos. Pueden eliminar la suciedad, pero diversos estudios muestran que el recuento bacteriano residual es sustancial147.
- –
Existen diferentes tipos de jabones antibacterianos. Algunos de ellos (como los basados en triclosán) asocian tasas significativas de resistencias bacterianas139.
- –
Es muy recomendable el uso de desinfectantes alcohólicos (basados habitualmente en etanol, isopropanol o n-propanol) tras el lavado de manos. Estos agentes muestran actividad antimicrobiana contra bacterias grampositivas y gramnegativas, incluyendo S. aureus resistente a meticilina. Varios estudios han mostrado que los geles y soluciones basados en compuestos hidroalcohólicos mejoran los resultados del lavado con agua y jabón148–151. En pacientes en DP se ha indicado que la secuencia de frotarse las manos con etanol al 70% tras lavado con jabón es más eficaz que cada medida por separado151. Aunque la desinfección con compuestos hidroalcohólicos constituye una alternativa adecuada en casos en los que el paciente no dispone de elementos para el lavado de manos, es opinión mayoritaria del panel de expertos (64%) que el uso de estos compuestos debe seguir, idealmente, a un correcto lavado de manos152.
- –
El uso de guantes estériles constituye un recurso en pacientes con problemas de cualquier tipo que tengan dificultades para una correcta desinfección de las manos (incluyendo polialergias o enfermedades cutáneas), pero los resultados de esta alternativa no han sido establecidos
No existe información sobre cómo influyen las condiciones de la zona de intercambio sobre el riesgo de peritonitis. Convencionalmente, se considera óptima una habitación de uso exclusivo, limpia, bien ventilada e iluminada, y con acceso a agua corriente. Sin embargo, muchos pacientes efectúan los cambios en sus dormitorios u otras estancias compartidas, sin que haya evidencia de que esta circunstancia aumente el riesgo de infección.
La guía ISPD 2016 señala que el uso de mascarilla durante el intercambio es opcional14. Esta decisión se debe a que la evidencia sobre el tema es escasa, débil y contradictoria153,154. Una cuestión relacionada es la del efecto de la salud dental y periodontal sobre el riesgo de IP. Los pacientes en diálisis muestran tasas de enfermedad periodontal superiores a la población general, y esta complicación se ha asociado con la presencia de marcadores inflamatorios sistémicos155. Un estudio retrospectivo sobre 75 pacientes en DP156 ha mostrado que los que mantenían mejores estándares de higiene oral presentaban tasas significativamente más bajas de IP.
Las mascotas representan una reconocida fuente potencial de IP157–161, con alta morbimortalidad, de acuerdo a los resultados de algunos estudios157. Una revisión reciente159 sugiere varias vías posibles de contaminación: que la mascota juegue o repose sobre la cicladora, y contamine; que muerda el catéter o que contamine las manos y orofaringe del paciente. Parece razonable establecer barreras que impidan el acceso de animales al entorno en que se realizan los intercambios, así como extremar las medidas de higiene por parte del paciente.
Esta cuestión es abordada de manera sucinta por la guía ISPD 201614, que remite a otros documentos ISPD11. En general, la evidencia que permita emitir recomendaciones firmes brilla por su ausencia. Tampoco han aparecido recientemente estudios que aporten información novedosa.
De la evidencia a la recomendación
La evidencia reciente no permite modificar los puntos de vista vigentes para la ISPD11,14, salvo algún ligero matiz.
Recomendaciones
Recomendamos que la técnica de DP se realice siempre en un entorno higiénico, a ser posible con acceso cercano a una fuente de agua corriente (1C).
Recomendamos una correcta higiene de manos antes de la realización de la técnica de DP, basada en lavado de manos con jabón común o antibacteriano, seguido por fricción con solución hidroalcohólica (1C).
Recomendamos impedir el contacto físico de mascotas con los materiales de DP, y que el paciente extreme las medidas de asepsia y desinfección, si tiene contacto con mascotas (1C).
Este comité sugiere la conveniencia del uso de mascarilla para el intercambio, sobre todo en pacientes con mala salud dental y periodontal (2C).
La guía ISPD 2016 recomienda los sistemas de doble bolsa («flush before fill») como método más apropiado de conexión para los intercambios de DP. Esta técnica está avalada por la práctica de tres décadas y por metaanálisis concluyentes47–49. La evidencia que soporta el uso de sistemas con doble bolsa sobre sistemas en Y con doble conexión no es tan concluyente, pero probablemente sí sea suficiente. Esta última comparación es poco relevante en nuestro país, al estar en desuso los sistemas de doble conexión.
Desde el 2016 no se ha generado nueva información que modifique lo expuesto en el párrafo anterior. Se ha presentado algún dispositivo que vuelve a la idea de la desinfección por rayos UV Mu161, pero sin evidencia que apoye sus resultados. Por otra parte, un reciente ensayo aleatorizado162, comparó los resultados de un régimen de DP incremental (tres cambios) con uno convencional de cuatro cambios en 139 pacientes incidentes en DP. El menor número de conexiones asoció una tendencia no significativa a un menor riesgo de IP.
Esta cuestión es una de las pocas que suscita unanimidad casi total entre los profesionales de DP. La guía ISPD 201614 proporciona una respuesta clara, que no ha sido modificada por evidencia posterior.
De la evidencia a la recomendación
La evidencia reciente no permite modificar los puntos de vista vigentes para la ISPD14.
Recomendaciones
Recomendamos los sistemas de desconexión y purgado antes de llenado como método preferente de conexión en DP (1A).
Sugerimos que los sistemas con doble bolsa incorporada son preferibles a los sistemas en Y con doble conexión (en desuso en nuestro país) (2B).
El menor número y mayor concentración temporal de las conexiones generó en su momento un notable interés en la posibilidad de que las técnicas de DPA asociaran tasas de IP inferiores a las de la DP manual. Los primeros estudios aleatorizados parecían confirmar esta impresión163. Sin embargo, ya en la primera década de este siglo, los grandes estudios observacionales de registro han mostrado tasas similares en ambas modalidades164–166. Esta percepción lleva a la guía ISPD 2016 a no considerar la indicación de DPA para reducir el riesgo de IP14. El motivo de la discordancia con estudios más antiguos podría relacionarse con diferencias relativas a los sistemas de conexión (uso de conectores de rosca vs. pinchos, uso de sistemas en Y en DP manual, etc.).
Con posterioridad a la guía 2016, se ha publicado un nuevo estudio observacional del grupo de trabajo BrazPD167, que mostró, una vez más, riesgo similar en DP manual y automatizada.
Los únicos estudios aleatorizados son antiguos y con bajo nivel de evidencia163. La guía ISPD 2016 se apoya en los resultados de diferentes estudios de registro que, por otra parte, son bastante coincidentes. Con posterioridad, un nuevo estudio multicéntrico167 ha ratificado la aparente ausencia de efecto de la modalidad de DP sobre el riesgo de IP, siempre que se comparen sistemas de conexión similares.
De la evidencia a la recomendación
La evidencia reciente no permite modificar los puntos de vista vigentes para la ISPD14.
Recomendaciones
Recomendamos que la prevención de IP no se incluya entre las indicaciones para tratamiento con DPA (1B).
Las llamadas soluciones biocompatibles se han impuesto en la última década, con base en sus beneficios, reales o supuestos, sobre la preservación de la membrana peritoneal, la función renal residual y los mecanismos de defensa peritoneal. Respecto a esta última cuestión, existe un número significativo de ensayos clínicos, con resultados contradictorios51,168–176. Con base en ello, y en metaanálisis que muestran resultados equívocos y una considerable heterogeneidad50,52,177, la guía ISPD 2016 no pudo recomendar estas soluciones como instrumento de prevención de IP en DP14.
Desde la publicación de la guía ISPD 2016, un nuevo ensayo clínico aleatorizó 78 pacientes prevalentes en DP a soluciones biocompatibles o clásicas (tamponadas con lactato), con un seguimiento de dos años178. La tasa de peritonitis fue más baja en el grupo con solución biocompatible. Un metaanálisis reciente (que no incluye el estudio de Farhat)179 confirmó esencialmente la imposibilidad de emitir una recomendación firme sobre la cuestión.
La guía ISPD 2016 no publica valoraciones sobre el efecto de la carga peritoneal de glucosa o de la icodextrina sobre la incidencia de IP. Un reciente análisis del ensayo BalANZ180 no mostró correlación alguna entre la carga peritoneal de glucosa (categorizada por mediana), y el riesgo de infección, tipo de microorganismo aislado o evolución clínica. En lo que se refiere a la icodextrina, disponemos de información de metaanálisis179,181, que no muestran ninguna relación aparente con el riesgo de IP.
A pesar de un número significativo de estudios aleatorizados, completados por metaanálisis50,52,179, la evidencia para responder a esta pregunta es contradictoria. Esto se debe, en gran parte, a una gran heterogeneidad en los estudios, muchos de los cuales tienen poca potencia estadística y seguimiento insuficiente de los pacientes. El ensayo de Farhat et al.178 apoya la causa de un efecto beneficioso de las soluciones biocompatibles, pero carece del nivel de evidencia necesario para modificar la percepción general.
De la evidencia a la recomendación
Este comité está de acuerdo con la opinión manifestada por la guía ISPD 201614.
Recomendaciones
Sugerimos que el uso soluciones biocompatibles no tiene un efecto contrastado sobre el riesgo de IP (2A).
Se desconoce con qué frecuencia se producen las roturas de la línea de asepsia en el curso del tratamiento con DP, pero, dado el alto número de conexiones que un paciente realiza cada año, es de suponer que no son raras. Un estudio previo proporcionó una serie de directrices (opiniones no graduadas) para abordar estas situaciones, incluyendo40:
- –
El paciente debe ser educado durante el entrenamiento sobre los riesgos potenciales de no adoptar medidas de protección tras una contaminación, incluyendo la de comunicar inmediatamente el evento al centro de referencia.
- –
Toma de cultivos de efluente peritoneal (optativa).
- –
Cobertura profiláctica para gérmenes grampositivos y gramnegativos.
- –
Si se produce algún aislamiento, tratar como IP, incluso en presencia de efluente claro, pero no contabilizar, al no haber respuesta inflamatoria. Si el aislamiento es de un microorganismo habitual de la piel, conviene tomar una muestra de confirmación antes de iniciar la antibioterapia.
- –
Si la contaminación por contacto (incluyendo contacto directo o detección de rotura en la bolsa) no fue seguida de infusión, puede ser suficiente cambiar la línea de transferencia.
- –
Si hay cualquier grado de duda sobre si se produjo infusión, asumir que sí se produjo.
Un estudio retrospectivo a lo largo de 15 años182 recopiló 548 episodios de contaminación. Cuando esta solo asociaba contactos inapropiados, con el sistema de transferencia cerrado y sin infusión de dializado (contaminación «seca»), no se registraban episodios de IP, mientras que el 5,6% de las llamadas contaminaciones «húmedas» fueron seguidas de infección. Notablemente, la administración de profilaxis antibiótica redujo de manera muy importante el riesgo de infección (hasta un 0,5%). Aunque el diseño de este estudio le confiere un bajo nivel de evidencia, apoya directamente lo planteado por Bender et al.40
Desde la publicación de la guía ISPD 2016 no ha surgido información controlada sobre el tema, aunque la nomenclatura sobre contaminación accidental («húmeda» vs. «seca») parece haber sido aceptada183. Tampoco hay información disponible sobre el tipo de antibióticos, vía de administración y duración de la profilaxis, en estos casos.
La actitud a adoptar ante una contaminación accidental no ha sido analizada por estudios con suficiente nivel de evidencia. La recomendación se circunscribe al sentido común y a un análisis retrospectivo y no controlado, aunque con resultados claros, que endosa la profilaxis para situaciones de contaminación húmeda182.
De la evidencia a la recomendación
Este comité está de acuerdo con la opinión manifestada por la guía ISPD 201614. Aunque su percepción es de conveniencia de cobertura antibiótica tras una contaminación húmeda, considera que el nivel de evidencia es insuficiente para emitir una recomendación.
Recomendaciones
Recomendamos que los pacientes sean específicamente instruidos durante el entrenamiento para DP sobre la actitud a adoptar en caso de producirse una rotura accidental en la línea de asepsia (1C).
Sugerimos que una contaminación húmeda o de naturaleza incierta se maneje con cambio en la línea de conexión y cobertura antibiótica, por vía oral o parenteral (intravenosa o intraperitoneal), que cubra gérmenes grampositivos y gramnegativos, y durante un mínimo de dos días (2C).
Sugerimos que una contaminación seca se maneje, al menos, con cambio de la línea de conexión (2D).
Los procedimientos invasivos digestivos (incluyendo endoscopias digestivas y procedimientos sobre la vía biliar) y ginecológicos manipulan áreas relacionadas a la cavidad peritoneal por lo que tienen la calidad potencial de focos de contaminación e IP. Aunque la información disponible es escasa y con bajo nivel de evidencia, la guía ISPD 2016 recoge algunos aspectos que ayudan a establecer unos criterios de actuación14:
- –
Los procedimientos biliares, digestivos bajos y ginecológicos asocian un riesgo definido, pero no cuantificado, de IP secundaria.
- –
La administración de profilaxis antibiótica podría tener la capacidad de reducir el riesgo de IP, en este contexto184,185.
- –
Por el contrario, los procedimientos endoscópicos digestivos altos no complicados no parecen asociar riesgo de IP185.
- –
No existe evidencia en relación con el riesgo específico de IP tras instrumentaciones urológicas, aunque en una mayoría de centros se administra profilaxis antibiótica con base en el riesgo potencial de bacteriemia. No hay evidencia que apoye la administración de profilaxis antibiótica rutinaria en caso de sondaje vesical.
- –
No se ha establecido el régimen antibiótico óptimo para la profilaxis, aunque parece lógico que la cobertura incluya enterobacterias y anaerobios intestinales. La cobertura de levaduras no parece indicada por sistema, pero se puede considerar en contextos de riesgo.
- –
Tampoco hay evidencia que sustente la práctica de algunos centros de vaciar la cavidad peritoneal para el procedimiento.
Desde la publicación de la guía 2016 han surgido algunas evidencias de interés. Un ensayo aleatorizado no mostró beneficio aparente de la profilaxis antibiótica con ceftazidima en pacientes de DP sometidos a colonoscopia186. Más recientemente187, un amplio estudio observacional retrospectivo mostró una incidencia de IP secundaria en el 3,8% de los procedimientos colonoscópicos en pacientes en DP. Ningún paciente que recibió profilaxis antibiótica sufrió la complicación. Notablemente, la incidencia de IP en los pacientes que se sometieron a polipectomía triplicó a la de los que no lo hicieron. En otro estudio menos potenciado188, 26 procedimientos ginecológicos se complicaron con siete episodios de IP. El riesgo de infección fue significativamente inferior en las pacientes que recibieron profilaxis antibiótica, aunque el tamaño muestral reduce su fiabilidad.
Un artículo reciente ha reevaluado la cuestión, abogando por administrar profilaxis antibiótica también antes de las endoscopias altas y por el vaciamiento de la cavidad peritoneal, para mejorar las defensas peritoneales183. Sin embargo, se trata de un documento de opinión, que no aporta evidencia por sí mismo.
La bacteriemia transitoria es frecuente tras los procedimientos dentales y puede conducir a IP. La alta prevalencia de enfermedad periodontal en los pacientes en DP aumenta potencialmente este riesgo155. Parece razonable administrar un antibiótico profiláctico, al menos en los procedimientos de mayor riesgo bacteriémico (extracciones, limpiezas periodontales, endodoncias, implantes), pero el posible beneficio de esta estrategia no ha sido contrastado. Esta sugerencia es apoyada por un 92% de los miembros del panel de expertos.
No hay evidencia que permita responder con fiabilidad a esta pregunta. La incidencia de IP tras una colonoscopia se sitúa entre el 6 y el 25% si no se hace profilaxis, y entre 0 y el 6,5% si se administra profilaxis antibiótica. Las guías ISPD de 201111 y 201614 recomiendan vaciado del abdomen y profilaxis antibiótica. Dos recientes estudios, uno aleatorizado, pero con baja potencia estadística185, y otro observacional, con un alto número de pacientes187, han arrojado resultados contradictorios. En relación con las exploraciones ginecológicas, la evidencia es aún más escasa, pero parece razonable la profilaxis antibiótica, al igual que en los procedimientos dentales bacteriémicos. Un pequeño estudio observacional188 ha asociado la profilaxis antibiótica con una reducción del riesgo de IP tras exploraciones ginecológicas. No se dispone de información sobre los regímenes de profilaxis más apropiados para cada procedimiento.
De la evidencia a la recomendación
Este comité está de acuerdo con la opinión manifestada por las guías ISPD 201111 y 201614.
Recomendaciones
Recomendamos que los pacientes en DP que vayan a ser sometidos a un procedimiento invasivo biliar, digestivo bajo o ginecológico reciban una profilaxis antibiótica apropiada (1C).
Sugerimos que la profilaxis antibiótica tenga actividad frente a enterobacterias y anaerobios intestinales habituales (2C).
Sugerimos que en las exploraciones endoscópicas digestivas altas no es necesario administrar profilaxis antibiótica (2C).
Sugerimos que la información disponible no permite establecer la conveniencia de vaciar la cavidad peritoneal para los procedimientos antes citados (no graduado).
Sugerimos que se considere profilaxis antibiótica habitual para procedimientos odontológicos, especialmente los de mayor potencial bacteriémico (no graduado).
Aunque las IP por hongos no son frecuentes (1-14% de las IP), representan una de las complicaciones más temidas de la DP, por su alta mortalidad y las elevadas tasas de fallo de la técnica que asocian189–193. El hecho de que entre un 56 y un 89% de los episodios aparecen después de una infección bacteriana, peritoneal o no, que ha sido tratada con antibióticos189,190,194, ha generado un interés recurrente, a lo largo de los últimos 30 años, sobre la conveniencia de administrar profilaxis antifúngica en estos contextos clínicos. Aunque se han publicado múltiples estudios con bajo nivel de evidencia, ensayos aleatorizados195,196 y metaanálisis119,120 con resultados positivos han servido de base a la guía ISPD 2016 para apoyar esta medida. La guía no incluye sugerencias sobre otros contextos clínicos concretos, ni sobre los antifúngicos de preferencia o la duración de la profilaxis en estos casos, aunque parece reconocer cierta ventaja a los azoles sobre la nistatina14. El 84% de los miembros del panel de expertos comparte esta última apreciación.
Desde la publicación de la guía ISPD no se ha generado nueva evidencia de interés. Un estudio observacional193, de carácter descriptivo, no ha aportado información novedosa. Un nuevo metaanálisis96 ha confirmado impresiones previas, al no incluir nueva evidencia. Dos encuestas recientes3,197 muestran una penetración muy variable de esta práctica en distintas partes del mundo, entre 0 y un 70%, así como criterios variables de utilización. Es notable la escasez de información relativa a qué tratamientos antibióticos deberían asociar profilaxis antifúngica.
La recomendación de la guía ISPD se basa en dos ensayos aleatorizados de tamaño pequeño y diseño heterogéneo195,196. Probablemente, la relevancia de la complicación ha impulsado la recomendación, al considerarse el beneficio potencial muy superior a los riesgos. Desde la guía ISPD 2016 no ha surgido nueva información que modifique este criterio.
De la evidencia a la recomendación
Este comité está de acuerdo con la opinión manifestada por la guía ISPD 201614.
Recomendaciones
Recomendamos que a los pacientes en DP que reciban tratamiento antibiótico por vía oral o parenteral se les administre profilaxis antifúngica por vía oral durante el periodo de tratamiento (1B).
Sugerimos que los azoles pueden ser más adecuados para este cometido, aunque la nistatina puede ser una alternativa adecuada (2C).
Además de las medidas citadas hasta el momento, se han propuesto muchas otras de prevención de la IP. En general, estas medidas son propiciadas por estudios observacionales que detectan asociación entre determinado factor y el riesgo de infección (tabla D1)5,177,198–202. Como es natural, poco se puede hacer respecto a factores de riesgo no modificables, salvo desaconsejar la DP a pacientes que los padecen. Una correcta selección de pacientes es, pues, un factor de gran importancia teórica para reducir la incidencia posterior de IP. Sin embargo, con la excepción de situaciones flagrantes (pacientes con enfermedad inflamatoria intestinal activa o historial de diverticulitis), resulta muy difícil predecir si un paciente concreto va a padecer episodios frecuentes de IP, y los modelos de riesgo presentados son, en general, débiles e inconsistentes36,165,203. Este comité considera que es más lógico centrarse en un enfoque individualizado y un entrenamiento correcto que excluir pacientes por su mera pertenencia a grupos de riesgo con traducción impredecible a nivel individual.
La consideración de los factores de riesgo modificables177 parece, a priori, más prometedora, pero topa con importantes dificultades en la práctica. La asociación de algunos de estos factores (el tabaquismo) con el riesgo de IP es controvertida. Tampoco existe evidencia de que la corrección de otros (como la obesidad o la depresión) reduzca el riesgo de infección. Sin embargo, en otros casos, la evidencia disponible merece alguna consideración.
La prevención de la IP entérica representa un quebradero de cabeza en las unidades de DP, por su alta frecuencia y gran agresividad clínica. Muchas de estas infecciones tienen su origen en trastornos gastrointestinales preexistentes. Desde hace años, se viene especulando que aquellos factores que debilitan la barrera antimicrobiana intestinal pueden aumentar el riesgo de IP entérica. Así, la guía ISPD 2016 incide brevemente en la conveniencia de evitar un peristaltismo anormal, tanto reducido (estreñimiento, paresia intestinal) como acelerado (gastroenteritis), pero haciendo hincapié en la debilidad de la evidencia14. Se ha invocado la relación entre hipocalemia e infección por gérmenes entéricos204,205, pero tampoco hay evidencia directa de que la corrección del trastorno reduzca el riesgo de esta complicación. Un solo estudio, con bajo nivel de evidencia206 ha relacionado el uso regular de laxantes con un menor riesgo de IP.
En el momento de redactarse la guía ISPD 2016 existían dos estudios observacionales207,208 que asociaban niveles bajos de 25OH-vitamina D3 con un riesgo incrementado de IP.
Desde la publicación de la Guía 2016, han surgido algunos estudios de interés, aunque con un nivel limitado de evidencia. Un metaanálisis sobre seis estudios observacionales (3.613 pacientes) concluyó que la evidencia que relacionaba hipocalemia con riesgo de IP es muy inconsistente209. Por otra parte, dos estudios observacionales retrospectivos210,211 han detectado una asociación entre el tratamiento con inhibidores de la secreción ácida gástrica y riesgo de infección peritoneal. En el primero de ellos, la asociación observada se limitaba a las infecciones por gérmenes entéricos, y era mucho más patente con los antagonistas H2 que con los inhibidores de la bomba de protones210. Por último, dos estudios observacionales212,213 han relacionado la existencia de sobrehidratación sostenida con el riesgo de IP por gérmenes entéricos en DP. En el más potenciado de estos estudios211 la relación era aparentemente consistente, pero existían indicios de un fenómeno de confusión con la presencia de malnutrición.
Un estudio observacional214 ha relacionado los niveles plasmáticos de vitamina D con el riesgo de IP, una asociación que, notablemente, no dependía de la administración de suplementos orales de este factor. Un metaanálisis más reciente215, que incluyó cinco estudios con pacientes en DP, 11 con pacientes en hemodiálisis y uno con ambos tipos de terapia, mostró un riesgo general de infección reducido en aquellos con niveles normales o elevados de vitamina D. Además, los pacientes que recibían suplementos orales de vitamina D también mostraban un riesgo reducido de esta complicación. La significación de este metaanálisis está limitada para el tema que nos ocupa, por la heterogeneidad de los estudios analizados.
La guía ISPD 2016 solo incluye un breve comentario sobre el tema, sin recomendación asociada. Aunque un metaanálisis reciente215 muestra una reducción del riesgo infeccioso en presencia de niveles medios-altos de vitamina D y/o administración de suplementos orales de esta vitamina, la aplicabilidad de estos hallazgos al campo específico de la DP es dudosa.
De la evidencia a la recomendación
Este comité añade una sugerencia sobre el tema en cuestión en relación con la ausencia de recomendaciones en la Guía ISPD 201614.
Recomendaciones
Sugerimos la conveniencia de mantener niveles plasmáticos adecuados de vitamina D (suplementándola si fuera necesario) con el fin de reducir el riesgo infeccioso, en general, en los pacientes tratados con DP (2D).
La IP debe manejarse desde el momento del diagnóstico como una complicación potencialmente grave de la DP, por dos razones fundamentales:
- a.
Como se ha indicado en la introducción de esta guía, la IP puede asociar consecuencias y repercusiones clínicas indeseables: desde los efectos adversos de procedimientos diagnósticos y terapéuticos, el posible ingreso hospitalario o fracaso de la técnica30–35, y mucho más importante, un riesgo bajo, pero no desdeñable, de mortalidad directa5,36,37.
- b.
La presentación clínica inicial de una IP no es un marcador fiable de su evolución o pronóstico. Infecciones de pronóstico grave (incluyendo las entéricas y las fúngicas) pueden tener una presentación inicial aparentemente indolente, mientras que otras que luego van a evolucionar sin incidencias pueden debutar con una respuesta inflamatoria alarmante (dolor intenso, afectación de estado general, turbidez intensa del efluente). Abordar por defecto las IP como complicaciones graves representa la estrategia más conservadora y sensata.
Se reflejan en la tabla T1. Un paciente correctamente entrenado debe conocer la relevancia de consultar inmediatamente tras la aparición de signos o síntomas de IP. Aunque no existe evidencia directa de que el tratamiento inmediato mejore los resultados de la terapia iniciada tras una demora de uno o más días, los principios generales de tratamiento de las enfermedades infecciosas así lo apoyan, y se acepta que el número de días de inflamación peritoneal influye en las posibilidades de preservar la membrana peritoneal y la propia técnica de DP216. Por esa misma razón, inducir una remisión rápida de la infección debe ser un objetivo primordial.
Principios generales de tratamiento inicial de una infección peritoneal
| El diagnóstico y el inicio del tratamiento deben ser lo más precoces posibles tras el inicio de los signos/síntomas de infección peritoneal |
| Debe evitarse iniciar el tratamiento sin una recogida adecuada previa de muestras bacteriológicas |
| El tratamiento inicial (empírico) de una infección peritoneal debe cubrir adecuadamente las bacterias grampositivas y gramnegativas |
| La selección de la antibioterapia inicial (empírica) debe tener en cuenta la microbiota local y los patrones de sensibilidad antibiótica habituales en el centro, respetando el principio anterior |
| La función renal residual es una consideración importante, tanto para seleccionar la terapia (evitar antibióticos nefrotóxicos) como para establecer las dosis antibióticas |
| Planificar adecuadamente el seguimiento (ingreso, tiempo a revisión), teniendo en cuenta el estado clínico del paciente, factores limitantes de respuesta (inmunosupresión, infección simultánea del túnel, etc.) y riesgo de tratamiento inadecuado en domicilio (mala adherencia, capacidad limitada, etc.) |
El tratamiento empírico inicial no puede cubrir todo el espectro antibacteriano, pero debe abarcar la principal de estas infecciones, que incluye a los cocos grampositivos y a los bacilos gramnegativos (BGN). Esta cobertura empírica se debe ajustar a la microbiota habitual de cada unidad. Las incidencias locales de infecciones por S. aureus y por BGN no fermentadores (particularmente Pseudomonas spp.) son los factores que más habitualmente modifican los protocolos de tratamiento inicial.
La dosificación de la antibioterapia debe situarse en el rango alto de lo deseable para el paciente, teniendo en cuenta su función renal residual y otros factores que puedan modificar su perfil de eficacia y seguridad (edad, hepatopatía o posibles interacciones medicamentosas, entre otros). Muchos centros utilizan dosis de antibióticos por encima de las recomendadas en los primeros días de tratamiento, para asegurar niveles intraperitoneales y sistémicos apropiados de forma rápida, en tanto no se identifica el microorganismo causal. No hay evidencia de que esta estrategia mejore los resultados del tratamiento. Un estudio reciente, observacional y no controlado217, detectó un mayor riesgo de fracaso terapéutico en pacientes con función renal residual, lo que los autores atribuyen al riesgo de infradosificación en este subgrupo. Aunque en dicho estudio el protocolo incluía un aminoglicósido en pacientes oligúricos y ceftazidima en aquellos con función renal residual, lo que también podría haber influido en los resultados, supone una llamada de atención a las posibles consecuencias negativas de infradosificar la antibioterapia de las IP.
La fase de diagnóstico inicial de una IP incluye una valoración del perfil de riesgo del paciente y de la repercusión que la propia infección tiene sobre su estado general. También deben valorarse factores que puedan limitar la respuesta a la antibioterapia como único tratamiento, como la presencia de un absceso de pared o de signos de una patología abdominal de fondo. Estos factores influyen a la hora de decidir el manejo ulterior, sobre todo si este se debe hacer en régimen de ingreso o ambulante. En general, atendiendo a razones clínicas, alrededor del 80% de las IP podrían manejarse en régimen ambulatorio59. Sin embargo, esta decisión también está influida por factores como el entorno social del paciente, sus habilidades, la distancia al centro, la infraestructura de cada Unidad o sus protocolos de entrenamiento (que no siempre incluyen la educación en administración de medicación intraperitoneal). Estos factores hacen que las tasas reales de ingreso por IP varíen mucho entre centros, y sean frecuentemente superiores al 50%5.
Terapia inicialElección de antimicrobianosEl conocimiento de la microbiota local condiciona el protocolo de tratamiento inicial de las IP. En su defecto, la ISPD14 sugiere administrar vancomicina o una cefalosporina de primera generación para la cobertura de grampositivos y un aminoglicósido o una cefalosporina de tercera generación para la cobertura de gramnegativos. Sin embargo, existen algunas consideraciones que conviene tener en cuenta:
- –
Por diferentes motivos (tabla T2), existen múltiples protocolos de tratamiento inicial de las IP en DP. La manifiesta escasez de evidencia comparativa entre distintas estrategias y factores locales limitan el alcance de cualquier tentativa de recomendación general. La alta prevalencia de alergia (real o supuesta) a los antibióticos betalactámicos, que son la base de la mayoría de las pautas, obliga a menudo a disponer de protocolos secundarios. En estos casos, se dispone de alternativas eficaces, tanto para el tratamiento de infecciones por grampositivos (vancomicina, teicoplanina, daptomicina o linezolid) como por gramnegativos (aztreonam, aminoglicósidos, quinolonas).
Tabla T2.Causas de la variabilidad en los protocolos de tratamiento antibiótico de infección peritoneal
Eficacia diagnóstica de la unidad (calidad de la microbiología) Espectro etiológico local Sensibilidad antibiótica de la microbiota local Función renal residual Contexto clínico (factores limitantes o que complican la respuesta) Alergias o intolerancias a antibióticos Diversidad de procedimientos de DP (DP automatizada y otros) Versatilidad antibiótica en cuanto a vías de administración e intervalos de dosificación Visión restrictiva versus proactiva sobre el uso de nuevos antibióticos Recursos económicos y disponibilidad local de antibióticos Escasez de experiencias controladas de calidad (evidencia) DP: diálisis peritoneal.
- –
Aunque existe acuerdo en la baja toxicidad de un ciclo corto de aminoglicósidos, la tendencia natural, si el microorganismo es sensible, suele ser continuar con la terapia inicial. Por este motivo, parece razonable limitar el uso de esta familia de fármacos en pacientes con función renal residual. Por el contrario, la vancomicina ofrece un perfil terapéutico empírico muy conveniente, que compensa su riesgo potencial de toxicidad, y la incidencia de resistencias es relativamente baja, en nuestro país.
- –
La tinción de Gram tiene una sensibilidad limitada. Además, aún en el caso de que se detecten gérmenes grampositivos o gramnegativos, esto no descarta el crecimiento en cultivo de otros microorganismos. A pesar de ello, esta técnica ayuda a definir la pauta inicial de terapia antibacteriana. Su mayor utilidad estriba en su capacidad para detectar precozmente la presencia de levaduras58, que modifica de manera radical la aproximación terapéutica.
La revisión de la literatura posterior a la guía 2016 muestra solamente dos contribuciones relevantes. Xu et al.218 mostraron, en un pequeño ensayo aleatorizado y unicéntrico, que moxifloxacina oral o ceftazidima intraperitoneal como acompañantes de vancomicina intraperitoneal tienen tasas de resolución equivalentes (78 vs. 80%, p = 0,80). En un ensayo aleatorio multicéntrico más reciente219, la tasa de éxito terapéutico (82,6 vs. 81,1%, p = 0,4), así como otras variables secundarias, fueron muy similares al comparar cefepime intraperitoneal o cefazolina con ceftazidima intraperitoneales; demostrando, según los autores, la eficacia de cefepime en monoterapia respecto a protocolos convencionales.
Las principales ventajas e inconvenientes de diferentes grupos antibióticos para el tratamiento empírico inicial de las IP se reflejan en la tabla T3. De la lectura de la tabla se deduce claramente por qué vancomicina y cefalosporinas constituyen la opción preferida. Carbapenems y daptomicina constituyen excelentes alternativas para la cobertura de gramnegativos y grampositivos, pero con menos experiencia acumulada, por lo que muchos centros los mantienen como opciones de reserva, dada la eficacia que las asociaciones más tradicionales muestran todavía como primera opción.
Las guías ISPD 2016 proporcionan una revisión exhaustiva de los protocolos de tratamiento empírico de la IP hasta ese año14. La revisión de la literatura posterior muestra solamente dos contribuciones relevantes218,219, pero que no modifican el escenario previo.
De la evidencia a la recomendación
Ante la ausencia de nueva evidencia de calidad, este comité se adhiere a la recomendación general de la ISPD14, con el matiz de un menor énfasis en la utilización de aminoglicósidos en pacientes con función renal residual, dada la nefrotoxicidad potencial de estos fármacos.
Recomendaciones
Recomendamos el inicio lo más precoz posible de antibioterapia una vez establecida la sospecha de IP (1C).
Recomendamos proporcionar siempre una adecuada cobertura de grampositivos y gramnegativos en el protocolo de tratamiento inicial de una IP (1B).
Recomendamos ajustar el protocolo de tratamiento empírico de las IP a la epidemiología local (1C).
Para los centros sin experiencia propia suficiente, recomendamos administrar vancomicina o una cefalosporina de primera generación para la cobertura de grampositivos y una cefalosporina de tercera generación o un aminoglicósido para la cobertura de gramnegativos (1B).
Sugerimos limitar el uso de aminoglicósidos en pacientes con IP y función renal residual significativa (2C).
Sugerimos el inicio de tratamiento de una IP con dosis antibióticas en el rango alto de su ficha técnica, teniendo en cuenta la función renal residual del paciente (2C).
Sugerimos la conveniencia de disponer de protocolos antibióticos alternativos para pacientes con historial de alergias o intolerancias antibióticas, sobre todo a betalactámicos (2C).
Principales ventajas e inconvenientes de los diferentes grupos antibióticos para el tratamiento inicial de las infecciones peritoneales en DP
| Grupo | Ventajas | Inconvenientes |
|---|---|---|
| Glicopéptidos | Consistencia frente a G+Activos frente a SAMRResistencia muy infrecuenteEficaces por vía parenteral e intraperitonealBaja toxicidad en la práctica clínica | Dosis y pautas de administración difíciles de individualizarPotencial de nefrotoxicidadEl manejo óptimo exige monitorizar nivelesPoco activos en presencia de biofilmVía oral no factible |
| Penicilinas y ampicilinas | Espectro relativamente amplio (excepto penicilinas)Buena cobertura de enterococos y estreptococosBaja toxicidadVersatilidad de administración | Resistencias frecuentesAlergias (reales o supuestas) a menudo impiden su uso |
| Cefalosporinas y aztreonam | Amplio espectro general (variable según generación)Muy eficaces clínicamente, si microorganismo sensibleToxicidad relativamente bajaVersatilidad de administración | Espectro variable según generaciónSensibilidad bacteriana inconstanteAlergias (reales o supuestas) a menudo impiden su uso |
| Carbapenems | Amplio espectroActivos frente a gérmenes resistentes a otras opciones (anaerobios, productores de BLEE)Eficaces por vía intravenosa e intraperitoneal | Vía oral no factibleCoste económicoNeurotoxicidad |
| Aminoglicósidos | Amplio espectroEficaces por vía intravenosa e intraperitoneal | Vía oral no factibleNefrotoxicidad |
| Quinolonas | Amplio espectroVersatilidad de administración (incluyendo vía oral) | Emergencia de resistencias tras uso repetidoCoste económicoEfectos adversos |
| Daptomicina | Gran actividad frente a grampositivosMás consistente que otras opciones en ámbito clínicoActiva frente a gérmenes que generan biofilmEficaz por vía intravenosa e intraperitoneal | Experiencia limitada en DPVía oral no factibleResistencias incipientesCoste |
BLEE: betalactamasas extendidas; DP: diálisis peritoneal; SAMR: Staphylococcus aureus resistente a meticilina.
Las guías ISPD14 abordan, en diferentes apartados, una serie de medidas auxiliares que pueden ser de ayuda en el manejo inicial de las IP. Algunas de estas medidas incluyen:
- –
La administración de analgesia proporcional a la intensidad del dolor del paciente. La adición de anestésicos locales a la solución de diálisis (ej. 3 a 5 cc de mepivacaína al 2% por bolsa) alivia el dolor, pero suele ser necesaria analgesia oral o parenteral en la mayoría de los casos.
- –
Los lavados peritoneales pueden ser útiles en presencia de dolor o turbidez marcada, para mejorar la mecánica de la diálisis y mitigar el dolor.
- –
La adición de heparina a la solución de diálisis cuando el drenado sea turbio o contenga gran cantidad de fibrina puede evitar la formación de trombos, que pueden empeorar la mecánica de la diálisis y agravar el déficit transitorio de ultrafiltración que caracteriza a la fase inflamatoria de la IP.
- –
Un pequeño ensayo aleatorizado, ya recogido por las guías ISPD 2016220 ha mostrado que usar icodextrina para el cambio largo durante la fase aguda de la IP permite mantener una ultrafiltración adecuada en esta fase. Dado que el estudio no pudo demostrar beneficio clínico de esta medida, esta indicación debe ser individualizada.
- –
Aunque existen algunas experiencias preliminares de sellado de catéteres con antimicrobianos como medida auxiliar para prevenir las recaídas221–224, esta práctica no ha sido avalada por ninguna experiencia controlada, por lo que no se puede recomendar en el momento actual.
- –
Hace ya años que los sellados con urocinasa para eliminar el biofilm bacteriano, y prevenir así las recaídas, han caído en desuso, y no hay evidencia reciente que contradiga este criterio225.
Con posterioridad a la Guía 2016, un ensayo aleatorizado, unicéntrico y de pequeño tamaño (40 episodios de peritonitis) ha valorado el efecto del lavado peritoneal (vs. no lavado) sobre el curso de la IP, sin beneficios aparentes226.
Esta cuestión ha sido abordada convenientemente por las guías ISPD 201614. En esencia, la evidencia disponible es escasa, y las diferentes prácticas vienen avaladas por la opinión de expertos. Un ensayo reciente sobre el efecto del lavado peritoneal (vs. no lavado) sobre el curso de la IP, no ha mostrado beneficios aparentes226.
De la evidencia a la recomendación
Nuevamente no hay evidencia posterior a las guías ISPD 201614 que modifique las consideraciones expuestas en ellas.
Recomendaciones
Recomendamos la realización de lavados peritoneales en caso de drenado peritoneal muy turbio y/o dolor abdominal intenso, con los objetivos de aliviar el dolor y mejorar la mecánica de la DP (1C).
Sugerimos la adición de heparina a la solución de diálisis en pacientes con efluente turbio, para mantener una buena mecánica de la DP (2C).
No se han publicado novedades relevantes que modifiquen las recomendaciones ISPD 201614, por lo que estas se mantienen en sus aspectos generales. Sin embargo, este comité considera pertinente resaltar algunos matices.
Las guías ISPD consideran de elección la vía intraperitoneal (vs. la intravenosa) para la administración de antibioterapia (exceptuando a los pacientes con signos de sepsis)14. Este comité apoya mayoritariamente (62% del panel) esta recomendación, aunque considera que viene apoyada por un nivel insuficiente de evidencia. La mayor parte de los antibióticos usados para el tratamiento de las IP tiene buena penetración a peritoneo tras su administración intravenosa. Además, niveles más elevados en el dializado tras la administración intraperitoneal no se asocian necesariamente con un mayor nivel tisular del antibiótico. Tampoco hay evidencia de menos efectos adversos usando la vía intraperitoneal. La evidencia clínica de las ventajas de la vía intraperitoneal sobre la intravenosa es débil, ya que se reduce a algún ensayo de pequeño tamaño con vancomicina225. Sin embargo, la vía intraperitoneal resulta muy conveniente para la administración ambulatoria del antibiótico, y este es quizá el argumento más convincente, en su favor. Algunas consideraciones adicionales a destacar incluyen:
- –
En pacientes ingresados, la vía intravenosa no suele plantear problemas de administración, y puede ser más predecible en presencia de signos de infección grave (sepsis), como apunta la propia guía ISPD14
- –
La administración intraperitoneal en régimen ambulatorio tiene limitaciones. Muchos centros no entrenan a sus pacientes en este procedimiento (algo que este comité considera recomendable unánimemente), y la manipulación por el paciente de fármacos de administración parenteral puede suscitar reservas.
- –
La mayoría de los antibióticos usados para el tratamiento de IP en DP son seguros y mantienen estabilidad en las soluciones de diálisis por el tiempo necesario14. Algunos centros suministran a sus pacientes bolsas de dializado con el antibiótico. Este procedimiento está razonablemente avalado por la práctica clínica, y es continua la aparición de estudios que muestran estabilidad de diferentes antibióticos en soluciones de DP227–231. Sin embargo, la eficacia clínica de este tipo de protocolos no ha sido evaluada de manera controlada.
- –
La vía intravenosa ambulatoria es factible en algunos pacientes, especialmente cuando se utilizan antibióticos de administración espaciada (glicopéptidos, aminoglicósidos, ceftazidima).
- –
La administración intraperitoneal continua de antibióticos genera inseguridades en algunos clínicos respecto al manejo de pacientes en regímenes intermitentes o semiintermitentes de DP (sobre todo en DPA) (ver más adelante).
La vía oral ha sido explorada periódicamente para el tratamiento de IP en DP, bien en régimen de monoterapia o como parte de una terapia combinada. La mayoría de los estudios se basan en el uso de quinolonas o betalactámicos, siendo todavía muy escasa la experiencia con linezolid. La vía oral tiene algunos problemas potenciales, incluyendo una penetración relativamente lenta a la cavidad peritoneal, una farmacocinética impredecible (muchos pacientes presentan íleo reflejo en presencia de IP, y la biodisponibilidad puede verse afectada por la dieta u otras medicaciones) y el riesgo potencial de mala adherencia en algunos pacientes, sobre todo cuando los síntomas comienzan a remitir. Este comité asume con las recomendaciones de las guías ISPD de 201614, que la consideran una vía factible, pero de relevancia secundaria.
Desde la publicación de las guías ISPD 201614 se ha generado un número relativamente amplio de estudios in vitro o pequeños estudios farmacocinéticos destinados a confirmar la estabilidad de diferentes antibióticos en soluciones de DP226–229, o la duración de los niveles de diferentes antibióticos tras su administración oral o intraperitoneal intermitente231–235, que no han modificado la percepción de esta cuestión. Un solo ensayo aleatorizado218, ya comentado previamente, mostró tasas comparables de fracaso terapéutico cuando se asocia moxifloxacino oral o ceftazidima intraperitoneal a vancomicina intraperitoneal como tratamiento inicial de IP en DP. El ensayo solo incluía 13 episodios de IP por gramnegativos, por lo que el riesgo de error beta es significativo. Un estudio observacional, unicéntrico y retrospectivo234 mostró eficacia similar de amoxicilina oral y vancomicina intraperitoneal para el tratamiento de las peritonitis enterocócicas en DP, con un nivel de evidencia claramente insuficiente para modificar las pautas recomendadas actualmente para el tratamiento de estas infecciones.
Desde la publicación de las guías ISPD 201614 solo suscitan interés tres estudios218,232,235 que avalan (con una grado bajo de evidencia) la vía oral de tratamiento de las IP, aunque uno de ellos218 asociaba vancomicina parenteral en ambas ramas del ensayo.
De la evidencia a la recomendación
Ante la ausencia de nueva evidencia de calidad, este comité apoya las recomendaciones de las guías ISPD de 201614, con algunos matices relacionados con la inconsistencia de la información disponible.
Recomendaciones
Recomendamos que la vía intraperitoneal sea la de preferencia para el tratamiento de las IP en régimen ambulatorio, siempre que el nivel de entrenamiento del paciente lo permita (1B).
Sugerimos que, en pacientes ingresados, la vía intraperitoneal sea también la preferente, aunque la vía intravenosa también se considere apropiada, condicionando la decisión a las propiedades farmacocinéticas del antibiótico utilizado y el contexto clínico (2B).
Recomendamos que el tratamiento de una IP no se base en monoterapia por vía oral (1C).
Este comité asume, en general, las recomendaciones de la guía ISPD de 201614. La administración intermitente de los aminoglicósidos parece particularmente conveniente, dado su perfil de eficacia-toxicidad, y para prevenir el fenómeno de resistencia adaptativa236. Más dudas suscita la recomendación de administración intermitente también para la vancomicina. Consideramos que no existe evidencia de que la administración intermitente o continua de este antibiótico conduzca a distintos resultados clínicos. Las permanencias diurnas habituales en DPCA (en torno a cuatro horas) no garantizan un equilibrado completo de la dosis administrada237, pero sí suficiente, en términos prácticos. Aunque la vancomicina es potencialmente tóxica, en el tratamiento de IP en DP es probable que la infradosificación acarree más riesgo que la sobredosificación. Desde un punto de vista teórico, la administración continua aseguraría mayor estabilidad en los niveles del fármaco, pero ninguno de los dos regímenes puede sustituir a la seguridad que aporta una monitorización farmacológica, especialmente en pacientes con función renal significativa, en los que la infradosificación es más probable217.
Aunque, en términos generales, se asume que los betalactámicos mejoran su perfil de eficacia en perfusión continua, este comité considera la equivalencia de los regímenes intermitentes o continuos de administración de estos antibacterianos y sus similares (carbapenems, aztreonam) para el tratamiento de IP en DP14. Dada la necesidad de administrar más de una dosis diaria de muchos de estos antibióticos, sobre todo en presencia de función renal residual, consideramos que la administración continua puede ser más conveniente para el conjunto de los pacientes, pero la administración intermitente es apropiada para muchos de estos compuestos (cefazolina o meropenem)14,238.
No consta evidencia reciente que modifique las consideraciones contenidas en las guías ISPD de 201614.
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614, con algunos matices, que se describen a continuación.
Recomendaciones
Recomendamos que los aminoglicósidos intraperitoneales sean administrados en régimen intermitente para el tratamiento de la IP en DP (1B).
Recomendamos que la administración de vancomicina intraperitoneal pueda hacerse tanto en régimen intermitente como continuo (1B).
Sugerimos que, siempre que sea posible, se monitoricen los niveles plasmáticos de vancomicina y aminoglicósidos, especialmente en pacientes con función renal residual (2B).
Sugerimos que la administración intraperitoneal de betalactámicos y carbapenems pueda hacerse tanto en régimen intermitente como continuo, estando la decisión condicionada por el intervalo normal de dosificación de cada antibiótico (2C).
La versatilidad de los regímenes de DPA supone una ventaja para los pacientes, pero genera a menudo dudas a la hora de tratar una IP. Este comité comparte la opinión de las guías ISPD de 201614 sobre que la información disponible para adoptar criterios claros es insuficiente. Algunas consideraciones que este comité desea resaltar incluyen:
- –
La mayor eficacia depurativa de la DPA respecto a la DPCA puede afectar a la farmacocinética de algunos antibióticos, incluyendo la vancomicina237, generando riesgo de infradosificación por lo que, si no se monitorizan los niveles plasmáticos del antibiótico, conviene administrar dosis en el rango más alto de las recomendadas.
- –
La administración intermitente de antibiótico, por vía intravenosa, intraperitoneal u oral, puede seguir los criterios generales, en pacientes en DPA. Como es natural, si la administración es intraperitoneal, conviene hacerlo en un cambio largo. La condición de permanencia mínima de seis horas planteada por las guías ISPD14 es muy razonable. En el caso de las cefalosporinas, se ha mostrado que la administración en cambios cortos genera también niveles plasmáticos adecuados239, pero esta opción no ofrece ventajas sobre la administración en cambio largo. Es importante tener en cuenta que la administración intermitente durante el cambio largo puede asociar niveles relativamente bajos de alguno antibióticos (caso de la vancomicina237 o las cefalosporinas240), durante las fases de cambios cortos.
- –
En pacientes en DP intermitente nocturna se puede considerar introducir un cambio diurno durante el periodo de tratamiento, para poder administrar el antibiótico, si se ha optado por la vía intraperitoneal. Esta consideración vale tanto para los regímenes de administración intermitente como continua.
- –
Si se opta por administración intraperitoneal continua, la dosis total de antibiótico debe repartirse entre los cambios diurnos y nocturnos. Algunos centros introducen un cambio suplementario diurno para asegurar las concentraciones intraperitoneales y plasmáticas de antibióticos de absorción y disposición más rápidas, aunque esta práctica no está apoyada por evidencia. Otros centros optan por la transferencia temporal a DPCA, si el paciente ingresa o conoce la mecánica de esta técnica. Esta decisión permite una dosificación más homogénea y puede proporcionar una mayor seguridad subjetiva al profesional en cuanto a cómo administrar el antibiótico, pero puede empeorar la capacidad de ultrafiltración en un momento crítico, y no hay evidencia de que mejore los resultados del tratamiento.
- –
Respecto al tratamiento por vía oral de las IP en DPA, la experiencia sigue siendo insuficiente14.
- –
No existe evidencia suficiente que establezca una respuesta diferente al tratamiento en las IP padecidas por pacientes en DPCA o DPA241,242.
No se ha generado evidencia relevante respecto al manejo de las IP en DPA después de las guías ISPD 201614. Un estudio, ya mencionado, de pequeño tamaño y no controlado239 mostró que la administración de cefazolina o ceftazidima en cambios cortos a concentraciones decrecientes (por la mezcla con dializado limpio) consigue niveles adecuados de ambos antibióticos. Otro estudio, con un nivel de evidencia todavía inferior232, mostró en pacientes en DPA sin IP que el ciprofloxacino por vía oral a una dosis de 750 mg cada 12 horas consigue niveles intraperitoneales apropiados en pacientes en DPA sin IP. Por otra parte, dos revisiones exhaustivas (pero no sistemáticas)237,240 han resaltado la posible conveniencia de administración intraperitoneal continua de vancomicina y cefalosporinas, para prevenir la presencia de niveles subterapéuticos en la fase nocturna (cambios cortos).
No se ha generado evidencia relevante respecto al manejo de las IP en DPA después de las guías ISPD 201614. Destacan por su interés dos revisiones no sistemáticas237,240 que sugieren la posible conveniencia de administración intraperitoneal continua de vancomicina y cefalosporinas, para prevenir la presencia de niveles subterapéuticos en la fase nocturna (cambios cortos).
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614, con ligeros matices que se describen a continuación
Recomendaciones
En pacientes en DPA con IP tratados con antibioterapia intraperitoneal, recomendamos la administración de vancomicina y betalactámicos en régimen continuo, con el fin de evitar niveles infraterapéuticos en dializado durante las permanencias cortas nocturnas (1B).
Recomendamos que, en caso de optar por una pauta de administración intermitente de antibiótico, tanto por vía intravenosa como intraperitoneal u oral, se sigan criterios generales en pacientes en DP automatizada, similares a los mantenidos en DPCA (1B).
En pacientes en DPA con IP recomendamos que, en caso de administración intraperitoneal intermitente, esta se haga en el curso de un cambio largo, con permanencia de al menos seis horas (1B).
Sugerimos que, en pacientes en régimen de DP intermitente nocturna (día seco) que vayan a ser tratados por vía intraperitoneal, se introduzca temporalmente un cambio diurno, para facilitar la administración, intermitente o continua, del tratamiento antimicrobiano (2D).
Sugerimos que la práctica de transferir a los pacientes en DPA a DPCA durante el tratamiento de una IP por vía intraperitoneal no está justificada por razones terapéuticas, aunque sí puede estarlo por motivos de índole práctica (2D).
Desde el inicio del tratamiento empírico se debe establecer una vigilancia clínica, (ver Control y seguimiento de una infección peritoneal). Algunas consideraciones relevantes en esta fase son:
- 1.
La tinción de Gram solo modifica radicalmente el tratamiento en los casos de detección de flora polimicrobiana y/o levaduras, pero ayuda en los demás casos positivos al diseño de la estrategia de tratamiento.
- 2.
Los cultivos bacterianos rinden resultados a menudo en menos de 24 horas, aunque en algunos casos la espera puede alargarse varios días.
- 3.
Es importante recordar que, sobre todo en infecciones entéricas, puede haber crecimientos asincrónicos. Los gérmenes gramnegativos y, sobre todo los anaerobios, pueden demorar su crecimiento en cultivo. Es pues muy conveniente mantener vigilancia sobre los resultados del cultivo más allá del aislamiento inicial.
Una vez identificado el/los microorganismo(s) causal(es) puede ser necesario un ajuste en la antibioterapia. Este comité está de acuerdo con las guías ISPD 201614 en que conviene ajustar el espectro del tratamiento a los aislamientos obtenidos. En determinados casos es conveniente mantener una asociación antibiótica (figura T1). Esta estrategia es habitual en las IP por BGN no fermentadores (excepto, quizá, las IP por Acinetobacter spp.243) y la mayoría de las polimicrobianas. El panorama frente a los enterococos es más dinámico, por la creciente experiencia con nuevos antibióticos244, aunque ampicilina y glicopéptidos siguen siendo la base más sólida de tratamiento.
La duración mínima del tratamiento de una IP es de dos semanas, aunque el germen causal o la presentación clínica pueden hacer conveniente una duración más prolongada14. Las guías ISPD recomiendan prolongar el tratamiento (21 días o más) en IP por algunos agentes etiológicos, esencialmente Staphylococcus aureus, Corynebacterium spp., Enterococcus spp., gramnegativos, flora mixta o micobacterias. Por el contrario, no se indica esta medida basada en el curso clínico (agresividad clínica, resolución tórpida) o factores de complicación (pacientes de alto riesgo, infección de catéter, tratamiento de recaídas)14.
No se ha detectado ningún estudio posterior a las guías ISPD 2016 que aporte evidencia robusta a estas cuestiones. Una revisión sistemática reciente245 destaca la escasa atención prestada al tema en los últimos años. El desarrollo de alternativas (incluyendo el linezolid y, sobre todo daptomicina) para el tratamiento de las IP por enterococos244,246, tiene indudable interés, pero aún no disponemos de experiencias controladas para indicar la sustitución de las recomendaciones actuales. En un estudio observacional y multicéntrico sobre 176 IP monobacterianas por Acinetobacter spp. del registro Anzdata243 solo se registraron asociaciones antibióticas en el 13%, con resultados similares a diferentes formas de monoterapia. Un reciente estudio observacional, retrospectivo y multicéntrico sobre 153 casos de IP por Pseudomonas spp. no mostró beneficio adicional de sumar un tercer antibiótico a la pauta habitual de dos antibióticos para el tratamiento de estas infecciones247.
No se ha aportado ninguna evidencia adicional a las guías ISPD 201614 en relación a la duración del tratamiento de las IP. Este tema no es objeto de atención en los principales estudios sobre IP245.
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614, con algunas consideraciones adicionales.
Recomendaciones
Recomendamos una duración mínima de 14 días para el tratamiento antibiótico de una IP en DP (1B).
Sugerimos que puede ser conveniente prolongar el tratamiento al menos tres semanas en IP causadas por Staphylococcus aureus, Corynebacterium spp., Enterococcus spp., bacterias gramnegativas y flora mixta, con participación de gérmenes entéricos (2B).
Sugerimos prolongar la duración del tratamiento al menos una semana más cuando, en base a criterio clínico, se considere que existe un riesgo incrementado de evolución complicada de la IP (2C).
No se ha detectado ningún estudio posterior a las guías ISPD 2016 que aporte evidencia fuerte a esta cuestión. Algunos análisis recientes han mostrado viabilidad de monoterapia en IP por enterococos244,246, Acinetobacter spp.243 y Pseudomonas spp.247, pero se trata de estudios no controlados, por lo que no modifican la percepción de este comité.
De la evidencia a la recomendación
Este comité asume las recomendaciones de la ISPD 201614.
Recomendaciones
Recomendamos tratar con dos antibióticos sinérgicos las IP por Pseudomonas spp. y Stenotrophomonas spp. (1B).
Recomendamos el tratamiento con asociaciones antibióticas de las IP polimicrobianas, en relación a los microorganismos aislados (1B).
Sugerimos que, en las IP enterocócicas de curso agresivo tratadas con vancomicina o ampicilina, se considere la asociación de un aminoglicósido intraperitoneal, siempre que el antibiograma muestre potencial de sinergismo (2B).
Las IP por estafilococos coagulasa negativos (ECN) representan el paradigma de infección asociada a contaminación por contacto manual durante el momento de la conexión o desconexión del sistema. Suelen ser clínicamente poco agresivas y muestran buena respuesta habitual a cualquier antibiótico con actividad frente a grampositivos. Las tasas de infección por ECN son un buen indicador de un correcto entrenamiento del paciente.
Este comité muestra acuerdo con las recomendaciones de las guías ISPD 201614, las cuales indican tratamiento con vancomicina o cefalosporinas de primera o segunda generación durante dos semanas. Sin embargo, existen algunas consideraciones a tener en cuenta:
- 1.
Muchos centros presentan una alta incidencia de infecciones por ECN meticilinresistentes248. La epidemiología local de cada centro es determinante a la hora de seleccionar betalactámicos o vancomicina para el tratamiento de estas infecciones.
- 2.
El principal problema que plantean estas infecciones es el riesgo de recaídas, muy asociadas a la capacidad de estas bacterias para generar biofilms249. En ocasiones no es fácil discernir si se trata de IP repetidas, recurrentes (nuevas infecciones por bacterias del mismo grupo) o verdaderas recaídas. En el primer caso, el reentrenamiento de los pacientes es la medida más lógica. En el caso de las recaídas, se han intentado diferentes estrategias, que incluyen ciclos antibióticos más prolongados, asociaciones antibióticas sinérgicas, uso de antibacterianos con buena penetración a biofilms, y lavados o sellados con fibrinolíticos, con resultados inconsistentes, en gran parte por tamaños muestrales insuficientes o uso de diseños no controlados. Las guías ISPD 201614 no apoyan el uso de fibrinolíticos, que en su día suscitaron notable interés. Un estudio reciente ha postulado combinar tratamientos prolongados con asociaciones antibióticas añadiendo alteplasa intraluminal, pero nuevamente se trata de una muestra pequeña y sin grupo control250. Algunas alternativas más recientes, como los sellados con antibacterianos222 necesitan de más experiencia antes de permitir conclusiones. En la práctica, no es infrecuente que las recaídas múltiples de IP por ECN demanden la sustitución del catéter peritoneal. Las guías ISPD 201614 consideran factible el recambio de catéter en un solo tiempo bajo cobertura antibiótica, algo que apoya este comité, siempre que la infección esté en remisión.
- 3.
Algunas especies de ECN, incluyendo el Staphylococcus lugdunenis, muestran un nivel de agresividad comparable al Staphylococcus aureus, por lo que podrían necesitar tratamientos más prolongados251, aunque no hay suficiente información para emitir una recomendación al respecto.
Este comité asume las consideraciones generales de las guías ISPD 201614, al no haberse presentado nueva información de interés. Los puntos principales son:
- –
El tratamiento de las IP por este microorganismo debe prolongarse al menos durante tres semanas, en base a su potencial de agresividad y persistencia
- –
La elevada frecuencia de infección simultánea asociada a catéter hace especialmente pertinente el despistaje de esta complicación. La coexistencia de ambas obliga a considerar la conveniencia de retirada del catéter peritoneal
- –
Las infecciones por cepas sensibles a meticilina pueden ser tratadas con una cefalosporina de primera generación o vancomicina, mientras que las resistentes a meticilina se han de tratar con daptomicina o vancomicina.
- –
No está claro el beneficio de agregar rifampicina a la terapia convencional ya que, a pesar de algún estudio no controlado favorable, este antibacteriano presenta efectos farmacocinéticos indeseables que pueden reducir sus ventajas.
Algunas consideraciones adicionales que hace este comité incluyen:
- –
Las IP por este microorganismo tiene una presentación clínica variable, pero pueden ser muy agresivas, con tasas medias de mortalidad comparables a las de las IP por gramnegativos59. En los casos con presentación clínica grave algunos grupos prefieren asociar un aminoglicósido a las cefalosporinas o vancomicina al menos hasta que la fase más grave remita. Esta estrategia no está apoyada por evidencia.
- –
Aunque la resistencia a la vancomicina es poco frecuente entre los Staphylococcus aureus, existen cepas con sensibilidad intermedia (VISA)252. Estas cepas muestran concentraciones mínimas inhibitorias en el rango intermedio entre sensibilidad y resistencia, y las IP que provocan tienen un riesgo aumentado de fracaso terapéutico. En estos casos se ha recomendado la administración continua de vancomicina por vía intraperitoneal252, pero la nomenclatura actual considera estas cepas como resistentes, por lo que administrar un antibacteriano alternativo (como daptomicina) parece lo más apropiado.
- –
La indicación de retirada del catéter es clara en las IP asociadas a infección de catéter en presencia de un absceso de pared o infección grave que amenace la supervivencia del paciente, pero debe ser individualizada en casos no complicados253.
Las IP estreptocócicas pueden tener diferentes orígenes, dada la ubicuidad de este género (piel, boca, tubo digestivo alto y bajo, aparato respiratorio alto). La cavidad oral es un foco probable, dada su amplia colonización por estos gérmenes254, pero su frecuente presencia en infecciones polimicrobianas59,255–257 sugiere también la posibilidad de origen entérico, en muchos casos. Las guías 2016 sugieren la ampicilina intraperitoneal como tratamiento óptimo, durante dos semanas. Este comité considera que, dada la habitual sensibilidad de estos gérmenes a antibióticos de uso empírico habitual (vancomicina y cefalosporinas)59,257, es igualmente sensato mantener uno de los antibacterianos de inicio (de preferencia una cefalosporina), en la mayoría de los casos.
EnterococosLas IP por enterococos tienen un curso clínico variable, pero a menudo complicado, por varios motivos. En primer lugar, pueden tener origen entérico, a menudo se presentan en un entorno polimicrobiano y, con frecuencia, reflejan procesos abdominales quirúrgicos subyacentes. En segundo lugar, sus patrones de sensibilidad antibiótica son complejos258. La mayoría de las cepas son resistentes a aminoglicósidos a baja concentración, aunque gentamicina y estreptomicina pueden presentar sinergismo si se administran en combinación con glicopéptidos o ampicilina. Además, aunque de forma poco habitual, constituyen la familia de grampositivos más frecuentemente resistentes a glicopéptidos. De las dos especies más habituales, las infecciones por Enterococcus faecium suelen tener patrones de sensibilidad y cursos clínicos más complicados258. Por último, se trata de gérmenes con importantes recursos para neutralizar los mecanismos de defensa antibacteriana y protegerse mediante biofilms258,259.
Las guías ISPD 201614 sugieren como terapia más apropiada vancomicina (más aminoglicósido en caso de sinergismo) durante tres semanas, y antibioterapias alternativas según susceptibilidad en caso de cepas resistentes a vancomicina (ampicilina, linezolid, daptomicina, o quinupristina/dalfopristina). Este comité hace algunas matizaciones:
- –
Para cepas sensibles, ampicilina puede ser una opción más apropiada, siendo vancomicina o linezolid más adecuadas como opciones de reserva para cepas resistentes.
- –
Aunque las guías ISPD indican terapia combinada solo en casos graves, sugerimos que la sinergia con aminoglicósidos puede ser aprovechada en todas las IP enterocócicas, sobre todo en pacientes sin función renal residual.
- –
No todos los aminoglicósidos son igualmente eficaces frente al enterococo. Gentamicina y estreptomicina muestran mayor eficacia, en este contexto258.
- –
Quinupristina/dalfopristina tiene un papel práctico limitado en el tratamiento de estas infecciones, por su escasa actividad frente a Enterococcus faecalis y por una experiencia insuficiente en su uso244.
Dada la capacidad demostrada por el género Corynebacterium para generar IP recurrentes y recaídas, este comité muestra su acuerdo con la sugerencia14 de prolongar el tratamiento de las IP con vancomicina al menos tres semanas. Un estudio observacional y multicéntrico reciente260 sugiere que dos semanas de antibioterapia pueden ser suficientes (en lugar de las tres que recomiendan las guías ISPD), y que una cefalosporina de primera generación puede ser equivalente a la vancomicina recomendada. Sin embargo, en este estudio la mayoría de los pacientes tratados inicialmente con cefazolina fueron transferidos a vancomicina tras el aislamiento, con riesgo importante de sesgos.
Diferentes bacilos grampositivos pueden ser causa de IP en DP, incluyendo gérmenes de los géneros Aerococcus, Propionibacterium, Listeria261, Bacillus262 o Microbacterius263, entre otros. Algunas de estas infecciones parecen mostrar pautas particulares de sensibilidad antimicrobiana o recurrencia, pero la experiencia se reduce a casos clínicos aislados o series muy pequeñas, por lo que las pautas terapéuticas deben ser individualizadas de acuerdo con las sensibilidades de cada microorganismo.
EnterobacteriaceaeLas guías ISPD no individualizan las IP por esta familia de microorganismos, subsumiéndolas en el conjunto de las IP por gérmenes gramnegativos (solo se tratan por separado las IP por Pseudomonas spp.)14. La única recomendación para este capítulo es la de prolongar el tratamiento durante al menos tres semanas, que este comité asume.
Las IP por enterobacterias tienen un pronóstico grave, con tasas de fracaso terapéutico, fallo de la técnica de DP y mortalidad superiores a las de cualquier grampositivo, con excepción de Staphylococcus aureus. Esta agresividad procede, fundamentalmente, de tres factores:
- –
Agresividad clínica intrínseca de las infecciones por diferentes especies, incluyendo Escherichia coli. Este comité considera que el uso de asociaciones antibióticas sinérgicas podría ser de utilidad en casos clínicamente agresivos, pero la evidencia a favor de esta estrategia es débil264.
- –
Probabilidad de procesos abdominales subyacentes, que generan, mantienen y agravan el curso clínico265. El riesgo de esta circunstancia es claro en las IP polimicrobianas. Aunque claramente menor en las monobacterianas, este comité sugiere considerar esta posibilidad, indicando pruebas de imagen, en las IP por Enterobacteriaceae de curso clínico agresivo.
- –
Patrones de resistencia antibacteriana progresivamente más complejos y, a menudo, difíciles de manejar248. La aparición de cepas productoras de betalactamasas de espectro extendido (sobre todo Escherichia coli y Klebsiella spp.) y carbapenemasas han representado un importante motivo de preocupación14. Las primeras pueden ser tratadas con carbapenems, pero las segundas obligan a menudo a indicar antibióticos no habituales (como la colistina) con cuyo uso el nefrólogo de DP no suele estar familiarizado, y el riesgo de fracaso terapéutico es elevado266,267. La introducción creciente de nuevas cefalosporinas combinadas con inhibidores de betalactamasas puede representar una solución a este problema.
Este comité asume las principales recomendaciones de las guías ISPD 201614 para el tratamiento de IP por Pseudomonas spp., que incluyen tratamiento con dos antibióticos con actividad antipseudomónica durante al menos tres semanas, y retirada de catéter en caso de infección concomitante de túnel u orificio de salida. Un 38% de los miembros del panel estiman que la monoterapia es también apropiada en las IP no agresivas. Desde la publicación de las citadas guías apenas se ha generado evidencia adicional. Un estudio observacional y unicéntrico247 no ha mostrado ventaja en añadir un tercer antimicrobiano (quinolona) a la pauta habitual de dos antibióticos (betalactámico y amikacina) para tratar infecciones por Pseudomonas spp.
El tratamiento de las IP por microorganismos del género Acinetobacter puede plantear retos importantes. En particular, la multirresistencia, incluyendo resistencia a carbapenems, es muy frecuente, sobre todo en Acinetobacter baumannii, lo que podría aumentar el riesgo de fracaso terapéutico. El tratamiento de base es similar al de las IP por Pseudomonas spp., pero debe ser individualizado en las especies más multirresistentes. Por otro lado, un reciente estudio del registro Anzdata243 ha mostrado tasas razonables (74%) de éxito terapéutico en estas infecciones, a pesar de un uso minoritario de terapias combinadas (13%), así como resultados comparables tras tratamiento con aminoglicósidos, quinolonas o ceftazidima. Las bacterias del género Stenotrophomona muestran también grados notables de multirresistencia, aunque suelen ser sensibles al cotrimoxazol14. Dado su curso clínico frecuentemente complicado, parece razonable el uso de asociaciones antibióticas, siempre que los patrones de sensibilidad lo permitan.
Infecciones polimicrobianasEste comité suscribe las principales recomendaciones de las guías ISPD 201614 respecto a las IP polimicrobianas:
- –
Las causadas por gérmenes no entéricos deben ser tratadas de acuerdo con sensibilidad antibiótica durante tres semanas.
- –
Las causadas por flora entérica deben ser tratadas con antibioterapia de amplio espectro, que cubra grampositivos, enterobacterias y anaerobios, durante al menos tres semanas. La combinación metronidazol + vancomicina + aminoglicósido o ceftazidima o ceftriaxona parece adecuada, para este cometido. Es esencial realizar una valoración quirúrgica individualizada.
Este comité realiza algunas pequeñas matizaciones:
- –
No existe evidencia clara sobre la duración requerida para el tratamiento de IP polimicrobianas no entéricas. Las causadas por gérmenes no agresivos (SCN o estreptococos) podrían ser tratadas durante dos semanas. Consideramos que, en general, el tratamiento debe durar lo que precise el microorganismo más agresivo aislado.
- –
Para las IP con presencia de flora entérica, este comité hace hincapié en la conveniencia (al menos en los primeros días) de cobertura de anaerobios recomendada por las guías ISPD, aunque no se objetive aislamiento inicial, dado el crecimiento frecuentemente tardío de estos microorganismos. Tal y como las propias guías sugieren, antimicrobianos con actividad frente a enterobacterias y anaerobios (carbapenems o penicilina-tazobactam) pueden realizar este cometido en monoterapia.
- –
Este comité enfatiza que el término valoración quirúrgica no implica necesariamente intervención, sino valoración clínica y por imagen. La decisión de intervenir se basa en estos criterios.
Este comité suscribe las principales recomendaciones de las guías ISPD 2016 para el tratamiento de IP fúngicas14, con alguna consideración:
El manejo debe incluir la retirada del catéter peritoneal. Aunque la retirada inmediata es la medida más habitual, algunos grupos optan por mantenerlo en los primeros días de tratamiento. El objetivo es seguir disponiendo de la vía intraperitoneal para la administración de antifúngicos y reducir la respuesta inflamatoria lo que, teóricamente, reduciría el daño a la membrana peritoneal. El catéter se retira posteriormente, tras inducir remisión de la infección, tanto más si el comportamiento es refractario. La evidencia escasa y contradictoria191,192 no permite emitir una recomendación clara al respecto. El panel de expertos se mostró en este caso profundamente dividido, incluyendo un 19% de miembros que no consideran imprescindible la retirada del catéter, y dividiéndose a partes iguales los partidarios de la retirada inmediata frente a los que prefieren intentar primero inducir la remisión de la infección. En todo caso, este comité considera que no se debe demorar la retirada del catéter en las infecciones clínicamente agresivas.
Un estudio reciente, retrospectivo y no controlado, ha mostrado tasas aceptables de curación de IP fúngicas sin retirada de catéter, usando un sellado con anfotericina B en una muestra de 11 casos223. La endeblez de la evidencia aportada no modifica los puntos de vista expuestos en el párrafo anterior.
La terapia antifúngica debe mantenerse al menos dos semanas tras la retirada del catéter peritoneal. Aunque anfotericina y flucitosina han sido la base del tratamiento de estas infecciones durante décadas, los azoles y las equinocandinas se han impuesto progresivamente en los últimos años. La anfotericina mantiene intacta su eficacia frente a levaduras y hongos filamentosos, pero presenta toxicidad significativa, tiene pobre penetración a peritoneo administrada por vía intravenosa, y es irritante por vía intraperitoneal. Los azoles muestran gran eficacia, pero de los dos más utilizados, fluconazol muestra actividad limitada frente a Candida no Albicans, y la incidencia de resistencias es significativa. Voriconazol muestra un efecto más consistente, y es activo frente a hongos filamentosos, pero su excipiente impide la administración intravenosa prolongada, en presencia de insuficiencia renal. Las equinocandinas son muy eficaces, y muestran buena penetración a cavidad peritoneal cuando se administran por vía intravenosa, aunque hay poca experiencia en cuanto a su administración intraperitoneal. No disponemos de información que nos permita emitir una recomendación sobre cuál es la terapia antifúngica más adecuada, pero es positivo que el número de alternativas terapéuticas se expanda268.
MicobacteriasLas guías ISPD no emiten ninguna recomendación específica respecto a las IP por micobacterias14, pero sí consideraciones con las que este comité muestra su acuerdo, incluyendo la lógica indicación de tratamiento antibiótico combinado por tiempo suficiente. Asimismo, se resalta que la decisión sobre retirada del catéter peritoneal debe ser individualizada, aunque suele ser necesario en la mayoría de los casos. No hay información reciente que modifique estos puntos de vista.
Cultivo negativoA pesar de representar entre un 10 y un 30% de las IP5, la información sobre el manejo de las IP con cultivo negativo es limitada. Una de las grandes dificultades para emitir recomendaciones para estas IP deriva de la heterogeneidad de causas por las que se pueden producir (tabla T4). Por eso las sugerencias de las guías ISPD 2016 sobre IP con cultivo negativo se basan en opinión del comité de expertos14.
Causas más habituales de cultivo negativo en una posible infección peritoneal
| Causa | Claves diagnósticas |
|---|---|
| Inflamación peritoneal no infecciosa (química, icodextrina, eosinófila) (v. también la Tabla D5) | Anamnesis y contexto clínicoCelularidad peritoneal con monocitosis (icodextrina) o eosinofilia (eosinófila) |
| Germen de crecimiento tórpido o que precisa medios especiales (hongos filamentosos, micobacterias) | Contexto clínicoVigilancia de crecimientos tardíosCultivo en medios específicos o PCR tras sospecha (curso refractario o intermitente) |
| Vírica (herpesvirus) | Celularidad monocitariaPCR específica tras sospechaCultivo en medios adecuados tras sospechaProbablemente excepcional, salvo contextos específicos (p. ej., inmunosuprimidos) |
| Gérmenes lábiles en cultivo | Generalmente grampositivosDiagnóstico y tratamiento por defecto |
| Tratamiento antibiótico activo/reciente | Historia clínica |
| Muestra poco concentrada (obtenida tras permanencia corta) | Control de calidadToma correcta de muestrasSe asume grampositivo por defecto |
| Muestra obtenida o conservada en condiciones inadecuadas | Manejo correcto de muestrasSe asume grampositivo por defecto |
Un reciente análisis del grupo Anzdata269 sobre 1.760 episodios de IP con cultivo negativo confirmó el pronóstico relativamente benigno de estas infecciones. Notablemente, los regímenes de tratamiento (en monoterapia o combinados) basados en cefazolina mostraron eficacia superior a los basados en vancomicina.
Este comité sugiere la siguiente estrategia:
- Si al tercer día la infección muestra signos de remisión, asumir por defecto IP por grampositivos, y mantener solamente cefalosporina o vancomicina, hasta completar dos semanas.
- Si al tercer día la infección muestra indicios de resolución lenta, mantener tratamiento empírico inicial y valorar toma de muestras para cultivo y PCR de micobacterias, según contexto clínico.
- Si la infección muestra refractariedad al quinto día, repetir cultivo y valorar antibioterapia alternativa (daptomicina, carbapenem) y/o retirada de catéter, según criterio clínico.
Desde la publicación de las guías ISPD hasta la actualidad se ha generado poca evidencia que modifique los criterios expuestos. Destacan tan solo estudios observacionales, no controlados, que sugieren la eficacia de vancomicina y cefalosporinas para el tratamiento de las IP estreptocócicas59, la viabilidad de monoterapia en las IP por Acinetobacter spp.243, la posibilidad de aplicar sellados con anfotericina como alternativa a la retirada del catéter en las IP fúngicas223 y la posible superioridad de cefazolina sobre vancomicina en el tratamiento de las IP con cultivo negativo269. Ninguno de estos estudios aporta un grado de evidencia que modifique los puntos de vista previos.
De la evidencia a la recomendación
Este comité asume las recomendaciones de la ISPD 201614, pero desea hacer algunas ligeras modificaciones, basadas en opinión y en información no controlada reciente.
Recomendaciones
Para las IP por ECN, recomendamos el tratamiento con vancomicina o cefalosporinas de primera o segunda generación durante el mínimo plazo establecido de dos semanas (1B).
Para las recaídas o recurrencias frecuentes de las IP por ECN, este comité sugiere individualizar la estrategia. En caso de decidirse el cambio de catéter peritoneal, la retirada e implantación puede hacerse de manera simultánea o tras un breve intervalo, una vez conseguida la remisión (2B).
Recomendamos mantener el tratamiento de las IP por Staphylococcus aureus al menos durante tres semanas (1C).
Recomendamos un despistaje exhaustivo de infección simultánea asociada a catéter en las IP por Staphylococcus aureus, y valorar la retirada del catéter peritoneal en las IP por Staphylococcus aureus asociadas a infección extensa de partes blandas o absceso de pared por el mismo microorganismo (1B).
Recomendamos tratar las IP por cepas sensibles a meticilina de Staphylococcus aureus con una cefalosporina de primera generación o vancomicina, mientras que las meticilin-resistentes se han de tratar con vancomicina o daptomicina (1C).
Sugerimos asociar un aminoglicósido en las IP por Staphylococcus aureus de presentación clínica agresiva (2C).
Sugerimos que las IP estreptocócicas sean tratadas con vancomicina o betalactámicos (ampicilina o cefalosporina) durante un mínimo de dos semanas, a partir del protocolo empírico aplicado inicialmente (2C).
Recomendamos que las IP enterocócicas sean tratadas con ampicilina o vancomicina (más aminoglicósido en caso de sinergismo) durante tres semanas, y antibioterapias alternativas según susceptibilidad en caso de cepas resistentes (linezolid, daptomicina) (1C).
Sugerimos que las IP por Corynebacterium sean tratadas con vancomicina durante al menos tres semanas (2C).
Recomendamos que las IP por Enterobacteriaceae sean tratadas durante al menos tres semanas (1C).
Sugerimos tratar con asociaciones antibióticas sinérgicas (cefalosporina y aminoglicósido) o carbapenem las IP por Enterobacteriaceae de presentación clínica agresiva (2C).
Recomendamos tratar las IP por Pseudomonas spp. con dos antibióticos con actividad antipseudomónica durante al menos 3 semanas, y retirar el catéter peritoneal en caso de infección concomitante de túnel u orificio de salida (1B).
Recomendamos tratar las infecciones polimicrobianas por gérmenes no entéricos durante dos o tres semanas, de acuerdo con el aislamiento de mayor agresividad (1C).
Recomendamos tratar las IP polimicrobianas con aislamiento de gérmenes entéricos con antibioterapia de amplio espectro, que cubra grampositivos, enterobacterias y anaerobios, durante al menos tres semanas (1C).
Recomendamos pruebas de imagen abdominal y/o valoración quirúrgica en las IP polimicrobianas entéricas, y en la causadas por Enterobacteriaceae o enterococos con presentación clínica agresiva, tórpida o refractaria (1C).
Recomendamos en las IP con cultivo negativo y remisión rápida, orientar el tratamiento a grampositivos, y mantenerlo durante dos semanas (1C).
En las IP con cultivo negativo y curso refractario al tratamiento empírico, sugerimos pasar a una terapia alternativa como máximo a partir del quinto día, y valorar retirada del catéter peritoneal (2C).
Han surgido pocas evidencias que modifiquen las consideraciones contenidas en las guías ISPD de 201614. Un estudio reciente, retrospectivo y no controlado223, sobre 11 pacientes con IP por levaduras ha mostrado una tasa razonable de éxito terapéutico (64%) sin retirada de catéter, utilizando sellados con anfotericina B.
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614, con algunos matices que se describen a continuación.
Recomendaciones
Recomendamos la retirada del catéter peritoneal en las IP por levaduras (1C).
Recomendamos tratamiento con antifúngicos según sensibilidad antibiótica durante al menos dos semanas tras la retirada del catéter peritoneal, en las IP por levaduras (1C).
Sugerimos que un azol (si la cepa es sensible) o una equinocandina (solos o asociados hasta conocer sensibilidad antimicrobiana) ofrecen un balance de eficacia-toxicidad superior a la anfotericina B, sola o asociada a flucitosina, en las IP por levaduras (2D).
Tras la publicación de las guías ISPD 2016, solo hemos recogido un estudio descriptivo sobre 14 casos de IP por micobacterias atípicas270 que no aporta información novedosa, aunque sí resalta el riesgo ya conocido de confundir estos gérmenes con difteroides.
De la evidencia a la recomendación
Este comité apoya las recomendaciones ISPD 201614, con algunos matices que se describen a continuación.
Recomendaciones
Recomendamos tratamiento combinado por tiempo suficiente para las IP por micobacterias (1C).
Recomendamos que, salvo en las formas clínicamente leves o con rápida respuesta a tuberculostáticos, se retire el catéter peritoneal en las IP por micobacterias (1C).
Sugerimos el despistaje sistemático de infección por micobacterias, en las IP con cultivo negativo y curso clínico tórpido o refractario (2B).
Este comité asume las definiciones relacionadas con una evolución atípica de una IP propuestas por las guías ISPD de 20057, 2010271 y 201614 (tabla D6). Consideramos, por principio, que no procede sugerir cambios en un sistema estandarizado a nivel internacional, aunque observamos alguna debilidad en las definiciones (o en su traducción al castellano), que comentamos más adelante.
Infección peritoneal refractariaEste comité apoya, en su conjunto, el enfoque de las guías ISPD 201614 en cuanto a la conveniencia de retirar el catéter peritoneal en caso de IP refractaria. Aunque no existe evidencia controlada, la experiencia general es que esta medida protege la vida del paciente y reduce el sufrimiento, siendo menos evidente su capacidad para preservar la membrana peritoneal con vista a la continuación de DP253. Queremos resaltar el carácter equívoco de la definición de IP refractaria en la formulación ISPD ya que, literalmente, demanda normalización de la celularidad peritoneal al 5° día de tratamiento específico. Sugerimos que el término refractario sea reservado para este contexto, pero consideramos que los casos con tendencia a mejoría (dolor en clara regresión, cultivos de control negativos y descenso inequívoco en el recuento celular, con evolución hacia un patrón monocitario) deben considerarse IP de resolución lenta. En estas circunstancias, la decisión de retirar el catéter debe ser individualizada, después de considerar estrategias alternativas (cambio/adición de antimicrobiano, monitorizar los niveles de antibiótico), valorar el estado clínico del paciente y ponderar el riesgo-beneficio de la medida.
Infección peritoneal con recaída o recurrenciaLas guías ISPD 2016 son deliberadamente ambiguas al hacer recomendaciones sobre el manejo de las IP con recaída, recurrentes o repetidas14, indicando que, en cualquiera de estas circunstancias, hay que considerar la retirada del catéter peritoneal. Estando de acuerdo con esta recomendación, desde este comité planteamos algunas matizaciones:
- –
En primeras recaídas de IP recomendamos revisar posibles quiebras en las condiciones de tratamiento de la IP original, incluyendo factores limitantes de respuesta (catéter-dependencia, patología abdominal), mala adherencia, antibioterapia no óptima o infradosificación.
- –
En primeras recaídas de IP de baja agresividad es criterio unánime del panel de expertos que la mejor alternativa es un nuevo ciclo antibiótico, prolongando su duración al menos tres semanas y/o administrando antimicrobianos con buen comportamiento frente a biofilms, con preferencia a la retirada directa del catéter.
- –
En primeras recaídas de IP agresivas, o en segundas recaídas, recomendamos considerar la retirada del catéter peritoneal.
- –
En el caso de IP recurrente o repetida el primer paso debe ser revisar la adherencia a la técnica por parte del paciente o cuidador.
- –
En caso de IP recurrente por gérmenes entéricos es esencial investigar exhaustivamente la presencia de patología abdominal subyacente.
Las guías ISPD 2016 no incluyen un apartado específico sobre el abordaje de las IP dependientes de catéter, aunque realizan múltiples consideraciones pertinentes a esta situación. Se asume que una IP fúngica, refractaria o con recaída se incluiría, sensu estricto, en esta categoría, dado que se considera que el catéter está colonizado y su mantenimiento va a perpetuar la infección.
En este aspecto, este comité asume las recomendaciones ISPD de valorar la retirada del catéter en las IP fúngicas, refractarias o con recaídas.
Los objetivos son acelerar la recuperación, mitigar el sufrimiento, reducir la mortalidad y generar un entorno que haga posible, si el paciente lo desea, volver a intentar el tratamiento con DP. Tras la retirada del catéter se debe permitir un lapso de tiempo (mínimo dos semanas) hasta la inserción de un nuevo catéter. Sin embargo, cuando el catéter se retira durante un período de remisión de la IP, se puede considerar la retirada y reinserción simultánea. Esta estrategia proporciona, en general, buenos resultados en las IP por ECN14, y se ha intentado, con éxito menos consistente, en IP por gérmenes más agresivos, como Staphylococcus aureus272 o Pseudomonas spp.273. Este comité apoya esta estrategia en las IP por ECN, pero no en los otros casos mencionados.
En el caso de las IP asociadas a infección del orificio de salida o túnel del catéter peritoneal, las guías ISPD 2016 son poco explícitas. Es preciso remitirse a las guías ISPD 201725 sobre infección asociada a catéter. En esta circunstancia, se sugiere valorar la retirada del catéter, permitiendo un plazo mínimo de dos semanas antes de insertar un nuevo catéter. Esta estrategia es especialmente conveniente en caso de infección por gérmenes agresivos y/o persistentes, como Staphylococcus aureus, BGN no fermentadores o enterobacterias (Serratia spp., Proteus spp. y otros)272. Este comité asume esta aproximación, recalcando que es posible un abordaje conservador de estas infecciones, siempre que no concurran elementos de complicación (IP refractaria o de resolución lenta, absceso de pared o infección de catéter refractaria o recurrente).
No consta evidencia reciente que modifique las consideraciones contenidas en las guías ISPD de 201614. Los estudios observacionales de Szeto274 y Burke et al.275 se mantienen como únicas referencias válidas para orientar el manejo de estos casos. Con posterioridad, solamente registramos dos pequeños estudios observacionales, unicéntricos y descriptivos, que no aportan información relevante276,277.
No consta evidencia reciente que modifique las consideraciones contenidas en las guías ISPD de 2016 14.
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614, con algunos matices que se describen a continuación
Recomendaciones
Recomendamos la retirada del catéter peritoneal en caso de IP refractaria (1C).
Sugerimos que, en las IP de resolución lenta (actividad decreciente al 5° día de tratamiento), se valore la optimización del tratamiento antimicrobiano antes de plantear la retirada del catéter (2C).
Recomendamos retirar el catéter peritoneal en las recaídas de IP agresivas, o en las segundas recaídas de cualquier IP (1C).
Sugerimos tratamiento antimicrobiano prolongado y optimizado para el manejo inicial de las IP no agresivas en primera recaída (2C).
Recomendamos investigar posibles factores causales de IP recurrente, incluyendo mala adherencia a la técnica o patologías abdominales ocultas (1C).
Sugerimos considerar la retirada del catéter peritoneal dentro de la estrategia de abordaje de la IP recurrente (2C).
Las guías ISPD de 201614 abordan muy tangencialmente esta cuestión, que sí es revisada por las guías 2017 de infección de catéter25. No hemos registrado artículos más recientes que aporten evidencia de valor al citado documento.
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614 y 201725, con ligeros matices.
Recomendaciones
Recomendamos la retirada del catéter peritoneal en las IP asociadas a infección de catéter por el mismo microorganismo en los siguientes casos: IP refractaria, IP de resolución lenta, IP con recaída, IP asociada a absceso de pared e IP asociada a infección de catéter de resolución tórpida o recurrente (1C).
Sugerimos considerar la retirada de catéter en los demás casos de infección simultánea del catéter por el mismo microorganismo (2C).
Sugerimos permitir un plazo de al menos dos semanas entre la retirada del catéter y la reinserción de un nuevo catéter, en las IP asociadas a infección de catéter por el mismo microorganismo (2C).
No consta evidencia reciente que modifique las consideraciones contenidas en las guías ISPD de 201614.
De la evidencia a la recomendación
Este comité asume las recomendaciones ISPD 201614.
Recomendaciones
Recomendamos establecer un lapso de al menos 2 semanas entre la retirada de un catéter peritoneal por IP y la inserción de un nuevo catéter (1C).
Recomendamos no intentar la inserción de un nuevo catéter si persisten signos de irritación peritoneal (1C).
Sugerimos que es posible la retirada e implantación simultáneas de un catéter peritoneal en IP, siempre que la infección esté en remisión completa y sea causada por microorganismos no agresivos (2B).
Se presentan en la tabla T514,237,240,244,278,279. Es importante resaltar la escasez de estudios controlados que permitan establecer las dosis de manera fiable. La mayor parte de las recomendaciones proceden de estudios observacionales no controlados, y muchas se basan en extrapolaciones de las dosis intravenosas correspondientes. Además, en general, no tienen en cuenta variables tan importantes como el tamaño corporal, el sexo, la función renal residual o la pauta de DP. Afortunadamente, existe un amplio cuerpo de experiencia empírica en el manejo de los antibióticos más comunes (vancomicina, cefalosporinas, carbapenemes y aminoglicósidos), que permiten al nefrólogo de DP dosificar con relativa tranquilidad.
Dosificación tentativa de antibioterapia intraperitoneal
| Antibiótico | Dosis intermitente diaria | Dosis continua | Observaciones |
|---|---|---|---|
| Amikacina | 2 mg/kgDC | 12 mg/LDC | Continua no recomendadaRecomendable monitorizar nivelesFRR |
| Gentamicina | 0,6 mg/kgDC | 4 mg/LDC | Continua no recomendadaRecomendable monitorizar nivelesFRR |
| Tobramicina | 0,6 mg/kgDC | 10 mg/LDC | Continua no recomendadaRecomendable monitorizar nivelesFRR |
| Cefazolina | 15-20 mg/kg | 125 mg/LDC | |
| Cefepime | 1.000 mg | 100-125 mg/LDC | En intermitente puede administrarse cada 48 hProblemas potenciales de estabilidad en soluciones de diálisis |
| Cefotaxima | 500-1.000 mg | 125-250 mg/LDC | Evidencia insuficiente en continuaFRR |
| Ceftazidima | 1.000-1.500 mg | 125 mg/LDC | En intermitente puede administrarse cada 48 hProblemas potenciales de estabilidad en soluciones de diálisisFRR |
| Ceftriaxona | 1.000 mg | Sin datos | |
| AmpicilinaAmpicilina-Sulbactam | 500-1.000 mg1.000 mg × 2 | 125 mg/L100 mg/LDC | Problemas potenciales de estabilidad en soluciones de diálisisFRR |
| Piperacilina-Tazobactam | 2.000 mg × 2 | 500 mg/LDC | FRR |
| Aztreonam | 500-1.000 mg × 2 | 125-250 mg/LDC | FRR |
| Ciprofloxacino | 500 mg | 50 mg/L | Intermitente no recomendada por falta de información |
| Ofloxacino | 100 mg | 25 mg/LDC | Intermitente no recomendada por falta de información |
| Daptomicina | 250-350 mgDC | 20 mg/LDC | En intermitente puede administrase cada 48 hProblemas potenciales de estabilidad en soluciones de diálisisIcodextrina interfiere con determinación de niveles |
| Linezolid | Sin datos | Sin datos | Estable en soluciones de DP, pero no recomendado por falta de experiencias clínicas |
| Quinupristina/ dalfopristina | 25 mg/L × 2DC | Sin datos | |
| Imipenem-Cilastatina | 500 mg × 2 | 50-125 mg/LDC | Problemas potenciales de estabilidad en soluciones de diálisisFRR |
| Meropenem | 1.000 mg | 125 mg/L | Poca experiencia con continuaFRR |
| Vancomicina | 15-30 mg/kg | 25-150 mg/LDC | Recomendable monitorizar nivelesFRR |
| Teicoplanina | 15-30 mg/kg | 10-50 mg/LDC | Recomendable monitorizar nivelesFRR |
| Cotrimoxazol | Sin datos | 40/200 mg/LDC | Experiencia escasa |
| Fluconazol | 200 mg | 25-50 mg/L | FRR |
| Voriconazol | 2,5 mg/kg | Sin datos | Riesgo de acumulación de excipiente SBECD tras administración parenteral prolongada |
SBECD: sulfobutiléter betaciclodextrina sódica; DP: diálisis peritoneal; DC: administrar dosis de carga inicial; FRR: prestar especial atención a la función renal residual para dosificar.
Fuentes: 14,232,235,239,273,274
Es importante resaltar también la importante variabilidad en los resultados de estudios que analizan la estabilidad de los antibióticos en las soluciones de DP. En general, los más utilizados mantienen su actividad más allá de 24 horas, y algunos lo hacen durante muchos días278. Sin embargo, un estudio reciente279 ha cuestionado la estabilidad de amoxicilina, cefepime, imipenem y ceftazidima y, no recomienda almacenamiento por más de 24 horas para vancomicina, cefazolina, tobramicina y cotrimoxazol. Los centros que mantienen la práctica de proporcionar bolsas de dializado con antibiótico a los pacientes con IP deben tener en cuenta este factor.
Propuestas de estudio y mejoraEsta guía pone de manifiesto, una vez más la escasez y baja calidad de la evidencia científica disponible en el campo de la Diálisis Peritoneal. Prácticas clínicas absolutamente consagradas por el tiempo carecen en realidad de un sustrato probatorio robusto de sus efectos beneficiosos o adversos. No pocas medidas de prevención o políticas de prescripción de antibióticos provocan desconcierto y, a veces, franco desacuerdo entre los microbiólogos y especialistas en enfermedades infecciosas. En ausencia (y a la espera) de mejor evidencia, hemos intentado alcanzar un equilibrio entre las recomendaciones de la ortodoxia general sobre las enfermedades infecciosas y las vigentes en la ISPD, que han sido propuestas por sucesivos comités de expertos, avaladas por la práctica, y no descalificadas por estrategias alternativas. El diseño de esta guía, sujeto al sistema GRADE, está orientado a integrar periódicamente nuevas informaciones que aporten o mejoren la calidad de nuestro conocimiento.
El panel de expertos considera que, en general, hacen falta más ensayos clínicos aleatorizados para contestar a las múltiples cuestiones controvertidas relacionadas con la prevención y tratamiento de las IP. Algunos aspectos sobre los que se ha mostrado interés específico incluyen:
- –
Conveniencia de disponer de un registro común a nivel nacional (con participación de médicos y enfermería de DP) que permita profundizar en el abordaje de estas infecciones, de forma parecida a lo logrado en el entorno Anzdata.
- –
Aplicación sistemática de estrategias combinadas de prevención (mejora continua en la calidad).
- –
Utilidad clínica de las técnicas emergentes de diagnóstico precoz/rápido y predicción de riesgo de recaídas de las IP.
- –
Mejoras en conectología, especialmente para pacientes con discapacidades.
- –
Mejorar la escasa y controvertida información sobre los cuidados óptimos, a corto y largo plazo, del orificio cutáneo del catéter peritoneal, incluyendo la conveniencia del uso de antibacterianos tópicos y su modo de aplicación.
- –
Definición de protocolos de tratamiento de portadores de Staphylococcus aureus.
- –
Utilidad real de los protocolos de profilaxis de IP en pacientes sometidos a procedimientos invasivos.
- –
Papel de los cambios en la microbiota intestinal y general de los pacientes en la epidemiología y prevención de las IP en DP.
- –
Papel de los sellados con antibacterianos para la prevención y tratamiento de las IP de curso complicado.
- –
Epidemiología y tratamiento de las IP por microorganismos multirresistentes.
- –
Indicaciones y utilidad clínica de las pruebas de imagen en las IP de curso atípico.
- –
Definición de criterios sobre el plazo de retirada del catéter peritoneal en las IP por levaduras.
- –
Información más completa sobre la farmacocinética y toxicidad de nuevos antibacterianos.
- –
Necesidad de registros comunes de IP en las nuevas indicaciones de la DP (insuficiencia cardíaca, hepatopatías con ascitis).
- –
Definición de pautas de prevención y tratamiento de las IP en las nuevas indicaciones de la DP (insuficiencia cardíaca, hepatopatías con ascitis).
- 1.
Se debe sospechar la presencia de IP en presencia de dolor abdominal y/o efluente peritoneal turbio. El diagnóstico se ha de confirmar mediante estudio citológico y microbiológico del efluente.
- 2.
La presencia de una concentración anormalmente elevada de leucocitos (> 100/mL) con presencia dominante de polimorfonucleares (> 50%) en el efluente es altamente sugestiva de la presencia de IP.
- 3.
El diagnóstico de IP se debe individualizar con relación a las circunstancias clínicas, partiendo de los criterios descritos en los apartados anteriores.
- 4.
Una valoración inicial cuidadosa, con una correcta recogida y manejo de muestras, es fundamental para asegurar el éxito en el manejo de la IP.
- 5.
Se debe realizar un análisis microbiológico sistemático del efluente mediante tinción de Gram, dentro del proceso diagnóstico inicial de la IP.
- 6.
Cada centro debe disponer de información evolutiva y actualizada de sus tasas de IP, globales y por agentes causales, utilizando estimadores estandarizados, al menos con periodicidad anual.
- 7.
Los parámetros monitorizados deben incluir, idealmente, la tasa global de IP, las tasas de IP por microorganismos específicos, el porcentaje de pacientes/año que permanecen libres de IP, y las resistencias antimicrobianas de los gérmenes causales.
- 8.
La mejor forma de comunicar las tasas de IP es en forma de número de episodios por paciente y año.
- 9.
Se deben aplicar similares criterios diagnósticos de IP en pacientes tratados con DP manual o automatizada.
- 10.
Es esencial monitorizar la IP de manera sistemática, mediante controles, clínicos, citológicos y microbiológicos, hasta que haya signos claros de una evolución favorable.
- -
Recomendamos que cada Unidad de DP desarrolle un programa de Mejora Continua de la Calidad para reducir la tasa de IP (1C) (Pregunta P1).
- -
Sugerimos que los equipos multidisciplinares responsables del programa de mejora continua en la calidad tengan reuniones periódicas de análisis de resultados (2C) (Pregunta P1).
- -
Recomendamos adoptar los principios de entrenamiento y monitorización de los pacientes propuestos por los documentos de la ISPD para reducir las tasas de IP (1C) (Pregunta P2).
- -
Recomendamos que el personal de enfermería que realiza las tareas de entrenamiento y monitorización de los pacientes sea especializado (1C) (Pregunta P2).
- -
Sugerimos que las visitas al domicilio del paciente, a ser posible iniciadas antes de comenzar el tratamiento con DP, pueden ayudar a reducir el riesgo de IP (2C) (Pregunta P2).
- -
Sugerimos que el reentrenamiento por indicación podría ayudar a reducir la incidencia de IP en situaciones de riesgo (2C) (Pregunta P2).
- -
En base a la evidencia disponible, este comité no avala los reentrenamientos programados para reducir la incidencia de IP (2C) (Pregunta P2).
- 1.
Recomendamos administrar profilaxis con antibióticos sistémicos inmediatamente antes de la inserción del catéter peritoneal (1A) (Pregunta P3).
- 2.
Sugerimos que cada programa de DP elija su propia pauta de profilaxis antibiótica, teniendo en cuenta el espectro de incidencia y sensibilidad antibiótica local (2D) (Pregunta P3).
- 3.
Sugerimos que vancomicina puede ser una opción preferente, pero una cefalosporina de primera o segunda generación puede aportar resultados equivalentes (2B) (Pregunta P3).
- 4.
Recomendamos que el riesgo de IP no sea una consideración a la hora de determinar qué técnica de inserción o qué diseño de catéter peritoneal se va a utilizar en un paciente en DP (1A) (Pregunta P3).
- 5.
Recomendamos la vigilancia y cura regular del orificio cutáneo del catéter peritoneal, a ser posible con periodicidad diaria, como forma indirecta de prevenir la IP (1C) (Pregunta P4).
- 6.
Recomendamos el tratamiento precoz de las infecciones asociadas a catéter, para prevenir su progresión a IP (1C) (Pregunta P4).
- 7.
Sugerimos la conveniencia de usar dispositivos de inmovilización que eviten las tracciones repetidas sobre el catéter peritoneal, al menos durante la fase de cicatrización postimplantación (2C) (Pregunta P4).
- 8.
Sugerimos que cada centro decida el tipo de jabón o antiséptico tópico para la cura del orificio del catéter con respecto a las condiciones de cada paciente (2C) (Pregunta P4).
- 9.
Sugerimos que cada centro decida el tipo de cura o apósito del orificio del catéter (descubierta o cerrada), de acuerdo con las condiciones de cada paciente, al no haber evidencia que apoye un tipo específico de forma general para prevenir la infección asociada a catéter y la IP (2C) (Pregunta P4).
- 10.
Recomendamos la administración de mupirocina o gentamicina tópicas durante el proceso de cuidados del orificio cutáneo del catéter peritoneal, como forma de reducir el riesgo de infección asociada a catéter e IP (1B) (Pregunta P5).
- 11.
Sugerimos la conveniencia de monitorizar periódicamente la posible emergencia de resistencias bacterianas a mupirocina o gentamicina entre la flora bacteriana (sobre todo Staphylococcus aureus) que coloniza las fosas nasales y el área pericatéter (2B) (Pregunta P5).
- 12.
Este comité no emite recomendación sobre la conveniencia de la administración diaria versus intermitente de los citados antibacterianos (no graduado) (Pregunta P5).
- 13.
Este comité considera que la evidencia no sustenta el tratamiento de portadores nasales de Staphylococcus aureus para reducir el riesgo directo de IP, aunque puede ser beneficioso a través de la reducción del riesgo de infección asociada a catéter (2B) (Pregunta P5).
- 1.
Recomendamos que la técnica de DP se realice siempre en un entorno higiénico, a ser posible con acceso cercano a una fuente de agua corriente (1C) (Pregunta P6).
- 2.
Recomendamos una correcta higiene de manos antes de la realización de la técnica de DP, basada en lavado de manos con jabón común o antibacteriano, seguido por fricción con solución hidroalcohólica (1C) (Pregunta P6).
- 3.
Recomendamos impedir el contacto físico de mascotas con los materiales de DP, y que el paciente extreme las medidas de asepsia y desinfección, si tiene contacto con mascotas (1C) (Pregunta P6).
- 4.
Este comité sugiere la conveniencia del uso de mascarilla para el intercambio, sobre todo en pacientes con mala salud dental y periodontal (2C) (Pregunta P6).
- 1.
Recomendamos los sistemas de desconexión y purgado antes de llenado como método preferente de conexión en DP (1A) (Pregunta P7).
- 2.
Sugerimos que los sistemas con doble bolsa incorporada son preferibles a los sistemas en Y con doble conexión (en desuso en nuestro país) (2B) (Pregunta P7).
- 3.
Recomendamos que la prevención de IP no se incluya entre las indicaciones para tratamiento con DP automatizada (1B) (Pregunta P8).
- 4.
Sugerimos que el uso soluciones biocompatibles no tiene un efecto contrastado sobre el riesgo de IP (2A) (Pregunta P9).
- 1.
Recomendamos que los pacientes sean específicamente instruidos durante el entrenamiento para DP sobre la actitud a adoptar en caso de producirse una rotura accidental en la línea de asepsia (1C) (Pregunta P10).
- 2.
Sugerimos que una contaminación húmeda o de naturaleza incierta se maneje con cambio en la línea de conexión y cobertura antibiótica, por vía oral o parenteral (intravenosa o intraperitoneal), que cubra gérmenes grampositivos y gramnegativos, y durante un mínimo de 2 días (2C) (Pregunta P10).
- 3.
Sugerimos que una contaminación seca se maneje, al menos, con cambio de la línea de conexión (2D) (Pregunta P10).
- 4.
Recomendamos que los pacientes en DP que vayan a ser sometidos a un procedimiento invasivo biliar, digestivo bajo o ginecológico reciban una profilaxis antibiótica apropiada (1C) (Pregunta P11).
- 5.
Sugerimos que la profilaxis antibiótica tenga actividad frente a enterobacterias y anaerobios intestinales habituales (2C) (Pregunta P11).
- 6.
Sugerimos que en las exploraciones endoscópicas digestivas altas no es necesario administrar profilaxis antibiótica (2C) (Pregunta P11).
- 7.
Sugerimos que la información disponible no permite establecer la conveniencia de vaciar la cavidad peritoneal para los procedimientos antes citados (no graduado) (Pregunta P11).
- 8.
Sugerimos que se considere profilaxis antibiótica habitual para procedimientos odontológicos, especialmente los de mayor potencial bacteriémico (no graduado) (Pregunta P11).
- 9.
Recomendamos que a los pacientes en DP que reciban tratamiento antibiótico por vía oral o parenteral se les administre profilaxis antifúngica por vía oral durante el período de tratamiento (1B) (Pregunta P12).
- 10.
Sugerimos que los azoles pueden ser más adecuados para este cometido, aunque la nistatina puede ser una alternativa adecuada (2C) (Pregunta P12).
- 11.
Sugerimos la conveniencia de mantener niveles plasmáticos adecuados de vitamina D (suplementándola si fuera necesario) con el fin de reducir el riesgo infeccioso, en general, en los pacientes tratados con DP (2D) (Pregunta P13).
- 1.
Recomendamos el inicio lo más precoz posible de antibioterapia una vez establecida la sospecha de IP (1C) (Pregunta T1).
- 2.
Recomendamos proporcionar siempre una adecuada cobertura de grampositivos y gramnegativos en el protocolo de tratamiento inicial de una IP (1C) (Pregunta T1).
- 3.
Recomendamos ajustar el protocolo de tratamiento empírico de las IP a la epidemiología local (1C) (Pregunta T1).
- 4.
Para los centros sin experiencia propia suficiente, recomendamos administrar vancomicina o una cefalosporina de primera generación para la cobertura de grampositivos y una cefalosporina de tercera generación o un aminoglicósido para la cobertura de gramnegativos (1B) (Pregunta T1).
- 5.
Sugerimos limitar el uso de aminoglicósidos en pacientes con IP y función renal residual significativa (2C) (Pregunta T1).
- 6.
Sugerimos el inicio de tratamiento de una IP con dosis antibióticas en el rango alto de su ficha técnica, teniendo en cuenta la función renal residual del paciente (2C).
- 7.
Sugerimos la conveniencia de disponer de protocolos antibióticos alternativos para pacientes con historial de alergias o intolerancias antibióticas, sobre todo a betalactámicos (2C) (Pregunta T1).
- 1.
Recomendamos la realización de lavados peritoneales en caso de drenado peritoneal muy turbio y/o dolor abdominal intenso, con los objetivos de aliviar el dolor y mejorar la mecánica de la DP (1C) (Pregunta T2).
- 2.
Sugerimos la adición de heparina a la solución de diálisis en pacientes con efluente turbio, para mantener una buena mecánica de la DP (2C) (Pregunta T2).
- 1.
Recomendamos que la vía intraperitoneal sea la de preferencia para el tratamiento de las IP en régimen ambulatorio, siempre que el nivel de entrenamiento del paciente lo permita (1B) (Pregunta T3).
- 2.
Sugerimos que, en pacientes ingresados, la vía intraperitoneal sea también la preferente, aunque la vía intravenosa también se considere apropiada, condicionando la decisión a las propiedades farmacocinéticas del antibiótico utilizado y el contexto clínico (2B) (Pregunta T3).
- 3.
Recomendamos que el tratamiento de una IP no se base en monoterapia por vía oral (1C) (Pregunta T3).
- 4.
Recomendamos que los aminoglicósidos intraperitoneales sean administrados en régimen intermitente para el tratamiento de la IP en DP (1B) (Pregunta T4).
- 5.
Recomendamos que la administración de vancomicina intraperitoneal pueda hacerse tanto en régimen intermitente como continuo (1B) (Pregunta T4).
- 6.
Sugerimos que, siempre que sea posible, se monitoricen los niveles plasmáticos de vancomicina y aminoglicósidos, especialmente en pacientes con función renal residual (2B) (Pregunta T4).
- 7.
Sugerimos que la administración intraperitoneal de betalactámicos y carbapenems pueda hacerse tanto en régimen intermitente como continuo, estando la decisión condicionada por el intervalo normal de dosificación de cada antibiótico (2C) (Pregunta T4).
- 8.
En pacientes en DP automatizada con IP tratados con antibioterapia intraperitoneal, recomendamos la administración de vancomicina y betalactámicos en régimen continuo, con el fin de evitar niveles infraterapéuticos en dializado durante las permanencias cortas nocturnas (1B) (Pregunta T5).
- 9.
Recomendamos que, en caso de optar por una pauta de administración intermitente de antibiótico, tanto por vía intravenosa como intraperitoneal u oral, se sigan en pacientes en DP automatizada criterios generales, similares a los mantenidos en DPCA (1B) (Pregunta T5).
- 10.
En pacientes en DP automatizada con IP recomendamos que, en caso de administración intraperitoneal intermitente, esta se haga en el curso de un cambio largo, con permanencia de al menos 6 horas (1B) (Pregunta T5).
- 11.
Sugerimos que, en pacientes en régimen de DP intermitente nocturna (día seco) que vayan a ser tratados por vía intraperitoneal, se introduzca temporalmente un cambio diurno, para facilitar la administración, intermitente o continua, del tratamiento antimicrobiano (2D) (Pregunta T5).
- 12.
Sugerimos que la práctica de transferir a los pacientes en DP automatizada a DPCA durante el tratamiento de una IP por vía intraperitoneal no está justificada por razones terapéuticas, aunque sí puede estarlo por motivos de índole práctica (2D) (Pregunta T5).
- 1.
Recomendamos una duración mínima de 14 días para el tratamiento antibiótico de una IP en DP (1B) (Pregunta T6).
- 2.
Sugerimos que puede ser conveniente prolongar el tratamiento al menos tres semanas en IP causadas por Staphylococcus aureus, Corynebacterium spp., Enterococcus spp., bacterias gramnegativas y flora mixta, con participación de gérmenes entéricos (2B) (Pregunta T6).
- 3.
Sugerimos prolongar la duración del tratamiento al menos una semana más cuando, en base a criterio clínico, se considere que existe un riesgo incrementado de evolución complicada de la IP (2C) (Pregunta T6).
- 4.
Recomendamos tratar con dos antibióticos sinérgicos las IP por Pseudomonas spp. y Stenotrophomonas spp. (1B) (Pregunta T7).
- 5.
Recomendamos el tratamiento con asociaciones antibióticas de las IP polimicrobianas, en relación a los microorganismos aislados (1B) (Pregunta T7).
- 6.
Sugerimos que, en las IP enterocócicas de curso agresivo tratadas con vancomicina o ampicilina, se considere la asociación de un aminoglicósido intraperitoneal, siempre que el antibiograma muestre potencial de sinergismo (2B) (Pregunta T7).
- 1.
Para las IP por ECN, recomendamos el tratamiento con vancomicina o cefalosporinas de primera o segunda generación durante el mínimo plazo establecido de dos semanas (1B) (Pregunta T8).
- 2.
Para las recaídas o recurrencias frecuentes de las IP por ECN, este comité sugiere individualizar la estrategia. En caso de decidirse el cambio de catéter peritoneal, la retirada e implantación puede hacerse de manera simultánea o tras un breve intervalo, una vez conseguida la remisión (2B) (Pregunta T8).
- 3.
Recomendamos mantener el tratamiento de las IP por Staphylococcus aureus al menos durante tres semanas (1C) (Pregunta T8).
- 4.
Recomendamos un despistaje exhaustivo de infección simultánea asociada a catéter en las IP por Staphylococcus aureus, y valorar la retirada del catéter peritoneal en las IP por Staphylococcus aureus asociadas a infección extensa de partes blandas o absceso de pared por el mismo microorganismo (1B) (Pregunta T8)
- 5.
Recomendamos tratar las IP por cepas sensibles a meticilina de Staphylococcus aureus con una cefalosporina de primera generación o vancomicina, mientras que las resistentes a meticilina se han de tratar con vancomicina o daptomicina (1C) (Pregunta T8).
- 6.
Sugerimos asociar un aminoglicósido en las IP por Staphylococcus aureus de presentación clínica agresiva (2C) (Pregunta T8).
- 7.
Sugerimos que las IP estreptocócicas sean tratadas con vancomicina o betalactámicos (ampicilina o cefalosporina) durante un mínimo de dos semanas, a partir del protocolo empírico aplicado inicialmente (2C) (Pregunta T8).
- 8.
Recomendamos que las IP enterocócicas sean tratadas con ampicilina o vancomicina (más aminoglicósido en caso de sinergismo) durante tres semanas, y antibioterapias alternativas según susceptibilidad en caso de cepas resistentes (linezolid, daptomicina) (1C).
- 9.
Sugerimos que las IP por Corynebacterium sean tratadas con vancomicina durante al menos tres semanas (2C) (Pregunta T8).
- 10.
Recomendamos que las IP por Enterobacteriaceae sean tratadas durante al menos tres semanas (1C) (Pregunta T8).
- 11.
Sugerimos tratar con asociaciones antibióticas sinérgicas (cefalosporina y aminoglicósido) o carbapenem las IP por Enterobacteriaceae de presentación clínica agresiva (2C) (Pregunta T8).
- 12.
Recomendamos tratar las IP por Pseudomonas spp. con dos antibióticos con actividad antipseudomónica durante al menos 3 semanas, y retirar el catéter peritoneal en caso de infección concomitante de túnel u orificio de salida (1B) (Pregunta T8).
- 13.
Recomendamos tratar las infecciones polimicrobianas por gérmenes no entéricos durante dos o tres semanas, de acuerdo con el aislamiento de mayor agresividad (1C) (Pregunta T8).
- 14.
Recomendamos tratar las IP polimicrobianas con aislamiento de gérmenes entéricos con antibioterapia de amplio espectro, que cubra grampositivos, enterobacterias y anaerobios, durante al menos tres semanas (1C) (Pregunta T8).
- 15.
Recomendamos pruebas de imagen abdominal y/o valoración quirúrgica en las IP polimicrobianas entéricas, y en la causadas por Enterobacteriaceae o enterococos con presentación clínica agresiva, tórpida o refractaria (1C) (Pregunta T8).
- 16.
Recomendamos en las IP con cultivo negativo y remisión rápida, orientar el tratamiento a grampositivos, y mantenerlo durante dos semanas (1C) (Pregunta T8).
- 17.
En las IP con cultivo negativo y curso refractario al tratamiento empírico, sugerimos pasar a una terapia alternativa como máximo a partir del quinto día, y valorar retirada del catéter peritoneal (2C) (Pregunta T8).
- 18.
Recomendamos la retirada del catéter peritoneal en las IP por levaduras (1C) (Pregunta T9).
- 19.
Recomendamos tratamiento con antifúngicos según sensibilidad antibiótica durante al menos dos semanas tras la retirada del catéter peritoneal, en las IP por levaduras (1C) (Pregunta T9).
- 20.
Sugerimos que un azol (si la cepa es sensible) o una equinocandina (solos o asociados hasta conocer sensibilidad antimicrobiana) ofrecen un balance de eficacia-toxicidad superior a la anfotericina B, sola o asociada a flucitosina, en las IP por levaduras (2D) (Pregunta T9).
- 21.
Recomendamos tratamiento combinado por tiempo suficiente para las IP por micobacterias (1C) (Pregunta T10).
- 22.
Recomendamos que, salvo en las formas clínicamente leves o con rápida respuesta a tuberculostáticos, se retire el catéter peritoneal en las IP por micobacterias (1C) (Pregunta T10).
- 23.
Sugerimos el despistaje sistemático de infección por micobacterias, en las IP con cultivo negativo y curso clínico tórpido o refractario (2B) (Pregunta T10).
- 1.
Recomendamos la retirada del catéter peritoneal en caso de IP plenamente refractaria (1C) (Pregunta T11).
- 2.
Sugerimos que, en las IP de resolución lenta (actividad decreciente al 5° día de tratamiento), se valore la optimización del tratamiento antimicrobiano antes de plantear la retirada del catéter (2C) (Pregunta T11).
- 3.
Recomendamos retirar el catéter peritoneal en las recaídas de IP agresivas, o en las segundas recaídas de cualquier IP (1C) (Pregunta T11).
- 4.
Sugerimos tratamiento antimicrobiano prolongado y optimizado para el manejo inicial de las IP no agresivas en primera recaída (2C) (Pregunta T11).
- 5.
Recomendamos investigar posibles factores causales de IP recurrente, incluyendo mala adherencia a la técnica o patologías abdominales ocultas (1C) (Pregunta T11).
- 6.
Sugerimos considerar la retirada del catéter peritoneal dentro de la estrategia de abordaje de la IP recurrente (2C) (Pregunta T11).
- 7.
Recomendamos la retirada del catéter peritoneal en las IP asociadas a infección de catéter por el mismo microorganismo en los siguientes casos: IP refractaria, IP de resolución lenta, IP con recaída, IP asociada a absceso de pared e IP asociada a infección de catéter de resolución tórpida o recurrente (1C) (Pregunta T12).
- 8.
Sugerimos considerar la retirada de catéter en los demás casos de infección simultánea del catéter por el mismo microorganismo (2C) (Pregunta T12).
- 9.
Sugerimos permitir un plazo de al menos dos semanas entre la retirada del catéter y la reinserción de un nuevo catéter, en las IP asociadas a infección de catéter por el mismo microorganismo (2C) (Pregunta T12).
- 10.
Recomendamos establecer un lapso de al menos 2 semanas entre la retirada de un catéter peritoneal por IP y la inserción de un nuevo catéter (1C) (Pregunta T13).
- 11.
Recomendamos no intentar la inserción de un nuevo catéter si persisten signos de irritación peritoneal (1C) (Pregunta T13).
- 12.
Sugerimos que es posible la retirada e implantación simultáneas de un catéter peritoneal en IP, siempre que la infección esté en remisión completa y sea causada por microorganismos no agresivos (2B) (Pregunta T13).
La realización de esta Guía se ha financiado a través de una beca competitiva de la Sociedad Española de Nefrología (Ayuda para la ealización de guías de práctica clínica, documentos de consenso y tomas de posición 2018) (GPC-DC/TP S.E.N.). Asimismo, la Guía ha recibido soporte financiero indirecto, parcial y no condicionado, por parte de Baxter Renal Care, canalizado a través de la Fundación SENEFRO.
Conflictos de interesesLos autores declaran no tener conflictos de interés.
Miguel Pérez Fontán (miguel.perez.fontan@sergas.es).
Licenciado en Medicina por la Universidad de Santiago de Compostela (1980). Médico Especialista en Nefrología tras residencia en Hospital la Paz (Madrid) (1986). Facultativo especialista de Nefrología, Hospital Universitario de A Coruña, desde 1986. Doctor en Medicina por la Universidad de A Coruña (1997). Profesor titular de Universidad de Nefrología. Experiencia en Diálisis Peritoneal desde 1983, con numerosas publicaciones.
Mercedes Moreiras Plaza (Maria.Mercedes.Moreiras.Plaza@sergas.es).
Licenciada en Medicina (Universidad de Santiago) (1987). MIR Nefrología (Hospital Universitario de Vigo (1989-1992). Facultativo Especialista en Nefrología (Hospital Universitario de Vigo) (1996). Unidad de Diálisis peritoneal, con gran número de comunicaciones a congresos y publicaciones en el campo.
Mario Prieto Velasco (mprietov@gmail.com).
Licenciatura en Medicina, Universidad de Sevilla (1987). Doctorado en medicina, Universidad de Cantabria (1997). MIR, Hospital Marqués de Valdecilla, Santander (1988-92). Jefe de Servicio de Nefrología Hospital de León (desde 2013)
Carlos Quereda Rodríguez-Navarro (carlosqueredam@gmail.com).
Licenciatura Universidad de Granada. MIR Hospital Puerta de Hierro (Nefrología y Medicina Interna). Jefe de Servicio de Nefrología del Hospital Ramón y Cajal de Madrid (2009-2015). Actividad preferente en Nefrología Clínica. Vocal del Grupo GLOSEN desde 2005. Workshop on Teaching Evidence Based Health Care. UCL London Medical School 1998. Subdirector Médico de Docencia e Investigación, jefe de Estudios, Patrono de la Fundación para la Investigación Biomédica, Vocal del Consejo Rector del Instituto «Ramón y Cajal» de Investigación Sanitaria y Técnico Asesor del Consejo Rector del mismo (IRYCIS). VII Premio Nacional a la Innovación y Gestión Sanitaria (Premio Especial a la Gestión de la Investigación) al HRC, Madrid 2000. Profesor Asociado de Medicina de la Universidad de Alcalá. Publicaciones: 190 internacionales y 224 en español. Miembro de Honor de la SEN 2013; vicepresidente de la Comisión Nacional de la Especialidad de Nefrología 2007 a 2014; Vocal de la Comisión de Investigación SEN. Director de la revista Nefrología 2007 a 2013. Coordinador del Grupo de Nefrología Basada en la Evidencia de la SEN desde 2005. Patrono de la Fundación SENEFRO desde 2015. Editor de Nefrologia y Nefrologia al Día continuando en la actualidad. Desde su jubilación (2015), colabora en la realización de Guías y documentos de consenso en la S.E.N.
Mª Auxiliadora Bajo Rubio (mabajo.hulp@salud.madrid.org).
Licenciatura en Medicina, Universidad de Salamanca (1987). Doctorado en Medicina (UAM 1996). Especialista en Nefrología (MIR), Hospital Universitario La Paz (1992). Jefe de Sección de Nefrología Hospital Universitario La Paz (2013). Jefe de Servicio de Nefrología en funciones, Hospital Universitario la Paz (2021).
Mercè Borràs Sans (mmborras.hj23.ics@gencat.cat).
Licenciatura en Medicina y Cirugía, Universidad Autónoma de Barcelona (1987). Doctora en Medicina (UAB 1994). Especialista en Nefrología (MIR) en Hospital Universitari Germans Trias i Pujol (1992). Jefe de Sección de Nefrología Hospital Universitari Arnau de Vilanova de Lleida (2004). Jefe de Servicio de Nefrología en funciones en Hospital Universitari Joan XXIII de Tarragona (2019).
Verónica de la Espada Piña (veronica.espadap@gmail.com).
Licenciatura en Medicina, Universidad de Cádiz (2013). Doctoranda en Medicina, 2. Universidad de Cádiz (2021). MIR Nefrología, Hospital Universitario de Puerto Real (2014-2018). Médico especialista en Nefrología, área de Diálisis Peritoneal, desde 2019
Javier Pérez Contreras (perez_fra@gva.es).
Licenciatura en Medicina, Universidad de Valencia (1982). Doctorado Universidad de Alicante (1997). MIR Nefrología, Hospital General de Asturias (1985-88). Jefe de Servicio de Nefrología del Hospital General Universitario de Alicante (2015).
Gloria del Peso Gilsanz (gloria.delpeso@salud.madrid.org).
Licenciatura en Medicina, Universidad Complutense de Madrid (1991). Doctorado por Universidad Autónoma de Madrid (2014). MIR Nefrologia, Hospital Universitario La Paz (Madrid) (1992-95). Facultativo Especialista de Área de Nefrología Hospital Universitario La Paz de Madrid (desde 1998).
Esther Ponz Clemente (eponz@tauli.cat).
Licenciatura en Medicina y Cirugía (Universidad de Barcelona) (1985). Doctorado en Medicina, Universidad de Barcelona (1992). Especialista en Nefrología (MIR), Hospital Clínic de Barcelona (1986-1989). Médico Adjunto Nefrología Parac Taulí Sabadell, Hospital Universitari desde mayo 1991.Méduco Consultor Senior (NIvel D) Parc Taulí Sabadell, Hospital Universitari desde 2016.
César Remón Rodríguez (cesarkai@telefonica.net).
Licenciado en Medicina (Universidad de Sevilla) (1975). Doctor en Medicina por la Universidad de Cádiz (2009). Presidente de la Sociedad Andaluza de Nefrología (2012-15). Profesor Asociado de Ciencias de la salud, Universidad de Cádiz (1987-). Jefe de Servicio de Nefrología (Hospitales Universitarios de Cádiz) (2010-). Amplia experiencia y múltiples publicaciones en el campo de la Nefrología en general, y de la Diálisis Peritoneal en particular.
Emilio Sánchez Alvarez (jesastur@hotmail.com).
Licenciatura en Medicina (Universidad de Oviedo) (1991). Doctorado en medicina, Universidad de La Laguna (2008). MIR Hospital Universitario Central de Asturias, 1992-1996. Jefe de Servicio de Nefrología; Hospital Universitario de Cabueñes (Gijón, Principado de Asturias).
Nicanor Vega Rodríguez (nvegdia@gobiernodecanarias.org).
Licenciatura en Medicina, Universidad de la La Laguna (1981). Doctorado en Medicina, Universidad de Sevilla (1992). MIR Nefrología Hospital Universitario Virgen Macarena. Sevilla (1982-1985). Jefe de Sección de Nefrología, Hospital Universitario de Gran Canaria Dr. Negrín, 2015.
Manel Vera Rivera (MVERA@clinic.cat).
Licenciatura en Medicina Universitat de Lleida (1995). Doctorado en Medicina.
Universitat de Barcelona (2020). MIR Hospital Clínic de Barcelona (1997-2001). C y responsable Unidad de Diálisis Peritoneal Hospital Clínic de Barcelona (desde 2005).
Nuria Aresté Fosalba (narestef@senefro.org).
Licenciada en Medicina y Cirugía (Universidad de Sevilla) (1993). MIR, Hospital Virgen Macarena (Sevilla) (1.994-1.998). Facultativo Especialista de Área de Nefrología en Hospital Virgen Macarena de Sevilla desde 2001. Responsable de la Unidad de Diálisis Peritoneal desde 2007 hasta la actualidad. Miembro de la Comisión de Infecciones y Política Antibiótica del Hospital Virgen Macarena de Sevilla.
Ana Bordes Benítez (aborben@gobiernodecanarias.org).
Jefe de Sección de Microbiología, Hospital Universitario Dr. Negrín (Las Palmas).
Mª José Castro Notario (mjcasnot@gmail.com).
Enfermera especialista en Diálisis Peritoneal. Hospital Universitario la Paz (Madrid).
Antonio Fernández Perpén (afdezperpen@senefro.org).
Licenciado en Medicina (Universidad Complutense, Madrid) (1992). MIR Nefrología (Hospital Universitario la Princesa) (1994-97). Facultativo Especialista de Nefrología del Hospital Universitario la Princesa (Madrid) desde 2004. Encargado del Área de Diálisis Peritoneal.
Mª José Fernández Reyes (jfernandezre@saludcastillayleon.es).
Licenciada en Medicina por la Universidad Autónoma de Madrid (1989). Especialista en Nefrología, Hospital Universitario la Paz 1990-1993.Doctora en Medicina por la Universidad Autónoma de Madrid (2011). Ejerce como licenciado Especialista en Nefrología del Complejo Hospitalario de Segovia desde el año 1995 y desde el Año 2011 como jefe de Unidad de Nefrología. Investigadora principal o colaboradora en más de 100 publicaciones en revistas indexadas. Colaboradora en varios grupos de trabajo de diálisis peritoneal (Grupo Centro de Diálisis P, Grupo de Apoyo al Desarrollo de la Diálisis Peritoneal).
Oriol Gasch Blasi (ogasch@tauli.cat).
Licenciado en Medicina por la Universidad de BARCELONA. Especialista en enfermedades infecciosas, con actividad en el Hospital Parc Taulí (Sabadell) desde 2012. Profesor Asociado de Medicina en la Universidad Autónoma de Barcelona. Coordinador de grupo de investigación en enfermedades infecciosas, con más de 40 publicaciones indexadas.
José Manuel Gil Cunquero (jmgilc@senefro.org).
Facultativo Especialista en Nefrología responsable de la Unidad de ERCA y de Diálisis Peritoneal en la UGC de Nefrología del Hospital Universitario de Jaén desde 2004.
Juan Carlos Julián Mauro (Federación Alcer) (jcjulian@alcer.org).
Doctorando de la Universidad Autónoma de Madrid (UAM) en Psicología de la Salud, departamento de Psicología Social y Metodología. Licenciado en Psicología, especialidad en Psicosociología del Trabajo y de las Organizaciones. Posgrado en gestión de Asociaciones de Pacientes por ESADE. Director General de la Federación Nacional de Asociaciones ALCER desde 2006. Profesor colaborador de la Universidad Europea de Madrid en aspectos psicosociales del paciente renal en el Curso Experto de Enfermería en Diálisis (2014-17). Investigador colaborador de la Facultad de Psicología de la UAM desde el año 2015. En la actualidad es el representante de ALCER en la International Kidney Cancer Coalition (IKCC), en la European Federation of Genetic Kiney Diseases (FEDERG) y el responsable del Plan de Acción de la European Kidney Patientś Federation (EKPF).
José Ignacio Minguela Pesquera (joseignacio.minguelapesquera@osakidetza.net).
Licenciado en Medicina (Universidad del País Vasco) (1988). Especialidad de Nefrología en el H. Cruces 1991-1994. Facultativo especilaista en Nefrología (Hospital Txagorritxu y Hospital Universitario Araba (1996-2020). Actividad asidstencial centrada en diálisis peritoneal. Jefe de servicio del Hospital OSI Bilbao-Basurto. Secretario de la sociedad Norte de Nefrología durante 10 años.
María Antonia Munar Vila (mariaa.munar@ssib.es).
Facultativa especialista en Nefrología del Hospital Universitario Son Espases (Mallorca) (2001). Responsable de la unidad de diálisis peritoneal (2011). Profesora en el curso de Diálisis Peritoneal (Grup de Diàlisi Peritoneal de Catalunya i Balears de la Societat Catalana de Nefrologia) (2013).
Miguel Núñez del Moral (nmoral76@hotmail.com).
Diplomado Universitario en Enfermería por la Universidad de Oviedo 1997 y Experto Universitario en Hemodiálisis 1998.Trabajo en diálisis peritoneal desde 2008. Vocal de diálisis peritoneal de la SEDEN desde 2014. Profesor Asociado en Ciencias de la Salud en la Universidad de Oviedo desde 2018. Supervisor de la unidad de diálisis peritoneal del Hospital Universitario Central de Asturias desde 2018. Director del grupo de investigación de Cuidados en nefrología del Instituto de Investigación Sanitaria del Principado de Asturias (ISPA) desde 2019.
Teresa Pérez López (Teresa.Perez.Lopez@sergas.es).
Diplomada en Enfermería. Supervisora de la Unidad de Diálisis Hospitalaria y Domiciliaria (Hospital Universitario de A Coruña).
Jose Portolés Pérez (josem.portoles@salud.madrid.org).
Licenciatura UCM Complutense (Madrid 1988). Doctorado UCM Madrid 1992. MIR Hospital Clínico San Carlos Madrid 1990-1993. Jefe de Servicio Nefrología Hospital Universitario Puerta de Hierro desde Abril 2011. Prof Asociado UAM autónoma desde 2011
Pedro Quirós Ganga (pedrol.quiros.sspa@juntadeandalucia.es).
Servicio de Nefrología, Hospital Universitario Puerto real (Cádiz).
Maite Rivera Gorrín (maiteelizabeth.rivera@salud.madrid.org).
Jefe de Sección de Nefrología (a cargo del área de Diálisis Peritoneal (2017). Múltiples comunicaciones y publicaciones en el campo de la Diálisis Peritoneal.
Carmen Rodríguez Suarez (CARMENRS@telefonica.net).
Licenciada en Medicina y Cirugía (Universidad de Oviedo) (1982). MIR Nefrología (Hospital General de Asturias) (1983-86). Facultativo espacialista de Nefrología (Hospital Central de Asturias) (1986). Actividad clínica asistencial, centrada especialmente, en el campo de la Enfermedad Renal Crónica (ERC) y la Terapia Renal Sustitutiva (TRS). Responsable de la Unidad de Diálisis Peritoneal del HUCA, desde su creación en 1993. Desarrollo del «Programa de ultrafiltración peritoneal en insuficiencia cardiaca refractaria” desde 2005.
Mario Sánchez Camargo (Alcer Giralda) (mario.sanchez@alcergiralda.org).
Mª Sagrario Soriano Cabrera (marias.soriano.sspa@juntadeandalucia.es).
MIR de Nefrología (Hospital Universitario Reina Sofía de Córdoba) 1995-1999. Nefróloga del Hospital Universitario Reina Sofía desde el año 1999. Tutora de Residentes de Nefrología desde el año 2007 hasta el año 2018. Jefa de Servicio de Nefrología del Hospital Universitario Reina Sofía desde el año 2019. Doctora en Medicina por la Universidad de Córdoba desde 2001. Profesora asociada de la Universidad de Córdoba desde 2004. Grupo de Investigación del Instituto de Investigación Maimónides del Hospital Universitario Reina Sofía de Córdoba y Universidad de Córdoba: Inflamación en la Insuficiencia Renal Crónica. Miembro de la Junta Directiva de la Sociedad Española de Nefrología. Participa en el Grupo de diálisis peritoneal de la Sociedad Española de Nefrología, en el grupo de trabajo de la Enfermedad Renal Crónica Avanzada y en el grupo de Anemias de la sociedad.