La coinfección VIH/leishmaniasis visceral es frecuente y cursa de forma tórpida y recurrente. La afectación renal incluye glomerulonefritis y afectación tubular. Presentamos un caso poco frecuente.
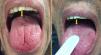
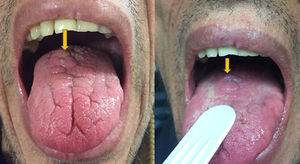
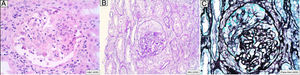
Se trata de un varón de 46 años adicto a alcohol y drogas parenterales diagnosticado en 2006 de infección VIH estadio C y VHC genotipo 4. Inicia TARGA en 2011, tras su primera descompensación ascítica por cirrosis hepática Child C, con hipertensión portal, esplenomegalia y pancitopenia. Lo suspende voluntariamente en mayo de 2015 y lo reinicia en noviembre del 2016 (raltegravir, abacavir y lamivudina). Un mes después, con carga viral no detectable y sin restauración inmune (CD4 74/mm3), desarrolla fracaso renal agudo no oligúrico (creatinina máxima 5,7mg/dL), proteinuria mixta de 2g/día, microhematuria y tumoración en el dorso de la lengua (fig. 1) con biopsia de displasia epitelial severa y candidiasis mucosa. En las pruebas complementarias destacaba descenso de C’3, gammapatía policlonal, aumento de inmunoglobulinas y de cadenas kappa y lambda y ANA positivos (1/640). Las crioglobulinas, el Mantoux y las serologías (VHB, sífilis, Toxoplasma) fueron negativas. Se determinaron IgG de CMV y Leishmania y antígeno rK39 en sangre, que resultaron positivos. La PCR para Leishmania en la lengua y la médula ósea fueron negativas. Se realizó biopsia renal, en la que se identificaron 6 glomérulos, uno con focos de necrosis segmentaria con fibrina y 2 con semilunas celulares sin trombos (fig. 2). En el intersticio aparecía inflamación crónica moderada y fibrosis, sin alteraciones tubulares. No había signos de vasculitis. La IFD era positiva de predominio mesangial para C’3 (++), IgG (+), C1q e IgM (+), y negativa para IgA y cadenas ligeras. No se identificó amiloide con la técnica del Rojo Congo. ME no estaba disponible. El paciente inició tratamiento con anfotericina B liposomal, normalizando 3 semanas más tarde la función renal y mejorando las alteraciones urinarias. Dos meses después inició tratamiento frente al VHC con respuesta viral sostenida. Tras 16 meses de seguimiento en los que se mantiene la profilaxis con anfotericina, el FG es normal y persiste mínima microhematuria y albuminuria. Se interpretaron la tumoración lingual y el fracaso renal agudo como secundarios a leishmaniasis aguda.
La leishmaniasis se produce por el protozoo Leishmania infantum/chagasi en el Mediterráneo, Asia y Sudamérica, y por Leishmania donovani en la India y el este de África. Englobado por las células del sistema retículo endotelial, se multiplica induciendo una severa hipergammaglobulinemia policlonal y pancitopenia. Posteriormente sale a la sangre periférica, pudiendo desencadenar un cuadro cutáneo, mucocutáneo, visceral o dermatológico posvisceral. Hay 1-2 millones de enfermos en el mundo, 500.000 nuevos casos y 50.000 fallecidos al año1–3. Afecta principalmente a pacientes inmunodeprimidos, infectados por el VIH y trasplantados. En España, la incidencia es de 0,25/105 pacientes-año. Desde 1986 a 1994, 858 casos de coinfección se han comunicado a la WHO Division for Control of Tropical Diseases en Francia, Italia, Portugal, Grecia y España. Entre un 1,6-4,9% de los casos de VIH se coinfectarán con Leishmania en el sur de Europa por una nueva infección o por una reactivación4. En pacientes con VIH la leishmaniasis visceral ocurre en un 60% de los casos tras el tratamiento, ya que la acumulación del protozoo en órganos atípicos como el riñón afecta la respuesta de macrófagos y células dendríticas e induce una disregulación de las citocinas, un aumento de la IL-10, la activación de CD8 citotóxicos, la alteración de la apoptosis, la producción de autoanticuerpos e inmunocomplejos y respuestas incompletas al tratamiento, con frecuentes recidivas y reacción inflamatoria crónica5–7. Además, conduce a una depleción de CD4 que empeora el curso de la infección por VIH. La mayoría de las coinfecciones se dan cuando los CD4 se encuentran por debajo de 200/μL. Los criterios diagnósticos incluyen la identificación del parásito en la médula ósea o la positividad del antígeno rK39 en sangre durante la infección activa, con una especificidad y una sensibilidad cercanas al 100%1. Es frecuente encontrar consumo del complemento, positividad del factor reumatoide, crioglobulinas3 y anticuerpos antiplaquetarios, antimúsculo liso y anti-MBG. En el riñón8, el daño es por depósito de inmunocomplejos, con activación de células T citotóxicas y de moléculas de adhesión2. Inicialmente se afecta el mesangio con hipercelularidad focal y depósitos granulares de IgG, IgM, C’3 en la matriz, MBG (subendoteliales, intramembranosos o subepiteliales) e intersticio. Si los inmunocomplejos sobrepasan esta barrera pueden depositarse en el glomérulo, induciendo proliferación epitelial o endotelial (GNMP). Es característico encontrar protozoos intramacrofágicos5 a nivel peritubular, daño intersticial9 que se manifiesta con ATR distal1,2,10, hiponatremia, hipomagnesemia, hipocalcemia, hipokaliemia e hipouricemia. Los casos recogidos en la literatura de coinfección leishmania visceral/VIH con daño renal se resumen en la tabla 1. En nuestro caso, el paciente comenzó con síndrome nefrótico y fracaso renal agudo con hematuria. La biopsia fue diagnóstica de glomerulonefritis necrosante. El hecho de que las crioglobulinas fueran negativas hace poco probable que se relacione con la infección por VHC. Resulta poco habitual la no identificación del parásito ni en la médula ósea ni en tejido renal, pero la positividad del antígeno rK39 y la resolución del cuadro tras el inicio del tratamiento certifican el diagnóstico.
Casos publicados en la literatura de coinfección leishmania visceral/VIH con daño renal
| Autor | Sexo/edad | VHC/criogb | CD4 | CVVIH | Inicio | Diagnóstico con VIH | Evolución renal | Biopsia renal |
|---|---|---|---|---|---|---|---|---|
| Clevenbergh et al. (2002)11 | V/45 | +/+ | 60 | <200 | FRANOPRTo subnefróticaHMTo | 7 meses | RC | HT mesangialGNFyS |
| Rollino et al. (2003)12 | M/28 | −/− | NE | NE | FRAO, PRTo, HMTo | NE | E | GNFyS colapsante con SL, NTA, tubulitis tóxica, vasculitis leucocitoclástica |
| Navarro et al. (2006)13 | V/28 | +/− | 62 | <80 | FRAO, PRTo nefrótica | NE | IRT en HD | Amiloidosis AA |
| Alexandru et al. (2008)5 | M/42 | +/+ | 344 | ND | SNo con FG conservado | 5 años | RP con frecuentes recidivas hasta E | GN mesangial con IF negativa |
| Amann et al. (2012)14 | V/45 | −/− | 174 | 790 | FRANO, SNe, SNo | 23 años | IRC con SNoRP | GNMP tipo 1 |
| De Vallière et al. (2009)15 | V/32 | +/+ | 160-170 | ND | SNo, FRA | Simultánea | IRC con SNo y RP | Hiperplasia mesangial |
| Rybniker et al. (2010)7 | V/49 | −/− | 180 | ND | FRA | 16 años | IRT en HD | GN extracapilar |
| Suankratay et al. (2010)16 | V/37 | +/− | 129 | ND | SNo, FRA | 4 años | RC | GNMP y GNFyS |
| Vassallo et al. (2014)17 | V/40V/35M/24V/49 | −/+−/¿−/++/+ | 114127084 | 162411.0000,2<40 | SNeSNoFRASNo | 15 años11 años24 años2 años | RPERP E | GNMP tipo 3GNMP tipo 3NIIAGNMP tipo 3 |
| Ortiz et al. (2015)3 | V/46 | −/+ | 786 | ND | SNo, FRA y macroHMTo | 3 años | RC | GNMP tipo 3 y Criogb con NIIA |
| Enríquez et al. (2015)18 | V/47 | −/− | 93 | ND | SNo | 3 años | IRC con PRTo nefrótica | GNMP |
| Puerta et al. (2018) | V/46 | +/− | 78 | ND | FRANO, PRTo no nefróticaMicroHMTo | 10 años | RC | GN necrosante con SL |
Criogb: crioglobulinas; CV: carga viral; E: exitus; FRAO: fracaso renal agudo oligúrico; FRANO: fracaso renal agudo no oligúrico; GN: glomerulonefritis; GNFyS: glomerulonefritis focal y segmentaria; GNMP: glomerulonefritis membranoproliferativa; HD: hemodiálisis; HMTo: hematuria; HT: hipertrofia; IRC: insuficiencia renal crónica; IRT: insuficiencia renal terminal; M: mujer; ND: no detectable; NE: no especificado; NIIA: nefritis inmunoalérgica aguda; NTA: necrosis tubular aguda; PRTo: proteinuria; RC: recuperación completa; RP: recuperación parcial; SL: semilunas; SNe: síndrome nefrítico; SNo: síndrome nefrótico; V: varón; VIH: virus de la inmunodeficiencia humana.