Bajo el término gammapatías monoclonales de significado renal (GMSR) se engloban un conjunto de enfermedades que se caracterizan patogénicamente por la proliferación de un clon de linfocitos B o células plasmáticas que sintetizan y segregan una inmunoglobulina monoclonal o uno de sus componentes (cadenas ligeras o pesadas), con capacidad para depositarse y producir daño a nivel glomerular, tubular, intersticial o vascular. La importancia de discriminar el término GMSR radica en poder indicar procedimientos diagnósticos y terapéuticos dirigidos al control de la síntesis y secreción de las proteínas monoclonales independientemente de los criterios clásicos vinculados con la expansión tumoral maligna. La patología renal asociada a las GMSR es muy heterogénea, lo que confiere a la biopsia renal una consideración de prueba diagnóstica clave. La correcta investigación diagnóstica de una GMSR debe incluir, además, la identificación en plasma u orina de la proteína monoclonal y un estudio hematológico completo que determine la naturaleza y extensión del clon celular. Los avances en el conocimiento de estas entidades han permitido mejorar el curso evolutivo y la supervivencia en varias formas de GMSR, aunque son necesarios más estudios y experiencia clínica para delinear protocolos terapéuticos más efectivos. En la presente revisión se resumen las principales características clínico-patológicas de las GMSR, se detalla la aproximación diagnóstica más adecuada, así como las opciones terapéuticas disponibles en el momento actual.
The term monoclonal gammopathy of renal significance (MGRS) comprises a group of diseases pathogenetically characterised by proliferation of a B-cell or plasma cell clone that synthesises and secretes a monoclonal immunoglobulin or its components (light and/or heavy chains), that may deposit and cause glomerular, tubular, interstitial and/or vascular damage. The importance of differentiating the term MGRS from other monoclonal gammopathies lies in the fact that diagnostic and therapeutic procedures aimed at controlling monoclonal protein synthesis and secretion can be indicated, irrespective of the classic criteria based on malignant tumour expansion. Renal pathology associated with MGRS is highly heterogeneous, and therefore renal biopsy should be considered a key diagnostic tool. A precise diagnostic approach, however, must also identify the monoclonal protein in plasma and/or in urine, together with a complete haematological study in order to determine the nature and extension of cell clones. Recent advances in the understanding of these entities have resulted in significant improvements in clinical course and survival in several forms of MGRS, although more studies and clinical experience are needed in order to delineate more effective therapeutic strategies. In this review, we summarise the main clinical and pathological features of MGRS, highlighting the most appropriate diagnostic approach and current therapeutic options.
Con el nombre de gammapatías monoclonales (GM) se agrupan varias entidades clínicas que tienen en común una proliferación clonal de linfocitos B o células plasmáticas con capacidad de formar y segregar un único tipo de inmunoglobulina o una parte constituyente de ella (componente monoclonal) en cantidades excesivas. El componente monoclonal puede estar formado por una cadena pesada (habitualmente cadena ¿ y, con menor frecuencia, cadenas α, μ, δ, ¿) junto con una cadena ligera (κ o λ), cadenas ligeras aisladas y, de forma excepcional solo cadenas pesadas1.
El espectro de patologías, manifestaciones clínicas y efectos adversos sobre la salud y supervivencia de estas entidades no solo se relaciona con la proliferación celular neoplásica, sino también con el daño que puede llegar a causar el depósito de estas proteínas monoclonales en diferentes órganos, o a través de mecanismos patogénicos más complejos que incluyen fenómenos de autoinmunidad, inflamación y fibrogénesis2–4.
En el año 2003 el International Myeloma Working Group2 revisó los criterios para el diagnóstico y clasificación de las entidades clínicas que agrupa el término GM. Según estos criterios se pueden distinguir 4entidades:
- 1.
GM de significado incierto (GMSI): componente monoclonal <30g/l, con proliferación de células plasmáticas en médula ósea <10% y ausencia de evidencia clínica de mieloma, linfoma o amiloidosis.
- 2.
Mieloma asintomático o quiescente: componente monoclonal ≥30g/l, con proliferación de células plasmáticas en médula ósea ≥10%, pero sin evidencia de afectación de órganos o tejidos y, más precisamente, ausencia de la típica tétrada de hipercalcemia, afectación renal, anemia y lesiones óseas.
- 3.
Mieloma sintomático que requiere la afectación de órganos o tejidos y que también puede presentarse como no secretor (sin componente de secreción de proteínas monoclonales). En 2014 se incorporaron como criterios adicionales la presencia de ≥60% de células plasmáticas en médula ósea, un ratio de cadenas ligeras libres en suero implicadas/no implicadas ≥100, o la existencia de más de una lesión focal mediante técnicas de imagen avanzadas (tomografía computarizada [TC], resonancia magnética [RNM] o tomografía por emisión de positrones con fluordesoxiglucosa-18F [PET-TC])5.
- 4.
Plasmocitoma óseo solitario, plasmocitoma extramedular y plasmocitomas solitarios múltiples.
Aproximadamente un 60% de todas las GM corresponden a GMSI6. En la GMSI un clon, generalmente no neoplásico, de linfocitos B o células plasmáticas sintetiza y segrega pequeñas cantidades de una inmunoglobulina monoclonal o de sus componentes (cadenas ligeras o pesadas)7,8.
Esta entidad es un hallazgo relativamente frecuente en la población adulta (prevalencia del 0,7% en población general, que aumenta al 3% en mayores de 50 años y al 5% en mayores de 70 años)8, con una incidencia estandarizada anual de entre 4 y 15 casos por 100.000 según diferentes estudios9,10, pero que en mayores de 80 años puede alcanzar hasta los 169 casos por 100.00010.
Se estima una transformación neoplásica (mieloma o linfoma) de estas GMSI de un 1% anual11–13. Los factores que han mostrado ser determinantes del riesgo de transformación neoplásica son11–13: cociente anormal entre cadenas ligeras libres kappa (κ) y lambda (λ), componente monoclonal distinto de inmunoglobulina (cadenas ligeras o pesadas) o de tipo IgA, y concentración de la proteína monoclonal ≥15g/l. Si se cumplen estos 3factores, el riesgo de progresión neoplásica alcanza el 58% en 20 años, mientras que es tan solo de un 5% si no se presenta ninguna de estas características13.
Además del riesgo de transformación neoplásica, se ha demostrado que estos pacientes también tienen entre 3 y 5 veces más probabilidades de padecer enfermedades renales14, y se ha observado en algunos estudios que el 23% de los pacientes con GMSI por cadenas ligeras tienen enfermedad renal15.
En la década de los años 80 ya se empezó a describir que el alcance patológico de una GMSI no solo se limitaba a su transformación neoplásica, sino que, además, la síntesis y secreción de proteínas monoclonales (M) podrían ser causa de otros procesos patológicos desarrollados por diferentes mecanismos patogénicos con efectos sistémicos16–18. Entre los órganos más frecuentemente afectados en el curso evolutivo de una GMSI está el riñón.
La afectación renal es muy frecuente en el mieloma sintomático y el mecanismo patogénico principal de la nefropatía asociada al mieloma es la precipitación intratubular de proteínas monoclonales segregadas por las células neoplásicas («nefropatía por cilindros»)19–22. En este caso se requiere la secreción de grandes cantidades de la proteína M para producir una precipitación masiva, y la clave patogénica en esta nefropatía viene condicionada por la alta carga y la agresividad tumoral21,22.
De forma creciente se han ido sucediendo las descripciones de diferentes procesos patológicos renales relacionados con las GM, que han conducido a que se adopte el término GM de significado renal (GMSR)1,23–28 para distinguir y despejar la incertidumbre que existe sobre el curso evolutivo benigno de otras GM.
La importancia de discriminar el término GMSR radica principalmente en poder indicar procedimientos diagnósticos y terapéuticos dirigidos al control de la síntesis y secreción de las proteínas M —si se confirmara que estas están vinculadas patogénicamente con la nefropatía—, de forma independiente de los criterios clásicos hematológicos más vinculados con la expansión tumoral maligna3,4,22,26.
En esta revisión se describen las principales características clínico-patológicas de las GMSR, se detalla la aproximación diagnóstica más adecuada, así como los avances terapéuticos y perspectivas de futuro.
Patología renal asociada a las gammapatías monoclonalesLa patología renal asociada a las GMSR es muy heterogénea, lo que confiere a la biopsia renal una consideración de prueba diagnóstica clave1,22,25–28. No obstante, la presencia concomitante de enfermedad renal de otra etiología puede dificultar en algunos casos la correcta interpretación histológica y ser un factor de confusión25.
Para una correcta investigación e interpretación de los hallazgos, se requiere no solo el examen de microscopia óptica sino también inmunofluorescencia con un panel de anticuerpos contra cadenas ligeras e isotipos de inmunoglobulinas, además de la microscopia electrónica (ME)4,22,25,29. En algunos casos, también se debería recurrir a técnicas más sensibles pero complejas como son la inmunomicroscopia electrónica (inmunoME)30, o la microdisección por láser seguida de proteómica con espectrometría de masas31–34, para confirmar la composición de los depósitos y sus localizaciones.
La inmunofluorescencia resulta crucial en el diagnóstico para establecer el vínculo patogénico con la discrasia sanguínea y, por tanto, debería ser práctica obligada el empleo de anticuerpos contra cadenas ligeras (κ y λ) en el estudio histológico de cualquier biopsia renal25.
En los casos en los que no se dispone de tejido renal válido en la muestra congelada para inmunofluorescencia es posible hacer técnicas de «rescate» de la muestra en parafina (tratamiento con pronasa) con alta probabilidad de éxito para la detección inmunohistoquímica de cadenas ligeras35.
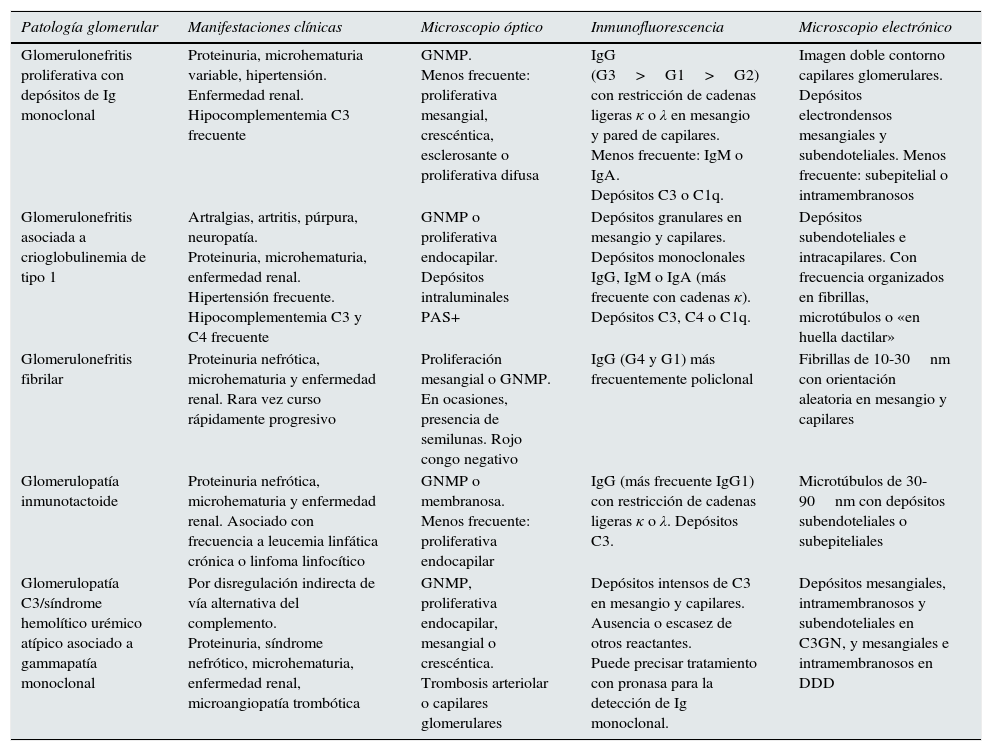
Se han propuesto diferentes métodos para clasificar las GMSR1,4. Una forma es de acuerdo con la localización predominante del daño renal (glomerular, tubular o mixto)1, aunque en la práctica no es infrecuente el solapamiento de más de una entidad en una misma biopsia36–39. En las tablas 1–3 se resumen las principales entidades clínicas y sus hallazgos histológicos según la extensión del daño.
Patrones histológicos de daño glomerular
| Patología glomerular | Manifestaciones clínicas | Microscopio óptico | Inmunofluorescencia | Microscopio electrónico |
|---|---|---|---|---|
| Glomerulonefritis proliferativa con depósitos de Ig monoclonal | Proteinuria, microhematuria variable, hipertensión. Enfermedad renal. Hipocomplementemia C3 frecuente | GNMP. Menos frecuente: proliferativa mesangial, crescéntica, esclerosante o proliferativa difusa | IgG (G3>G1>G2) con restricción de cadenas ligeras κ o λ en mesangio y pared de capilares. Menos frecuente: IgM o IgA. Depósitos C3 o C1q. | Imagen doble contorno capilares glomerulares. Depósitos electrondensos mesangiales y subendoteliales. Menos frecuente: subepitelial o intramembranosos |
| Glomerulonefritis asociada a crioglobulinemia de tipo 1 | Artralgias, artritis, púrpura, neuropatía. Proteinuria, microhematuria, enfermedad renal. Hipertensión frecuente. Hipocomplementemia C3 y C4 frecuente | GNMP o proliferativa endocapilar. Depósitos intraluminales PAS+ | Depósitos granulares en mesangio y capilares. Depósitos monoclonales IgG, IgM o IgA (más frecuente con cadenas κ). Depósitos C3, C4 o C1q. | Depósitos subendoteliales e intracapilares. Con frecuencia organizados en fibrillas, microtúbulos o «en huella dactilar» |
| Glomerulonefritis fibrilar | Proteinuria nefrótica, microhematuria y enfermedad renal. Rara vez curso rápidamente progresivo | Proliferación mesangial o GNMP. En ocasiones, presencia de semilunas. Rojo congo negativo | IgG (G4 y G1) más frecuentemente policlonal | Fibrillas de 10-30nm con orientación aleatoria en mesangio y capilares |
| Glomerulopatía inmunotactoide | Proteinuria nefrótica, microhematuria y enfermedad renal. Asociado con frecuencia a leucemia linfática crónica o linfoma linfocítico | GNMP o membranosa. Menos frecuente: proliferativa endocapilar | IgG (más frecuente IgG1) con restricción de cadenas ligeras κ o λ. Depósitos C3. | Microtúbulos de 30-90nm con depósitos subendoteliales o subepiteliales |
| Glomerulopatía C3/síndrome hemolítico urémico atípico asociado a gammapatía monoclonal | Por disregulación indirecta de vía alternativa del complemento. Proteinuria, síndrome nefrótico, microhematuria, enfermedad renal, microangiopatía trombótica | GNMP, proliferativa endocapilar, mesangial o crescéntica. Trombosis arteriolar o capilares glomerulares | Depósitos intensos de C3 en mesangio y capilares. Ausencia o escasez de otros reactantes. Puede precisar tratamiento con pronasa para la detección de Ig monoclonal. | Depósitos mesangiales, intramembranosos y subendoteliales en C3GN, y mesangiales e intramembranosos en DDD |
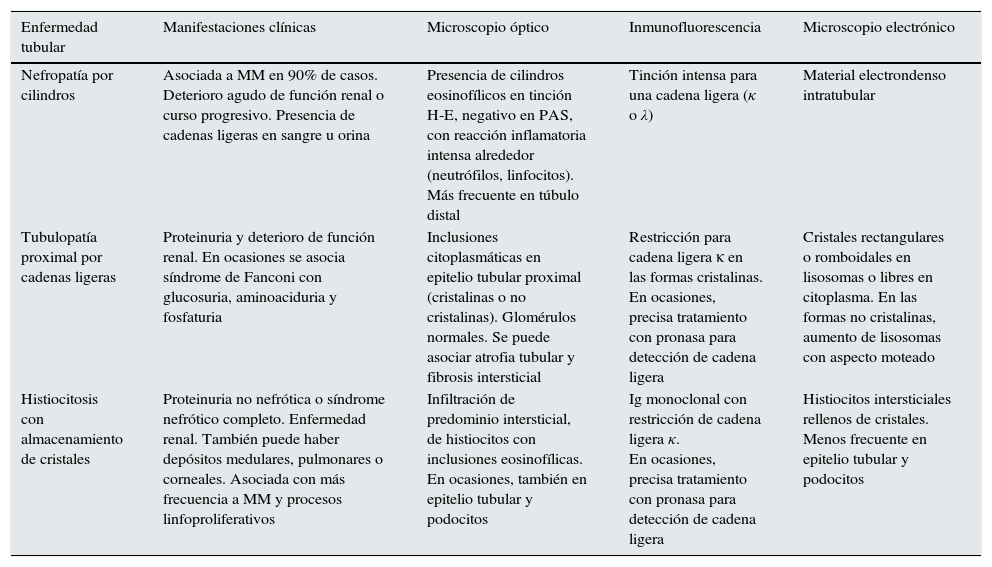
Patrones histológicos de daño tubular
| Enfermedad tubular | Manifestaciones clínicas | Microscopio óptico | Inmunofluorescencia | Microscopio electrónico |
|---|---|---|---|---|
| Nefropatía por cilindros | Asociada a MM en 90% de casos. Deterioro agudo de función renal o curso progresivo. Presencia de cadenas ligeras en sangre u orina | Presencia de cilindros eosinofílicos en tinción H-E, negativo en PAS, con reacción inflamatoria intensa alrededor (neutrófilos, linfocitos). Más frecuente en túbulo distal | Tinción intensa para una cadena ligera (κ o λ) | Material electrondenso intratubular |
| Tubulopatía proximal por cadenas ligeras | Proteinuria y deterioro de función renal. En ocasiones se asocia síndrome de Fanconi con glucosuria, aminoaciduria y fosfaturia | Inclusiones citoplasmáticas en epitelio tubular proximal (cristalinas o no cristalinas). Glomérulos normales. Se puede asociar atrofia tubular y fibrosis intersticial | Restricción para cadena ligera κ en las formas cristalinas. En ocasiones, precisa tratamiento con pronasa para detección de cadena ligera | Cristales rectangulares o romboidales en lisosomas o libres en citoplasma. En las formas no cristalinas, aumento de lisosomas con aspecto moteado |
| Histiocitosis con almacenamiento de cristales | Proteinuria no nefrótica o síndrome nefrótico completo. Enfermedad renal. También puede haber depósitos medulares, pulmonares o corneales. Asociada con más frecuencia a MM y procesos linfoproliferativos | Infiltración de predominio intersticial, de histiocitos con inclusiones eosinofílicas. En ocasiones, también en epitelio tubular y podocitos | Ig monoclonal con restricción de cadena ligera κ. En ocasiones, precisa tratamiento con pronasa para detección de cadena ligera | Histiocitos intersticiales rellenos de cristales. Menos frecuente en epitelio tubular y podocitos |
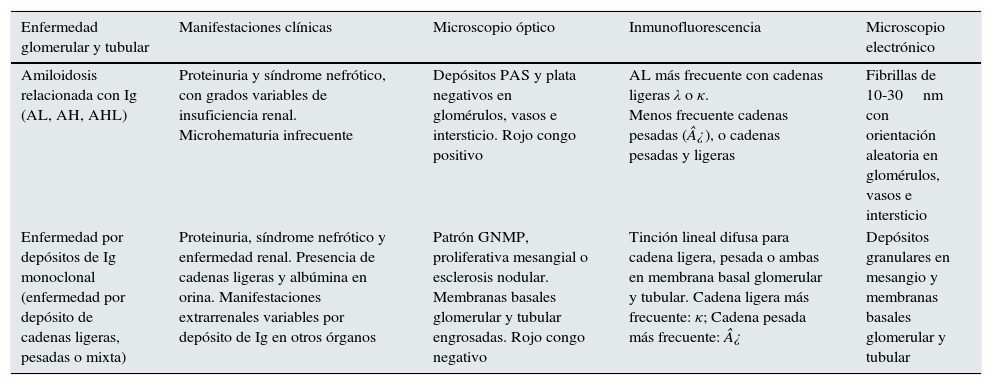
Patrones histológicos de daño mixto glomerular y tubular
| Enfermedad glomerular y tubular | Manifestaciones clínicas | Microscopio óptico | Inmunofluorescencia | Microscopio electrónico |
|---|---|---|---|---|
| Amiloidosis relacionada con Ig (AL, AH, AHL) | Proteinuria y síndrome nefrótico, con grados variables de insuficiencia renal. Microhematuria infrecuente | Depósitos PAS y plata negativos en glomérulos, vasos e intersticio. Rojo congo positivo | AL más frecuente con cadenas ligeras λ o κ. Menos frecuente cadenas pesadas (¿), o cadenas pesadas y ligeras | Fibrillas de 10-30nm con orientación aleatoria en glomérulos, vasos e intersticio |
| Enfermedad por depósitos de Ig monoclonal (enfermedad por depósito de cadenas ligeras, pesadas o mixta) | Proteinuria, síndrome nefrótico y enfermedad renal. Presencia de cadenas ligeras y albúmina en orina. Manifestaciones extrarrenales variables por depósito de Ig en otros órganos | Patrón GNMP, proliferativa mesangial o esclerosis nodular. Membranas basales glomerular y tubular engrosadas. Rojo congo negativo | Tinción lineal difusa para cadena ligera, pesada o ambas en membrana basal glomerular y tubular. Cadena ligera más frecuente: κ; Cadena pesada más frecuente: ¿ | Depósitos granulares en mesangio y membranas basales glomerular y tubular |
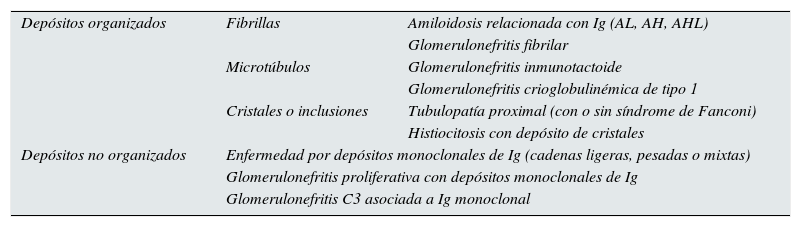
La clasificación más aceptada de las lesiones asociadas a GMSR se basa en la distinción de la estructura de los depósitos o inclusiones según estos muestren una configuración «organizada» o «no organizada»4,25 (tabla 4).
Esquema de clasificación de la enfermedad asociada a la GMSR de acuerdo con la presencia de depósitos organizados o no organizados
| Depósitos organizados | Fibrillas | Amiloidosis relacionada con Ig (AL, AH, AHL) |
| Glomerulonefritis fibrilar | ||
| Microtúbulos | Glomerulonefritis inmunotactoide | |
| Glomerulonefritis crioglobulinémica de tipo 1 | ||
| Cristales o inclusiones | Tubulopatía proximal (con o sin síndrome de Fanconi) | |
| Histiocitosis con depósito de cristales | ||
| Depósitos no organizados | Enfermedad por depósitos monoclonales de Ig (cadenas ligeras, pesadas o mixtas) | |
| Glomerulonefritis proliferativa con depósitos monoclonales de Ig | ||
| Glomerulonefritis C3 asociada a Ig monoclonal | ||
AH: amiloidosis de cadenas pesadas; AL: amiloidosis de cadenas ligeras; AHL: amiloidosis de cadenas pesadas y ligeras; Ig: inmunoglobulina.
Fuente: Modificado de esquema original de Bridoux et al.4.
Los depósitos «organizados» se subdividen en: fibrillas, microtúbulos y cristales o inclusiones.
Los procesos patológicos asociados a fibrillas son: amiloidosis relacionada con inmunoglobulinas (de cadenas ligeras, cadenas pesadas o mixtas de cadenas ligeras y pesadas)4,25,40–43 y glomerulonefritis fibrilar4,33,44,45.
Cuando la microestructura de los depósitos adopta una forma de microtúbulos se distinguen 2entidades4,25: glomerulonefritis inmunotactoide, también denominada glomerulonefritis con microtúbulos organizados y depósitos de inmunoglobulina monoclonal33,44,46, y la glomerulonefritis asociada a crioglobulinemia de tipo 133,47–51.
Los depósitos de cristales e inclusiones4,25 producen una patología de predominio tubular e intersticial y se distinguen 2subtipos: tubulopatía proximal (con o sin síndrome de Fanconi)52–54 y la histiocitosis con almacenamiento de cristales51,55–59 en la que los depósitos cristalinos no se encuentran en las células del epitelio tubular, sino dentro de los histiocitos1. También se han descrito casos de nefritis intersticial aguda sin relación con depósitos de cristales o precipitación intratubular de cilindros, pero con demostración de depósito de cadenas ligeras en las membranas basales tubulares60.
La entidades patológicas con depósitos «no organizados» incluyen: enfermedad por depósitos de inmunoglobulina monoclonal tipo Randall (enfermedad por depósitos de cadenas ligeras, cadenas pesadas o mixtas)25,61–63; glomerulonefritis proliferativa con depósitos de inmunoglobulina monoclonal17,25,64–68 y la glomerulopatía C3 (C3G) asociada a gammapatía monoclonal69–74. En el caso de la glomerulonefritis proliferativa con depósitos de inmunoglobulina monoclonal, la afectación se limita al glomérulo, mientras que en la enfermedad por depósitos de inmunoglobulina monoclonal existe afectación extraglomerular y, con frecuencia, extrarrenal4.
Además de estos procesos, también se ha descrito una posible implicación patogénica de la GM en otras glomerulopatías como la GN membranosa75,76, glomeruloesclerosis focal y segmentaria77, extracapilar pauciinmune78, glomerulonefritis proliferativa C479 y en microangiopatías trombóticas79–83.
Presentación clínicaLas GMSR se pueden presentar con un amplio rango de manifestaciones, dependiendo del mecanismo patogénico subyacente y del lugar primario del afectación1,3,4. En la mayor parte de los casos, el depósito de proteínas M es el responsable de la enfermedad renal, mientras que en otras ocasiones se produce de manera indirecta a través de una disregulación de la vía alternativa del complemento que da lugar a una C3G1,3,4,71 o, más raramente, a un síndrome hemolítico urémico atípico81. Así, el componente monoclonal sería capaz de interferir con las proteínas reguladoras del complemento ejerciendo como miniautoanticuerpos contra el factor H73,74, o como factor nefrítico C3, que estabiliza la convertasa C3 de la vía alternativa y mantiene su hiperactivación1,70,71.
Las características estructurales y químicas innatas de cada proteína M, así como la respuesta inflamatoria individual, parecen ser determinantes a la hora de condicionar el tipo de daño renal18,84. Proteínas con elevado peso molecular como las inmunoglobulinas (formadas por cadenas pesadas y ligeras) no atraviesan la barrera de filtración y se depositan en el glomérulo, lo que desencadena, a su vez, procesos inflamatorios. Por contra, las cadenas ligeras son capaces de atravesar la barrera de filtración y producir afectación tubular diversa.
En numerosas ocasiones la afectación renal es la primera manifestación de la discrasia sanguínea26. De acuerdo con las diferentes series, la edad de diagnóstico suele ser superior a 50 años, es más frecuente la enfermedad por depósitos de inmunoglobulina monoclonal en varones y la glomerulonefritis proliferativa con depósitos de inmunoglobulina monoclonal en mujeres63,66,85.
Dentro de la manifestaciones clínicas de las GMSR, es frecuente encontrar diferentes grados de proteinuria, que pueden alcanzar el rango nefrótico, junto con microhematuria e hipertensión en ciertos casos. En un alto porcentaje de pacientes se detecta insuficiencia renal en el momento del diagnóstico, que puede progresar a enfermedad renal terminal4,63,66,86. Esto tiene especial importancia, dado que la recidiva de algunas de estas dolencias en riñones trasplantados es muy frecuente87–92. Este hecho reitera la necesidad de un correcto diagnóstico patológico incluso si resultara improbable salvar la función de los riñones nativos.
También se pueden presentar manifestaciones extrarrenales, sobre todo en los casos de amiloidosis, enfermedad por depósitos de inmunoglobulina monoclonal y crioglobulinemia de tipo 1, con afectación predominante a nivel cardiaco, hepático, cutáneo y articular1,4,93. La investigación sobre la posibilidad de extensión de la enfermedad a otros órganos y tejidos es necesaria en pacientes diagnosticados de amiloidosis43, debido a la frecuente afectación cardiaca, que suele ser el principal determinante de mortalidad43.
También se han descrito casos de osteomalacia secundaria al síndrome de Fanconi52.
Otras manifestaciones sistémicas de una GM pueden estar en relación con el daño endotelial y la microangioangiopatía trombótica sistémica asociada a la secreción del factor de crecimiento endotelial vascular (VEGF) como ocurre en el síndrome POEMS (polineuropatía, organomegalia, endocrinopatía, GM y lesiones dérmicas)94 y el escleromixedema95.
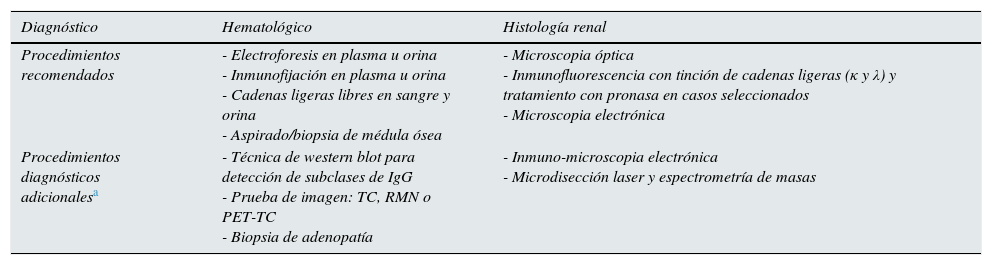
Diagnóstico de las gammapatías monoclonales de significado renalLa correcta investigación diagnóstica de una GMSR debe incluir, además de la biopsia renal, la demostración e identificación de la GM en plasma u orina, el estudio hematológico que determine la naturaleza y extensión del clon celular causante de la GM, y, en algunos procesos (e.g. amiloidosis), la ampliación del estudio para descartar la extensión de la enfermedad a otros órganos4,25,26. En la tabla 5 se resumen las principales técnicas para el diagnóstico hematológico e histológico.
Técnicas para el diagnóstico hematológico y de la histología renal de las GMSR
| Diagnóstico | Hematológico | Histología renal |
|---|---|---|
| Procedimientos recomendados | - Electroforesis en plasma u orina - Inmunofijación en plasma u orina - Cadenas ligeras libres en sangre y orina - Aspirado/biopsia de médula ósea | - Microscopia óptica - Inmunofluorescencia con tinción de cadenas ligeras (κ y λ) y tratamiento con pronasa en casos seleccionados - Microscopia electrónica |
| Procedimientos diagnósticos adicionalesa | - Técnica de western blot para detección de subclases de IgG - Prueba de imagen: TC, RMN o PET-TC - Biopsia de adenopatía | - Inmuno-microscopia electrónica - Microdisección laser y espectrometría de masas |
IgG: inmunoglobulina G; PET-TC: tomografía por emisión de positrones con fluordesoxiglucosa-18F; RMN: resonancia magnética nuclear; TC: tomografía computarizada.
El diagnóstico de sospecha de una GMSR casi siempre se establece por la asociación de una afectación renal (deterioro de función, proteinuria, síndrome de Fanconi u otras alteraciones metabólicas asociadas a disfunción túbulo-intersticial) junto con la presencia de un pico monoclonal en el espectro electroforético4,96,97.
En la mayoría de los casos el diagnóstico de GM se realiza mediante electroforesis convencional en plasma u orina4,96. La presencia de inmunoglobulinas monoclonales se suele identificar por la existencia de un pico alto y delgado en la región beta o gamma, a diferencia del aumento policlonal, que suele producir una banda ancha en la región gamma96.
Sin embargo, en algunos casos la concentración de la proteína monoclonal en plasma u orina es tan pequeña que la electroforesis no es capaz de detectarla. De hecho, algunos casos de afectación renal por GM se diagnostican primariamente por los hallazgos de la biopsia renal (inmunohistoquímica), sin haberse sospechado este diagnóstico en el momento de la indicación de la biopsia.
Además de la electroforesis convencional, se debe realizar en todos los casos una inmunofijación en plasma y orina para identificar el tipo de proteína M, ya que es más sensible para su detección que la electroforesis4,96,98.
Otro método diagnóstico es la determinación de cadenas ligeras libres (CLL) en sangre y orina96,98–102. La concentración de estas proteínas se puede medir mediante inmunoanálisis nefelométricos usando anticuerpos policlonales contra epítopos de cadenas ligeras, los cuales están expuestos cuando la cadena se encuentra libre, pero ocultos cuando la cadena está unida conformando la estructura de la Ig99.
Estas mediciones de CLL son muy sensibles, pero tienen el inconveniente de no ser capaces de demostrar la monoclonalidad de las CLL. Esta posibilidad se propone de forma indirecta por la relación entre las concentraciones de cadenas κ y λ98,100.
Un cociente de concentraciones κ y λ anormal se debe interpretar más cuidadosamente en pacientes con deterioro de la función renal4,102. Existe una fuerte correlación entre la concentración de CLL y la función renal. Según desciende el filtrado glomerular, se elevan las concentraciones de CLL policlonales tanto κ como λ. Además, en pacientes con función renal normal, la mayor producción fisiológica de CLL policlonal κ queda enmascarada por el aclaramiento más rápido de las formas monoméricas de CLL κ en comparación con las formas diméricas λ de mayor tamaño. De esta forma, en caso de insuficiencia renal, se produce un cambio en la relación de concentraciones entre CLL κ y λ4,102. Cuando la función renal es normal, el rango de este cociente oscila entre 0,26 y 1,65, mientras que cuando existe insuficiencia renal la relación aceptada como normal oscila entre 0,37 y 3,17, si bien no se ha establecido un rango para cada estadio de insuficiencia renal102.
La diferencia de concentraciones entre la CLL es muy útil no solo para el diagnóstico sino también para el seguimiento y como índice de respuesta al tratamiento y, por tanto, se recomienda su monitorización frecuente103.
Las CLL se incluyen actualmente también entre los criterios de respuesta al tratamiento de la amiloidosis AL104. Así, para el diagnóstico de una remisión completa se requiere una normalización de la relación de concentraciones κ y λ, junto con un resultado negativo en la inmunofijación en sangre y orina.
La utilización de la medición de las CLL como prueba aislada de detección de una GM es controvertida105 y, aunque puede ser de utilidad para apoyar el diagnóstico de GM en el mieloma, macroglobulinemia o amiloidosis, las recomendaciones actuales son las de utilizar para el diagnóstico de GM el EF y la inmunofijación en sangre y orina.
Para la detección de algunas subclases de inmunoglobulinas (IgG) o cadenas pesadas monoclonales incompletas circulantes son necesarios análisis más complejos (western blot o electrotransferencia) en sangre y orina que son capaces de detectar concentraciones muy pequeñas de proteínas monoclonales con una mayor sensibilidad106, aunque desafortunadamente estas técnicas de laboratorio no son de disponibilidad rutinaria.
Para confirmar el diagnóstico de GMSR no solo se debe demostrar la implicación patogénica de la GM en la afectación renal, sino que, además, se debe descartar el mieloma y caracterizar el clon celular productor de la proteína M por su interés en la estrategia terapéutica. Para ello se debe contar con el apoyo de un Servicio de Hematología3,4,107.
En casos de GMSR en los que la biopsia renal muestra IgG, IgA o CL, el aspirado de médula ósea y biopsia suele ser suficiente para demostrar el clon mediante técnicas de citometría de flujo e inmunohistoquímica4. Además, se debe descartar la extensión tumoral ósea o la presencia de plasmocitoma solitario con técnicas de imagen (TC, RNM o PET-TC)4,5. La RNM es la técnica con mayor sensibilidad en la detección de infiltración en médula ósea, aunque resulta laboriosa5. Por otra parte, la PET-TC permite la identificación de cambios en las lesiones a lo largo del seguimiento y evita el empleo de contraste intravenoso, aunque expone a los pacientes a una elevada radiación y es económicamente más costosa5.
En pacientes con GMSR IgM se debe sospechar la posibilidad de que el clon no sea de células plasmáticas sino de linfocitos B, por lo que el estudio de imagen deberá incluir aquellas zonas más sospechosas de albergar linfadenopatías para su biopsia3.
TratamientoLas estrategias de tratamiento de las GMSR se basan en la quimioterapia que debe adaptarse a la naturaleza del clon celular, tanto linfocítico como plasmocítico, a la función renal y a la presencia o no de afectación extrarrenal22,107.
La rápida supresión de la inmunoglobulina monoclonal nefrotóxica ha demostrado ser un tratamiento con resultados satisfactorios sobre la función renal y la supervivencia del paciente en varias formas de GMSR107, aunque, como más adelante se enfatizará, son necesarios más estudios y experiencia clínica para delinear protocolos terapéuticos basados en evidencias sólidas.
El objetivo fundamental del tratamiento, salvo en el caso de la amiloidosis de cadenas ligeras, debe ir encaminado a preservar la función renal26,91,107,108. Así, los pacientes con daño renal irreversible no serían candidatos a recibir tratamiento quimioterápico, a no ser que se deseara alcanzar una remisión hematológica completa para evitar la recurrencia en un trasplante renal107.
En 2013, el International Kidney and Monoclonal Gammopathy Working Group publicó un documento de consenso con las pautas de tratamiento recomendadas para las GMSR, basadas en la experiencia clínica del tratamiento de las discrasias sanguíneas en sus formas malignas107. La tabla 6 resume las principales recomendaciones del grupo. Sin embargo, dada la heterogeneidad de las enfermedades asociadas a las GMSR, existe gran incertidumbre en cuanto al tratamiento óptimo de algunas formas complejas, con una experiencia limitada a casos clínicos o pequeñas series de casos63,64,70,71,77,109. Así, en el caso de la glomerulonefritis fibrilar se han empleado diferentes regímenes que incluían ciclofosfamida, micofenolato mofetil, ciclosporina, melfalan, lenalidomida o rituximab, con resultados limitados44,45,110. Por otra parte, en la glomerulopatía C3 asociada a la gammapatía monoclonal se han empleado pautas de tratamiento similares a la glomerulonefritis proliferativa con depósitos de inmunoglobulina monoclonal70,71,107. No obstante, la información disponible sobre el pronóstico a largo plazo de estos procesos con las terapias actuales es escasa26.
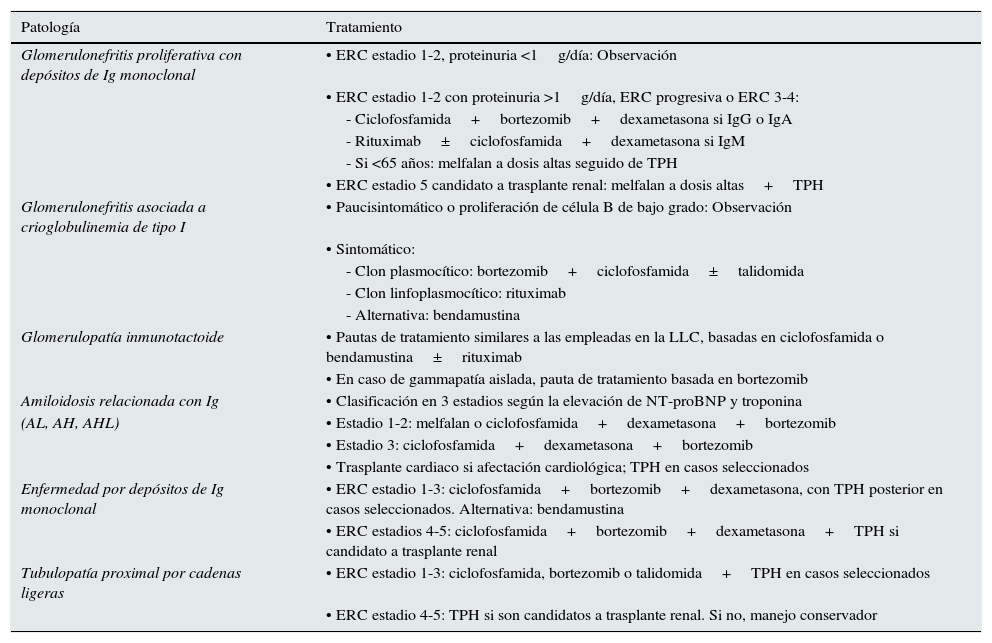
Regímenes terapéuticos propuestos en las GMSR
| Patología | Tratamiento |
|---|---|
| Glomerulonefritis proliferativa con depósitos de Ig monoclonal | • ERC estadio 1-2, proteinuria <1g/día: Observación |
| • ERC estadio 1-2 con proteinuria >1g/día, ERC progresiva o ERC 3-4: | |
| - Ciclofosfamida+bortezomib+dexametasona si IgG o IgA | |
| - Rituximab±ciclofosfamida+dexametasona si IgM | |
| - Si <65 años: melfalan a dosis altas seguido de TPH | |
| • ERC estadio 5 candidato a trasplante renal: melfalan a dosis altas+TPH | |
| Glomerulonefritis asociada a crioglobulinemia de tipo I | • Paucisintomático o proliferación de célula B de bajo grado: Observación |
| • Sintomático: | |
| - Clon plasmocítico: bortezomib+ciclofosfamida±talidomida | |
| - Clon linfoplasmocítico: rituximab | |
| - Alternativa: bendamustina | |
| Glomerulopatía inmunotactoide | • Pautas de tratamiento similares a las empleadas en la LLC, basadas en ciclofosfamida o bendamustina±rituximab |
| • En caso de gammapatía aislada, pauta de tratamiento basada en bortezomib | |
| Amiloidosis relacionada con Ig | • Clasificación en 3 estadios según la elevación de NT-proBNP y troponina |
| (AL, AH, AHL) | • Estadio 1-2: melfalan o ciclofosfamida+dexametasona+bortezomib |
| • Estadio 3: ciclofosfamida+dexametasona+bortezomib | |
| • Trasplante cardiaco si afectación cardiológica; TPH en casos seleccionados | |
| Enfermedad por depósitos de Ig monoclonal | • ERC estadio 1-3: ciclofosfamida+bortezomib+dexametasona, con TPH posterior en casos seleccionados. Alternativa: bendamustina |
| • ERC estadios 4-5: ciclofosfamida+bortezomib+dexametasona+TPH si candidato a trasplante renal | |
| Tubulopatía proximal por cadenas ligeras | • ERC estadio 1-3: ciclofosfamida, bortezomib o talidomida+TPH en casos seleccionados |
| • ERC estadio 4-5: TPH si son candidatos a trasplante renal. Si no, manejo conservador |
AH: amiloidosis de cadenas pesadas; AL: amiloidosis de cadenas ligeras; AHL: amiloidosis de cadenas pesadas y ligeras; ERC: enfermedad renal crónica; Ig: inmunoglobulina; NT-proBNP: propéptido natriurético cerebral N-terminal; TPH: trasplante de progenitores hematopoyéticos.
Fuente: Adaptado de original Fermand et al.108.
Debido al creciente protagonismo de las GMSR en la nefrología clínica, resulta importante conocer los principales agentes terapéuticos empleados en la actualidad, su tolerancia y efectos adversos más frecuentes. Muchos de estos tratamientos se administran de forma combinada por el efecto sinérgico sobre la célula B y la célula plasmática111. Las principales combinaciones incluyen107,111,112: bortezomib, ciclofosfamida y dexametasona; bendamustina y rituximab, y agentes inmunomoduladores como la talidomida o la lenalidomida.
El bortezomib tiene un papel destacado dentro del arsenal terapéutico por su perfil de seguridad y la posibilidad de ser administrado a dosis plenas en pacientes con enfermedad renal avanzada112–114. El mecanismo de acción se basa en la inhibición de la actividad proteasoma, que produce la apoptosis de la célula plasmática y, además, inhibe la vía NF-κB al reducir la liberación de citocinas proinflamatorias e inducir vías antiapoptóticas a nivel tubular115–117. Los efectos adversos no suelen ser graves; destaca el desarrollo o empeoramiento de neuropatía periférica, aunque con menos frecuencia cuando la vía de administración es subcutánea118. Asimismo, se recomienda instaurar profilaxis contra el herpes zóster por el riesgo de reactivación111.
Dentro de los agentes citotóxicos, tanto el melfalan como la ciclofosfamida tienen efecto sobre la célula B y la célula plasmática, aunque se suele emplear esta última por su menor toxicidad107,111. Otra alternativa es la bendamustina, aprobada en el tratamiento de algunos linfomas y adecuada para pacientes con insuficiencia renal por su metabolismo predominante a nivel hepático119–121.
El melfalan se emplea a dosis mieloablativas como tratamiento de acondicionamiento para el trasplante autólogo de progenitores hematopoyéticos en casos seleccionados sin enfermedad extrarrenal significativa107,111. Este trasplante autólogo ha demostrado mejorar la supervivencia en pacientes con mieloma múltiple y amiloidosis de cadenas ligeras, aunque en la práctica menos del 20% son candidatos adecuados para este tratamiento, que se asocia con una elevada morbimortalidad86,122–124.
Los anticuerpos monoclonales como el rituximab (dirigido contra el antígeno CD20) constituyen una opción terapéutica adecuada en las diferentes formas de GMSR mediadas por linfocitos B por su buena tolerancia y escaso número de efectos adversos107,111,112. Recientemente se ha aprobado el empleo de daratumumab (contra el CD38) para el mieloma en recaída o refractario125, aunque por el momento no se dispone de experiencia en casos de GMSR.
Dentro de la familia de los fármacos inmunomoduladores, la talidomida sería más adecuada que la lenalidomida, debido a que esta última tiene eliminación renal y, además, puede producir deterioro de función renal en algunos casos126–128. Sin embargo, también se han reportado efectos adversos con la talidomida, como el desarrollo de hiperpotasemia129.
ConclusionesLas GMSR se asocian con un variado espectro de enfermedades renales como consecuencia del depósito de inmunoglobulinas o de sus componentes en el riñón, o a través de una disregulación del sistema del complemento. Aunque la mortalidad de los pacientes con GMSR es inferior a la del mieloma u otras formas neoplásicas relacionadas, la probabilidad de desarrollo de enfermedad renal crónica avanzada es muy elevada. Por este motivo, en la evaluación de pacientes con sospecha de GMSR resulta fundamental la realización de un estudio anatomopatológico, hematológico y bioquímico completos que permitan determinar el tipo de entidad y su extensión. Los avances en el conocimiento de estas entidades han permitido mejorar el curso evolutivo y la supervivencia en varias formas de GMSR, aunque son necesarios más estudios y experiencia clínica para delinear protocolos terapéuticos más efectivos. Es, por tanto, prioritaria una colaboración estrecha entre nefrólogos y hematólogos para individualizar el tratamiento a las características clínicas y comorbilidad de los pacientes, y así intentar mejorar el pronóstico global de estas enfermedades.
En el momento actual se desconoce la incidencia y prevalencia de este grupo de enfermedades en la población española, de los que se han publicado pocos casos130. Según la experiencia en la práctica clínica, estas enfermedades no son infrecuentes, pero hasta el momento no se ha realizado ningún estudio epidemiológico que confirme estas apreciaciones. Además, al ser enfermedades poco frecuentes pero que requieren un estudio complejo, el diagnóstico podría llegar a ser menos adecuado o incompleto en pacientes atendidos en muchos centros hospitalarios que no cuentan con los medios necesarios de diagnóstico no convencional. Por el contrario, la implementación de estos medios en todos los hospitales no parece una medida eficiente. Así, la creación de unidades de excelencia y referencia diagnóstica-terapéutica para este tipo de enfermedades podría ser una solución apropiada para rentabilizar el valor asistencial, académico y económico.
Propuesta de estudio GLOSENEn 2009 se creó un grupo internacional para la investigación de las GMSR en el que participan departamentos de nefrología, hematología y anatomía patológica de varios países4,26,107. Los estudios y publicaciones de los miembros de este grupo de investigación son reconocidos actualmente como la vanguardia de la investigación de estas enfermedades, con avances diagnósticos y terapéuticos muy significativos. La incorporación de grupos españoles a este grupo internacional podría revertir en beneficios mutuos, como la formación y transferencia de experiencia a los miembros españoles, así como la incorporación de unidades y pacientes españoles a ensayos clínicos internacionales.
Todas estas razones podrían justificar la creación de un registro nacional de GMSR que ayudara a investigar las características clínico-patológicas de estas entidades, identificar determinantes evolutivos y de respuesta a los tratamientos actuales.
Creemos que el Grupo de Estudio de la Patología Glomerular de la Sociedad Española de Nefrología (GLOSEN) puede ser el marco ideal para liderar un trabajo de estas características, dada la amplia experiencia en la realización de proyectos colaborativos131–133.
Como proyecto inicial se propone recoger de forma retrospectiva todos los casos diagnosticados de GMSR con biopsia renal durante los últimos años en los diferentes centros adheridos al estudio. Aunque próximamente se remitirá a todos los miembros del grupo una propuesta del trabajo, lanzamos con estas líneas un mensaje para recabar el interés de todos los nefrólogos y patólogos interesados en las enfermedades glomerulares y solicitar su colaboración en el estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de interés relacionado con la publicación de este artículo.
- 1.
Las GMSR se caracterizan patogénicamente por la proliferación de un clon de linfocitos B o células plasmáticas que sintetizan y segregan una inmunoglobulina monoclonal o uno de sus componentes (cadenas ligeras o pesadas), con capacidad para depositarse y producir daño a nivel glomerular, tubular, intersticial o vascular.
- 2.
Dada la heterogeneidad de la enfermedad renal asociada a las GMSR, la biospia renal es fundamental, y su correcta investigación histológica debe incluir microscopia óptica, inmunofluorescencia y microscopia electrónica.
- 3.
Existen diferentes formas de clasificar la enfermedad renal asociada a las GMSR, aunque la más aceptada es de acuerdo con la organización de los depósitos: «organizados» (fibrillas, microtúbulos y cristales) o «no organizados» (enfermedad por depósitos de inmunoglobulina monoclonal, glomerulonefritis proliferativa con depósitos de inmunoglobulina monoclonal y glomerulonefritis C3 asociada a inmunoglobulina monoclonal).
- 4.
El estudio diagnóstico debe incluir, además, la electroforesis e inmunofijación en plasma y orina para identificar la proteína monoclonal y la determinación de las cadenas ligeras libres.
- 5.
Además, se debe descartar el mieloma y caracterizar el clon celular productor de la proteína monoclonal mediante aspirado y biopsia de médula ósea.
- 6.
El tratamiento actual está basado en la experiencia clínica del tratamiento de las discrasias sanguíneas en sus formas malignas, por lo que es prioritaria la colaboración estrecha entre nefrólogos y hematólogos para individualizar el tratamiento a las características clínicas y comorbilidad de los pacientes.
Este trabajo ha sido apoyado en parte por fondos FEDER ISCIII-RETIC REDinREN RD16/0009.