¿PODEMOS MEJORAR EL DIAGNÓSTICO DE LA ENFERMEDAD RENAL CRÓNICA? DIFICULTADES EN SU CLASIFICACIÓN
El punto de partida que consideramos en esta revisión son las guías K/DOQI de la National Kidney Foundation de 2002, con su división de la ERC en cinco estadios, basándose en datos de daño renal y en el cálculo del filtrado glomerular estimado (eFG) por las fórmulas derivadas del estudio Modification of Diet in Renal Disease (MDRD). Estas guías han sido enormemente beneficiosas al poner orden en el caótico sistema de nomenclatura de la ERC, han propiciado el resurgimiento del interés por este aspecto de la Nefrología clínica, permiten un mejor conocimiento y una mayor difusión de su importancia, facilitan su detección precoz, evaluación y manejo y favorecen el establecimiento de planes de acción según el estadio.
Sin embargo, desde su publicación estas guías han recibido críticas basadas en algunas de sus principales características, que conducen a imprecisiones y a dificultades en la clasificación de la ERC:
- Los estadios 1 y 2 se definen por el eFG y por signos de daño renal (en los estudios poblacionales, fundamentalmente la albuminuria). Sin embargo, los estadios 3, 4 y 5 se definen exclusivamente por el descenso del eFG, sin tener en cuenta la albuminuria.
- No se consideran otros datos en la definición de ERC, como la edad o el sexo.
- No se contemplan aspectos como la etiología de la ERC, el grado de proteinuria o la patología asociada.
FILTRADO GLOMERULAR COMO ÍNDICE DE LA FUNCIÓN RENAL
Se ha estandarizado el cálculo del filtrado glomerular mediante ecuaciones que tratan de obtener una estimación a partir de la creatinina sérica y de algunas variables demográficas y antropométricas (edad, sexo, peso, talla y etnia). En la práctica clínica es habitual la inclusión del cálculo del eFG mediante la fórmula MDRD-4 o la MDRD-IDMS (si la creatinina ha sido calibrada) en los informes de los análisis realizados por los distintos laboratorios. Éste es un objetivo recomendado por las guías K/DOQI y recogido por los consensos de la Sociedad Española de Nefrología (S.E.N.) con las Sociedades españolas de Bioquímica Clínica y Patología Molecular (SEQC)1 y de Medicina Familiar y Comunitaria (semFYC)2.
NECESIDAD DE LA ESTANDARIZACIÓN DE LA CREATININA PLASMÁTICA
La falta de estandarización de los métodos de medida de la creatinina origina desviaciones propias de cada laboratorio y una importante variabilidad interlaboratorios, con diferencias clínicamente significativas en las estimaciones del eFG obtenidas a partir de las ecuaciones. Este hecho tiene una mayor repercusión en aquellos valores de creatinina próximos a los límites de referencia, lo que se traduce en una elevada inexactitud en la estimación de eFG próximos a 60 ml/min/1,73 m2, con una sobrestimación del estadio 3 de ERC1.
Por lo tanto, en la mejora del diagnóstico de la ERC, el primer paso debe ser la estandarización de las determinaciones de creatinina plasmática en los analizadores (con diferentes calibraciones y manufacturas) mediante espectrofotometría de masas por dilución isotópica o por métodos enzimáticos con trazabilidad para esta técnica. Komenda et al.3 describen su experiencia en la estandarización de la determinación de creatinina plasmática en la región de British Columbia (Canadá), con una población de 4,1 millones de habitantes y 107 laboratorios con 124 analizadores y 6 métodos distintos de determinación. Sus resultados muestran una diferencia media entre los valores de creatinina calibrados y sin calibrar del 23,9% (entre el 4 y el 54%) que se reduce al 8,7% tras la calibración. La determinación de creatinina ofrecía resultados un 16,5% por encima de su valor, que se reduce al 2,7% tras la estandarización. Al utilizar los valores ajustados para el cálculo del eFG por la ecuación MDRD en su base de datos, los autores concluyen que los mayores errores se centran en eFG en torno a 60 ml/min/1,73 m2 y que la implementación de este programa a gran escala puede reducir el porcentaje de clasificación incorrecta del estadio 3 de ERC en un 84%.
UTILIDAD Y PRECISIÓN DE LAS FÓRMULAS DE CÁLCULO DEL FILTRADO GLOMERULAR
Stevens et al.4 compararon el filtrado glomerular estimado por la ecuación MDRD con el filtrado glomerular medido por el aclaramiento urinario de yodotalamato en 5.504 pacientes participantes en 10 estudios. La fortaleza de este trabajo reside en el elevado número de participantes (con amplios rangos de filtrado glomerular, edad, índice de masa corporal e inclusión de diabéticos y trasplantados renales), en la utilización de la determinación de creatinina estandarizada y el cálculo en todos los casos del filtrado glomerular por yodotalamato. Hallaron que la ecuación MDRD tiene una buena precisión en filtrados glomerulares inferiores a 60 ml/min/1,73 m2 (diferencia media 0,9 ± 9,6 ml/min/1,73 m2) e infraestima el filtrado glomerular superior a 60 ml/min/1,73 m2 (diferencia media 8,3 ± 23,6 ml/min/1,73 m2). En su serie, si el filtrado glomerular es inferior a 60 ml/min/1,73 m2 (ERC estadios 3 a 5), la ecuación MDRD apenas se ve influida por la edad, el sexo, la raza, el índice de masa corporal, la presencia de diabetes o de un órgano trasplantado. Sin embargo, el porcentaje de determinaciones del eFG por la fórmula MDRD que quedan dentro del 30% (P30) del valor del filtrado glomerular estimado por yodotalamato es del 82%, lo que significa que un importante porcentaje de pacientes presentan una desviación excesiva, fuente de falsos positivos y negativos. Los autores concluyen que la ecuación MDRD ofrece valores específicos con eFG <60 ml/min/1,73 m2, pero que el P30 del 82% supone una precisión limitada individualmente, en especial en valores cercanos a filtrado glomerular de 60 ml/min/1,73 m2, siendo recomendable en estos casos valorar el contexto clínico.
Levey et al.5 pretenden mejorar esta precisión mediante una nueva ecuación, la CKD-EPI. Esta fórmula se desarrolló en 3.896 pacientes y se validó en 8.254, con una media de eFG 68 ± 36 ml/min/1,73 m2. Sus resultados ofrecen una menor diferencia media con el filtrado glomerular medido con yodotalamato que la ecuación MDRD, especialmente en valores entre 60-90 ml/min/1,73 m2. Sin embargo, un P30 del 84,1% limita su precisión. La alternativa de la ecuación CKD-EPI extendida con diabetes, órgano trasplantado y peso no mejora la estimación6. Los autores concluyen que la ecuación CKD-EPI es más precisa que la ecuación MDRD, especialmente con valores de filtrado glomerular >60 ml/min/1,73 m2 y puede reemplazarla en la práctica clínica habitual, aunque la precisión de esta nueva ecuación sigue siendo limitada.
La determinación mediante ecuaciones eFG en trasplantados presenta la dificultad de que se basa en pocos estudios y en ocasiones con distinta metodología. En general, la precisión de las ecuaciones es menor, con una mayor diferencia media con respecto a la medición estándar y valores de P30 en torno al 75-78%6.
BÚSQUEDA DE NUEVOS MARCADORES DE FUNCIÓN RENAL: CISTATINA
Se ha postulado que la precisión de las ecuaciones basadas en la cistatina C podría mejorar el diagnóstico de ERC, siendo una buena alternativa cuando la producción de creatinina es «anormal» (masa muscular disminuida, dieta, ancianos, hepatopatía). La producción de cistatina C se distribuye entre todas las células nucleadas y, por lo tanto, se modifica menos con la disminución de masa muscular que, sin embargo, tiene una mayor repercusión en la producción de creatinina. En principio, la determinación de la función renal podría ser más precisa en los ancianos, una población en la que el diagnóstico de ERC preocupa especialmente por la posibilidad de presentar cifras de creatinina inferiores por reducción de masa muscular. Stevens et al.7 realizaron un estudio importante al comparar la utilidad del cálculo del eFG por fórmula MDRD y por fórmulas que incluyen la cistatina C en 3.418 pacientes con una correcta metodología: cálculo de creatinina estandarizada y cálculo del filtrado glomerular por yodotalamato. Concluyen que las fórmulas basadas en la cistatina C no mejoran la precisión del cálculo del eFG. El porcentaje de diferencia es del 0,3% por MDRD frente al 0,1% por fórmulas basadas en la cistatina C, y el P30 del 85% por MDRD frente al 81% por fórmulas basadas en la cistatina C. Es de destacar que no encuentran tampoco mayor precisión en los 600 pacientes mayores de 65 años que se incluyen (diferencia media 0,1% frente al -0,3%; P30 87% frente al 82%). Las conclusiones son que, por su coste y por su similar precisión respecto al cálculo del eFG por fórmula MDRD, no está justificada la inclusión de la determinación sistemática de cistatina C en el diagnóstico de ERC en la población general.
¿CUÁLES SON LAS DIFICULTADES EN EL DIAGNÓSTICO DE LA ERC?
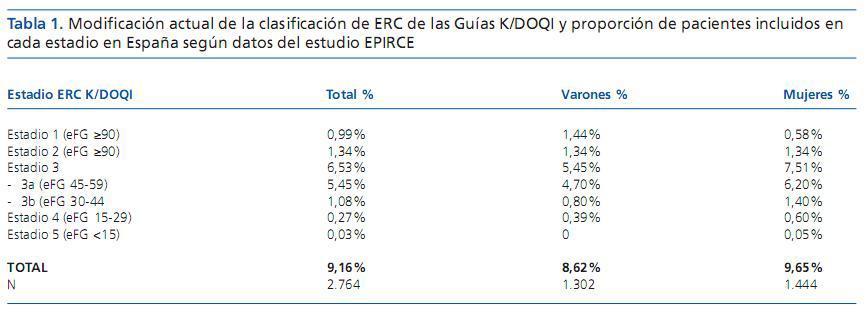
La ERC es un proceso con una alta prevalencia en la población general, del 9,16% en España según datos del estudio EPIRCE8 (tabla 1). En los pacientes visitados en atención primaria, el estudio EROCAP y el estudio realizado por los autores de este artículo en el Sector Sanitario de Alcañiz muestran que esta incidencia se incrementa a porcentajes entre el 16-21% de eFG <60 ml/min/1,73m2,9,10. Este dato es importante porque supone una radiografía de la situación a la que se enfrentan los médicos de atención primaria, que deberán decidir entre el manejo adecuado de estos pacientes en el centro de salud, su derivación a Nefrología o su manejo conjunto. Al analizar esta elevada prevalencia se aprecia la importancia del estadio 3, que incluye un abrumador porcentaje de pacientes diagnosticados de ERC y en el que se centran las principales dificultades diagnósticas, resumidas en los siguientes puntos:
La no estandarización de la determinación de los valores de creatinina plasmática conduce a una importante sobrestimación del estadio 3.
- En las ecuaciones de cálculo del eFG, el P30 del 82% limita su precisión, especialmente en valores de eFG próximos a 60 ml/min/1,73 m2, con la consiguiente dificultad para diagnosticar ERC estadio 3.
- La habitual determinación única del eFG en un proceso crónico en la que se basan la mayoría de los estudios limita la validez de sus resultados, ya que el 25-30% de sujetos con estadio 3 de ERC salen de la categoría si se repiten las determinaciones.
- El no incluir en el diagnóstico de estadio 3 la albuminuria, ni considerar otros datos como edad y sexo, conduce a dificultades para analizar su repercusión sobre la morbimortalidad y la progresión de la ERC.
- El envejecimiento de la población conduce a un progresivo descenso del eFG también en personas sanas, con un incremento de la prevalencia de ERC de difícil interpretación.
Estas limitaciones en el diagnóstico de ERC generan las siguientes reflexiones en los distintos grupos de trabajo:
- Jong y Gansevoort11: existe un descorazonador diagnóstico de gran cantidad de sujetos con ERC estadio 3, muchos de los cuales no van a sufrir eventos cardiovasculares ni progresar a insuficiencia renal terminal.
- Guías NICE12,13: las fórmulas de cálculo de eFG son inadecuadas en el 90-95% de la población que tiene «normal» o «moderado deterioro de la función renal», es decir, eFG >45 ml/min. La etiqueta de ERC puede ser innecesariamente preocupante para los pacientes y distraer a los médicos.
- Bauer et al.14: ¿los porcentajes estimados tan elevados de ERC en la población general no restan credibilidad a nuestros esfuerzos y recomendaciones?
REPERCUSIÓN DE LA ERC SOBRE LA MORBIMORTALIDAD Y LA EVOLUCIÓN A ERC TERMINAL
¿eFG; por qué el límite de 60 ml/min/m2?
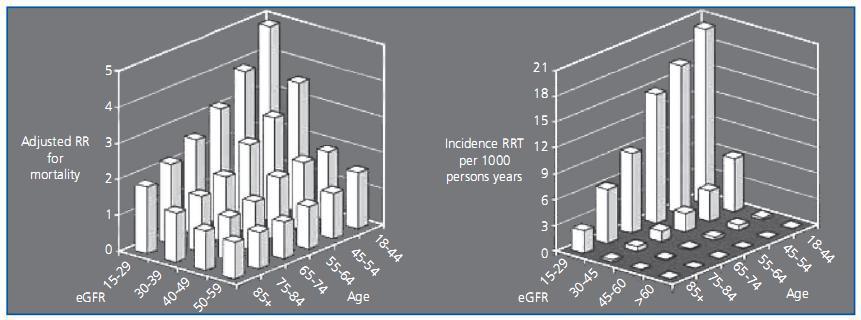
Es conocido que la ERC supone un importante factor de riesgo cardiovascular y renal. Los estudios de Go et al.15 así lo demuestran, aunque de los datos aportados en su valoración inicial parece deducirse que el incremento de la morbimortalidad se produce en todos los pacientes con eFG <60 ml/min/1,73m2, independientemente del sexo y la edad. Estudios posteriores de O¿Hare et al. demuestran que la correlación de ERC con aumento de la morbimortalidad16 y evolución a ERC terminal17 se ve modificada y atenuada por la edad (figura 1). Otros trabajos apoyan estas conclusiones: Majunath et al.18 no registran ningún incremento de la mortalidad en ancianos con eFG entre 45-59 ml/min/1,73 m2 y el estudio francés de Tres Ciudades19 no aprecia incrementos de la mortalidad en mayores de 65 años con eFG entre 45-59 ml/min/1,73 m2. Una posterior revisión de los datos del Kaiser Permanent Study20 confirma estos resultados, aportando una estratificación del riesgo de mortalidad ajustada por sexo, edad y raza: en varones caucásicos menores de 60 años se detecta un incremento de la mortalidad con eFG <60 ml/min/1,73 m2, pero este límite se reduce a 45 ml/min/1,73 m2 en mujeres hasta de 80 años y en varones entre 60 y 80 años. Por encima de los 80 años, aumenta el riesgo con valores inferiores a 30 ml/min/1,73 m2 en ambos sexos.
Tras estos estudios, parece necesario modificar los valores de corte del eFG si se pretende mejorar el valor predictivo de morbimortalidad y progresión a la ERC terminal basándonos en ellos, así como asumir distintos valores según el sexo y la edad.
¿Y la albuminuria?
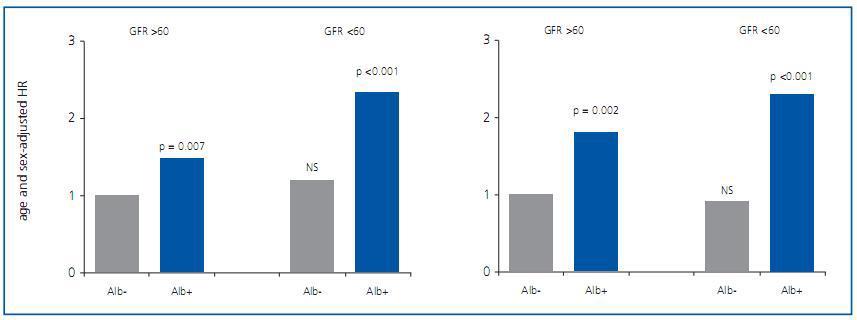
La relación de la albuminuria con la morbimortalidad de causa fundamentalmente cardiovascular y con la progresión a ERC terminal es bien conocida, de forma que el análisis de los estadios 1, 2 y 3 cambia radicalmente cuando se incluye esta variable. Así lo demuestran estudios realizados sobre pronóstico cardiovascular tan serios como el CARE Study (n = 4.098)21, el Framigham Offspring Cohort (n = 2.966)22 y el MIRFT Study (n = 12.866)23 (figura 2). En ellos, la incidencia de episodios cardiovasculares no se incrementa significativamente con eFG <60 ml/min/1,73 m2 en los casos en que no se presenta albuminuria. El estudio HUNT (n = 9.709)24 demuestra que en mayores de 70 años sin albuminuria no se registra incremento de los episodios cardiovasculares incluso con eFG <45 ml/min/1,73 m2.
Analizando la progresión de la ERC, el estudio MIRFT concluye que la albúmina/proteinuria es un factor determinante en el riesgo de ERC terminal25. En 12.866 varones con seguimiento a 25 años, el riesgo de evolución a ERC terminal (ajustado para raza, tabaquismo, índice de masa corporal, presión arterial sistólica, colesterol y glucosa) se incrementa de forma notable en los pacientes con dipstick positivo para proteínas con respecto a los que no presentan proteinuria para un mismo valor de eFG.
Para completar la importancia de estos datos, debemos tenemos en cuenta que el 76% de los pacientes con ERC estadio 3 no presenta albuminuria.
PROPUESTAS DE LOS DISTINTOS GRUPOS DE TRABAJO
A lo largo de 2008 se ha suscitado un importante debate sobre el diagnóstico y la repercusión de la ERC con interesantes editoriales. En un breve resumen, éstas serían las principales propuestas de los más importantes grupos de trabajo en ERC:
- Glassock y Winearls26: en el estadio 3 de ERC definido por eFG sin otros datos, se debería reducir el corte a 45 ml/min/1,73 m2 o bien utilizar percentiles basados en edad y sexo. Al utilizar percentiles, centraríamos nuestra atención en el 5% de pacientes de cada grupo de edad y sexo que presentan valores más bajos de eFG.
- Jong y Gansevoort11: sería conveniente considerar la albuminuria en la definición del estadio 3 de ERC, estableciéndose en su definición dos cortes:
- eFG <45 ml/min en pacientes sin albuminuria.
- eFG <60 ml/min en pacientes con albuminuria.
Otra opción supondría definir valores de corte de eFG específicos para edad y sexo. Estos autores critican la utilización de percentiles, ya que con ellos un 5% en cada grupo de edad y sexo presentaría ERC, prevalencia excesiva en pacientes jóvenes y reducida en pacientes ancianos.
- Las guías NICE recomiendan:
- Dividir el estadio 3 de ERC en 3Ay 3B (definidos por eFG entre 45-59 ml/min/1,73 m2 y 30-44 ml/min/1,73 m2).
- Utilizar el sufijo «p» para casos con albuminuria (definido como cociente albúmina/creatinina en orina simple >30 mg/g). Ayudaría a identificar los casos con alto riesgo de episodios cardiovasculares y progresión e ERC.
- En un esfuerzo por disponer de un score (puntuación) de riesgo de progresión de la insuficiencia renal, Taal y Brenner27 revisan las fórmulas desarrolladas en población general, diabéticos y con glomerulonefritis IgA, y que habitualmente incluyen edad, creatinina plasmática, proteinuria, presión arterial sistólica, proteínas y albúmina en plasma como principales variables.
- Ante estas propuestas, que suponen una modificación de relativo calado en las guías K/DOQI, las iniciativas de la KDIGO plantean las siguientes reflexiones28:
- No se deben realizar modificaciones excesivas de la clasificación actual de la ERC: es clara, simple, útil, aceptada universalmente y transmite un mensaje simple aplicable en diferentes disciplinas y comunidades.
- Es necesaria la información clínica adicional para casos individuales.
- Los beneficios potenciales de agregar información serían superados por las desventajas de una complejidad aumentada y una descripción incompleta de una enfermedad esencialmente heterogénea.
- En ancianos parece razonable evitar la clasificación como enfermedad, pero es prematuro utilizar la alta prevalencia o falta de tratamiento adecuado para definir individuos con eFG reducido como sanos29.
Basándose en estos criterios, en su última reunión se ha propuesto una única modificación, considerando la división del estadio 3 de ERC en 3A con eFG entre 45-69 ml/min/1,73 m2 y 3B con eFG entre 30-44 ml/min/1,73 m2, sin incluir la albuminuria en la definición del estadio 38.
CONCLUSIONES
La definición, manejo e investigación en la enfermedad renal crónica (ERC) no está tan madura como en otras enfermedades crónicas, debido a las limitaciones en la medida de la función renal (especialmente en ancianos) y a la dificultad de evaluar y tratar el riesgo cardiovascular y renal. Por este motivo, es difícil establecer normas claras en áreas con escasas evidencias, lo que favorece el uso del juicio clínico (p. ej., en criterios de remisión).
La utilización de nuevos marcadores de filtrado glomerular como la cistatina C no parece recomendable para la población general dado su coste y por el hecho de que no aportan mayor precisión respecto a las fórmulas basadas en la determinación de creatinina.
La actual clasificación de ERC en la cual se asume que todo paciente con eFG <60 ml/min/m2 está en riesgo necesita refinamiento. Como opciones más razonables se proponen las siguientes:
- Introducir límites específicos según edad y sexo.
- Definir tan sólo sujetos con eFG <45 ml/min/1,73 m2 como de riesgo. Con valores superiores, deben estar presentes signos adicionales de daño renal (fundamentalmente albuminuria).
- Dividir el estadio 3 de ERC según el punto de corte de 45 ml/min/1,73 m2 y añadir el sufijo «p» en los pacientes con albuminuria, en un esfuerzo por delimitar aquellos pacientes con mayor riesgo cardiovascular y renal.
- La modificación actualmente adoptada por las guías K/DOQI mejora la anterior al fijar la división del estadio 3 en 3A y 3B según el corte de eFG 45 ml/min/1,73 m2, permitiendo una mejor clasificación de la ERC según su repercusión clínica. Sin embargo, el mantener la exclusión de la albuminuria en la definición de los estadios 3, 4 y 5 en aras de una mayor simplicidad limita de manera notable su utilidad. Esto obliga a tener presente de alguna manera la importancia de la determinación de la albuminuria y su consideración como potente factor de riesgo cardiovascular y renal. Así, en la detección y seguimiento de la ERC, sigue siendo fundamental el cálculo del eFG según la fórmula MDRD junto con la determinación del cociente albúmina/creatinina en orina simple, métodos simples, baratos y reproducibles que aportan conjuntamente una valiosa información.
Debemos enfatizar la importancia de conocer y manejar de forma adecuada el elevado riesgo cardiovascular en todos los pacientes con ERC y reservar la remisión a Nefrología especialmente para pacientes con complicaciones o progresión de la ERC. Sin embargo, faltan herramientas para estimar el riesgo de progresión de la enfermedad renal.
Por último, aunque pueda ser dificultosa la adopción de un sistema de clasificación poco claro, las distintas guías son muy útiles para los médicos generales que son quienes tratarán a la mayoría de los pacientes.
Tabla 1. Modificación actual de la clasificación de ERC de las Guías K/DOQI y proporción de pacientes incluidos en cada estadio en España según datos del estudio EPIRCE
Figura 1.
Figura 2.