El riñón interviene en la regulación de numerosos funciones vitales entre ellas la regulación de la tonicidad del fluido corporal a través del control de la excreción renal de agua. El riñón para realizar simultáneamente todas las funciones de homeostasis debe regular de forma independiente la excreción de agua y la excreción de solutos y esto lo realiza gracias a su capacidad para concentrar y diluir la orina. El principal factor responsable de la regulación de la excreción de agua es la vasopresina. Esta hormona actúa a diferentes niveles a lo largo del túbulo renal para controlar el solutos1. renal de agua, iones y de solutos1.
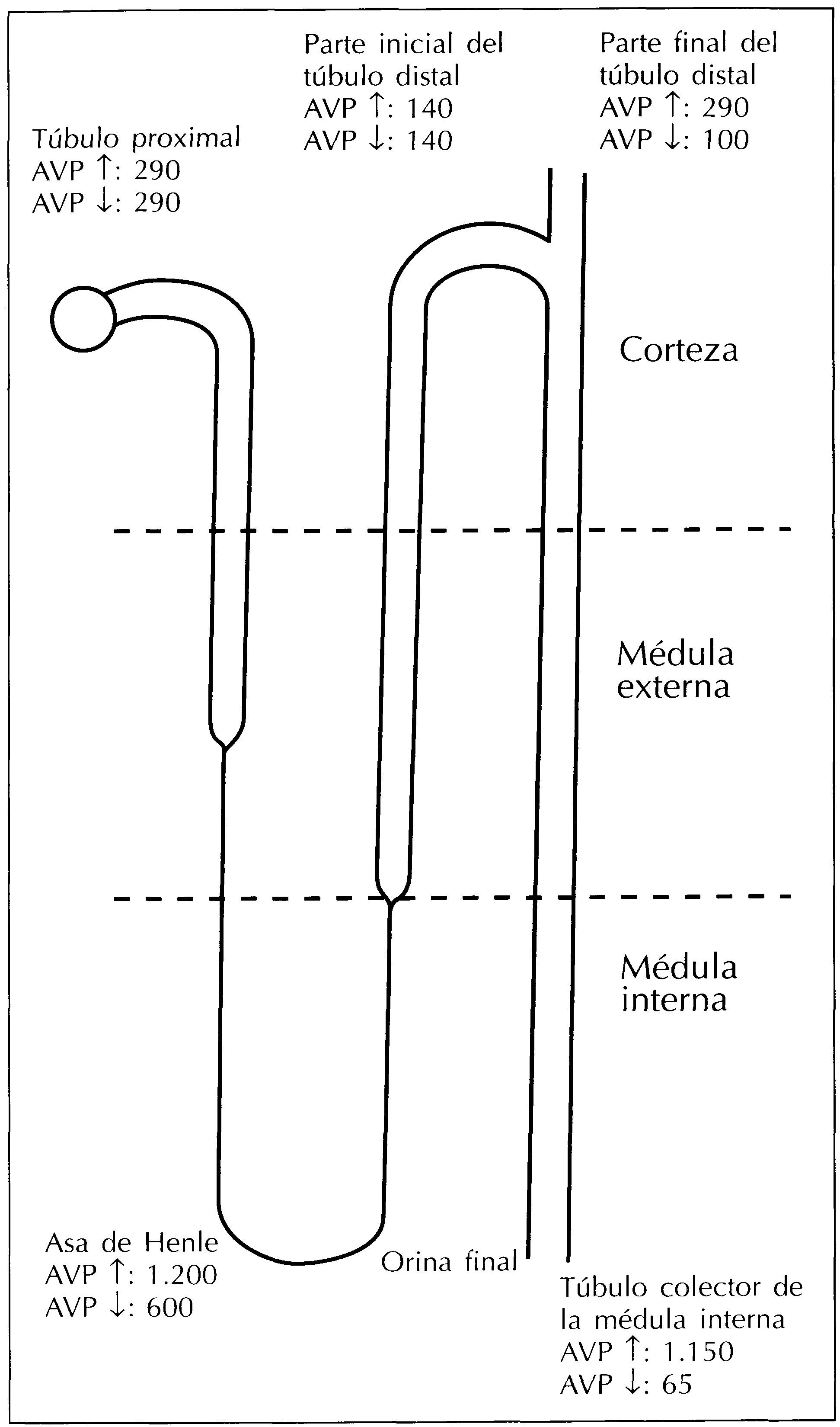
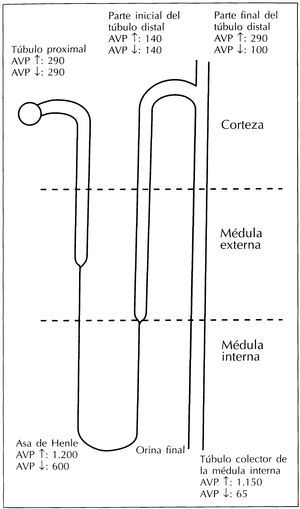
El filtrado glomerular tiene una osmolaridad que cambia a medida que atraviesa los distintos segmentos del túbulo renal (figura 1). En el túbulo contorneado proximal el filtrado glomerular es isosmótico con respecto al plasma volviéndose hipotónico cuando llega al túbulo contorneado distal. Es en la parte final del túbulo contorneado distal, lo que corresponde con la localización del túbulo conector y la parte inicial del túbulo colector, donde la osmolaridad del fluido tubular cambia como consecuencia de la acción de la vasopresina. Así, cuando los niveles circulantes de vasopresina son altos el fluido tubular se vuelve isosmótico, pero se mantiene hipotónico si los niveles de vasopresina son bajos. En el túbulo colector de la médula renal la osmolaridad del fluido tubular aumenta hasta niveles superiores a los del plasma en situaciones de antidiuresis, pero se sigue manteniendo hipotónico en situaciones de diuresis acuosa1.
En los últimos años, se han realizado considerables progresos en el clonaje de proteínas que son claves para el proceso de concentración urinario. Esto incluye los canales de agua o aquaporinas, los transportadores de sodio, los transportadores de urea, los receptores de vasopresina y los canales iónicos. Esto ha permitido adquirir nuevos conocimientos sobre la función, localización y regulación de estos transportadores/canales que han servido para obtener información molecular sobre la contribución de estas proteínas en el proceso de concentración de la orina. En este manuscrito se revisan los conceptos clásicos de este mecanismo y se describen las aquaporinas localizadas en el riñón. Se discuten las bases moleculares del proceso de regulación de la permeabilidad al agua de los túbulos colectores por la vasopresina que, como se comentará, es un punto crítico para el mecanismo de concentración urinaria. También se discute el papel de la disregulación de la aquaporina-2 como base patogénica de la diabetes insípida nefrogénica. Finalmente, se explican brevemente las observaciones realizadas a partir del estudio del fenotipo de ratones deficientes en los genes que codifican para algunas aquaporinas (knockout mice).
MECANISMOS DE CONCENTRACIÓN URINARIA. EVOLUCIÓN HISTÓRICA
En los años 50 Kuhn y cols. propusieron que el asa de Henle era capaz de generar un gradiente de concentración de solutos entre la corteza y la médula renal mediante un mecanismo de multiplicación a contracorriente2. Plantearon que este proceso ocurre como resultado del flujo a contracorriente entre la rama ascendente y descendente del asa de Henle produciéndose un progresivo aumento de la osmolaridad del fluido tubular a medida que el asa de Henle profundiza en la médula renal. Esta hipótesis, sin embargo, no fue ampliamente aceptada hasta que Gottschalk and Mylle demostraron, utilizando técnicas de micropunción renal, que el fluido tubular del asa de Henle en la médula interna era hipertónico con respecto al plasma y que el fluido que sale del asa de Henle es siempre hipotónico independientemente de la osmolaridad final de la orina (como se predecía por el mecanismo de la multiplicación a contracorriente)3. Posteriormente, se demostró que la hipotonicidad del fluido tubular que sale del asa de Henle era debida a una baja concentración de CINa como consecuencia de una reabsorción activa de CINa en la rama gruesa ascendente del asa de Henle y no a una entrada de agua en la luz del túbulo4. La hipotonicidad del fluido tubular se mantiene a lo largo del túbulo distal y del sistema de túbulos colectores en situaciones de diuresis acuosas (en ausencia de vasopresina circulante) debido a una baja permeabilidad osmótica al agua de los túbulos colectores. Sin embargo, en situaciones de antidiuresis, cuando los niveles circulantes de vasopresina son elevados, se produce una reabsorción neta de agua en el sistema de túbulos colectores por el aumento de la permeabilidad osmótica al agua en estos túbulos. En la médula, la fuerza osmótica que favorece esta reabsorción de agua desde la luz del túbulo colector es la alta concentración de solutos en el intersticio medular renal generado por el mecanismo de multiplicación a contracorriente. Burg y cols. utilizando la técnica de microperfusión de túbulos renales aislados, que ellos diseñaron, realizaron importantes aportaciones para el conocimiento del proceso de concentración urinaria. La microperfusión de túbulos renales aislados permite estudiar directamente el transporte de distintas sustancias (agua, iones, etc.) en los diferentes segmentos de la nefrona. Con esta técnica, demostraron que en la rama gruesa ascendente del asa de Henle se produce un transporte activo de CINa que conduce a una disminución de la concentración luminal de CINa en relación al fluido peritubular5'6. En estas condiciones, a pesar de existir un gradiente osmótico transepitelial alto no se produce transporte de agua porque la rama gruesa ascendente del asa de Henle tiene una permeabilidad osmótica al agua muy baja.
La técnica de microperfusión de túbulos renales aislados también ha contribuido enormemente a mejorar nuestros conocimientos sobre la acción de la vasopresina en la regulación del transporte de agua, iones y solutos en los túbulos renales. Esta hormona ejerce su efecto en distintos segmentos de la nefrona. La excreción renal de agua está regulada por la vasopresina, en parte, debido a la acción que tiene sobre la regulación de la permeabilidad osmótica al agua del epitelio de los túbulos colectores. Por otro lado, la vasopresina favorece la conservación renal de agua por su efecto a nivel de vasopresina ascendente del asa de Henle, ya que estimula la reabsorción activa de CINa que favorece el mecanismo de multiplicación a contracorriente. Esta hormona aumenta la permeabilidad a la urea en los túbulos colectores de la médula interna proceso que contribuye a la generación del gradiente osmótico corticomedular7. Se ha demostrado también, que la vasopresina estimula el transporte activo de sodio y potasio en los túbulos colectores de la corteza renal y en la parte final del túbulo distal8,9. Todas estas acciones son vitales para la regulación de la excreción renal de agua por la vasopresina.
El CLONAJE MOLECULAR: NUEVA ESTRATEGIA PARA EL ESTUDIO DEL MECANISMO DE CONCENTRACIÓN URINARIO
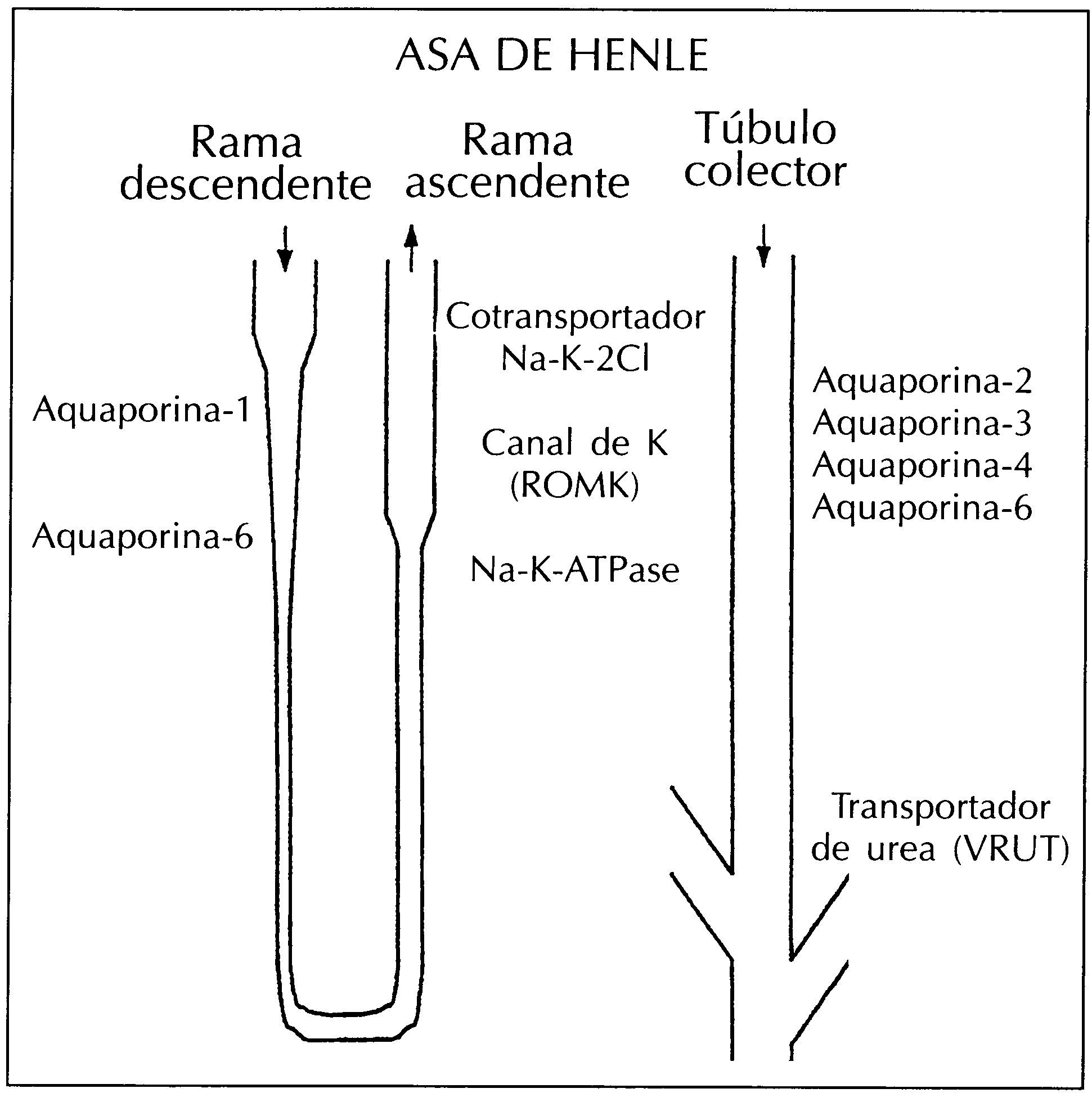
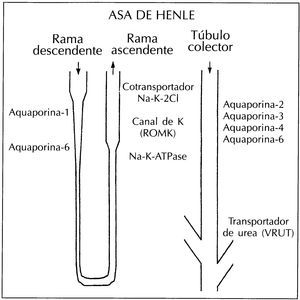
El gran desarrollo de la biología molecular en los últimos años ha permitido realizar numerosos progresos en el campo de la fisiología renal gracias al clonaje del DNA complementario de la mayoría de los transportadores y canales de agua y solutos que se localizan a lo largo del túbulo renal. El proyecto del clonaje del genoma humano completará esta labor permitiéndonos un abordaje más comprensivo de la estructura primaria de las proteínas. Teniendo en cuenta que la mayoría de las funciones celulares están mediadas por proteínas y que los procesos reguladores más importantes del organismo están mediados también por proteínas, el diseño de nuevas estrategias que permitan estudiar la expresión proteica es, por tanto, fundamental. Las proteínas más importantes que intervienen en el mecanismo de concentración urinaria están indicadas en la figura 2. A partir de la secuencia de aminoácidos se pueden diseñar péptidos inmunógenos para el desarrollo de anticuerpos policlonales específicos para el estudio de estas moléculas. Diversos trabajos utilizando anticuerpos específicos contra las aquaporinas han sido fundamentales para el estudio de las bases moleculares de numerosos procesos entre ellos el proceso de concentración urinarias10-17
AQUAPORINAS: CANALES DE MEMBRANA PARA EL AGUA
Las aquaporinas son una familia de proteínas intrínsecas de membrana que funcionan como canales selectivos de agua y median el transporte de agua a través de la membrana plasmática de las células18. La primera aquaporina identificada, CHIP 28 («Channel-forming integral membrane protein of 28 kDa»), posteriormente denominada aquaporina-CHIP o simplemente aquaporina-1, fue purificada por Agre y cols.19 en eritrocitos humanos en la década de los 80. Hasta el momento actual se han identificado 11 canales proteicos de agua en los tejidos de mamíferos, que se han denominado consecutivamente aquaporina-0 a aquaporina-10.
Estructura molecular de las aquaporinas
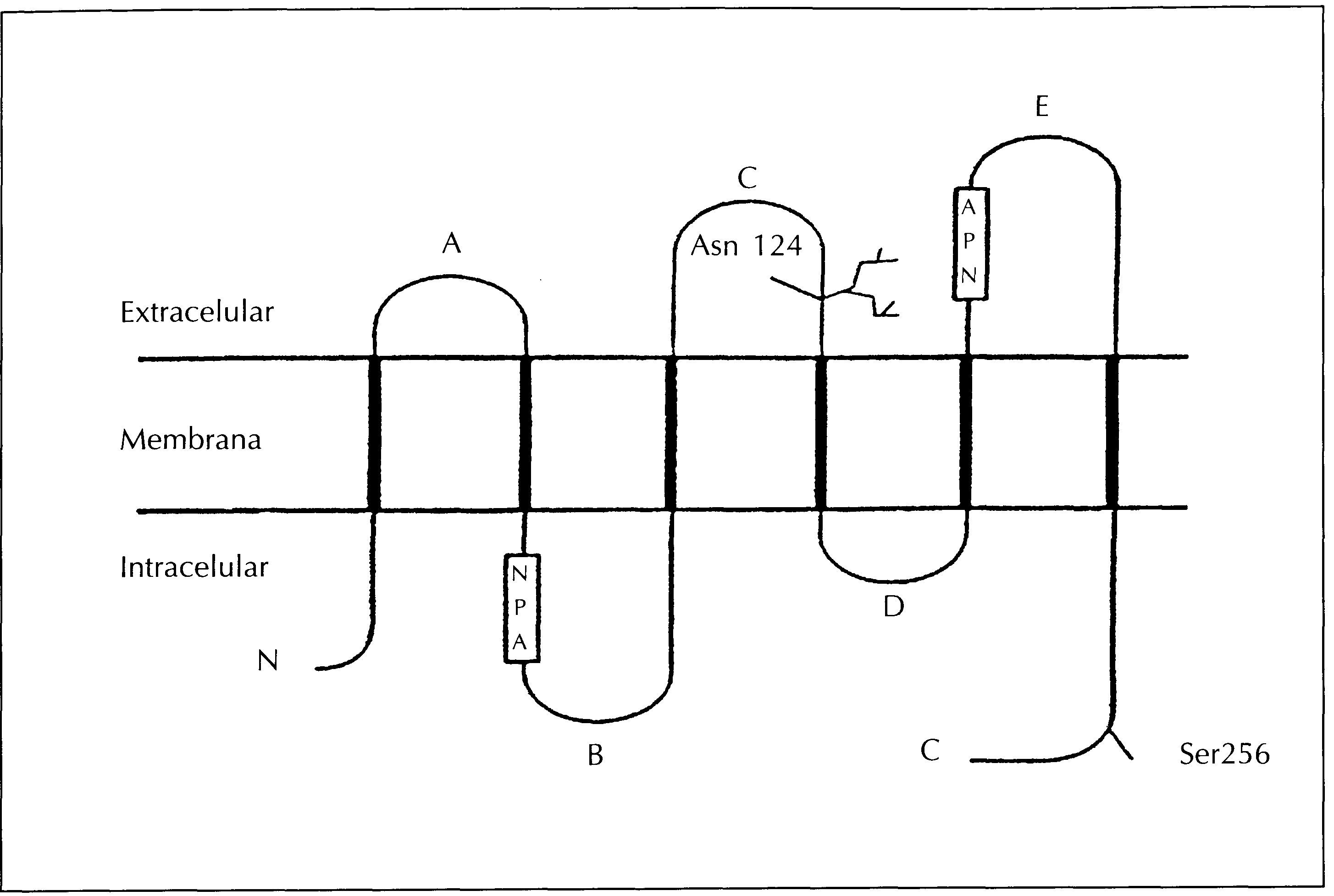
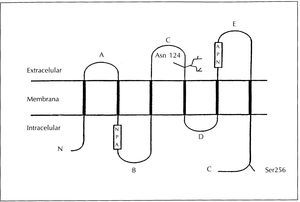
La estructura general de las aquaporinas fue descubierta por Agre y cols.19 en la aquaporina-l. Se trata de una cadena polipeptídica sencilla con un peso molecular aproximado de 28 kDa. La cadena atraviesa la membrana seis veces, formando cinco asas y quedando los extremos N y C en el interior de la célula. De las cinco asas, tres son extracelulares (denominadas A, C, y E) y dos son intracelulares (B y D) (figura 3). Las asas B y E contienen la secuencia Asp-Pro-Ala (NPA), que es característica de las proteínas intrínsecas de membrana (MIP, «major intrinsic protein»), de las cuales las aquaporinas son miembros. La parte más variable de la molécula es el extremo carboxilo. Así, se ha utilizado esta parte de la molécula para desarrollar anticuerpos policlonales específicos contra las distintas aquaporinas renales10. Recientemente, se ha determinado la estructura tridimensional de la aquaporina-1 y se ha observado que se agrupa en homotetrámeros en la membrana plasmática y que cada subunidad monomérica forma un canal de agua20. La gran homología en la estructura primaria de las aquaporinas hizo pensar que todas tendrían una estructura tridimensional similar, sin embargo, se ha observado que esto no se cumple en todas las aquaporinas. Así, recientemente se ha observado que la aquaporina-4 presenta una estructura ortogonal21.
Patrón de expresión de las aquaporinas en el riñón
La aquaporina-1 abunda en la membrana apical y basolateral de los túbulos proximales renales y en la rama descendente del asa de Henle10. La distribución renal de la aquaporinas-1 podría explicar el papel de los segmentos renales proximales en la conservación del agua, donde se reabsorbe cerca del 80% del componente acuoso del filtrado glomerular. La aquaporina-2 o aquaporina-CD (aquaporin-collecting duct) es la aquaporina de los túbulos colectores. Actualmente se sabe, que esta es la aquaporina que esta regulada por la vasopresina. La principal característica del transporte de agua en el túbulo colector es el rápido e intenso cambio de permeabilidad inducido por la vasopresina, que es capaz de aumentar 10 veces la permeabilidad al agua de los túbulos colectores en menos de 30 segundos1. La aquaporina-3 se expresa en la membrana basolateral de las células principales de los túbulos colectores22. A diferencia de los otros miembros de esta familia, la aquaporina-3 posee permeabilidad tanto al agua como a la urea. La aquaporina-4 también se localiza en la membrana baso-lateral de las células principales de los túbulos colectores de la médula interna23. Recientemente se ha clonado la aquaporina-6 y la aquaporina-724,25. La aquaporina-6, a diferencia de las otras aquaporinas, se localiza exclusivamente en vesícula-intracelulares de los podocitos glomerulares, de las células del túbulo proximal y de las células intercaladas del túbulo colector. Esta distribución intracelular en diversos tipos de células del epitelio renal plantea su posible papel en otros procesos celulares diferentes del transporte transcelular de fluidos como por ejemplo en la regulación del equilibrio ácido-base24. La aquaporina-7 se expresa en la membrana apical de las células del túbulo proximal y su papel fisiológico esta aún por determinar25.
BASES MOLECULARES DEL MECANISMO DE CONCENTRACIÓN URINARIO
Regulación de la permeabilidad al agua de los túbulos colectores por la vasopresina. Papel de la aquaporina-2
La tonicidad del fluido corporal se regula en gran medida a través de la regulación de la excreción renal de agua. La conservación renal de agua se produce como resultado de la función combinada del asa de Henle y del túbulo colector, ambos segmentos están regulados por la vasopresina. El asa de Henle genera un intersticio medular hipertónico mediante el mecanismo de multiplicación a contracorriente. El túbulo colector permite, en presencia de vasopresina, que se produzca un equilibrio osmótico entre la orina y el intersticio medular hipertónico gracias a un aumento en la permeabilidad al agua de este segmento1.
En el túbulo colector hay dos tipos celulares, las células principales responsables de la reabsorción de agua a favor del gradiente osmótico del intersticio renal, y las células intercaladas ligadas al transporte ácido-base. La aquaporina-2 se localiza en la membrana apical y en ciertas vesículas intracelulares, que sirven como reservorio de la aquaporina-2, de las células principales de los túbulos colectores. Actualmente existen numerosas evidencias que demuestran que la aquaporina-2 es el canal de agua regulado por la vasopresinana1-11. Se ha demostrado, que el contenido celular de aquaporina-2 aumenta en respuesta a la restricción hídrica en ratas normales o en respuesta a la infusión de vasopresina en las ratas Brattleboro (que carecen de vasopresina endógena circulante)12. Asimismo, se ha demostrado un aumento en el RNA mensajero (RNAm) de la aquaporina-2 contenida en la médula renal tras la restricción hídrica, mientras que no se observa aumento en el contenido de otros canales de agua26. Estos hechos apoyan la idea de que la aquaporina 2 es una proteína regulada y que su respuesta representa un cambio adaptativo de los túbulos colectores para conseguir una mayor eficacia en la conservación renal del agua1. La vasopresina regula la permeabilidad al agua del túbulo colector por dos mecanismos asociados a la regulación de la aquaporina-2, un mecanismo de regulación a corto plazo y otro mecanismo de regulación a largo plazo.
Regulación a corto plazo de la permeabilidad al agua del túbulo colector
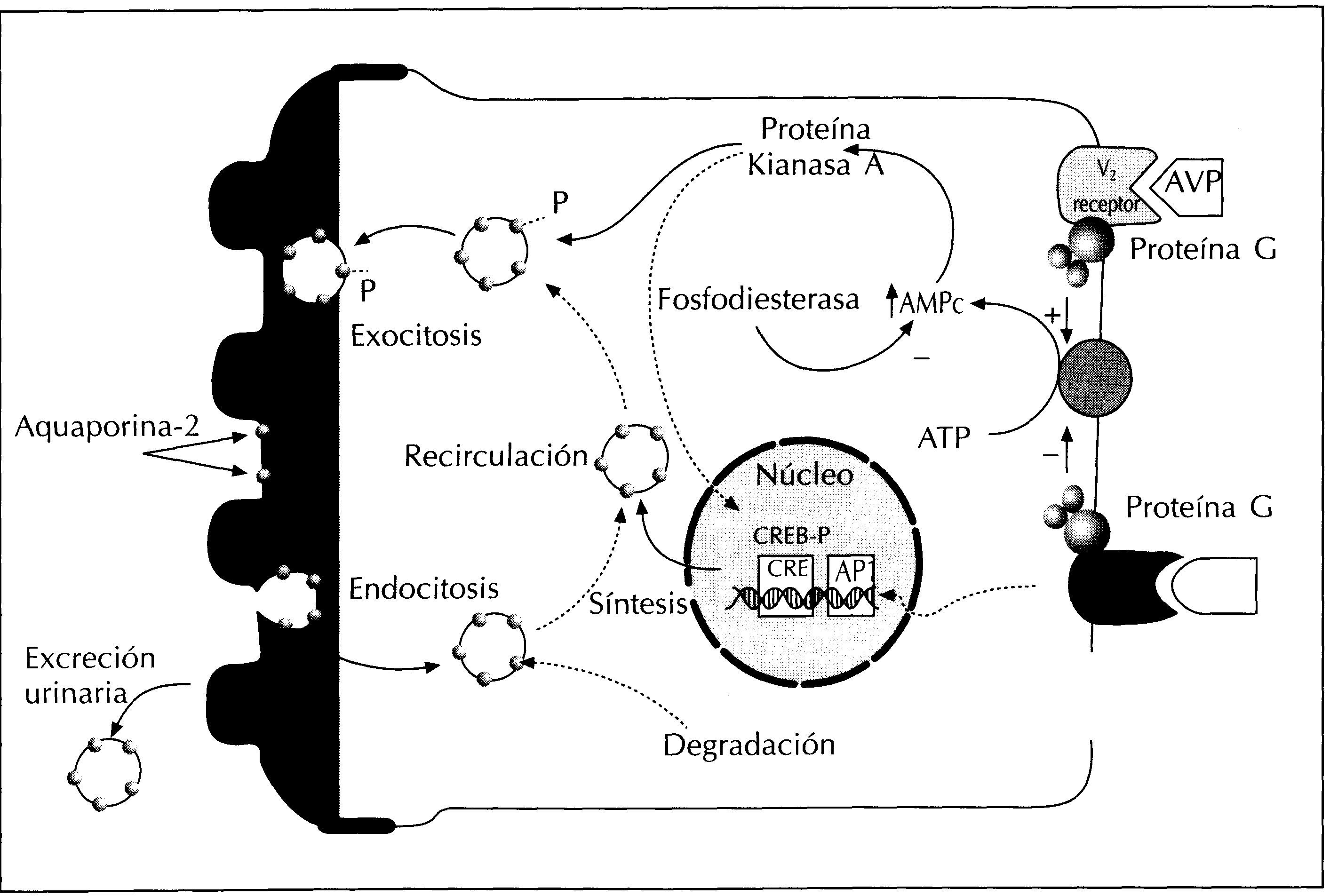
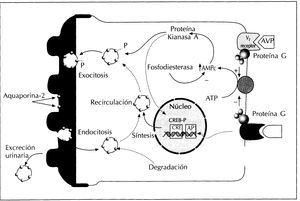
Ocurre como respuesta a la vasopresina que produce un incremento de la permeabilidad al agua de los túbulos colectores en segundos o minutos. Esta respuesta es el resultado de la redistribución de la aquaporina-2 dentro de la célula. Las vesículas intracelulares que contienen aquaporina-2 se fusionan con la membrana plasmática apical conduciendo a un aumento en el número de canales de agua en la membrana apical. La disminución en los niveles de vasopresina induce una disminución del número de canales de agua en la membrana plasmática apical asociado a la reaparición de la aquaporina-2 en las vesículas citoplasmáticas. Este cambio en la distribución celular de la aquaporina-2 es paralelo a cambios en la permeabilidad al agua del epitelio tubular". El mecanismo molecular de este proceso se pone en marcha mediante la unión de la vasopresina al receptor V2 presente en la membrana basolateral de las células principales del túbulo colector (figura 4).
Este receptor es un receptor proteico unido a la proteína G «GTP-binding protein». La unión de la vasopresina con el receptor V2 activa la adenilciclasa que acelera la producción de adenosin monofosfato cíclico (AMPc) a partir de adenosin trifosfato27. Posteriormente el AMPc se une a la subunidad reguladora de la proteína kinasa A (PKA) produciendo un disociación de la subunidad reguladora de la catalítica. La subunidad catalítica de la PKA se activa al disociarse y fosforila diversas proteínas, entre ellas la aquaporina-2. La fosforilación de la aquaporina-2 produce una traslocación de las vesículas intracitoplasmáticas, que contienen la aquaporina-2 fósforilada, a la membrana plasmática apical. El resultado final es un aumento de la permeabilidad al agua de los túbulos colectores11. Se ha demostrado que la fosforilación de la serina 256 de la aquaporina-2 es crítica para que se produzca la traslocación de esta proteína28.
Regulación a largo plazo de la permeabilidad al agua del túbulo colector
Es un aumento mantenido de la permeabilidad al agua de los túbulos colectores como respuesta a niveles prolongadamente altos (24 horas o más) de vasopresina circulante. A diferencia de la regulación a corto plazo este proceso no se revierte rápidamente, ya que no se asocia a cambios en la distribución celular de la aquaporina-2 sino a un aumento en el número total de canales de agua debido probablemente a un aumento en la síntesis de la proteína12. Esta respuesta está mediada por la regulación de la transcripción del gen de la aquaporina-2 a través de un mecanismo dependiente de AMPc. El extremo 5' del gen de la aquaporina-2 presenta una secuencia de respuesta al AMPc denominada cAMP responsive element (CRE). Parece que la unión de una proteína previamente fosforilada a esta zona del gen (CRE-binding protein), favorece la transcripción del mismo y conduce a un aumento en su ARNm y finalmente de la proteína (figura 4)27. Recientemente, se ha observado en ratones transgénicos (DI +/+) que presentan genéticamente niveles elevados de actividad AMPe fósfódiesterasa y, por tanto, niveles celulares bajos de AMPc, una poliuria severa y una marcada disminución en la expresión renal de aquaporina-213
DIABETES INSÍPIDA NEFROGÉNICA
Esta entidad se caracteriza por un defecto en la capacidad renal de concentrar la orina y se manifiesta con la presencia de una poliúria masiva y una osmolaridad urinaria baja que se acompaña, sin embargo, de niveles altos de vasopresina circulante. En esta entidad el riñón no es capaz de responder a la acción antidiurética de la vasopresina debido a un trastorno intrarenal en el mecanismo de concentración urinaria. Se distinguen dos formas: congénita y adquirida. La forma más común es la adquirida que por lo general no presenta una clínica tan severa como la forma congénita. La diabetes insípida nefrogénica adquirida se observa asociada a diversas patologías, la más frecuente es la secundaria a la administración prolongada de litio. Se ha observado que la regulación a largo plazo de la aquaporina-2 está alterada en diversos modelos experimentales de diabetes insípida netrogénica adquirida secundaria por ejemplo al tratamiento prolongado con litio14, a hipokalemia15, a hipercalcemia16, o a obstrucción ureteral17. Así, en estos modelos animales de diabetes insípida nefrogénica se ha observado una disminución en la expresión de la aquaporina-2 en el riñón que se cree contribuye al trastorno en el proceso de concentración urinaria. Se ha demostrado que el litio inhibe la adenilciclasa ciclasa en diferentes tipos celulares incluidas las células del epitelio renal. Sin embargo, es importante destacar que la disminución renal de aquaporina-2 no es necesariamente el único factor determinante en el trastorno del mecanismo de concentración urinaria. Ya se ha comentado que este mecanismo depende no sólo de la regulación de la permeabilidad al agua del túbulo colector por la aquaporina-2 sino también de la acumulación de soluto en la médula renal.
La diabetes insípida nefrogénica congénita es una entidad más rara que las anteriores. Presenta una clínica más severa que la forma adquirida y se caracterizada por la presencia de hipernatremia, hipertermia, retraso mental e insuficiencia renal. La importancia de un diagnóstico precoz es fundamental porque se pueden prevenir las complicaciones con la administración temprana de agua. En la mayoría de las familias esta enfermedad presenta un patrón de herencia recesiva ligada al sexo causada por una mutación en el gen del receptor V2 de la vasopresina29. Se han descrito pacientes con un patrón de herencia diferente, en estos individuos se ha demostrado una mutación en el gen de la aquaporina-230. Aunque, hasta el momento no se han observado diferencias clínicas entre estos dos grupos de pacientes, desde el punto de vista bioquímico se pueden distinguir mediante la administración de dDAVP (agonista selectivo del receptor V2 de la vasopresina). Los pacientes con mutaciones en el gen de la aquaporina-2 presentan vasodilatación y liberación de factores de la coagulación y fibrinolíticos. Sin embargo, esta respuesta está ausente en los pacientes con diabetes insípida nefrogénica secundaria a una mutación en el gen del receptor V2 de la vasopresina30
Hasta el momento se han descrito diversas mutaciones en el gen de la aquaporina-2 en individuos con una diabetes insípida nefrogénica con un patrón de herencia autosómico recesivo. Parece ser que la mayoría de estas mutaciones se asocian con un defecto en la salida de la proteína del retículo endoplasmático por lo que la aquaporina no puede llegar a la membrana plasmática apical30,31 En una forma dominante de diabetes insípida nefrogénica se ha descrito una mutación en el residuo 258 de la aquaporina-2 (glu258 → Lys). En este caso se ha observado que la aquaporina-2 mutada se queda almacenada en el aparato de Golgi32. Se ha especulado que en los individuos heterozigotos los homotetrámeros de aquaporina-2 estarían formados por proteína mutada y no mutada, pero que los tetrámeros se quedarían almacenados en el aparato de Golgi. Esto explicaría el patrón de herencia dominante en está familia con diabetes insípida nefrogénica. Se ha observado que las mutaciones de la aquaporina-2 con un patrón de herencia recesivo se localizan entre el primer y último dominio transmembrana y que las mutaciones con un patrón de herencia dominante se localizan en el extremo carboxilo de la proteína.
RATONES DEFICIENTES EN LOS GENES QUE CODIFICAN PARA DIVERSAS AQUAPORINAS
En los últimos años el gran avance en las técnicas de manipulación genética ha permitido el desarrollo de ratones deficientes en genes que codifican para los canales de agua. Esto ha permitido profundizar en el papel fisiológico de las aquaporinas. El estudio de los ratones modificados genéticamente que son deficientes en el gen de la aquaporina-1 (aquaporin1-knockout mice), y por tanto en la proteína aquaporina-1, ha puesto de manifiesto el importante papel de este canal de agua en el mantenimiento del balance hídrico33. Así, se ha demostrado que los ratones deficientes en aquaporina-1 presentan un severo deterioro en la capacidad de concentrar la orina. Curiosamente, este trastorno sólo se detecta cuando se somete a los ratones a una prueba de deprivación de agua durante 36 h. En estas condiciones, los ratones que carecen de la proteína aquaporina-1 llegan a una situación de deshidratación severa, con una perdida importante del peso corporal, un aumento de la osmolaridad plasmática y una osmolaridad urinaria que no aumenta. Se ha demostrado, por técnicas de microperfusión tubular, que la permeabilidad transepitelial osmótica al agua del epitelio del túbulo proximal era cinco veces menor en los ratones deficientes en la aquaporina-1 que en los ratones contemporáneos no mutados. Además, estos ratones deficientes en la aquaporina-1 también presentan una disminución de la permeabilidad osmótica al agua en la rama descendente del asa de Henle. Se especula que la defección de la aquaporina-1 conduciría a un trastorno en el mecanismo de multiplicación a contracorriente y que no se generaría un intersticio medular hipertónico. En los ratones deficientes en aquaporina-1 a diferencia de la diabetes insípida nefrogénica, donde la osmolaridad urinaria es generalmente muy baja, la orina puede concentrarse algo debido a que los transportadores de iones y solutos son funcionales y que los túbulos colectores son permeables al agua. Esto podría explicar porqué no se han encontrado alteraciones clínicas significativas en un grupo de individuos deficientes en aquaporina-1 cuando han sido estudiados en condiciones de normohidratación34
Los ratones deficientes en el gen de la aquaporina-4 (aquaporin-4-knockout mice) aunque fenotípicamente son normales, también han mostrado alteraciones cuando se les somete a situaciones de estrés. Así se ha observado, al someterlos a una prueba de deprivación de agua durante 36 h que tenían una osmolaridad urinaria máxima significativamente mas baja que sus contemporáneos no mutados35. La aquaporina-4 es el canal de agua que, junto a la aquaporina-3, se localiza en la membrana basolateral de las células principales de los túbulos colectores. La aquaporina-4 predomina en la zona medular y la aquaporina-3 en la corteza. Esto podría explicar porqué se ha observado que la permeabilidad transepitelial osmótica al agua del epitelio del túbulo colector de la médula interna, medida con técnicas de microperfusión, era menor en los ratones deficientes en la aquaporina-4 que en sus contemporáneos no mutados. Parece ser que en los ratones deficientes en aquaporina-4 la reabsorción de agua de los túbulos colectores es mucho mayor a nivel cortical que en los túbulos colectores de la médula. El desarrollo en un futuro de ratones deficientes en aquaporina-3 y ratones deficientes simultáneamente en aquaporina-3 y aquaporina-4 puede ayudar a ampliar los conocimientos sobre el papel fisiológico de los canales de agua basolaterales de los túbulos colectores en el proceso de concentración urinario. Es importante destacar que aunque, la información que se obtiene del estudio fenotípico de estos ratones es importante para estudiar el papel fisiológico de las proteínas hay que interpretarla con cautela. La pérdida de función de una proteína puede ser debido a una delección directa de la proteína o indirectamente a otros factores que afecten al desarrollo o la estructura del órgano. Por otro lado, no hay que olvidarlo, que la fisiología del ratón y la humana son diferentes y esto a la hora de extrapolar los resultados de los estudios animales.
En resumen, las aquaporinas son proteínas de membrana que favorecen el transporte osmótico de agua en diferentes epitelios. Las aquaporinas renales, tanto las localizadas a nivel proximal, aquaporina-1, como las que se localizan en los túbulos colectores, aquaporina-2, -3 y -4, juegan un papel central en el proceso concentración urinario como se ha podido deducir de los diferentes estudios comentados. Además de las aquaporinas, existen otros transportadores en el epitelio tubular renal como son: los transportadores de sodio o los transportadores de urea que favorecen el transporte de iones y solutos. Estos transportadores también son necesarios para la generación de un intersticio medular hipertónico y por tanto también intervienen en el proceso de concentración urinario.
Figura 1. Medidas de la osmolaridad del fluido tubular en diferentes lugares del túbulo renal en situaciones de niveles altos (↑) y bajos (↓) de vasopresina circulante.
Figura 2. Proteínas de membrana que intervienen en el mecanismo de concentración urinario.
Figura 3. Estructura general de las aquaporinas.
Figura 4. Representación esquemática de los principales eventos que resultan de la interacción de la vasopresina con el receptor V2 de la célula principal del túbulo colector.