La hiponatremia, definida como el descenso de concentración sérica de sodio por debajo de 135mmol/l, es el trastorno electrolítico más prevalente en el medio hospitalario, presentando una prevalencia del 15-30% al ingreso1, asociándose con un incremento de la estancia y mortalidad hospitalaria2.
El SIADH constituye la primera causa de hiponatremia en el paciente hospitalizado3. Fisiopatológicamente se produce por una incapacidad para suprimir la secreción de vasopresina, dando como resultado una reducción en el volumen urinario y en su concentración, conduciendo al descenso de la natremia sérica (SNa). La introducción de vaptanes, antagonistas de los receptores V2 de vasopresina, ha supuesto la principal novedad terapéutica en su manejo, disponiendo en Europa del tolvaptán4. Aunque la dosis más baja formalmente aceptada es de 15mg/día, el riesgo de sobrecorrección hace que en ocasiones se opte por una dosis inicial de 7,5mg/día.
Como ocurre con cualquier tratamiento de la hiponatremia, la principal preocupación es la sobrecorrección rápida de los niveles de natremia, que puede causar desmielinización osmótica, potencialmente mortal5. Para tratar de evitarlo, debe hacerse una monitorización estrecha e individualizada de SNa en las primeras horas de instauración del tratamiento, marcando como objetivos límite de incremento los 8-12mmol/l a las 24h y los 12-18mmol/l a las 48h6–8.
Valoramos la utilización de tolvaptán en un hospital terciario entre marzo de 2014 y agosto de 2017, con la finalidad de aportar conocimiento sobre el uso de tolvaptán. Durante este periodo 17 pacientes recibieron tratamiento con tolvaptán. Se utilizaron distintas dosificaciones de inicio (7,5mg; 15mg; 30mg). El tratamiento con dosis de 7,5mg lo iniciaron 9/17 pacientes. Las características por grupos se resumen en la tabla 1. El 100% de los pacientes presentaba hiponatremia crónica (>48h). El 17,6% tenía una natremia<120mmol/l al inicio del tratamiento.
Características generales de los pacientes, desglosadas por dosis inicial de tolvaptán
| 7,5mg | 15mg | 30mg | Total | |
|---|---|---|---|---|
| n | 9 | 7 | 1 | 17 |
| Diagnóstico, n (%)SIADH idiopáticoSIADH farmacológicoSIADH posquirúrgicoSIADH paraneoplásicoSIADH secundario a enfermedad neurológicaSIADH secundario a enfermedad respiratoriaHiponatremia dilucional (cirrosis) | 1 (11,1)3 (33,3)0 (0)3 (33,3)2 (22,2)1 (11,1)1 (11,1) | 0 (0)0 (0)3 (42,8)1 (14,3)2 (28,6)1 (14,3)0 (0) | 0 (0)0 (0)0 (0)1 (100)0 (0)0 (0)0 (0) | 1 (5,9)3 (17,7)3 (17,7)3 (17,7)4 (23,5)2 (11,8)1 (5,9) |
| Edad (años), mediana (RIC) | 73,0 (13,7) | 65,9 (14,9) | 59,0 | 70,9 (16,8) |
| Sexo %, varón/mujer | 66,7/33,3 | 57,1/42,9 | 100/0 | 64,7/35,3 |
| Causa de ingreso, n (%)Inicio de tolvaptánHiponatremiaOtra | 1 (11,1)6 (66,7)2 (22,2) | 0 (0)2 (28,6)5 (71,4) | 0 (0)1 (100)0 (0) | 1 (5,9)9 (52,9)7 (41,2) |
| SNa inicial (mmol/l), mediana (RIC) | 125 (6) | 125 (4) | 115 | 125 (6) |
RIC: rango intercuartílico; SIADH: síndrome de secreción inadecuada de hormona antidiurética; SNa: natremia.
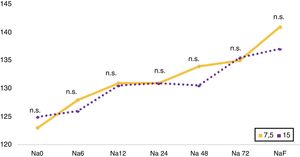
El seguimiento evolutivo de la SNa fue desigual, realizándose una determinación analítica a las 6h en el 23,5% (n=4), a las 12h en el 29,4% (n=5), a las 24h en el 76,5% (n=13), a las 48h en el 70,6% (n=12) y a las 72h en el 58,8% (n=10). Se realizó una comparativa (fig. 1) del evolutivo de SNa en función de la dosis de inicio de tolvaptán empleada (7,5 vs. 15mg), sin diferencias significativas en los distintos puntos de corte.
Comparación entre dosis de inicio de tolvaptán de 7,5 y 15mg. Gráfico de líneas del evolutivo de natremia Na 0, Na 6, Na 12, Na 24, Na 48, Na 72, NaF, que corresponden a la natremia inicial, a las 6, 12, 24, 48 y 72h, y a la última natremia disponible, respectivamente.
Na: natremia; n.s.: no significativo.
En la tabla 2 se desglosan los porcentajes de pacientes que alcanzaron eunatremia o presentaron sobrecorrección. Ningún paciente desarrolló desmielinización osmótica. No se encontraron diferencias en la tasa de sobrecorrección por dosis de inicio empleada, sexo, edad ni diagnóstico etiológico. Se observó una tendencia a mayor tasa de sobrecorrección (24h) en pacientes sin control de SNa a las 6h (0 vs. 30%; p=0,279) y en SNa de inicio<120mmol/l (30 vs. 66%; p=0,510), sin significación estadística.
Evolutivos de natremia durante el seguimiento tras el inicio de tolvaptán en el conjunto de pacientes
| 7,5mg | 15mg | Total | p | ||
|---|---|---|---|---|---|
| Eunatremia, % | 6h | 0 | 0 | 0 | - |
| 12h | 0 | 0 | 0 | - | |
| 24h | 25 | 25 | 33,33 | - | |
| 48h | 33,33 | 0 | 20 | 0,361 | |
| 72h | 50 | 66,67 | 57,14 | 0,513 | |
| Sobrecorrección, % | 6h | 0 | 0 | 0 | - |
| 12h | 0 | 0 | 0 | - | |
| 24h | 50 | 25 | 38,46 | 0,501 | |
| 48h | 0 | 0 | 0 | - |
Se considera sobrecorrección incrementos>5mmol/l a las 6h; >8mmol a las 12h; >10mmol/l a las 24h; >18mmol/l a las 48h.
En nuestra experiencia no parecen existir diferencias en el evolutivo de la natremia en las primeras 72h por dosis inicial de tolvaptán (7,5 vs. 15mg), cuestión que debe valorarse en nuevos estudios, dada la limitación inherente a la escasa muestra empleada. Encontramos una elevada tasa de sobrecorrección a las 24h (38,5%), superior al 5,6% publicado en los estudios SALT-1 y SALT-29 sobre seguridad del fármaco. La explicación podría venir por la inclusión del pacientes con SNa inicial<120mmol/l y la ausencia de seguimiento del evolutivo de SNa tras el inicio del tratamiento, impidiendo la aplicación de medidas correctoras. La variabilidad en el seguimiento de los pacientes y los riesgos asociados a un inadecuado inicio del manejo terapéutico con tolvaptán evidencian la necesidad de seguir los protocolos recomendados en los consensos de expertos a falta de estudios específicos sobre el tema.
AutoríaDavid E. Barajas-Galindo y Alfonso Vidal-Casariego concibieron y diseñaron el estudio. David E. Barajas-Galindo analizó los datos y escribió el documento. Todos los autores contribuyeron a la adquisición de datos, a la redacción del manuscrito y aprueban la versión definitiva del mismo.
Conflicto de interesesEl Dr. Barajas-Galindo y la Dra. Gómez-Hoyos informan de haber recibido honorarios de Otsuka Pharmaceutical Co. Ltd., fuera del trabajo presentado. El resto de los autores declara no tener ningún conflicto de intereses.