La membrana peritoneal (MP) se emplea como membrana dialítica de forma habitual, segura y eficiente en los pacientes con enfermedad renal crónica (ERC) estadio 5. No obstante, con el tiempo y exposición a determinadas sustancias se produce la transición epiteliomesenquimal (TEM) de sus tejidos que, en los casos más dramáticos y de manera infrecuente puede desencadenar, a largo plazo, la denominada peritonitis esclerosante encapsulante (EPS)1,2.
Presentamos el caso de una mujer de 34 años con una glomerulonefritis focal y segmentaria diagnosticada en el año 1991 a los 8 años de edad con inicio de hemodiálisis en 1992. Se trasplanta en dos ocasiones, perdiendo el segundo injerto en el año 2000, volviendo a hemodiálisis.
En agosto de 2001 se implanta catéter peritoneal Tenckhoff II y comienza terapia sustitutiva renal mediante diálisis peritoneal automatizada (DPA) con las soluciones de diálisis convencionales disponibles en ese momento (Dianeal®). Desde 2005, se modifica la pauta de diálisis según el esquema PEN (Physioneal®- Nutrineal®- Extraneal®) para proporcionarle soluciones biocompatibles. Durante su permanencia en DPA presenta dos complicaciones infecciosas fundamentales: una peritonitis por Haemophilus influenzae en 2006 que obligó a ingreso y una infección del orificio en 2009 por Micobacterium abscessus que obligó a la retirada del catéter y transferencia temporal a hemodiálisis entre mayo y septiembre de 2009.
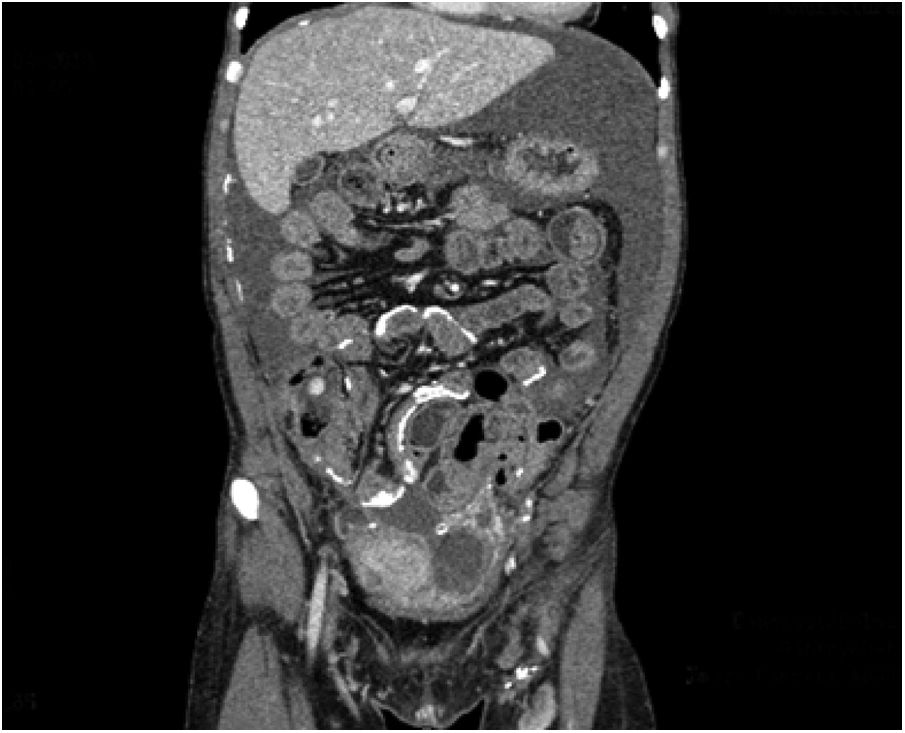
A partir del año 2017 la paciente presenta episodios de dolor abdominal compatibles con cuadros suboclusivos y un deterioro progresivo de la función peritoneal, desembocando en un fallo de ultrafiltración (tabla 1). Se realiza una tomografía axial computarizada (TAC) con presencia de calcificaciones peritoneales que orientó el diagnóstico de EPS (fig. 1).
En esta gráfica se presenta los estudios de función de la membrana peritoneal durante cuatro años. Conviene destacar que, a lo largo de los años, aumenta la superficie de intercambio de la membrana peritoneal y por tanto el coeficiente de transferencia de masa (CTM). Por su parte, al disminuir la conductancia osmótica de la glucosa, disminuye también la ultrafiltración a través de los poros pequeños y acuoporinas
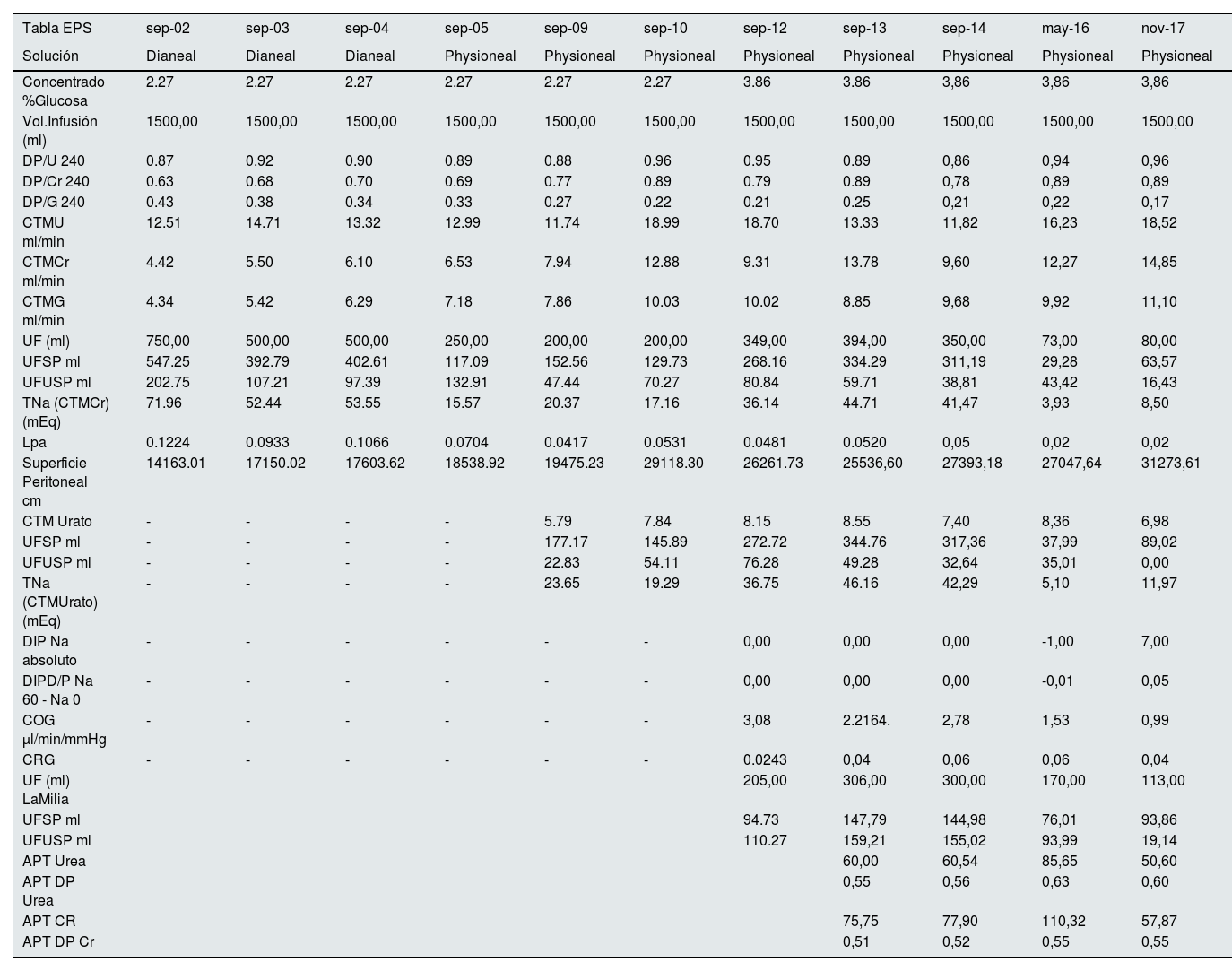
| Tabla EPS | sep-02 | sep-03 | sep-04 | sep-05 | sep-09 | sep-10 | sep-12 | sep-13 | sep-14 | may-16 | nov-17 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Solución | Dianeal | Dianeal | Dianeal | Physioneal | Physioneal | Physioneal | Physioneal | Physioneal | Physioneal | Physioneal | Physioneal |
| Concentrado %Glucosa | 2.27 | 2.27 | 2.27 | 2.27 | 2.27 | 2.27 | 3.86 | 3.86 | 3,86 | 3,86 | 3,86 |
| Vol.Infusión (ml) | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 | 1500,00 |
| DP/U 240 | 0.87 | 0.92 | 0.90 | 0.89 | 0.88 | 0.96 | 0.95 | 0.89 | 0,86 | 0,94 | 0,96 |
| DP/Cr 240 | 0.63 | 0.68 | 0.70 | 0.69 | 0.77 | 0.89 | 0.79 | 0.89 | 0,78 | 0,89 | 0,89 |
| DP/G 240 | 0.43 | 0.38 | 0.34 | 0.33 | 0.27 | 0.22 | 0.21 | 0.25 | 0,21 | 0,22 | 0,17 |
| CTMU ml/min | 12.51 | 14.71 | 13.32 | 12.99 | 11.74 | 18.99 | 18.70 | 13.33 | 11,82 | 16,23 | 18,52 |
| CTMCr ml/min | 4.42 | 5.50 | 6.10 | 6.53 | 7.94 | 12.88 | 9.31 | 13.78 | 9,60 | 12,27 | 14,85 |
| CTMG ml/min | 4.34 | 5.42 | 6.29 | 7.18 | 7.86 | 10.03 | 10.02 | 8.85 | 9,68 | 9,92 | 11,10 |
| UF (ml) | 750,00 | 500,00 | 500,00 | 250,00 | 200,00 | 200,00 | 349,00 | 394,00 | 350,00 | 73,00 | 80,00 |
| UFSP ml | 547.25 | 392.79 | 402.61 | 117.09 | 152.56 | 129.73 | 268.16 | 334.29 | 311,19 | 29,28 | 63,57 |
| UFUSP ml | 202.75 | 107.21 | 97.39 | 132.91 | 47.44 | 70.27 | 80.84 | 59.71 | 38,81 | 43,42 | 16,43 |
| TNa (CTMCr) (mEq) | 71.96 | 52.44 | 53.55 | 15.57 | 20.37 | 17.16 | 36.14 | 44.71 | 41,47 | 3,93 | 8,50 |
| Lpa | 0.1224 | 0.0933 | 0.1066 | 0.0704 | 0.0417 | 0.0531 | 0.0481 | 0.0520 | 0,05 | 0,02 | 0,02 |
| Superficie Peritoneal cm | 14163.01 | 17150.02 | 17603.62 | 18538.92 | 19475.23 | 29118.30 | 26261.73 | 25536,60 | 27393,18 | 27047,64 | 31273,61 |
| CTM Urato | - | - | - | - | 5.79 | 7.84 | 8.15 | 8.55 | 7,40 | 8,36 | 6,98 |
| UFSP ml | - | - | - | - | 177.17 | 145.89 | 272.72 | 344.76 | 317,36 | 37,99 | 89,02 |
| UFUSP ml | - | - | - | - | 22.83 | 54.11 | 76.28 | 49.28 | 32,64 | 35,01 | 0,00 |
| TNa (CTMUrato) (mEq) | - | - | - | - | 23.65 | 19.29 | 36.75 | 46.16 | 42,29 | 5,10 | 11,97 |
| DIP Na absoluto | - | - | - | - | - | - | 0,00 | 0,00 | 0,00 | -1,00 | 7,00 |
| DIPD/P Na 60 - Na 0 | - | - | - | - | - | - | 0,00 | 0,00 | 0,00 | -0,01 | 0,05 |
| COG μl/min/mmHg | - | - | - | - | - | - | 3,08 | 2.2164. | 2,78 | 1,53 | 0,99 |
| CRG | - | - | - | - | - | - | 0.0243 | 0,04 | 0,06 | 0,06 | 0,04 |
| UF (ml) LaMilia | 205,00 | 306,00 | 300,00 | 170,00 | 113,00 | ||||||
| UFSP ml | 94.73 | 147,79 | 144,98 | 76,01 | 93,86 | ||||||
| UFUSP ml | 110.27 | 159,21 | 155,02 | 93,99 | 19,14 | ||||||
| APT Urea | 60,00 | 60,54 | 85,65 | 50,60 | |||||||
| APT DP Urea | 0,55 | 0,56 | 0,63 | 0,60 | |||||||
| APT CR | 75,75 | 77,90 | 110,32 | 57,87 | |||||||
| APT DP Cr | 0,51 | 0,52 | 0,55 | 0,55 |
La EPS es una complicación infrecuente (incidencia de 0,7-13,6 por 1000 pacientes/año) pero grave de la DP. Se presenta más frecuentemente en pacientes jóvenes y se asocia a un alto porcentaje de mortalidad y necesidad de transferencia a hemodiálisis. La teoría de Augustine (X) plantea que son necesarios dos factores («hits») para su desarrollo3–5. El primer «hit» es la inflamación de la MP la cual está favorecida por las infecciones peritoneales, los líquidos de diálisis ricos en glucosa o bajos en pH, sus productos de degradación o el lactato4–6. Se elevan moléculas pro-inflamatorias tales como TGF-beta, IL-1, FGF o TNF-alfa, dando lugar al fenómeno conocido como TEM. De forma paralela se incrementa el VEGF, disminuye el tPA favoreciendo la neoangiogénesis, el aumento de la matriz extracelular y la migración de células mesoteliales. El segundo «hit» se desencadena por el cese agudo de la terapia de DP, trasplante renal, peritonitis frecuentes o predisposición genética4–7 Otros autores plantean que la EPS se desarrolla como un continuum progresivo y reversible desde la TEM, pasando por la esclerosis peritoneal hasta el estadio final que sería la EPS (X).
Paralelamente a los cambios morfológicos, podemos observar cambios funcionales de la MP. En primer lugar, debido a la neoangiogénesis se produce un aumento del transporte de solutos. Posteriormente, tras el comienzo de la fibrosis, tiene lugar la disociación del transporte de solutos y la conductancia osmótica de la glucosa (COG). Por último, tiene lugar el fallo de la ultrafiltración (UF)6. De forma característica la EPS ocasiona un fallo de UF con disminución de superficie peritoneal efectiva y permeabilidad7.
Para el estudio de la MP habitualmente extraemos dos muestras de sangre y 6 muestras de líquido peritoneal a los 0, 30, 60, 120, 180 y 240 minutos. En los últimos años extraemos una tercera muestra de sangre e incluimos una bolsa de Physioneal® 1.36% con drenaje completo a los 60 minutos para estudio según metodología de La Milia.
El objetivo del caso es exponer la utilidad de los estudios de función peritoneal para anticipar casos como el de nuestra paciente. Como se observa en la tabla 1 los estudios de MP en nuestra unidad hasta 2005 se hacían con solución Dianeal® y bolsas de 2.27%, llamando la atención respecto a los estudios realizados con Physioneal® una mayor UF. Además, a partir de 2012 los estudios se empiezan a realizar con bolsas de 3.86%. Llama especialmente la atención los cambios producidos tras la transferencia temporal en hemodiálisis en 2009, comparando los estudios de 2009 y 2010. Lo primero que destacamos es el aumento de la superficie peritoneal y aumento del CTM de urea, creatinina y glucosa tras el “descanso peritoneal”. También es reseñable la marcada disminución de la UF a través de los poros grandes, pequeños y ultraporos entre los estudios de 2014 y 2016, así como de la COG, desembocando en el fallo de ultrafiltración y anticipando la EPS que se pone de manifiesto clínicamente a partir de 2017.
En el caso de nuestra paciente se optó por iniciar tratamiento con tamoxifeno pero se tuvo que retirar al cabo de un año por alteraciones hepáticas y transferencia a hemodiálisis definitiva tras haber permanecido en DPA durante 16 años y 8 meses.
El diagnóstico de la EPS continúa siendo un reto. Las modificaciones en los parámetros de funcionalidad de la MP pueden ser evidentes antes de que se establezca el diagnóstico por lo que el estudio sistemático y periódico de la funcionalidad de la membrana peritoneal permite la detección y abordaje precoz de esta enfermedad.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.