Las estrategias ordenadas de tratamiento sustitutivo renal tienen especial sentido en pacientes con acceso potencial al trasplante renal. El proceso de elección informada precisa de renovación periódica cada vez que se plantea un cambio en la modalidad de tratamiento. La presente revisión proporciona algunas claves que ayudan a orientar estas decisiones en pacientes que van a iniciar diálisis, tanto antes del trasplante como una vez que éste ha cesado en su función.
La DP ofrece ventajas teóricas como técnica de inicio en estos pacientes, incluyendo la mejor preservación de la FRR, resultados óptimos en los primeros años de TSR, ausencia de impedimentos para una transferencia programada ulterior a HD y no necesidad de creación de accesos vasculares. En la práctica, los pacientes tratados con DP se trasplantan más precozmente, presentan mejores patrones de función precoz y una supervivencia superior de pacientes e injerto, mientras que los procedentes de HD muestran tasas más bajas de trombosis vascular primaria tras el trasplante.
Existen notables lagunas en el conocimiento necesario para una buena planificación del el reingreso en diálisis de pacientes con un injerto renal malfuncionante. La información sobre resultados comparados de HD y DP es poco orientativa, aunque no parece que haya grandes diferencias entre ellas. La elección de modalidad está influída por factores como el reinicio oportuno de diálisis, el estado general del paciente y el comportamiento de la FRR del injerto. En general, el reinicio tardío, el declive rápido del filtrado glomerular, la presencia de factores de riesgo que hagan indeseable mantener algún grado de inmunosupresión o la previsión de inadecuación en DP en ausencia de FRR favorecen la indicación de HD mientras que, en pacientes en buen estado general que reinician diálisis de forma oportuna, la opción de DP puede ser igual de válida que en el inicio primario en diálisis.
Introducción
Cada año, decenas de miles de pacientes se enfrentan a la fase terminal de una insuficiencia renal crónica en todo el mundo. Exceptuando a una pequeña minoría de afortunados (poco más del 1% de los incidentes en nuestro país) que reciben directamente un trasplante renal de donante vivo o cadáver, el destino de estos pacientes es la inclusión en programas de diálisis. El trasplante renal sigue siendo la salida preferible en esta fase, aunque apenas una quinta parte de los que inician diálisis tiene posibilidades de acceso al trasplante, por razones médicas o de otros tipos1. Incluso los que son elegibles han de soportar esperas, a menudo prolongadas, para recibir su injerto, debiendo mientras tanto someterse a tratamiento dialítico. Por otra parte, más de un tercio de los pacientes que consiguen transplantarse pierde la función de su injerto y ha de reingresar en diálisis, a lo largo de los primeros diez años tras el trasplante2. En conjunto, la accesibilidad al trasplante acota una población numerosa de pacientes renales que han de recorrer un largo itinerario terapéutico, marcado por algunas características comunes: expectativa de supervivencia prolongada, previsible utilización de diferentes modalidades de tratamiento sustitutivo renal (TSR) e incertidumbre sobre la sucesión, duración y resultados de las distintas fases. Este contexto exige, más aún que otros, una planificación cuidadosa, que combine la visión inmediata, enfocada a la calidad de vida y circunstancias clínicas del paciente, con una estrategia a largo plazo, que asegure una evolución ordenada y racional de las diferentes terapias, obteniendo lo mejor y evitando lo peor de cada una en cada fase evolutiva, e intentando mantener siempre abierto el mayor número posible de opciones.
Cualquier cambio de modalidad de TSR debe ir precedido de un proceso de elección informada por parte del paciente. No importa que éste ya hubiera dado este paso en un pasado más o menos distante, porque tanto sus circunstancias clínicas y personales como su mismo punto de vista pueden haber variado. Pocos nefrólogos en nuestro país se mostrarían en desacuerdo con este planteamiento, aunque su aplicación práctica diste de ser perfecta. Partiendo, pues, de la premisa irrebatible (y mandato legal) de que es el paciente quién debe decidir tras ser informado, en el presente artículo presentaremos argumentos teóricos y de experiencia clínica que faciliten al paciente candidato a trasplante renal la elección de la modalidad más adecuada en cada momento de su evolución.
El paciente que inicia diálisis a la espera de un trasplante renal
Consideraciones teóricas
El paciente incidente en diálisis a la espera de un trasplante presenta, por razones obvias, una edad y un grado de comorbilidad inferiores a las de la población general incidente en diálisis. Estas características auguran una buena adaptación a cualquier modalidad de diálisis, aunque no evitan una morbilidad y mortalidad todavía significativas3. Sin embargo, HD y DP presentan ciertas diferencias generales, que tanto el nefrólogo como el paciente deben conocer.
Aunque hablamos de modalidades terapéuticas de ámbito universal, el acceso a una u otra no es igualmente fácil y directo en diferentes áreas geográficas. En general, la distribución de recursos facilta un mayor uso global de la HD en centro, mientras que la DP tiene una penetración parcheada, con grandes variaciones entre países y dentro de cada país. Con algunas excepciones, la HD domiciliaria ocupa un lugar marginal como oferta terapéutica de TSR. Las notables diferencias en la oferta sanitaria real juegan, sin duda, un papel principal en la distribución actual de las diferentes técnicas de diálisis en nuestro país. Esta situación se mantiene, con pequeñas variaciones, si el análisis se limita a las subpoblaciones en lista de espera de trasplante renal4 pero, notablemente, parece variar sustancialmente si consideramos sólo a los pacientes que reciben de manera efectiva un trasplante. Disponemos de datos de varios registros nacionales que muestran que los pacientes tratados con DP tienen alrededor de un 40% más de posibilidades de trasplantarse que sus homólogos en HD4,5. Las causas de esta diferencia no están claras, aunque hay al menos dos factores con influencia probable. En primer lugar algunas subpoblaciones (niños, adolescentes) están sobrerrepresentadas, tanto en programas de DP como en las listas de receptores reales de trasplante. Por otra parte, en ciertas áreas confluyen una mayor actividad de trasplante y una superior penetración de las técnicas domiciliarias de diálisis. Este ¿efecto centro¿ ha sido objetivado con claridad por el registro francés4. Los fenómenos de concurrencia demográfica no pueden ser vistos como una simple coincidencia, ya que reflejan el efecto favorable que tanto la diálisis domiciliaria como el trasplante tienen sobre la independencia y calidad de vida de los pacientes renales.
Los pacientes candidatos a un trasplante renal inician a menudo el TSR de manera programada y con una función renal residual (FRR) significativa. El mantenimiento de ésta última es un importante objetivo terapéutico en diálisis, ya que facilita el tratamiento y mejora la supervivencia de los pacientes tratados con DP 6 o HD 7. La DP se adapta mejor que la HD a las estrategias de prescripción de diálisis que tienen en cuenta la FRR, al preservar ésta de manera más duradera 6. Así, los pacientes que empiezan con DP pueden ser tratados durante períodos relativamente prolongados (a menudo hasta el mismo trasplante) con un número bajo de intercambios (DP incremental), lo que mejora su calidad de vida y reduce el coste económico de la terapia. En general, se admite que DP y HD ofrecen resultados globales comparables. Esta equivalencia se observa también cuando la comparación se restringe a poblaciones subsidiarias de trasplante renal 8. Sin embargo, se sabe también que la relación de riesgo entre ambas técnicas es variable en el tiempo. Así, la DP ofrece claras ventajas sobre la HD en los primeros años de tratamiento, en términos de morbilidad y mortalidad 9-11. Aunque sus resultados comparados tienden a declinar con el tiempo, en paralelo al declive de la FRR, muchos pacientes recibirán su injerto renal en este período de rendimiento óptimo. Desde una perspectiva opuesta, la ya comentada dependencia de la FRR hace que la DP ofrezca resultados más pobres si se indica secundariamente a la HD 12,13, mientras que el uso previo de DP no representa un problema específico si una espera prolongada hace aconsejable la transferencia a HD 13,14. Por tanto, una estrategia ordenada a largo plazo hace recomendable la indicación inicial de DP. El acceso para diálisis representa un problema potencial en el paciente que va a recibir un trasplante renal. El inicio con HD implica la creación de un acceso vascular, cuyos efectos secundarios persisten, en la mayoría de los casos, tras el trasplante. Así, las fístulas arteriovenosas nativas generan una considerable sobrecarga hemodinámica, cuya consecuencia más visible es la hipertrofia ventricular izquierda, un reconocido factor de riesgo cardiovascular 15. Las fístulas internas protésicas añaden a los efectos hemodinámicos su carácter de focos infecciosos y/o inflamatorios potenciales, sean o no funcionantes 16. Por último, el uso de catéteres externos permanentes para HD, muy prevalente en algunos países, conlleva un riesgo evidente de infecciones graves y lesiones permanentes en venas centrales. Una vez más, la preservación de la vasculatura central y de miembros superiores tiene una especial importancia en pacientes con expectativas de supervivencia prolongada. Por otro lado, el acceso peritoneal tiene menores riesgos potenciales, pero no es inocuo. El riesgo de peritonitis tras el trasplante es bajo, pero específico de esta técnica 17-19. Una infección agresiva (peritonitis entéricas o fúngicas sobre todo) o una peritonitis esclerosante 20,21 pueden distorsionar gravemente la estructura de la cavidad abdominal, generar una morbimortalidad específica y comprometer la viabilidad de un eventual trasplante, sobre todo de riñón y páncreas.Aunque la DP sigue sufriendo el estigma de ser una técnica proclive a las infecciones, estudios recientes muestran una mayor incidencia general de infecciones graves y mortalidad infecciosa entre los pacientes tratados con HD, especialmente en ámbitos en los que es frecuente el inicio no programado de tratamiento sustitutivo renal22. Por otra parte, la infección crónica por el virus de la hepatitis C es más prevalente en pacientes tratados con HD que con DP23, y no se debe olvidar que representa una considerable fuente de morbilidad y mortalidad a largo plazo en trasplantados renales24.
La mayor parte de los estudios publicados hasta la fecha muestran que la DP tiene un coste económico significativamente inferior a la HD. Esta ventaja se optimiza si se usa la DP como modalidad de inicio, al permitir diálisis a dosis bajas por períodos más prolongados.
¿Influye la modalidad previa de diálisis en los resultados del trasplante renal?
La función inmediata del injerto tras el trasplante renal está amenazada por múltiples factores, destacando el daño de isquemia-reperfusión, la nefrotoxicidad aguda de los inmunosupresores administrados y el daño precoz por aloreactividad. La disfunción precoz del injerto acarrea múltiples consecuencias negativas, incluyendo ingreso prolongado, mayor morbilidad precoz, coste económico muy superior del proceso del trasplante y menor supervivencia a largo plazo de pacientes e injerto25. En la última década varios estudios han mostrado tasas significativamente superiores de malfunción inicial del injerto en pacientes tratados previamente con HD que en los tratados con DP. La diferencia de riesgo parece situarse entre un 10 y un 30%, y el riesgo relativo ajustado HD/DP se ha estimado entre 1,4 y 1,75,26-28. Las causas de este fenómeno no son bien conocidas. Se ha sugerido que la sobrehidratación que caracteriza a muchos pacientes en DP podría ejercer un cierto efecto hemodinámico protector durante la fase periquirúrgica29. Otros estudios han relacionado la diferencia con la no necesidad habitual de una sesión de HD pretrasplante en este subgrupo y con la mejor función renal residual de los pacientes en DP en el momento del trasplante (una consecuencia tanto de la propia técnica como de la relativa precocidad con que se trasplantan estos pacientes)30,31.
El riesgo observado de trombosis vascular precoz del injerto renal es mayor en pacientes previamente tratados con DP que en los tratados con HD32,33. Aunque esta complicación del trasplante es globalmente infrecuente, la diferencia bastaría para generar cierta ventaja en la supervivencia precoz del trasplante para los pacientes procedentes de HD5. Es posible que el tratamiento previo con DP favorezca un entorno protrombótico para el injerto renal, pero la diferencia podría ser también consecuencia de sesgos de selección de pacientes con diferentes niveles de riesgo de trombosis para las distintas modalidades de diálisis. Por ejemplo, no es descartable una sobreasignación de pacientes con síndromes de hipercoagulabilidad a DP, ya que éstos son frecuentes y se asocian a trombosis recurrentes del acceso vascular para HD34. El riesgo particularmente elevado (hasta cuatro veces más) de trombosis del injerto observado en pacientes en DP que fueron tratados previamente con HD32,33, presta cierto apoyo a esta sospecha.
Algunos estudios menores publicados en la primera mitad de los años 80 sugerían una alta incidencia de rechazo en pacientes trasplantados tratados previamente con DP34,35. Sin embargo, ninguna evidencia posterior ha confirmado efecto alguno de la modalidad de diálisis previa sobre la incidencia de rechazo agudo del injerto renal. Por otra parte, la información disponible sobre la incidencia general comparada de infecciones postrasplante en DP y HD es contradictoria17,18,37, lo que sugiere ausencia de diferencias significativas. Aunque los pacientes tratados con DP están expuestos al riesgo específico de peritonitis postrasplante, los tratados con HD lo están al de infecciones relacionadas con el acceso vascular, especialmente en el caso de catéteres permanentes. Desafortunadamente, un extenso análisis recientemente publicado38 prescindió de la modalidad de diálisis previa en el análisis del perfil de riesgo para infecciones postrasplante.
En general, se admite que la modalidad de diálisis previa tiene un impacto final limitado sobre los resultados globales del trasplante renal. Existen múltiples estudios de cohortes, la mayoría con muestras relativamente pequeñas, que muestran tasas similares de supervivencia de pacientes e injertos en pacientes procedentes de DP y HD. Algunos estudios de registro, que permiten analizar poblaciones mucho más amplias y representativas, muestran también resultados muy similares4. Por el contrario, el análisis de datos del registro norteamericano (USRDS) ha mostrado tasas ligera pero significativamente superiores de supervivencia de pacientes e injertos en pacientes tratados previamente con DP39. Esta diferencia podría asociarse a factores como la mejor función renal residual al trasplante, las tasas superiores de función precoz del injerto, los efectos negativos del acceso vascular tras el trasplante o la mayor prevalencia de infección por virus C en las poblaciones en HD. Sin embargo, no se puede descartar que la diferencia sea el producto de sesgos metodológicos. Por ejemplo, el mero hecho de que los pacientes en DP se trasplanten más precozmente tiene un efecto potencial sobre los resultados del tratamiento40. Además, las poblaciones trasplantadas procedentes de DP muestran indicios de mayor calidad que las tratadas con HD41, y no es seguro que las técnicas de análisis multivariante corrijan con eficacia este sesgo de selección. Se ha sugerido que la relación de supervivencia del injerto podría depender del tiempo, siendo favorable a la HD en los primeros meses postrasplante (probablemente por el impacto de las menores tasas de trombosis vascular precoz), mejorando luego progresivamente los resultados relativos de la DP5.
El paciente que reinicia diálisis tras el cese funcional de un trasplante renal
Aunque los pacientes que reinician diálisis después del fallo de un injerto renal tienen unas características demográficas favorables respecto a la población general que inicia diálisis, presentan también un perfil de riesgo específico, por diferentes razones. En primer lugar, el tiempo acumulado en TSR es ya significativo en muchos casos, con el consiguiente riesgo de complicaciones (enfermedad cardiovascular, neoplasias, malnutrición y agotamiento de accesos para diálisis, entre otras). Además, estos pacientes afrontan problemas específicos, incluyendo la inmunosupresión acumulada, complicaciones propias del trasplante, reingreso tardío en diálisis, secuelas psicológicas, efectos negativos generados por el injerto in situ y declive acelerado de la FRR. Estas limitaciones parecen explicar la mayor mortalidad en esta subpoblación respecto a otras demográficamente comparables, pero primariamente incidentes en diálisis42,43. Los primeros meses tras el reinicio de diálisis contemplan los mayores picos de mortalidad en esta subpoblación3.
La elección de modalidad de diálisis tras el fallo de un trasplante renal debe seguir a un nuevo proceso de elección informada por el paciente en el que, tanto desde una perspectiva teórica como práctica, PD y HD mantienen a menudo una posición comparada distinta a la que llevó al paciente a elegir una u otra opción antes del trasplante.
Consideraciones teóricas
El contexto clínico de un paciente que reinicia diálisis tras el cese funcional de un trasplante renal refleja, en negativo, algunos de los factores que favorecen el uso de la DP en incidentes primarios en diálisis. Algunos argumentos favorables a esta técnica siguen teniendo validez, incluyendo la concurrencia demográfica, la visión estratégica general del tratamiento integrado (preferir DP mientras haya función renal residual) o su menor coste económico. Además, el hábito de independencia adquirido por los pacientes durante la fase de trasplante funcionante puede inducir a algunos a elegir modalidades domiciliarias de diálisis (HD o DP) tras su cese funcional. Sin embargo, la HD se encuentra en un plano de comparación favorable, ya que no tiene más contraindicaciones que las presentes en fases previas (ej. dificultades de acceso vascular). Por el contrario, existen varios inconvenientes potenciales para el uso de la DP tras el fallo del injerto renal. El uso previo de DP puede haber generado complicaciones que impidan su reinicio en esta fase, como el fallo de ultrafiltración o la peritonitis esclerosante. No es infrecuente que ésta última se diagnostique de novo durante la fase de injerto funcionante20,21. Otros pacientes han sufrido agresiones directas a su membrana peritoneal durante la fase de trasplante, incluyendo cirugía abdominal, peritonitis y hemoperitoneo. Sin embargo, estos riesgos afectan a una fracción limitada de pacientes, y son ya conocidos en el momento de decidir la modalidad de TSR postrasplante. La evolución de la FRR tras el reinicio de diálisis representa un problema mayor, al asociar incertidumbre con impacto significativo en la toma de decisiones clínicas.
En general, se asume que el filtrado glomerular de un injerto renal disfuncionante declina más rápidamente que el de los riñones nativos de un paciente incidente primario en diálisis. Seguramente sea así como norma, aunque es notable la escasez de información controlada que lo confirme, pero también sabemos que el declive procede a un ritmo muy variable, dependiendo de la causa de fallo del injerto y otros factores. El significado pronóstico de la FRR en este contexto no ha sido objeto de análisis específico, pero cabe también suponer que será similar al general, y mayor si el TSR elegido es la DP que si es la HD6. Es obvio que poder predecir con un mínimo nivel de certeza cómo va a evolucionar la FRR tras el reinicio de diálisis sería de gran ayuda a la hora de seleccionar la modalidad de diálisis postrasplante pero, en la mayoría de los casos, no tenemos esa suerte. Proponer la DP como opción a un paciente de tamaño corporal medio o alto, cuya permeabilidad peritoneal o capacidad de ultrafiltración desconocemos (o si ya sabemos que una o ambas son bajas) y sin saber cómo se va a comportar la FRR en los meses inmediatos puede conducir al éxito, pero también a una transferencia precipitada a HD, en un momento especialmente precario para el paciente3. A primera vista, pues, la HD parece una opción más segura en este contexto, pero para dar por cerrada la cuestión habría que contestar a dos preguntas: ¿es el declive acelerado de la FRR un proceso inevitable? Y, si no es así, ¿cuál es el balance riesgo-beneficio para el paciente si aplicamos las medidas que retrasen ese declive?.
La preservación del filtrado glomerular de un injerto disfuncionante ha recibido poca atención en el pasado. Sólo recientemente se ha adquirido conciencia efectiva de las ventajas potenciales del reinicio oportuno y programado de diálisis en estos pacientes44, aunque varias sociedades científicas, incluyendo la SEN45,46, ya han asumido esta estrategia. Tampoco se ha hecho suficiente hincapié en la conveniencia de medidas generales de renoprotección, incluyendo el uso sistemático de IECA-ARA, en estas fases. Por otra parte, nuestras dudas se agudizan a la hora de plantear la conveniencia de mantener parcialmente la inmunosupresión, con el fin de preservar la FRR, una vez reiniciada la diálisis. Como ocurre tantas veces en nuestra profesión, nos enfrentamos a decisiones importantes con información insuficiente. Así, tememos que prorrogar la inmunosupresión pueda acarrear algunos riesgos, sobre todo cardiovasculares e infecciosos47, pero los principales estudios que apoyan este punto de vista pertenecen a un ámbito temporal obsoleto, y muestran notables deficiencias metodológicas. No está claro que una inmunosupresión individualizada, e indicada sólo a pacientes de bajo riesgo, sea perjudicial, si se espera un beneficio a cambio. Pero lo cierto es que tampoco sabemos con certeza si esta medida frena significativamente el declive de la FRR del injerto, ni cuál es la contribución efectiva de un filtrado glomerular reducido al pronóstico de estos pacientes. En algunos casos (toxicidad por anticalcineurínicos, nefropatías por poliomavirus) es posible que retirar los inmunosupresores sea beneficioso para la función del injerto. Así pues, tanto los partidarios como los detractores de prorrogar la inmunosupresión pueden invocar argumentos de sentido común, aunque poca evidencia clínica de calidad, para apoyar sus posturas. Está claro que la decisión debe individualizarse. Mantenerla tiene más sentido en pacientes enfocados a DP que a HD, y será más útil cuánto mejor sea la función renal al reinicio de diálisis, más indolente su declive y menor el riesgo de efectos secundarios del tratamiento. En cambio, los pacientes con antecedentes de neoplasias o infecciones graves o recurrentes, los que hayan mostrado mala tolerancia a estas drogas, los que presenten un estado general deteriorado (especialmente los desnutridos) y aquéllos en los que se prevé una pérdida inexorable y a corto plazo de la FRR son malos candidatos potenciales para mantener cualquier tipo de tratamiento inmunosupresor, ya que el riesgo asumido puede superar fácilmente al beneficio esperado.
¿Influye la modalidad de tratamiento elegida en el pronóstico del paciente que reinicia diálisis tras el cese funcional de un trasplante renal?
La evidencia clínica sobre los resultados específicos de HD y DP tras el fallo de un injerto renal es claramente insuficiente. Incluso desconocemos con precisión cuál es el uso comparado que se da a ambas técnicas en este contexto, aunque los datos de registro diponibles (USRDS, ANZDATA) sugieren que se mantiene la correlación con la prevalencia general en cada ámbito geográfico.
Existen dos vías básicas para explorar los resultados de una técnica dialítica tras el fallo del injerto renal. La primera es comparar los resultados con los de poblaciones en la misma técnica incidentes primarias en diálisis. En el caso de la HD, ya hemos apuntado que la mortalidad es superior a la observada en poblaciones incidentes primarias similares demográficamente3,43, sobre todo en los primeros meses tras el reinicio de diálisis. Por contra, los estudios disponibles en DP no han mostrado diferencias patentes en cuanto a supervivencia de pacientes y técnica, al compararlos con incidentes primarios en DP48-50. No hay una razón clara para esta diferencia, salvo que los pacientes que se tratan con DP tras el trasplante podrían estar relativamente seleccionados por su calidad. Es posible que la cuestión se reduzca a un mero problema de potencia estadística, ya que los estudios en DP analizan muestras relativamente pequeñas.
Hay poca evidencia de calidad que compare la evolución de los pacientes que reinician HD o DP tras el fallo del trasplante. En general, la supervivencia de los pacientes parece similar en ambas técnicas, aunque la de la técnica es acusadamente inferior en los tratados con DP49,51-53, igual que en incidentes primarios. Notablemente, el estudio más consistente publicado hasta la fecha muestra una incidencia de infecciones graves mayor en los pacientes que inician HD tras el fallo del TR, aunque en su ámbito (EE.UU.) es frecuente el uso de catéteres para HD54. Igual que ocurre en incidentes primarios (y, probablemente, por razones parecidas), la probabilidad de recibir un retrasplante renal podría ser mayor en los pacientes tratados con DP tras el fallo de un primer injerto renal54.
Resumen y propuesta de actuación
Las estrategias ordenadas de TSR tienen especial sentido en pacientes con acceso potencial al trasplante renal, por su expectativa prolongada de supervivencia y por la previsible necesidad de diferentes técnicas a lo largo de su evolución. Cada cambio de modalidad de TSR debe ir precedido de un proceso de decisión informada, al ser frecuentes las variaciones tanto en las circunstancias clínicas como en la propia apreciación subjetiva por parte del paciente.
En general, la DP ofrece claras ventajas teóricas como técnica de partida en estos casos, fundamentadas en la mejor preservación de la FRR, sus resultados óptimos en los primeros años de TSR, la ausencia de impedimentos para una transferencia programada ulterior a HD (estrategia integrada) y la no necesidad de creación de accesos vasculares. En términos prácticos, los pacientes tratados con DP se trasplantan más precozmente, presentan mejores patrones de función precoz y una supervivencia superior de pacientes e injerto, mientras que los procedentes de HD muestran tasas más bajas de trombosis vascular primaria tras el trasplante. Las incidencias globales de rechazo agudo e infecciones no parecen diferir significativamente entre ambas técnicas. Existen razones para sospechar que algunas de las diferencias observadas son consecuencia de sesgos metodológicos, más que de un efecto real de la modalidad de diálisis sobre los resultados del trasplante renal.
Persisten lagunas de conocimiento que dificultan la planificación del reingreso en diálisis de pacientes con un injerto renal malfuncionante. En particular, la información sobre los resultados comparados de las técnicas de HD y DP es poco concluyente, aunque no parece que haya grandes diferencias entre ellas. La decisión entre una u otra modalidad está influída por factores como el reinicio oportuno de diálisis, el estado general del paciente y, sobre todo, el comportamiento de la FRR del injerto. En general, el reinicio tardío, el declive rápido del filtrado glomerular, la presencia de factores de riesgo que hagan indeseable mantener algún grado de inmunosupresión o la previsión de inadecuación en DP en ausencia de FRR favorecen la indicación de HD mientras que, en pacientes en buen estado general que reinician diálisis de forma oportuna, la opción de DP puede ser igual de válida que en el inicio primario en diálisis. La falta de evidencias clínicas controladas obliga a tomar estas decisiones sobre bases individualizadas, aplicando el sentido común y extrapolando en ocasiones la experiencia en otros contextos (incidentes primarios en diálisis).
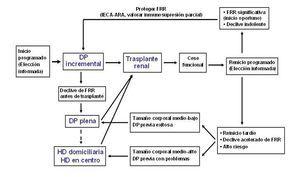
En la Figura 1 proponemos un diagrama de flujo para un tratamiento ordenado de la insuficiencia renal terminal en pacientes subsidiarios de trasplante renal. En los próximos años será preciso un esfuerzo de investigación destinado a aclarar las múltiples dudas que todavía dificultan la toma de decisiones en esta cuestión.
Figura 1. Diagrama de flujo para el tratamiento integrado de la insuficiencia renal terminal en pacientes subsidiarios de trasplante renal no preventivo