Antecedentes: El desgaste proteico-energético (DPE), asociado a inflamación e hiperhidratación, es común en pacientes en hemodiálisis (HD) y se asocia a mayor morbilidad y mortalidad. Objetivo: Evaluar la relación entre el estado nutricional, los marcadores inflamatorios y la composición corporal a través de bioimpedancia espectroscópica (BIS) en pacientes en HD. Métodos: En este estudio observacional, transversal, unicéntrico, realizado en un centro de HD en Forte da Casa (Portugal), participaron 75 pacientes en programa de HD. En todos los participantes se hicieron las siguientes determinaciones analíticas: hemoglobina, albúmina, proteína C reactiva (PCR) y 25-hidroxivitamina D3 [25(OH)D3]. Se calculó el índice de masa corporal (IMC) de todos los pacientes y se aplicó una versión modificada de la valoración global subjetiva (VGS) para pacientes en diálisis. El agua intracelular (AIC) y extracelular (AEC) se midió con BIS (Body Composition Monitor®, Fresenius Medical Care®) después de la sesión de HD. En el análisis estadístico se utilizó la correlación de Spearman para el análisis univariante y la regresión lineal para el análisis multivariante (SPSS 14.0). Una p < 0,05 se consideró estadísticamente significativa. Resultados: El DPE, evaluado inversamente a través de la relación AIC/peso corporal (PC), se relacionó positivamente con la edad (p < 0,001), la presencia de diabetes (p = 0,004), el IMC (p = 0,01) y la PCR (p = 0,008) y negativamente con la albúmina (p = 0,006) y la 25(OH)D3 (p = 0,007). La hiperhidratación, evaluada directamente a través de la relación AEC/PC, se relacionó positivamente con la PCR (p = 0,009) y con la VGS (p = 0,03), y negativamente con la 25(OH)D3 (p = 0,006) y el IMC (p = 0,01). En el análisis multivariante, el DPE se asoció a edad más elevada (p < 0,001), presencia de diabetes (p = 0,003), 25(OH)D3 más baja (p = 0,008), PCR más elevada (p = 0,001) y niveles de albúmina más bajos (p = 0,004). La hiperhidratación se asoció a PCR más elevada (p = 0,001) y niveles de 25(OH)D3 más bajos (p = 0,003). Conclusiones: Teniendo en cuenta estos resultados, las relaciones AIC/PC y AEC/PC, evaluadas con BIS, han demostrado ser buenos marcadores del estado nutricional e inflamatorio de pacientes en programa de HD. La BIS puede ser una herramienta útil para evaluar regularmente el estado nutricional y de hidratación en estos pacientes y puede permitir mejorar y adecuar el asesoramiento nutricional.
Background: Protein-energy wasting (PEW), associated with inflammation and overhydration, is common in haemodialysis (HD) patients and is associated with high morbidity and mortality. Objective: Assess the relationship between nutritional status, markers of inflammation and body composition through bioimpedance spectroscopy (BIS) in HD patients. Methods: This observational, cross-sectional, single centre study, carried out in an HD centre in Forte da Casa (Portugal), involved 75 patients on an HD programme. In all participating patients, the following laboratory tests were conducted: haemoglobin, albumin, C-reactive protein (CRP) and 25-hydroxyvitamin D3 [25(OH)D3]. The body mass index of all patients was calculated and a modified version of subjective global assessment (SGA) was produced for patients on dialysis. Intracellular water (ICW) and extracellular water (ECW) were measured by BIS (Body Composition Monitor®, Fresenius Medical Care®) after the HD session. In statistical analysis, Spearman’s correlation was used for the univariate analysis and linear regression for the multivariate analysis (SPSS 14.0). A P value of <.05 was considered statistically significant. Results: PEW, inversely assessed through the ICW/body weight (BW) ratio, was positively related to age (p<.001), presence of diabetes (p=.004), BMI (p=.01) and CRP (P=.008) and negatively related to albumin (p=.006) and 25(OH)D3 (p=.007). Overhydration, assessed directly through the ECW/BW ratio, was positively related with CRP (p=.009) and SGA (p=.03), and negatively with 25(OH)D3 (p=.006) and BMI (p=.01). In multivariate analysis, PEW was associated with older age (p<.001), the presence of diabetes (p=.003), lower 25(OH)D3 (p=.008), higher CRP (p=.001) and lower albumin levels (p=.004). Overhydration was associated with higher CRP (p=.001) and lower levels of 25(OH)D3 (p=.003). Conclusions: Taking these results into account, the ICW/BW and ECW/BW ratios, assessed with BIS, have proven to be good markers of the nutritional and inflammatory status of HD patients. BIS may be a useful tool for regularly assessing the nutritional and hydration status in these patients and may allow nutritional advice to be improved and adjusted.
INTRODUCCIÓN
El desgaste proteico-energético (DPE), asociado a inflamación e hiperhidratación, es común en pacientes en hemodiálisis (HD) y se asocia a mayor morbilidad y mortalidad1. La proteína C reactiva (PCR) es un predictor independiente de riesgo cardiovascular y mortalidad en la enfermedad renal crónica avanzada (ERCA)1.
La valoración global subjetiva (VGS) es la herramienta más utilizada para evaluar el estado nutricional2 y válida en pacientes en HD3. Los datos antropométricos, como el índice de masa corporal (IMC), son indicadores del estado nutricional de estos pacientes2, pero tienen sus limitaciones si se consideran por sí solos. La albúmina sérica ha sido ampliamente utilizada como marcador nutricional en pacientes en HD y es uno de los marcadores de mortalidad más sensibles4 y un importante marcador de inflamación1,5. Por esta razón, una disminución en la albúmina puede reflejar un estado inflamatorio en lugar de DPE1 y, como la albúmina disminuye con la sobrecarga hídrica, su relevancia se reduce en pacientes en HD1. Los efectos antiinflamatorios de la vitamina D están bien documentados6 y varios autores, incluido nuestro grupo de investigación, han descrito una fuerte correlación entre la deficiencia de 25-hidroxivitamina D3 [25(OH)D3] y la mortalidad tanto en la población en general7,8 como en pacientes en HD9,10.
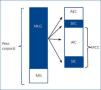
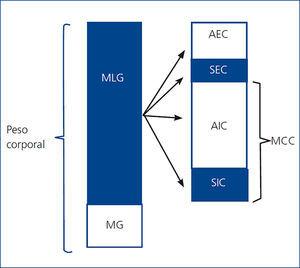
La bioimpedancia espectroscópica (BIS) parece ser un método válido para la valoración y monitorización del estado de hidratación y nutricional en pacientes en HD11 y, aparte de determinar el estado hídrico individual (agua corporal total, agua intra y extracelular [AIC/AEC]) de forma independiente12, analiza la composición corporal (masa celular corporal, masa magra y masa grasa) de forma simple, objetiva y no invasiva13. El agua corporal total se puede dividir en AIC y AEC; por otro lado, la masa libre de grasa (MLG), en AEC y masa celular corporal (MCC), que incluye la AIC (figura 1). El compartimento del AEC refleja, predominantemente, la hiperhidratación13,14, que existe frecuentemente en pacientes en HD y se asocia a inflamación y mayor riesgo de mortalidad15. La MCC es el compartimento que refleja el estado nutricional16 y, como no está tan afectado por los cambios en el estado de hidratación que ocurren sobre todo en
el compartimento que refleja la hiperhidratación (AEC), nos da más información que la MLG en estos pacientes. El compartimento del AIC comprende el 72 % de la MCC y no es afectado por los cambios isoosmóticos que tienen lugar en el compartimento del AEC. Además, el AIC se utiliza frecuentemente para estimar la MCC, que refleja el estado nutricional13,14. Para evaluar el estado nutricional y la hidratación se pueden utilizar dos relaciones: AIC/peso corporal (PC), que refleja el estado nutricional (cuanto mayor es, mejor nutrido está el paciente, y viceversa), y AEC/PC, que refleja la hiperhidratación14,17.
El objetivo principal de este estudio consistió en evaluar la relación entre el estado nutricional, los marcadores de inflamación y la composición corporal, evaluada a través de BIS, en pacientes en programa de HD.
MÉTODOS
Diseño del estudio
Estudio observacional, transversal, unicéntrico, en el que participaron pacientes en programa de HD.
Pacientes
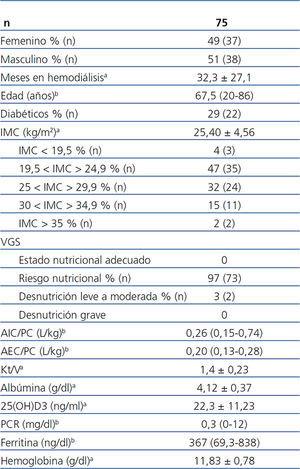
Se incluyeron 75 pacientes en programa de HD tres días a la semana (con técnica de hemofiltración on-line), estables durante al menos tres meses, 51 % del sexo masculino, 29 % diabéticos, y todos mayores de 18 años. Las etiologías de la insuficiencia renal crónica eran: nefropatía diabética (n = 17), nefroesclerosis hipertensiva (n = 13), glomerulonefritis crónica (n = 9), enfermedad poliquística (n = 4), pielonefritis crónica (n = 6), otras (n = 13), desconocida (n = 13). Las demás características clínicas y nutricionales de la población estudiada se muestran en la tabla 1.
Todos los pacientes fueron dializados con membranas de alto flujo (Helixone®, Fresenius®) y agua ultrapura de acuerdo con los criterios de la normativa ISO 13959:2009 – El agua para hemodiálisis y terapias relacionadas. El tiempo medio en programa de HD fue de 32,3 ± 27,1 meses. Una de las limitaciones reconocidas por el fabricante del Monitor de Composición Corporal consiste en su utilización en pacientes con amputaciones mayores de las extremidades o con marcapasos, ya que no garantiza que las mediciones sean precisas en estos pacientes. Por esta razón, estos pacientes se excluyeron del estudio.
Determinaciones analíticas
Se hicieron las siguientes determinaciones analíticas: hemoglobina, albúmina, PCR y 25(OH)D3. Estas se extrajeron previamente a la sesión de diálisis intermedia de la semana y próximo al día en el que se realizó la BIS.
La albúmina se midió utilizando la técnica colorimétrica con bromocresol púrpura (valor de referencia > 4,0 g/dl) y la PCR se obtuvo por el método inmunoturbidimétrico. La 25(OH)D3 sérica se determinó a través de radioinmunoensayo cedido por IDS (Boldon, Reino Unido). El valor de referencia para la 25(OH)D3 es 10-60 ng/ml.
Análisis de la composición corporal
En todos los pacientes se realizó la BIS, utilizando el Monitor de Composición Corporal (Fresenius Medical Care Deutschland GmbH, Alemania), que toma mediciones a 50 frecuencias comprendidas en un rango de 5 a 1000 KHz. La medición se realizó aproximadamente 30 minutos después de la sesión de HD a mitad de la semana colocando cuatro electrodos convencionales al paciente en decúbito supino: dos en la mano y dos en el pie, contralaterales al acceso vascular. En relación con la calidad de las mediciones, todas ellas superaron el 95 %. El fabricante del Monitor de Composición Corporal (Fresenius Medical Care) indica que 30 minutos después de la sesión de HD el equilibrio entre el líquido intra y extracelular se restablece y no se observan diferencias significativas en relación con los valores prediálisis18. Los parámetros obtenidos directamente a través de BIS que se utilizaron en este estudio fueron el AIC y el AEC. El DPE, representado por la relación AIC/PC, y la hiperhidratación, representada por la relación AEC/PC, fueron analizados.
Valoración global subjetiva
Se utilizó la versión modificada de la VGS para pacientes en diálisis19. Los datos se obtuvieron teniendo en cuenta cambios en el PC, hábitos de alimentación, presencia de síntomas digestivos, actividad funcional y presencia
de comorbilidades. Se realizó un breve análisis físico para evaluar la pérdida de masa muscular y de masa grasa y la presencia de edema. A cada componente de la VGS se le asignó una puntuación de 1 (normal) hasta 5 (muy grave). Se atribuyó una clasificación final a cada paciente después de sumar todas las puntuaciones de los diferentes componentes de la VGS; cuanto mayor es la puntuación, mayor el riesgo de DPE.
Parámetros antropométricos
Se recogieron los siguientes datos; altura (m) medida con un estadiómetro telescópico de precisión (Seca 222®), peso seco (kg) medido con báscula calibrada (Soehnle® S20) e IMC (kg/m2).
Análisis estadístico
Las variables categóricas se expresan como frecuencias, las variables con distribución normal se expresan como media ± desviación estándar, y como mediana (rango intercuartil) las variables cuya distribución es no normal. Se utilizó la correlación de Spearman para el análisis univariante y se realizó un análisis de regresión linear multivariante (intervalo de confianza del 95 %).
Para los cálculos estadísticos, se ha utilizado el programa informático SPSS 14.0 (SPSS Inc., Chicago, IL, Estados Unidos). Una p < 0,05 se ha considerado estadísticamente significativa.
RESULTADOS
En nuestro estudio, el IMC no se relacionó significativamente con parámetros nutricionales ni inflamatorios.
En total, 16 pacientes (22 %) presentaban albúmina inferior a 4,0 g/dl. El valor medio de albumina sérica se encontraba por encima de 4,0 g/dl y la mediana de la PCR por debajo de 1 mg/dl, de acuerdo con las directrices K/DOQI3. La 25(OH)D3 sérica se encontraba por debajo de los valores deseables (< 30 ng/ml) en el 80 % (59) de los pacientes.
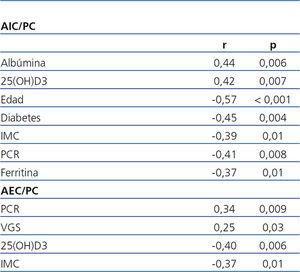
En el análisis de regresión univariable, el DPE, evaluado inversamente por la relación AIC/PC, se relacionó positivamente con la edad, la diabetes, el IMC, la PCR y la ferritina. El DPE se relacionó negativamente con la albúmina y la 25(OH)D3 (tabla 2). Por otra parte, se encontró una correlación negativa entre la albúmina sérica y la PCR (r = -0,49; p < 0,001) y concentraciones más bajas de 25(OH)D3 se asociaron a niveles más elevados de PCR (r = -0,29; p = 0,03).
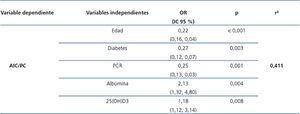
El análisis multivariante demuestra que el DPE se asocia a edad más avanzada, presencia de diabetes, niveles más bajos de 25(OH)D3 y de albúmina y más elevados de PCR (tabla 3).
En el análisis univariante, la hiperhidratación, evaluada por la relación AEC/PC, se relacionó positivamente con la PCR y
la VGS, y negativamente con los niveles de 25(OH)D3 e IMC (tabla 2). En el análisis multivariante, la hiperhidratación se asoció a niveles más elevados de PCR y más bajos de 25(OH)D3 (tabla 4).
DISCUSIÓN
En este trabajo, un peor estado nutricional (menor
AIC/PC) se asocia a edad más avanzada, diabetes y marcadores inflamatorios. La diabetes mellitus ha sido identificada como un factor de riesgo del DPE en pacientes en HD20. El valor de la albúmina, como marcador del estado nutricional, ha sido cuestionado porque su concentración está afectada por parámetros no nutricionales, como el estado de hidratación, las pérdidas de albúmina en la orina y la acidosis plasmática21, la infección o inflamación, siendo este último el factor más importante que conlleva la disminución de la albúmina1,22. Con la utilización de la BIS, hemos demostrado que un peor estado nutricional se asoció a niveles más bajos de albúmina y mayor inflamación (niveles de PCR y ferritina más elevados). Al igual que otros autores23, nuestros resultados también indicaron una correlación negativa entre la albúmina sérica y la PCR, lo que sugiere que los niveles de albúmina más bajos que se observan en pacientes con DPE pueden ser secundarios a procesos inflamatorios. Según los datos obtenidos, niveles más bajos de 25(OH)D3 se asociaron a un peor estado nutricional y su deficiencia contribuye al desarrollo de inflamación crónica debido a su asociación con concentraciones de PCR más elevadas24. En nuestro trabajo, niveles más bajos de 25(OH)D3 se asociaron a niveles de PCR más elevados. En este sentido, se ha demostrado que la suplementación con esta vitamina conduce a la reducción de los niveles de PCR25.
De acuerdo con estos resultados, la relación AIC/PC analizada a través de BIS parece ser adecuada para hacer el seguimiento del estado nutricional de pacientes en programa de HD, ya que un peor estado nutricional se asoció de forma significativa a condiciones frecuentes en pacientes en HD como: edad avanzada, diabetes, inflamación y deficiencia de 25(OH)D3.
Nuestros datos sobre el IMC están en línea con estudios recientes26,27 que han demostrado un aumento progresivo del IMC en pacientes con ERCA, así como un mayor número de pacientes con sobrepeso y obesidad28. En este trabajo, hemos encontrado una asociación negativa entre AIC/PC y el IMC, lo que significa que los pacientes mejor nutridos eran aquellos con valores de IMC más bajos. Cabe destacar que entre los pacientes de este estudio, y de acuerdo con el IMC, apenas el 4 % tenían bajo peso. En los pacientes en HD, existe una relación inusual (llamada «epidemiología inversa») entre el IMC y la supervivencia, con un aumento de la mortalidad en pacientes con bajo IMC (IMC < 20 kg/m2[29]) y mayor supervivencia en pacientes con sobrepeso (IMC ≥ 27,5 kg/m2 [30]; IMC > 25 kg/m2 [29,31]) y obesidad (IMC > 30 kg/m2 [31])29,30,32. Cabe destacar que el IMC no discrimina entre masa magra, grasa o agua, apenas determina una proporción entre el peso y la altura y no todos los pacientes que tienen un IMC alto lo tienen a expensas de la grasa33. No obstante, la utilización del IMC por sí solo tiene limitaciones para evaluar el estado nutricional de estos pacientes34 porque puede encubrir el DPE en pacientes hiperhidratados2.
En lo que se refiere a la VGS, la mayoría de los pacientes presentaban riesgo de desnutrición o desnutrición leve, muy pocos presentaban desnutrición moderada, y ninguno grave. Es importante destacar que en la versión modificada de la VGS para pacientes en diálisis todos los pacientes en HD desde hace más de un año, incluso con parámetros de la historia clínica y examen físico normales, obtienen una puntuación de 9, lo que los clasifica como en riesgo nutricional o desnutrición leve. Esta situación explica la elevada prevalencia de desnutrición (evaluada a través de la VGS) que se ve en nuestra población, ya que la media de tiempo en diálisis fue superior a 2 años (68 % de los casos seguían HD desde hace más de un año). Resultados parecidos han sido señalados por otros autores35. En nuestro trabajo, la VGS no se relacionó con la relación AIC/PC, lo que puede haberse debido a que apenas existían dos pacientes con desnutrición moderada y ninguno con desnutrición grave. A pesar de que esta herramienta de catalogación nutricional tiene utilidad para diferenciar los pacientes muy desnutridos de aquellos con un estado nutricional adecuado, puede que no sea un indicador fiable sobre el grado de desnutrición1,19,36.
La falta de adhesión a las restricciones hídricas puede llevar a sobrecarga hídrica37 y representa uno de los aspectos más difíciles del régimen de tratamiento en HD15, con una prevalencia de percepción de incumplimiento por parte de los pacientes que va desde el 30 % hasta el 74 %38,39. En nuestro estudio, la hiperhidratación se relacionó con concentraciones de PCR más elevadas. Esta asociación ha sido anteriormente descrita en pacientes en diálisis40,41. El vínculo entre la inflamación y la expansión del volumen extracelular es, probablemente, causado por el edema intestinal que facilita la translocación de toxinas bacterianas42,43. Además, nuestros resultados demuestran que los pacientes con hiperhidratación tenían un peor estado nutricional (VGS más elevada y menor 25(OH)D3). Se ha descrito que la prevalencia de DPE, evaluada a través de la VGS, disminuye en los pacientes cuyo estado de hidratación mejora (AEC disminuye y AIC aumenta), y viceversa44. La misma asociación se ha encontrado utilizando un score nutricional distinto (el Bilbrey nutritional index)45. La deficiencia en 25(OH)D3 ha sido asociada a la inhibición de la vía renina-angiotensina46, lo que puede estar relacionado con la hiperhidratación. La correlación negativa observada entre la hiperhidratación y el IMC sugiere que valores de IMC más elevados estaban asociados a mayor acumulación de grasa corporal. Esto apoya el hecho de que los pacientes con mejor estado nutricional eran aquellos con peso normal, según la clasificación del IMC. Por consiguiente, el estado de hidratación, evaluado a través del análisis regular con BIS, puede permitir detectar cambios tanto en el estado nutricional como en el estado inflamatorio. Como ya ha sido descrito por otros autores11, la BIS constituye una técnica importante para analizar el estado nutricional y la hidratación en pacientes en HD y ha demostrado ser tan precisa como los métodos de referencia considerados patrón de oro47. Algunos autores consideran que la técnica de medición espectroscópica presenta alta reproductibilidad y especificidad47,48. En pacientes en programa de HD ha sido utilizada para evaluar el peso seco49,50, pero también es válida para analizar la composición corporal, el estado nutricional14,51 y la hiperhidratación52,53. Por otra parte, se ha evidenciado que la BIS, a través de la medición del estado de hidratación, puede ser adecuada para la valoración del pronóstico de los pacientes en HD54,55.
Nuestro trabajo tiene como limitaciones el tamaño de la muestra y el diseño transversal y unicéntrico. No obstante, sucesivas mediciones con BIS a lo largo del tiempo pueden ser de gran utilidad para evaluar la tendencia del estado nutricional, la inflamación y la hidratación en pacientes en HD, permitiendo la optimización de la terapia y la adecuación del asesoramiento nutricional.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Composición corporal
Tabla 3. Asociaciones entre la relación agua intracelular/peso corporal y diferentes parámetros, incluyendo marcadores de inflamación y nutrición (análisis multivariante)
Tabla 4. Asociaciones entre la relación agua extracelular/peso corporal y marcadores de inflamación y nutrición (análisis multivariante)
Tabla 1. Características de los pacientes
Tabla 2. Coeficientes de correlación de Spearman entre la relación agua intracelular/peso corporal y agua extracelular/peso corporal con marcadores nutricionales e inflamatorios (análisis univariante)