Cuando desde el comité organizador de la VIII Reunión Nacional de Diálisis Peritoneal me invitaron a participar en esta controversia defendiendo la utilidad de la realización de cinéticas peritoneales en la práctica clínica, mi respuesta fue clara a favor del sí. Creemos firmemente en la necesidad de realizar estudios de función peritoneal tanto para hacer una adecuada prescripción como para detectar precozmente cambios funcionales que puedan anticiparnos la aparición de lesiones estructurales con significado patológico, inducidas por la propia técnica.
UTILIDAD DE LA CINÉTICA PERITONEAL PARA PRESCRIBIR
La utilización del peritoneo (tejido biológico, individual y reactivo) como membrana semipermeable para realizar la diálisis condiciona la existencia, ya desde el inicio, de diferencias intersujeto en los tipos de transporte. Varios estudios han mostrado que existe una amplia dispersión en las características de transporte basal del peritoneo y que estas no son predecibles por los factores sociodemográficos, la enfermedad de base o las comorbilidades de los pacientes1,2. Por otro lado, dichas características pueden cambiar con el uso prolongado de la diálisis peritoneal (DP), la exposición permanente a líquidos no biocompatibles y las peritonitis que, ocasionalmente, se asocian a la técnica3-5. El conocimiento de las características de transporte de agua y solutos nos ayudará a realizar una prescripción adecuada, y a optimizar los tiempos de permanencia y evitar la sobreexposición a agentes osmóticos que pueden dañar la membrana, tales como la glucosa y los productos de degradación de esta (PDG)5-7.
¿Se debe realizar una cinética peritoneal en el momento basal para prescribir la modalidad de diálisis peritoneal?
Tanto la guía de la Kidney Disease Outcomes Quality Initiative (KDOQI) en su revisión de 2006 como las directrices para la adecuación de diálisis de las CARI (Cuidados Australianos en la Insuficiencia Renal)8 o las guías europeas para la buena práctica clínica en DP9 coinciden en proponer la realización de una cinética peritoneal a las 4-8 semanas del inicio de la DP, con el fin de optimizar la prescripción basal. No obstante, esta recomendación no es universal; de hecho, las guías canadienses recientemente publicadas10 no la consideran imprescindible, entendiendo que en el momento de inicio de la DP los pacientes todavía presentan función renal residual (FRR) y que no existen grandes problemas para conseguir un Kt/V o un balance negativo de agua y sodio adecuados, tanto con DP continua ambulatoria (DPCA) como con DP automática (DPA). Los autores defienden que cuando aún existe FRR la elección de una u otra técnica de DP se hace más basándose en criterios de calidad de vida y preferencias del pacientes que en el tipo de transporte; no obstante, en una carta reciente a Peritoneal Dialysis International reconocen que el test de equilibrio peritoneal (PET) basal puede ser de ayuda para realizar la prescripción inicial11. Es conveniente recordar que el peor pronóstico atribuido a los pacientes altos transportadores (AT) basales12 desaparece cuando estos pacientes son tratados desde el inicio con DPA y/o icodextrina12-14. Por tanto, el diagnóstico de AT en estadios basales puede en muchos casos ayudar a sentar la indicación de DPA con o sin icodextrina, no solo porque con ello conseguiremos mejores parámetros en términos de diálisis adecuada, sino porque mejorará el pronóstico del paciente.
En resumen, la mayoría de las guías recomiendan hacer una cinética peritoneal basal que se utilizará como una herramienta más para llevar a cabo una adecuada prescripción y para conocer el punto de partida del peritoneo.
¿Qué tipo de cinética debe hacerse en el estudio basal?
Para evaluar la función peritoneal se han descrito varios test, pero no hay ningún estudio prospectivo y aleatorizado que nos diga cuál es el mejor. La cinética ideal debe medir tanto la capacidad de transporte de pequeños solutos (capacidad difusiva) como el transporte de agua y sodio (transporte convectivo), debe ser sencilla de realizar en la práctica clínica habitual, y sus resultados, reproducibles y estables.
El más utilizado y, a la vez, el propuesto en la mayoría de la guías8,9 es el PET con un intercambio de 4 horas al 2,27 % propuesto por Twardoski en 198715. En el transporte de pequeños solutos se analiza la relación dializado/plasma de creatinina a los 240 minutos del intercambio y los pacientes son clasificados en altos, promedios altos, promedios bajos o bajos transportadores, según los grupos descritos inicialmente por Twardoski. El éxito del PET radica en su sencillez y en que ha sido el más utilizado en la mayoría de los centros, sobre todo para medir transporte difusivo, lo que nos aporta valores de referencia para estudios y comparaciones con experiencias previas.
Pero el PET-2,27 % adolece de diferentes grados de inexactitud, entre los que se incluye el ser una medida semicuantitativa (clasifica a los pacientes en tipos de transporte) y que tiene un alto coeficiente de variabilidad, que oscila entre 10-25 %, sobre todo si la metodología no está bien estandarizada en términos de duración del intercambio previo, volúmenes de infusión, posición del paciente y métodos de laboratorio utilizados. Pero el mayor problema del PET-2,27 % es que no discrimina bien entre las diferentes causas de fallo de ultrafiltración (UF), únicamente se asume que los pacientes AT conseguirán menos UF, pues en ellos la glucosa difunde rápidamente del peritoneo a la sangre, perdiéndose su capacidad osmótica en intercambios de larga duración. Resumiendo, los datos semicuantitativos aportados por el PET-2,27 % nos ayudan a realizar una prescripción inicial, sabiendo que el paciente AT se beneficiará más de DPA y/o uso de icodextrina en intercambios largos, pero son claramente insuficientes para explorar todas las causas del fallo de UF, ya que únicamente explican la parte debida a un aumento de permeabilidad peritoneal.
Se han descrito otros test más complejos para medir la difusión peritoneal de manera más exacta, entre los que se incluyen: el coeficiente de transferencia de masas calculado según un modelo matemático complejo16 y el peritoneal permeability analysis descrito por Pannekeet en 199517, que miden el transporte de pequeños solutos mediante el coeficiente de transferencia de masas, además de estimar la absorción de glucosa, el aclaramiento de proteínas séricas y la reabsorción linfática mediante la infusión de dextrano 70. El mayor problema de estos test, para realizarlos en la práctica clínica, es que son complejos y siguen sin darnos una buena medida de la capacidad y las vías de transporte de agua a través del peritoneo.
La importancia pronóstica que ha adquirido un adecuado balance negativo de agua y sodio en los pacientes en DP18 ha llevado a la Sociedad Internacional de Diálisis Peritoneal (ISPD) a recomendar la medida de la capacidad de UF con un intercambio de 4 horas con glucosa hipertónica19. La cinética realizada con glucosa 3,86/4,25 % permite medir el transporte de agua libre (TAL) a través de aquaporinas en condiciones de máxima diferencia osmótica (mediante la medida del cribado de sodio a los 60 minutos) y disponer de una determinación estandarizada de la UF.
Con el fin de seguir las recomendaciones de la ISPD, sin perder los datos históricos de referencia, se han propuesto varios test cinéticos basados en los principios del PET pero utilizando glucosa hipertónica. El mini-PET (intercambio de 1 hora con glucosa al 3,86 %) ha demostrado ser muy eficaz para analizar el TAL a través de la aquaporina20. El doble mini-PET (dos intercambios sucesivos de 1 hora con glucosa al 3,86 % y al 1,36 %, respectivamente) añade al anterior la medida de la conductancia osmótica21. El problema de estos test de 1 hora es que los resultados de D/P creatinina no son extrapolables a los obtenidos con el PET de 4 horas22. Por tanto, habría que realizar los dos test por separado, un día el doble mini-PET y otro día un PET-2,27 % de 4 horas, lo que supone un incremento muy importante en la duración del estudio y el número de determinaciones analíticas.
Algunos autores han propuesto combinar el PET al 3,86 % y el mini-PET en un único test, lo que se consigue con un intercambio de 4 horas con glucosa hipertónica pero haciendo un drenaje completo de la cavidad abdominal a los 60 minutos y determinando en ese momento el cribado de sodio y la UF. Posteriormente se reinfunde todo el líquido y se continúa el test durante 3 horas más, lo que nos permite medir simultáneamente el TAL y la UF a través del pequeño poro, además de obtener los resultados de D/P de creatinina a las 4 horas23,24.
Nuestra propuesta inicial era la realización de un PET-3,86 % de 4 horas por varios motivos: 1) es el recomendado por la ISPD para definir el fallo de UF (UF < 400 ml) y para realizar una medida estandarizada de la UF25; 2) la medida del cribado de sodio a los 60 minutos nos permite explorar la función de las aquaporinas; 3) los resultados obtenidos en términos de D/P creatinina son equiparables a los obtenidos con el PET-2,27 %26 y nos permiten seguir clasificando a los pacientes según su capacidad de transporte de pequeños solutos. No obstante, a raíz de los datos del grupo de La Paz con el PET modificado 3,86 % con drenaje completo a la hora, este test podría considerarse como cinética peritoneal de referencia al no perder ninguna de las ventajas del PET-3,86 % y discriminar mejor entre TAL y UF por pequeño poro24.
¿Cuándo deben realizarse estudios cinéticos para prescribir la modalidad de diálisis peritoneal a lo largo del seguimiento?
En este punto no existe consenso. Algunas guías recomiendan estudios cinéticos de rutina con periodicidades que varían entre uno y dos años8,9, mientras que otras no consideran necesarias las cinéticas programadas en condiciones de estabilidad clínica (KDOQI10). En lo que coinciden todas las guías es en que la cinética peritoneal puede ser de ayuda para evaluar algunos problemas clínicos tales como los trastornos metabólicos asociados a desnutrición e infradiálisis, especialmente en el caso de la sobrecarga de volumen.
Queremos insistir aquí en que la cinética es una herramienta más para estudiar estos problemas, pero no la única. Así, por ejemplo, en un paciente con sobrecarga de volumen, primero habrá que evaluar todas las posibles causas que hayan podido contribuir, como: un exceso de ingesta de sodio, una disminución de la diuresis residual o problemas de drenaje, etc., y tras haber descartado todas estas posibilidades ajenas a la función peritoneal recurriremos al estudio cinético con glucosa hipertónica. La cinética al 3,86 % (si es posible con drenaje completo a la hora) con medida de cribado de sodio a los 60 minutos nos dará información sobre el tipo de transporte de pequeños solutos y el funcionamiento de las aquaporinas y podrá ayudarnos a optimizar la terapia, valorar la utilidad real del uso de icodextrina e incluso a indicar la necesidad de paso a hemodiálisis (HD) si hay un fallo de UF asociado a un AT adquirido con pérdida del TAL.
Tampoco existe consenso sobre si se debe realizar una cinética peritoneal tras las peritonitis; únicamente se recomienda en las guías australianas8. En varios trabajos realizados por nuestro grupo se muestra cómo las peritonitis son un factor de riesgo de desarrollo de AT y fallo de UF tanto a largo plazo4 como durante los primeros años5. En un trabajo reciente realizado con cinéticas hipertónicas vemos cómo los pacientes que han sufrido peritonitis tienen menos cribado de sodio, anticipándose este dato al fallo de UF o al aumento de transporte27. Por este motivo creemos que la realización de una cinética un mes después de sufrir una peritonitis, y más si esta es agresiva, es recomendable, ya que nos servirá para detectar precozmente pacientes en riesgo de sufrir un fallo de UF.
Como resumen de este apartado dedicado a responder a la pregunta ¿es útil la cinética peritoneal para la prescripción de DP?, diré que:
Nuestras recomendaciones sobre la utilización de la cinética peritoneal para la prescripción de diálisis vienen esquematizadas en la tabla 1.
UTILIDAD DE LA CINÉTICA PERITONEAL PARA DETECTAR PRECOZMENTE CAMBIOS PATOLÓGICOS INDUCIDOS POR LA DIÁLISIS
La utilización del peritoneo como membrana de diálisis supone su exposición reiterada a líquidos no biocompatibles (glucosa hipertónica y PDG, lactato, pH ácidos, etc.) y a agresiones, como las infecciones peritoneales, para las que no está preparado. Es obligación del nefrólogo clínico:
¿Sirven las cinéticas peritoneales para vigilar la viabilidad del peritoneo y reconocer precozmente cambios patológicos inducidos por la diálisis que puedan limitar su uso?
El principal cambio funcional que ocurre con el tiempo en diálisis es el desarrollo de fallo de UF asociado al AT adquirido3-5. Tras cinco años de diálisis el 20-30 % de los pacientes desarrollan un fallo de UF debido fundamentalmente a un aumento de la permeabilidad4, pero además estos cambios funcionales se relacionan con cambios anatómicos como la transición epitelio-mesenquimal (TEM)28. Tanto el AT adquirido con fallo de UF asociado como la TEM son reconocidas como patologías inducidas por la propia técnica y como factores de riesgo para el desarrollo de esclerosis peritoneal (EP).
La EP encapsulante (EPE) es una patología, aunque poco frecuente, muy grave y claramente asociada al tiempo en DP (generalmente más de cinco años); aunque hasta la fecha no se ha conseguido identificar claramente qué pacientes están en riesgo de desarrollarla. En un estudio realizado por Lambie et al.29 se describe una incidencia muy baja de EPE (9 casos de 692 pacientes tratados). Cuando analizan los factores de riesgo, describen cómo en 2 casos ocurre asociada a peritonitis graves antes de los cinco años, pero en los otros 7 ocurre sin un antecedente claro de peritonitis y tras más de cinco años en DP. Al revisar los estudios cinéticos de estos 7 pacientes y compararlos con los del resto de la población en riesgo, comprobaron que no había diferencias en las características de transporte de agua o solutos basales ni se detectaba el desarrollo de AT de pequeños solutos hasta el momento del diagnóstico de EPE y la suspensión de la DP. Lo que sí describen es una pérdida de la capacidad de UF desde dos años antes del diagnóstico clínico y, además, dicha disminución pudo detectarse realizando un PET-2,27 %. Es posible que si se hubiesen realizado las cinéticas con glucosa al 3,86 % y se hubiese medido el cribado de sodio, la detección de pacientes en riesgo de desarrollar un fallo de UF y EPE hubiese sido más precoz y sensible. En un trabajo de La Milia et al.30 realizado en 95 pacientes a los que se les realiza PET-3,86 % basal y se les sigue prospectivamente con una cinética (PET-3,86 %) anual durante cinco años, se describe como el único factor asociado con el desarrollo de fallo de UF en el análisis de Cox la disminución en el cribado de sodio a los 60 minutos. Algunos estudios anatomopatológicos han sugerido que el fallo en la función de las aquaporinas puede estar asociado a angiopatía y fibrosis31.
Los autores que no defienden el uso de cinéticas de rutina argumentan que no todos los fallos de UF acaban produciendo EPE y, mientras que el primero es un fenómeno relativamente frecuente (hasta un 50 % de los pacientes con más de cinco años en DP), la EPE es una patología muy rara. Por nuestra parte, los que defendemos las cinéticas de rutina lo hacemos con base en que la EPE es una patología muy grave asociada a una alta mortalidad y que una vez comienzan los síntomas clínicos ya hay muy pocas posibilidades de tratamiento, por lo que es muy importante detectarla en las fases precoces, ya que algunas medidas, como los descansos peritoneales, si se aplican precozmente pueden revertir el proceso al menos parcialmente32. Incluso, en caso de detectarse un riesgo alto, los pacientes deben ser transferidos a HD utilizando tamoxifeno, ya que el uso de este fármaco parece mejorar el pronóstico en los casos de EPE33 y es conocido que si el proceso de esclerosis ha comenzado la simple suspensión de la diálisis no evita su progresión.
En resumen:
- Vigilancia estrecha de la permeabilidad y la capacidad de UF mediante cinéticas con glucosa hipertónica.
- Valorar tratamiento mediante descansos peritoneales con lavados con heparina.
- En caso de fallo de UF persistente, el paciente debe ser transferido definitivamente a HD y valorarse la posibilidad de tratamiento con tamoxifeno.
¿Influye el tipo de transporte basal en la supervivencia en diálisis peritoneal?
En los últimos 15 años ha existido un importante debate sobre si los pacientes con AT basal tenían peor supervivencia global o en la técnica. Algunos estudios realizados a finales de los noventa y principios de 2000, fundamentalmente en pacientes en DPCA, así lo indicaban34-37, aunque este hallazgo no fue confirmado por todos38,39. Como ya se ha comentado en el apartado anterior, en el metaanálisis realizado por Brimble et al.12 basado fundamentalmente en los cuatro primeros estudios y en los datos del registro neozelandés40 parecía confirmarse el peor pronóstico en DP de los pacientes con AT basal e incluso se llegaba a recomendar que estos pacientes fuesen transferidos a HD41.
Nuestra experiencia42 y la de otros autores, basada en el análisis de datos retrospectivos, no confirma este peor pronóstico si se utilizan todas las herramientas de las que disponemos en la actualidad, como la DPA y la icodextrina13,14. Los efectos beneficiosos del uso de icodextrina para retrasar el desarrollo del AT adquirido en pacientes prevalentes anúricos fueron ya mostrados en un subanálisis del estudio EAPOS43. Cabe la posibilidad de que, si el clínico no realiza estudios cinéticos periódicos, no adapte precozmente las pautas a las características de transporte, y el retraso en esta adaptación pueda empeorar el pronóstico. En este sentido quiero destacar un hallazgo de nuestro grupo: en un primer estudio en el que pretendíamos analizar la importancia pronóstica de las características del transporte basal, encontramos cómo de manera global durante el primer año había una disminución de la permeabilidad (no significativa) y un aumento de la capacidad de UF. Este fenómeno era sobre todo evidente en los pacientes con AT o fallo de UF basal44 en los que el cambio era significativo, de modo que en un alto porcentaje de ellos el problema se corregía, al menos parcialmente. En un estudio más reciente hemos confirmado este fenómeno, pero además observamos como, si durante este primer año el paciente es expuesto a altas concentraciones de glucosa, el descenso de la permeabilidad y el aumento de la UF descritos en el grupo global no ocurría5. Esto nos llevó a analizar en un nuevo trabajo qué ocurría si los pacientes eran tratados desde un inicio con icodextrina: en este caso el descenso de permeabilidad y el aumento de UF a lo largo del primer año sí alcanzaban significación estadística y eran cuantitativamente mucho mayores que los descritos con las soluciones convencionales45.
¿Sirven las cinéticas para evaluar en la clínica las posibles mejoras con soluciones de diálisis más biocompatibles?
En los últimos años se han desarrollado nuevas soluciones de DP con el fin de mejorar la biocompatibilidad y evitar agresiones sobre el peritoneo. Estos nuevos líquidos de diálisis son mejores desde el punto de vista teórico, al haber disminuido la cantidad de PDG y lactato y tener un pH más fisiológico. Varios estudios realizados tanto en modelos animales como en biopsias de pacientes han mostrado sus beneficios.
Pero queda lo más difícil: demostrar en la clínica que su uso repetido tiene ventajas en términos de protección funcional y anatómica del peritoneo. En nuestro caso, tras haber realizado cinéticas de manera sistemática con las soluciones convencionales y seguir realizándolas con las nuevas soluciones, estamos en condiciones de comparar y analizar precozmente las ventajas de las nuevas soluciones. Un ejemplo de ello lo tenemos en el estudio comentado previamente, en el que analizamos el efecto del uso de icodextrina desde el momento basal45: como disponíamos de una base de datos con el comportamiento del peritoneo durante el primer año con soluciones convencionales, rápidamente pudimos comparar resultados y confirmar que la disminución de la permeabilidad y el aumento de UF eran mayores con la icodextrina, lo que aporta un efecto protector del peritoneo.
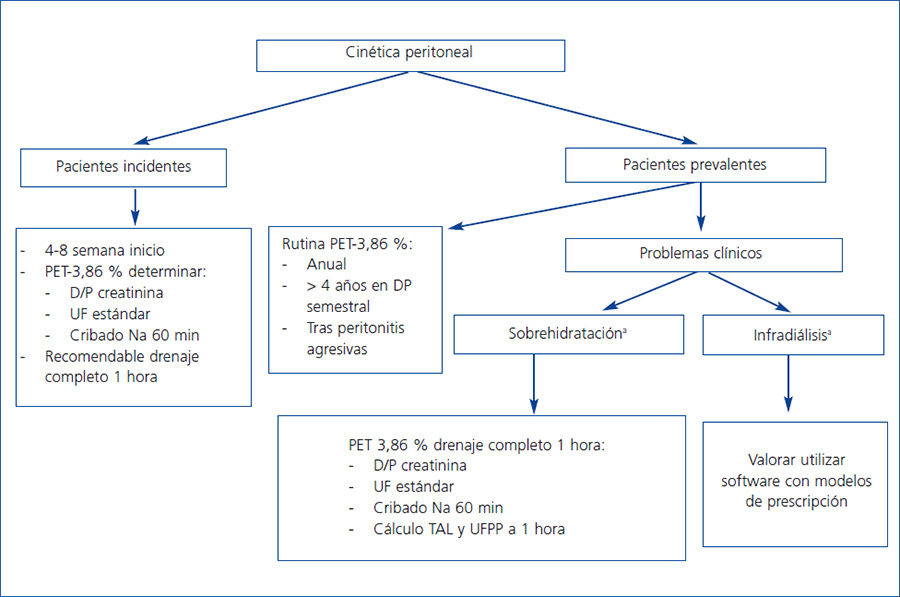
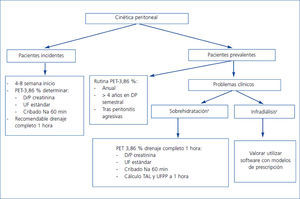
Nuestras recomendaciones sobre la utilización de la cinética peritoneal para detectar precozmente cambios patológico inducidos por la diálisis peritoneal vienen esquematizadas en la tabla 2. En la figura 1 hacemos una propuesta general del uso de la cinética peritoneal en la practica clínica habitual.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Recomendaciones de uso de cinéticas peritoneales para pescribir
Tabla 2. Recomendaciones de uso de las cinéticas peritoneales para la detección de cambios patológicos inducidos por la diálisis peritoneal
Figura 1. Esquema de recomendaciones globales de uso de cinética peritoneal en la clínica