Los estudios sobre la prevalencia de anemia en enfermedad renal crónica (ERC) en adultos no en diálisis (ERC-ND) y en programa de diálisis (ERC-D) en España no son recientes, o se centran en ciertos subgrupos. El objetivo fue conocer la epidemiología y los patrones actuales de tratamiento de la anemia asociada a la ERC en España.
Materiales y métodosEstudio multicéntrico, no intervencionista, retrospectivo con pacientes ERC-ND estadios 3a-5 y ERC-D, atendidos en España entre 2015 y 2017 (estudio RIKAS).
ResultadosLa prevalencia de anemia en ERC-ND y ERC-D en 2015 fue del 33,8 y del 91,5%, respectivamente, con resultados similares durante 2016-2017. La prevalencia de inflamación sistémica en pacientes anémicos (18,1 y 51,8% para ERC-ND y ERC-D, respectivamente) fue superior, especialmente en aquellos tratados con agentes estimuladores de eritropoyesis (AEE), respecto a la población general con ERC-ND. Tras 12meses de seguimiento, los valores medios de ferritina y del índice de saturación de transferrina (IST) en pacientes anémicos con ERC-ND fueron de 187,1ng/ml y del 22,2%, respectivamente, mientras que en ERC-D fueron de 254,6ng/ml y del 20,2%. En pacientes tratados con AEE, los valores medios fueron de 190,6ng/ml y del 22,0% en ERC-ND, y de 255,0ng/ml y del 20,2% en ERC-D.
ConclusionesLa prevalencia de anemia y de inflamación aumentan con la severidad de la enfermedad, siendo mayores en ERC-D. Los parámetros férricos en pacientes anémicos tratados o no con AEE son insuficientes según las guías, por lo que existe un margen de mejora para el tratamiento de la anemia asociada a la ERC.
Studies on the prevalence of anaemia in chronic kidney disease (CKD) in adults not on dialysis (CKD-ND) and in dialysis programmes (CKD-D) in Spain are not recent or focus on certain subgroups. The aim of this study was to know the epidemiology and current treatment patterns of anaemia associated with CKD in Spain.
Materials and methodsMulticentre, non-interventional, retrospective study with CKD-ND stage 3a-5 and CKD-D patients treated in Spain between 2015 and 2017 (RIKAS study).
ResultsThe prevalence of anaemia in CKD-ND and CKD-D in 2015 was 33.8% and 91.5%, respectively, with similar results during 2016-2017. The prevalence of systemic inflammation in anaemic patients (18.1% and 51.8% for CKD-ND and CKD-D, respectively) was higher, especially in those treated with erythropoiesis-stimulating agents (ESA), compared to the general population with CKD-ND. After 12months of follow-up, mean ferritin and transferrin saturation index (TSI) values in anaemic patients with CKD-ND were 187.1ng/ml and 22.2%, respectively, while in CKD-D were 254.6ng/ml and 20.2%. In ESA-treated patients, mean values were 190.6ng/ml and 22.0% in ND-CKD, and 255.0ng/ml and 20.2% in D-CKD.
ConclusionsThe prevalence of anaemia and inflammation increased with disease severity, being higher in D-CKD. Iron parameters in anaemic patients treated or not with ESA are insufficient according to the guidelines, so there is room for improvement in the treatment of anaemia associated with CKD.
La anemia es una de las complicaciones más comunes en la enfermedad renal crónica (ERC), siendo más prevalente según progresa la enfermedad1. Las causas de la anemia asociada a la ERC son diversas. Clásicamente se ha descrito que la principal es la producción inadecuada de eritropoyetina endógena. No obstante, en los últimos años se han reconocido otros factores contribuyentes, como una respuesta eritropoyética de la médula ósea disminuida, el déficit absoluto o funcional de hierro y la vida media de los hematíes acortada, entre otros2,3.La anemia en la ERC conlleva una reducción de la calidad de vida, un mayor riesgo de enfermedad cardiovascular y de progresión a ERC terminal, un aumento de las tasas de hospitalización y de mortalidad, así como de alteraciones cognitivas4-7.
La ERC tiene una prevalencia global que oscila entre el 11 y el 13%, encontrándose la mayoría de los pacientes en estadio38,9. En España, los estudios EPIRCE (2010)10,11 y ENRICA (2018)12 han evaluado esta prevalencia, denotando su aumento en el tiempo en nuestro país.
Respecto a la anemia, aunque hay estudios en España que analizan su prevalencia en la ERC, existen limitaciones en los datos disponibles. Estas publicaciones son antiguas o se limitan a una población concreta de pacientes13-17. El estudio MERENA (2011) estimó esta comorbilidad en ERC estadios 3 y 4 (43,7% y 58,1%, respectivamente)14. El estudio NADIR (2013) analizó la incidencia de anemia en pacientes con ERC estadio3 (35% en 36meses)13,15. Poco después, el estudio MICENAS (2014) evaluó la prevalencia de la anemia (58,5%) y su manejo clínico en pacientes con ERC estadios 3-516. En 2017, Guerrero et al.17 estimaron la prevalencia en pacientes con ERC en estadio 3a-5 y mayores de 90años en un 35,7%.
En este contexto, la ferroterapia y los agentes estimuladores de la eritropoyesis (AEE) han sido ampliamente empleados, sobre todo de manera combinada, para el tratamiento de la anemia renal1.Sin embargo, el uso del hierro para el tratamiento de la anemia renal no es óptimo, pues no se corrigen adecuadamente los parámetros férricos18. Además, la literatura acerca de la epidemiología y de los tratamientos en España no es reciente y resulta limitada10-17. El objetivo del presente estudio fue evaluar la prevalencia y la incidencia de anemia en la ERC, así como caracterizar la subpoblación con anemia, así como su manejo en situación de práctica clínica real en España.
Material y métodosDiseño del estudioSe definieron dos tipos de poblaciones. La población con ERC incidente fue aquella cuya enfermedad comenzó en su inclusión en el estudio (no había registros de ERC durante el año precedente a su inclusión). La población prevalente ya tenía ERC a fecha 1 de enero de 2015, 1 de enero de 2016 y 1 de enero de 2017. Para estimar la incidencia de estos resultados, se construyeron cohortes dinámicas. Esto permitió a los pacientes entrar y/o salir de una cohorte durante la mitad del período de estudio. De forma análoga, los pacientes con anemia incidente lo fueron en el momento de su inclusión en el estudio (no tenían anemia durante el año precedente). Los pacientes con anemia prevalente ya eran anémicos a fecha 1 de enero de 2015. Los pacientes incidentes anémicos tratados con AEE eran aquellos que recibieron la primera prescripción durante el año de inclusión en el estudio (sin precedente en el año anterior). Los pacientes prevalentes en este caso eran aquellos cuya primera prescripción ocurrió antes del 1 de enero de 2015.
Estas estimaciones se estandarizaron por edad y sexo respecto a la población de España. Los pacientes de la cohorte de interés fueron indexados a fecha 1 de enero de cada año si tenían una historia de diagnóstico/tratamiento o en el primer diagnóstico/tratamiento que ocurrió en ese año. Los pacientes que tenían antecedentes del evento antes de la fecha de indexación se excluyeron del cálculo con el fin de crear una cohorte de pacientes en riesgo. Los pacientes de la cohorte fueron seguidos desde su fecha de indexación hasta la primera fecha de evento en la base de datos, 12meses después de la indexación, muerte, trasplante, diálisis (solo cohortes con ERC no en diálisis [ERC-ND]) o última observación (lo que ocurriera primero).
Entre los criterios de inclusión de los pacientes destacaban: sujetos mayores de 18años con ERC-ND en estadios 3a-5 o ERC en programa de diálisis (ERC-D), en cualquier momento durante el periodo del estudio (del 1 de enero de 2015 al 31 de diciembre de 2017). Para poder formar parte de las cohortes prevalentes (pertenecientes a los años 2015, 2016, 2017) los pacientes debían cumplir los criterios de inclusión (2015-2017), y no tener evidencia previa de cáncer (o estar en tratamiento con quimioterapia) antes de la fecha de indexación. Adicionalmente, los pacientes no podían estar permanentemente institucionalizados durante 2015-2017, ni haber recibido un trasplante o tener anemia por déficit de hierro en cualquier punto antes de la indexación.
Recogida de datos y variables evaluadasLos datos fueron extraídos de informes médicos anonimizados en España incluidos en la base de datos BIG-PAC®19, que contiene los datos anonimizados de 1,9 millones de pacientes en el país, de siete comunidades autónomas. Se ha demostrado que el uso de esta base es aceptable en términos de representatividad de la población, de forma que los resultados se pueden proyectar directamente sobre la totalidad20. Se extrajeron los datos, y se realizó el seguimiento de los pacientes mediante un identificador administrativo único.
El objetivo primario fue estimar la incidencia y la prevalencia de la anemia asociada a la ERC-ND (3a-5) y ERC-D en la población general para los años 2015, 2016 y 2017.
Los objetivos secundarios fueron: describir la prevalencia y la incidencia de ERC en la población general, así como la prevalencia y la incidencia de anemia en pacientes diagnosticados con ERC y del tratamiento con agentes estimuladores de la eritropoyesis (AEE) en pacientes anémicos con ERC; describir las características clínicas y demográficas; describir los patrones de tratamiento para la anemia asociada a la ERC, y en particular en pacientes tratados con AEE.
En las características clínicas y demográficas se han registrado la presencia o ausencia las siguientes comorbilidades, presentadas junto con su código de International Classification of Diseases (ICD): historia de hipertensión arterial (ICD-10: I10-15), artritis reumatoide (ICD-10: M05-M06), diabetes mellitus tipo2 (ICD-10: M06), dislipidemia (ICD-10: E78), obesidad (ICD-10: E66), enfermedad cardiovascular (cardiopatía isquémica [ICD-10: I20], infarto agudo de miocardio [ICD-10: I21-22], accidente cerebrovascular [ICD-10: I61-I64], ictus [ICD-10: I63], enfermedad arterial periférica [ICD-10: I73.9], insuficiencia cardiaca [ICD-10: I50]), depresión (ICD-10: F34.1), enfermedad pulmonar obstructiva crónica (ICD-10: J41-42, J44) y osteoporosis (ICD-10: M80-82).
Respecto a las variables analizadas, se consideró que el paciente presentaba anemia cuando existía un diagnóstico y/o al menos dos mediciones consecutivas de hemoglobina (Hb) <13g/dl (8,1mmol/l) para los hombres y <12g/dl (7,5mmol/l) para las mujeres según las guías KDIGO, y/o al menos dos tratamientos para la anemia (por ejemplo, hierro intravenoso y/o AEE). Los pacientes se clasificaron en los diferentes estadios de ERC de acuerdo con las guías KDIGO según el valor de filtrado glomerular estimado (FGe): 3a (45-59ml/min/1,73m2), 3b (30-44ml/min/1,73m2), 4 (15-29ml/min/1,73m2), 5 (<15ml/min/1,73m2). El índice de resistencia a la eritropoyetina (IRE) se calculó como la posología semanal de AEE en relación con el peso del paciente y los niveles de hemoglobina (posología semanal de AEE /peso (kg) /Hb [g/dl]). Para homogeneizar las dosis de AEE se utilizaron factores de conversión para expresar las dosis en unidades internacionales (UI). Si el paciente recibía darbepoetina semanal se multiplicó este valor por 200. En el caso de dosis quincenales, primeramente el valor fue dividido entre dos para obtener la dosis/semana y luego se aplicó el factor de corrección. Por otro lado, si el paciente era tratado con metoxipolietilenglicol (MPG)-epoetina beta, la dosis mensual se dividió por cuatro (valor dosis/semana) y el resultado se multiplicó por 250.
Las características basales pertenecen a los 12meses de historia de cada paciente en cada cohorte. Cada característica identificada se analizó y presentó en tablas de estadística descriptiva, medias, desviación estándar (DE) y porcentajes para variables categóricas. Las variables cualitativas se muestran como frecuencias absolutas y relativas, mientras que las cuantitativas se expresan como media y desviación estándar.
ResultadosPrevalencia e incidenciaLa prevalencia y la incidencia de ERC en la población general en las distintas cohortes durante los años 2015, 2016 y 2017 se resumen en la tabla 1.
Prevalencia e incidencia de la ERC y de la anemia asociada a la ERC en España
| Anemia en ERC en la población general | ERC en la población general (%) | Anemia en población con ERC (%) | Pacientes anémicos con ERC tratados con AEE (%) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Cohorte | Prevalencia | Incidencia | Prevalencia | Incidencia | Prevalencia | Incidencia | Prevalencia | ||||||||||
| Fecha | Enero 2015 | Enero 2015 | Enero 2015 | Enero 2016 | Enero 2017 | Enero 2015 | Enero 2016 | Enero 2017 | Enero 2015 | Enero 2016 | Enero 2017 | Enero 2015 | Enero 2016 | Enero 2017 | Enero 2015 | Enero 2016 | Enero 2017 |
| ERC-ND(3a-5) | 1,6 | 0,3 | 4,6 | 4,7 | 4,7 | 10,9 | 10,9 | 10,9 | 33,8 | 34,0 | 34,4 | 8,1 | 6,9 | 7,7 | 26,4 | 25,6 | 26,2 |
| ERC-ND (3a) | 0,6 | 0,1 | 2,3 | 2,4 | 2,3 | 7,6 | 7,5 | 6,6 | 26,3 | 26,2 | 26,5 | 5,1 | 3,4 | 4,3 | 18,1 | 15,7 | 16,5 |
| ERC-ND (3b) | 0,5 | 0,09 | 1,5 | 1,5 | 1,5 | 9,6 | 9,9 | 10,3 | 32,8 | 33,4 | 33,7 | 8,9 | 8,8 | 9,2 | 28,7 | 30,1 | 29,1 |
| ERC-ND (4) | 0,4 | 0,08 | 0,7 | 0,7 | 0,7 | 30,9 | 31,7 | 37,0 | 55,0 | 55,6 | 56,4 | 10,4 | 9,5 | 10,2 | 31,2 | 28,8 | 31,9 |
| ERC-ND (5) | 0,08 | 0,02 | 0,1 | 0,1 | 0,1 | 68,8 | 72,0 | 70,0 | 71,8 | 72,5 | 73,4 | 28,0 | 25,1 | 24,2 | 54,3 | 61,9 | 54,3 |
| ERC-D | 0,03 | 0,001 | 0,04 | 0,04 | 0,04 | 56,4 | 60,9 | 69,7 | 91,5 | 90,7 | 91,3 | 61,5 | 58,0 | 61,4 | 90,0 | 86,0 | 83,7 |
| Hemodiálisis | 0,02 | 0,0 | 0,02 | 0,02 | 0,03 | 70,5 | 61,6 | 69,1 | 96,9 | 95,3 | 95,0 | 70,7 | 64,2 | 60,2 | 92,5 | 88,5 | 84,7 |
| Diálisis peritoneal | 0,01 | 0,001 | 0,01 | 0,01 | 0,01 | 51,9 | 60,5 | 70,2 | 82,5 | 82,6 | 84,7 | 53,4 | 50,9 | 63,6 | 85,1 | 81,1 | 81,9 |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; ERC: enfermedad renal crónica; ND: no en diálisis.
Los datos de prevalencia e incidencia se proporcionan a día 1 de enero de cada año.
La prevalencia y la incidencia de anemia renal en la población general fueron, respectivamente, del 1,6 y del 0,4% para ERC-ND y del 0,03 y el 0,001% para ERC-D. Estos valores se mantuvieron estables durante todo el periodo analizado. La prevalencia y la incidencia de anemia en la población con ERC-ND se mantuvieron estables: (∼34 y 10,9%, respectivamente). La prevalencia de la anemia aumenta a medida que se deteriora la función renal, siendo de del 71,8-73,4% en pacientes ERC-ND estadio5. En el caso de ERC-D la prevalencia fue estable (∼91%), con una incidencia oscilante en el rango 56,4-69,7% según el año considerado. Durante el periodo del estudio, la prevalencia en los pacientes en hemodiálisis (HD) se mantuvo estable (∼95,5%), con una incidencia del 61,6-70,5% según el año considerado. En diálisis peritoneal (DP) la prevalencia fue ∼83%, con una incidencia creciente.
La prevalencia de pacientes anémicos con ERC-ND tratados con AEE se mantuvo en torno al 26%, con una incidencia de ∼8%. El uso de AEE aumentó conforme lo hacía la gravedad de la ERC en el rango de 15,7-18,1% en estadio3a, hasta 54,3-61,9% en estadio5. En pacientes con ERC-D la prevalencia se mantuvo en torno al 85%, con una incidencia cercana al 61%. En ambos parámetros el porcentaje en pacientes en HD fue superior a aquellos en DP.
Características demográficas y clínicas de los pacientesLas características demográficas y clínicas se resumen en la tabla 2. La edad media de los pacientes anémicos con ERC-ND y ERC-D fue de 78,0 y de 68,2años, respectivamente. En la población anémica bajo tratamiento con AEE la media fue de 73,3 y 65,4años. En general, el porcentaje de varones fue superior al de mujeres en cada cohorte.
Datos demográficos y clínicos de los pacientes en la población prevalente
| Pacientes con ERC | Pacientes con ERC anémicos | Pacientes con ERC anémicos tratados con AEE | ||||
|---|---|---|---|---|---|---|
| Variables | ERC-NDn=37.664 | ERC-Dn=326 | ERC-NDn=12.730 | ERC-Dn=280 | ERC-NDn=3.362 | ERC-Dn=252 |
| Edad (años), media (DE) | 78,2 (10,5) | 68,1 (10,6) | 78,0 (11,5) | 68,2 (10,6) | 73,3 (12,4) | 65,4 (15,9) |
| Género | ||||||
| Mujeres, n (%) | 16.233 (43,1) | 79 (25,8) | 5.929 (46,6) | 68 (24,3) | 1.347 (40,1) | 91 (36,1) |
| Hombres, n (%) | 21.417 (56,9) | 227 (74,2) | 6.801 (53,4) | 212 (75,7) | 2.015 (60,0) | 161 (63,9) |
| PCR > 5 mg/l | 2.505 (9,9) | 181 (55,5) | 2.302 (18,1) | 145 (51,8) | 983 (29,2) | 121 (48,0) |
| IMC, media (DE) | 24,4 (4,3) | 20,3 (3,7) | 24,1 (4,5) | 19,8 (3,3) | 23,5 (4,7) | 18,1 (2,6) |
| Comorbilidades, n (%) | ||||||
| Índice de comorbilidad de Charlson, media (DE) | 4,0 (1,4) | 4,2 (1,4) | 4,0 (1,4) | 4.2 (1,4) | 4,1 (1,5) | 4,3 (1,5) |
| Hipertensión arterial | 29.649 (78,7) | 224 (73,2) | 10.061 (79,0) | 202 (72,1) | 2.566 (76,3) | 184 (73,0) |
| Dislipidemia | 17.236 (45,8) | 144 (47,1) | 5.833 (45,8) | 134 (47,9) | 1.309 (38,9) | 121 (48,0) |
| Diabetes mellitus | 16.780 (44,6) | 155 (50,7) | 5.666 (44,5) | 141 (50,4) | 1.417 (42,2) | 119 (47,2) |
| Enfermedad cardiovascular | 13.771 (36,6) | 253 (82,7) | 5.527 (43,4) | 237 (84,6) | 1.816 (54,0) | 201 (79,8) |
| Causa de la ERC, n (%) | ||||||
| Enfermedad renal hipertensiva y vascular | 15.445 (41,0) | 125 (40,9) | 5.218 (41,0) | 115 (41,1) | 1.524 (45,3) | 125 (49,6) |
| Enfermedad renal diabética | 7.901 (21,0) | 70 (22,9) | 2.609 (20,5) | 64 (22,9) | 837 (24,9) | 65 (25,8) |
| Glomerulopatías | 1.948 (5,2) | 25 (8,2) | 659 (5,2) | 24 (8,6) | 191 (5,7) | 17 (6,8) |
| Medicación actual, n (%) | ||||||
| Antihipertensivos | 33.142 (88,0) | 281 (91,8) | 11.505 (90,4) | 257 (91,8) | 3.125 (93,0) | 231 (91,7) |
| Diuréticos | 16.441 (43,7) | 16 (4,9) | 6.668 (52,4) | 13 (4,6) | 2.324 (69,1) | 7 (2,8) |
| Hipolipemiantes | 17.694 (47,0) | 139 (45,4) | 6.023 (47,3) | 131 (46,8) | 1.363 (40,5) | 127 (50,4) |
| Antidiabéticos | 14.492 (38,5) | 133 (43,5) | 4.912 (38,6) | 122 (43,6) | 1.221 (36,3) | 107 (42,5) |
| Vitamina D | 9.737 (25,9) | 196 (64,1) | 4.515 (35,5) | 183 (65,4) | 1.830 (54,4) | 154 (61,1) |
| Perfil de hierro en el momento de indexación (1 de enero de 2015) | ||||||
| Hemoglobina (g/dl), media (DE) | 12,6 (1,6) | 12,1 (0,2) | 11,3 (1,2) | 12,1 (0,1) | 10,5 (0,8) | 12,1 (0,2) |
| Ferritina (ng/ml), media (DE) | 172,8 (31,9) | 241,3 (41,3) | 187,3 (35,6) | 256,0 (44,7) | 198,3 (40,2) | 268,6 (46,0) |
| Índice de saturación de transferrina (%), media (DE) | 24,8 (1,5) | 22,0 (1,3) | 21,8 (1,6) | 19,9 (1,2) | 20,7 (1,4) | 19,5 (1,1) |
| Perfil de hierro 3 meses antes de comenzar el tratamiento con AEE | ||||||
| Hemoglobina (g/dl), media (DE) | NA | NA | NA | NA | 10,6 (0,8) | 9,6 (0,5) |
| Ferritina (ng/ml), media (DE) | NA | NA | NA | NA | 181,8 (29,9) | 248,1 (29,0) |
| Índice de saturación de transferrina (%), media (DE) | NA | NA | NA | NA | 20,9 (2,5) | 21,0 (2,5) |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; DE: desviación estándar; ERC: enfermedad renal crónica; IMC: índice de masa corporal; ND: no en diálisis; NA: no aplica; PCR: proteína C reactiva.
Todas las cohortes presentaron un índice de comorbilidad de Charlson en torno a4. Las comorbilidades más prevalentes fueron la hipertensión arterial, la dislipidemia, la diabetes mellitus y la enfermedad cardiovascular en proporciones variables. En consonancia con estas patologías, las medicaciones más empleadas en todas las cohortes fueron los agentes antihipertensivos, diuréticos, hipolipemiantes, antidiabéticos y vitaminaD. Respecto a la causa de la enfermedad renal, la más prevalente fue la enfermedad hipertensiva y vascular (rango: 40,9-49,6%), seguida de la diabetes mellitus (rango: 20,5-25,8%).
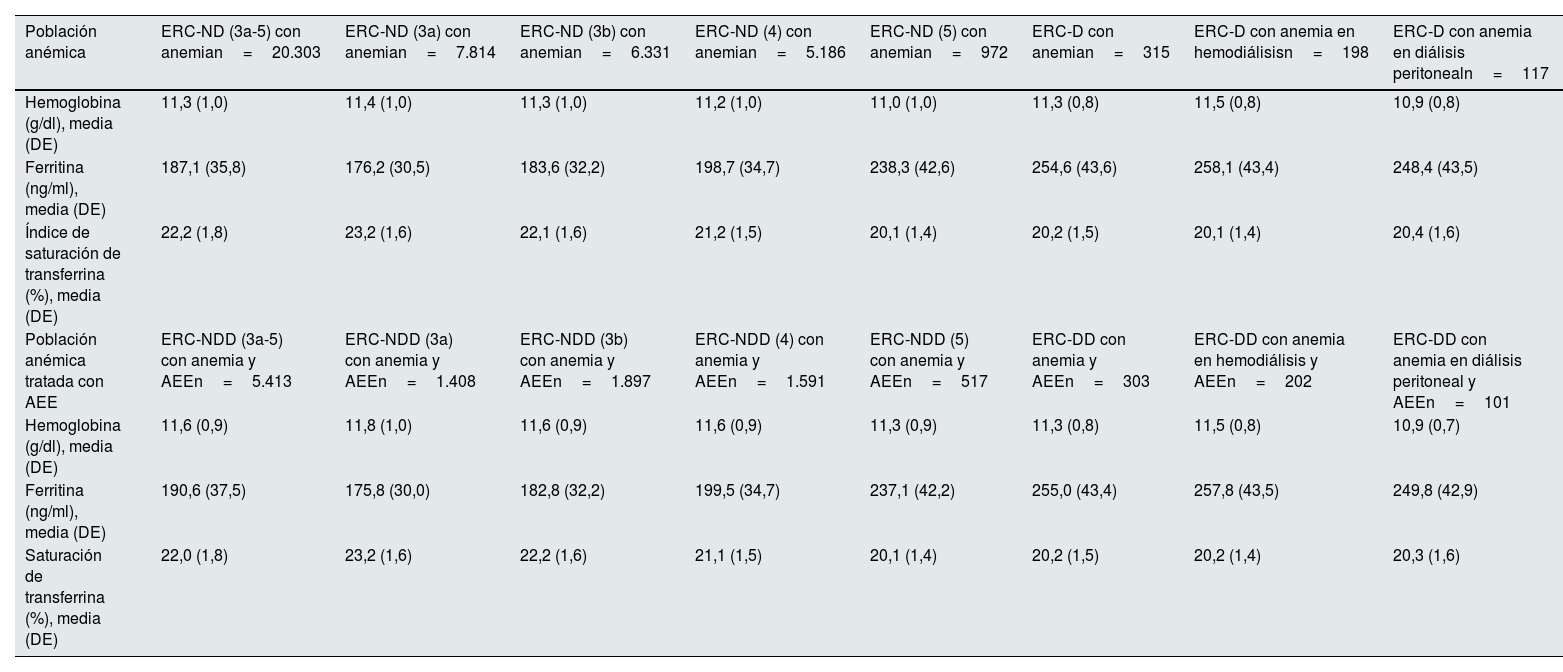
Los niveles medios de ferritina y del índice de saturación de transferrina (IST) en las poblaciones con ERC-ND fueron de 172,8ng/ml y del 24,8%, respectivamente. Los datos para el subgrupo con ERC-D fueron de 241,3ng/ml y del 22,0%. En pacientes con ERC-ND anémicos, los valores fueron de 187,3ng/ml y del 21,8%, respectivamente. El nivel basal medio de ferritina e IST para pacientes anémicos con ERC-D fue de 256,0ng/ml y del 19,9%. Bajo tratamiento con AEE, los datos fueron de 198,3ng/ml y del 20,7% para ERC-ND y de 268,6ng/ml y del 19,5% para ERC-D.
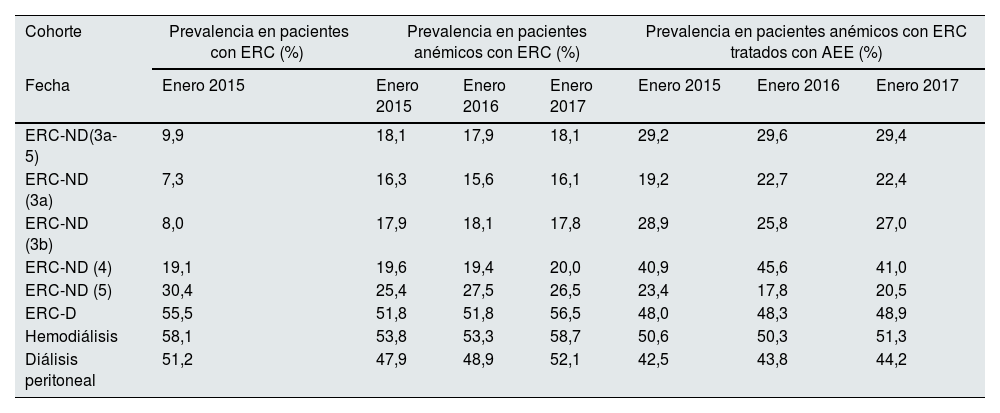
La prevalencia de inflamación (definida por unos valores de proteínaC reactiva superiores a 5mg/l) en la población con ERC-ND y ERC-D fue del 9,9 y del 55,5%, respectivamente (año 2015). En el grupo con anemia los valores se mantuvieron estables durante el periodo del estudio (∼18% y ∼54%, respectivamente; tabla 3). La prevalencia en pacientes anémicos tratados con AEE fue de ∼29% y de ∼48%, respectivamente. En los pacientes con ERC-ND la prevalencia de inflamación fue superior en aquellos anémicos (siendo aún más destacado si estaban siendo tratados con AEE) frente a la población general con ERC-ND. Además, los pacientes ERC-D, con independencia del estado anémico o del tratamiento con AEE, presentaron una mayor prevalencia de inflamación que aquellos con ERC-ND.
Prevalencia de pacientes con valores de proteína C reactiva superiores a 5mg/l en la población de pacientes con ERC, con anemia asociada a la ERC y pacientes anémicos tratados con AEE
| Cohorte | Prevalencia en pacientes con ERC (%) | Prevalencia en pacientes anémicos con ERC (%) | Prevalencia en pacientes anémicos con ERC tratados con AEE (%) | ||||
|---|---|---|---|---|---|---|---|
| Fecha | Enero 2015 | Enero 2015 | Enero 2016 | Enero 2017 | Enero 2015 | Enero 2016 | Enero 2017 |
| ERC-ND(3a-5) | 9,9 | 18,1 | 17,9 | 18,1 | 29,2 | 29,6 | 29,4 |
| ERC-ND (3a) | 7,3 | 16,3 | 15,6 | 16,1 | 19,2 | 22,7 | 22,4 |
| ERC-ND (3b) | 8,0 | 17,9 | 18,1 | 17,8 | 28,9 | 25,8 | 27,0 |
| ERC-ND (4) | 19,1 | 19,6 | 19,4 | 20,0 | 40,9 | 45,6 | 41,0 |
| ERC-ND (5) | 30,4 | 25,4 | 27,5 | 26,5 | 23,4 | 17,8 | 20,5 |
| ERC-D | 55,5 | 51,8 | 51,8 | 56,5 | 48,0 | 48,3 | 48,9 |
| Hemodiálisis | 58,1 | 53,8 | 53,3 | 58,7 | 50,6 | 50,3 | 51,3 |
| Diálisis peritoneal | 51,2 | 47,9 | 48,9 | 52,1 | 42,5 | 43,8 | 44,2 |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; ERC: enfermedad renal crónica; ND: no en diálisis.
Los datos de prevalencia e incidencia se proporcionan a día 1 de enero de cada año. Se considera un seguimiento de los pacientes durante 12 meses a partir del 1 de enero de cada año.
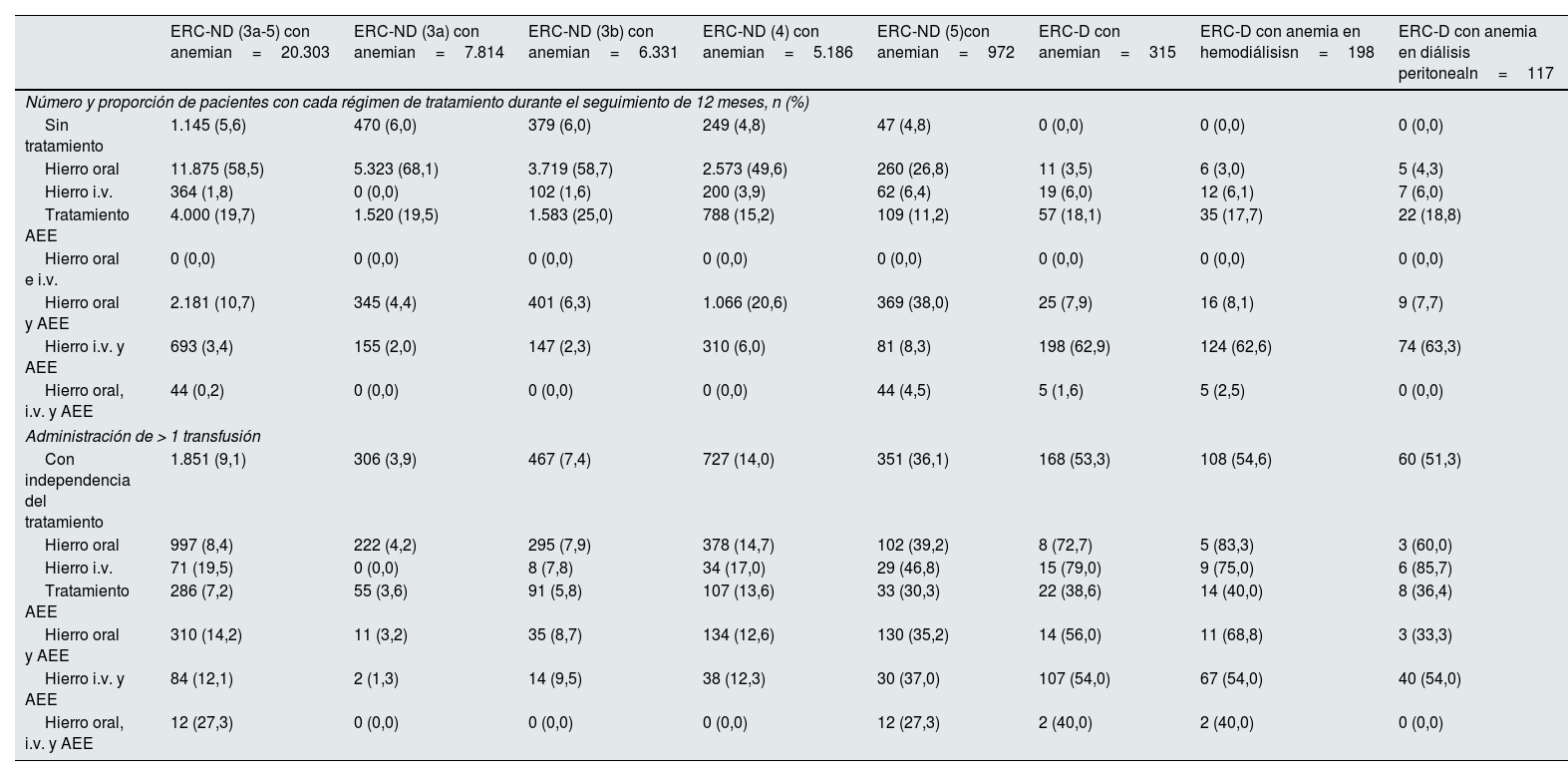
El detalle de los tratamientos para la población prevalente seguida a lo largo del año 2015 durante 12meses se muestra en la tabla 4, con información adicional de los pacientes tratados con AEE en la Tabla suplementaria 1. Los pacientes anémicos con ERC-ND y ERC-D fueron tratados con hierro oral (58,5% y 3,5%, respectivamente), hierro intravenoso (1,8% y 6,0%), AEE con hierro oral (10,7% y 7,9%) o AEE con hierro intravenoso (3,4% y 62,9%).
Régimen de tratamiento y necesidad de transfusiones en pacientes con anemia asociada a la ERC en población prevalente durante el seguimiento de 12 meses
| ERC-ND (3a-5) con anemian=20.303 | ERC-ND (3a) con anemian=7.814 | ERC-ND (3b) con anemian=6.331 | ERC-ND (4) con anemian=5.186 | ERC-ND (5)con anemian=972 | ERC-D con anemian=315 | ERC-D con anemia en hemodiálisisn=198 | ERC-D con anemia en diálisis peritonealn=117 | |
|---|---|---|---|---|---|---|---|---|
| Número y proporción de pacientes con cada régimen de tratamiento durante el seguimiento de 12 meses, n (%) | ||||||||
| Sin tratamiento | 1.145 (5,6) | 470 (6,0) | 379 (6,0) | 249 (4,8) | 47 (4,8) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Hierro oral | 11.875 (58,5) | 5.323 (68,1) | 3.719 (58,7) | 2.573 (49,6) | 260 (26,8) | 11 (3,5) | 6 (3,0) | 5 (4,3) |
| Hierro i.v. | 364 (1,8) | 0 (0,0) | 102 (1,6) | 200 (3,9) | 62 (6,4) | 19 (6,0) | 12 (6,1) | 7 (6,0) |
| Tratamiento AEE | 4.000 (19,7) | 1.520 (19,5) | 1.583 (25,0) | 788 (15,2) | 109 (11,2) | 57 (18,1) | 35 (17,7) | 22 (18,8) |
| Hierro oral e i.v. | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Hierro oral y AEE | 2.181 (10,7) | 345 (4,4) | 401 (6,3) | 1.066 (20,6) | 369 (38,0) | 25 (7,9) | 16 (8,1) | 9 (7,7) |
| Hierro i.v. y AEE | 693 (3,4) | 155 (2,0) | 147 (2,3) | 310 (6,0) | 81 (8,3) | 198 (62,9) | 124 (62,6) | 74 (63,3) |
| Hierro oral, i.v. y AEE | 44 (0,2) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 44 (4,5) | 5 (1,6) | 5 (2,5) | 0 (0,0) |
| Administración de > 1 transfusión | ||||||||
| Con independencia del tratamiento | 1.851 (9,1) | 306 (3,9) | 467 (7,4) | 727 (14,0) | 351 (36,1) | 168 (53,3) | 108 (54,6) | 60 (51,3) |
| Hierro oral | 997 (8,4) | 222 (4,2) | 295 (7,9) | 378 (14,7) | 102 (39,2) | 8 (72,7) | 5 (83,3) | 3 (60,0) |
| Hierro i.v. | 71 (19,5) | 0 (0,0) | 8 (7,8) | 34 (17,0) | 29 (46,8) | 15 (79,0) | 9 (75,0) | 6 (85,7) |
| Tratamiento AEE | 286 (7,2) | 55 (3,6) | 91 (5,8) | 107 (13,6) | 33 (30,3) | 22 (38,6) | 14 (40,0) | 8 (36,4) |
| Hierro oral y AEE | 310 (14,2) | 11 (3,2) | 35 (8,7) | 134 (12,6) | 130 (35,2) | 14 (56,0) | 11 (68,8) | 3 (33,3) |
| Hierro i.v. y AEE | 84 (12,1) | 2 (1,3) | 14 (9,5) | 38 (12,3) | 30 (37,0) | 107 (54,0) | 67 (54,0) | 40 (54,0) |
| Hierro oral, i.v. y AEE | 12 (27,3) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 12 (27,3) | 2 (40,0) | 2 (40,0) | 0 (0,0) |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; ERC: enfermedad renal crónica; i.v.: intravenoso; ND: no en diálisis.
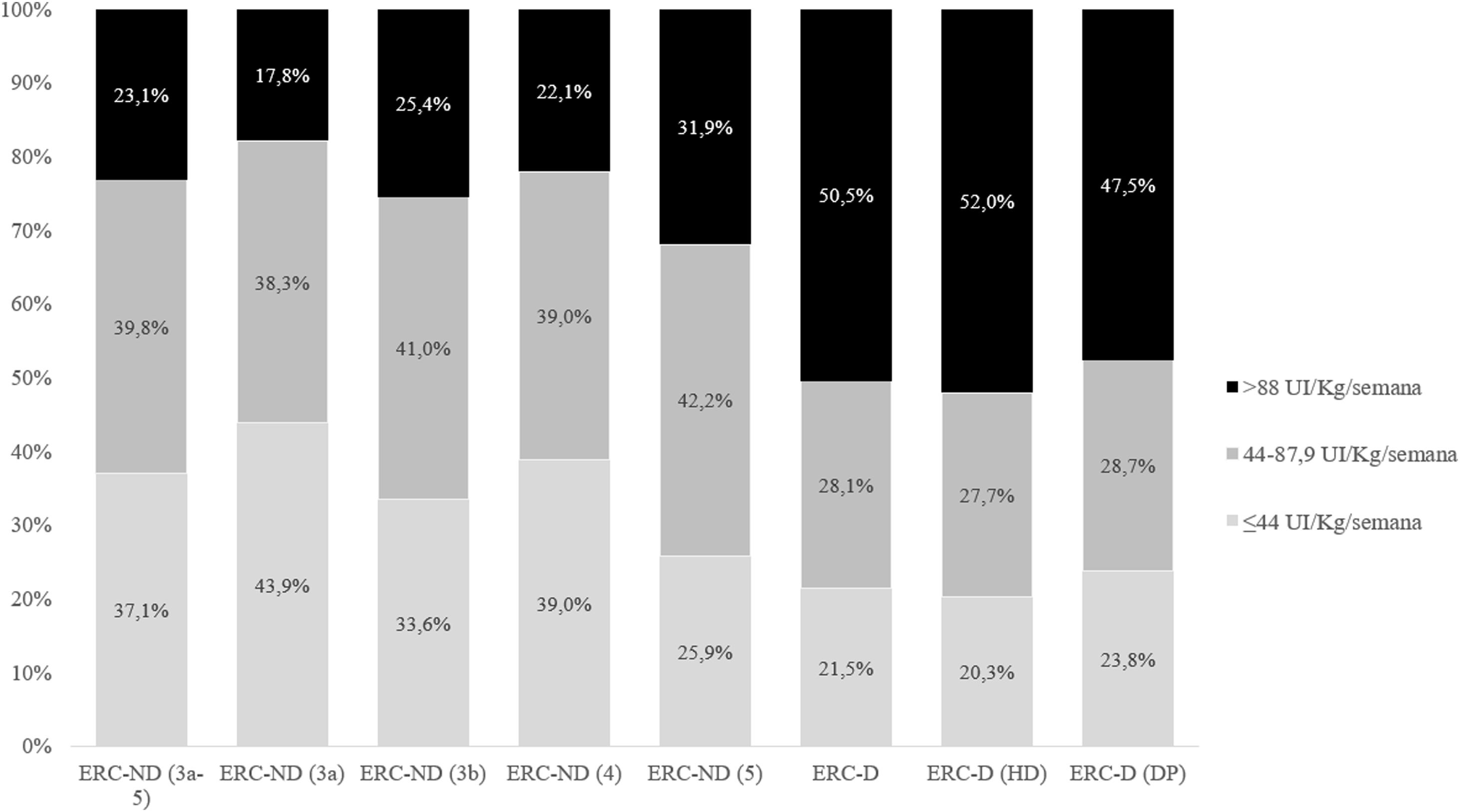
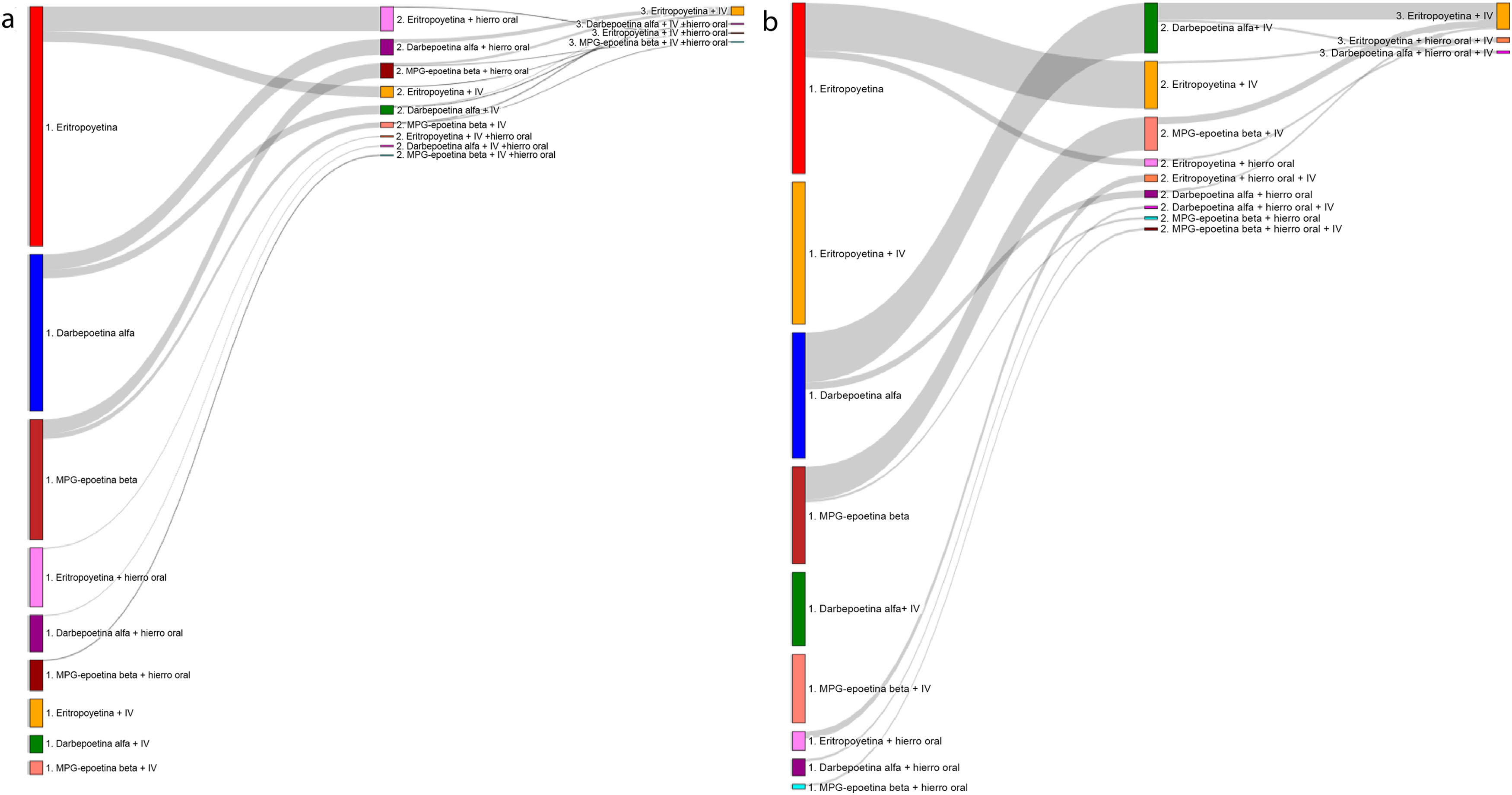
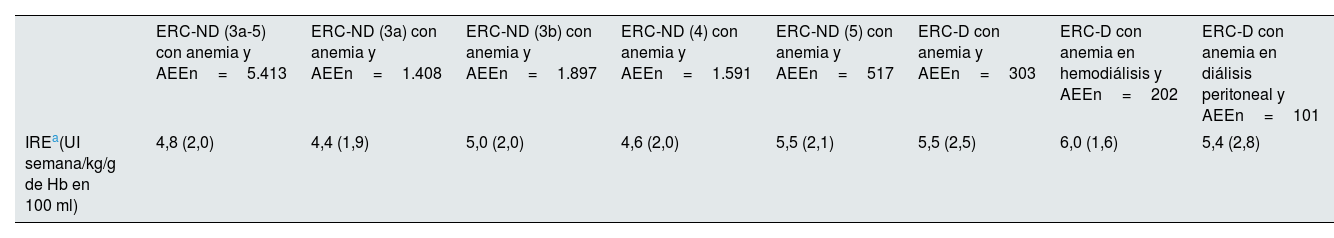
En el grupo de los pacientes tratados con AEE, la eritropoyetina recombinante humana (rHuEPO) fue la más empleada en ambos subgrupos (46,6% y 46,2% para ERC-ND y ERC-D, respectivamente), seguida de darbepoetina alfa (30,1% y 30,0%) y metoxipolietilenglicol (MPG)-epoetina beta (23,4% y 23,8%; Tabla suplementaria 2). Las dosis empleadas se detallan en la figura 1, mostrándose la media en la Tabla suplementaria 3. Las líneas de tratamiento con AEE en pacientes anémicos con ERC-ND (3a-5) y ERC-D se muestran en la figura 2. La mayoría de los pacientes mantuvieron el tratamiento inicial y muy pocos cambiaron a una segunda o tercera línea de tratamiento. En los pacientes tratados con AEE el IRE medio fue de 4,8 y 5,5 UI semana/kg/g de Hb en 100ml, respectivamente (tabla 5).
Índice de resistencia a eritropoyetina durante el periodo de seguimiento
| ERC-ND (3a-5) con anemia y AEEn=5.413 | ERC-ND (3a) con anemia y AEEn=1.408 | ERC-ND (3b) con anemia y AEEn=1.897 | ERC-ND (4) con anemia y AEEn=1.591 | ERC-ND (5) con anemia y AEEn=517 | ERC-D con anemia y AEEn=303 | ERC-D con anemia en hemodiálisis y AEEn=202 | ERC-D con anemia en diálisis peritoneal y AEEn=101 | |
|---|---|---|---|---|---|---|---|---|
| IREa(UI semana/kg/g de Hb en 100 ml) | 4,8 (2,0) | 4,4 (1,9) | 5,0 (2,0) | 4,6 (2,0) | 5,5 (2,1) | 5,5 (2,5) | 6,0 (1,6) | 5,4 (2,8) |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; ERC: enfermedad renal crónica; Hb: hemoglobina; ND: no en diálisis; UI: unidades internacionales.
Estos datos se encuentran detallados en la tabla 6. A los 12meses de seguimiento los valores medios de ferritina e IST en pacientes con ERC-ND fueron de 187,1ng/ml y del 22,2%, respectivamente. En pacientes con ERC-D fueron de 254,6ng/ml y del 20,2%. En pacientes tratados con AEE, los valores medios de ferritina e IST fueron de 190,6ng/ml y del 22,0% en ERC-ND, y de 255,0ng/ml y del 20,2% en aquellos con ERC-D.
Resultados del tratamiento de la anemia asociada a la ERC durante el seguimiento
| Población anémica | ERC-ND (3a-5) con anemian=20.303 | ERC-ND (3a) con anemian=7.814 | ERC-ND (3b) con anemian=6.331 | ERC-ND (4) con anemian=5.186 | ERC-ND (5) con anemian=972 | ERC-D con anemian=315 | ERC-D con anemia en hemodiálisisn=198 | ERC-D con anemia en diálisis peritonealn=117 |
|---|---|---|---|---|---|---|---|---|
| Hemoglobina (g/dl), media (DE) | 11,3 (1,0) | 11,4 (1,0) | 11,3 (1,0) | 11,2 (1,0) | 11,0 (1,0) | 11,3 (0,8) | 11,5 (0,8) | 10,9 (0,8) |
| Ferritina (ng/ml), media (DE) | 187,1 (35,8) | 176,2 (30,5) | 183,6 (32,2) | 198,7 (34,7) | 238,3 (42,6) | 254,6 (43,6) | 258,1 (43,4) | 248,4 (43,5) |
| Índice de saturación de transferrina (%), media (DE) | 22,2 (1,8) | 23,2 (1,6) | 22,1 (1,6) | 21,2 (1,5) | 20,1 (1,4) | 20,2 (1,5) | 20,1 (1,4) | 20,4 (1,6) |
| Población anémica tratada con AEE | ERC-NDD (3a-5) con anemia y AEEn=5.413 | ERC-NDD (3a) con anemia y AEEn=1.408 | ERC-NDD (3b) con anemia y AEEn=1.897 | ERC-NDD (4) con anemia y AEEn=1.591 | ERC-NDD (5) con anemia y AEEn=517 | ERC-DD con anemia y AEEn=303 | ERC-DD con anemia en hemodiálisis y AEEn=202 | ERC-DD con anemia en diálisis peritoneal y AEEn=101 |
| Hemoglobina (g/dl), media (DE) | 11,6 (0,9) | 11,8 (1,0) | 11,6 (0,9) | 11,6 (0,9) | 11,3 (0,9) | 11,3 (0,8) | 11,5 (0,8) | 10,9 (0,7) |
| Ferritina (ng/ml), media (DE) | 190,6 (37,5) | 175,8 (30,0) | 182,8 (32,2) | 199,5 (34,7) | 237,1 (42,2) | 255,0 (43,4) | 257,8 (43,5) | 249,8 (42,9) |
| Saturación de transferrina (%), media (DE) | 22,0 (1,8) | 23,2 (1,6) | 22,2 (1,6) | 21,1 (1,5) | 20,1 (1,4) | 20,2 (1,5) | 20,2 (1,4) | 20,3 (1,6) |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; DE: desviación estándar; ERC: enfermedad renal crónica; ND: no en diálisis.
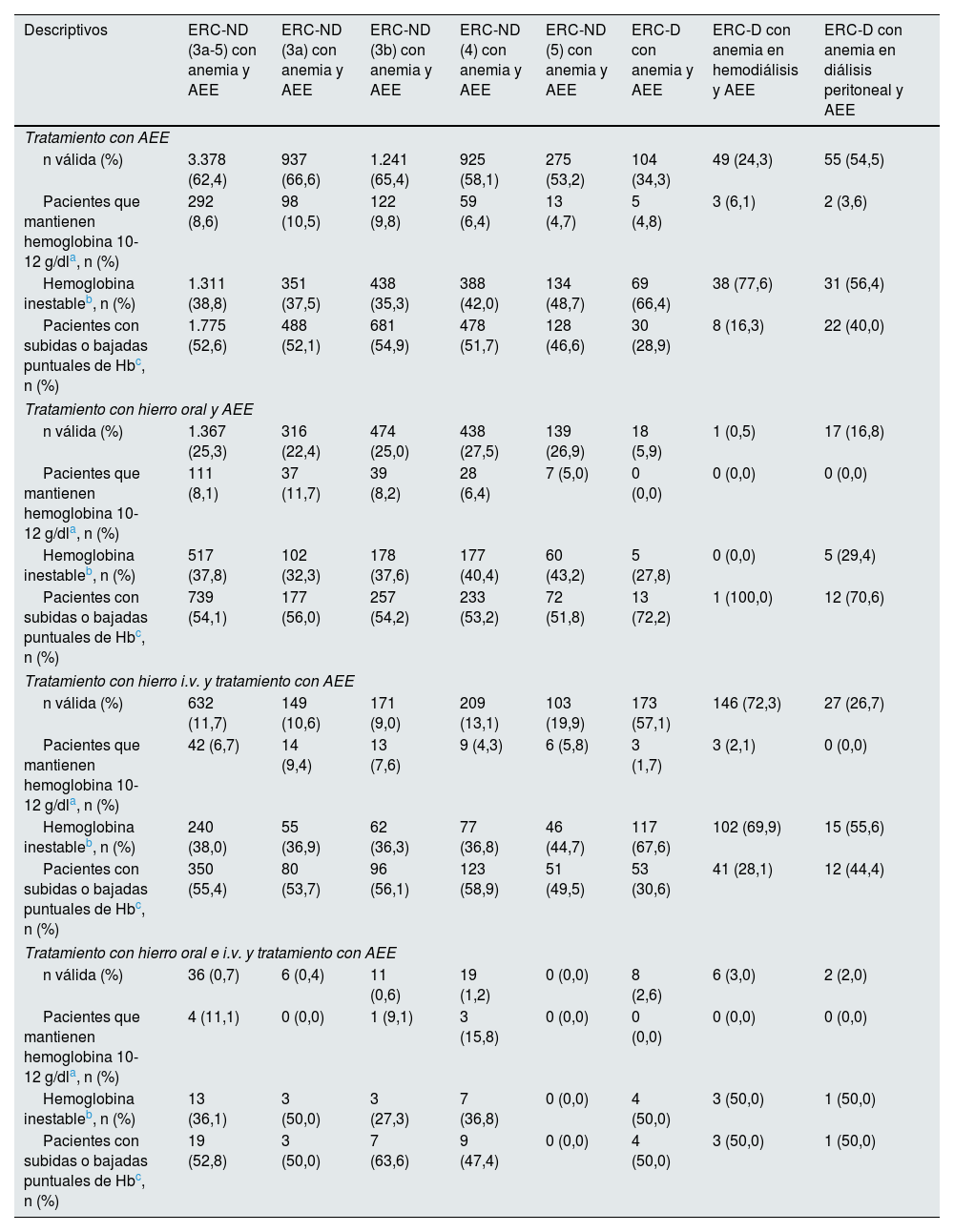
En esta sección se presentan los datos de pacientes anémicos tratados con AEE (solo o en combinación) respecto al mantenimiento de los niveles objetivo de hemoglobina. El detalle de estos pacientes según estadio y tratamiento concomitante se muestra en la tabla 7, donde se recogen los datos de pacientes estables(aquellos que mantenían los niveles de Hb en 10-12g/dl a lo largo del seguimiento), sujetos con Hb inestable (al menos un valor de Hb <10g/dl y al menos un valor >12g/dl durante los 12meses de seguimiento) y pacientes con subidas o bajadas puntuales (todos los valores de Hb <12g/dl y al menos un valor <10g/dl [bajada] o todos los valores >10g/dl y al menos un valor >12g/dl [subida]). Entre los pacientes con ERC-ND, aproximadamente el 10% mantuvieron siempre niveles objetivo de hemoglobina, existiendo variaciones en función del tratamiento (un 8,6% para AEE, un 8,1% para combinación de hierro oral y AEE, un 6,7% para hierro intravenoso y AEE, un 11,1% para combinación de hierro oral, intravenoso y AEE). En este mismo subgrupo, en torno al 50% mantuvieron la mayoría del tiempo niveles objetivo (pero con ascensos o descensos puntuales) y cerca del 40% tuvieron oscilaciones importantes en los niveles de Hb. Entre los pacientes con ERC-D menos del 5% mantuvieron los niveles objetivo (un 4,8% para tratamiento con AEE, un 0,0% para hierro oral y AEE, un 1,7% para hierro intravenoso y AEE, un 0,0% para la combinación hierro oral, intravenoso y AEE). Aproximadamente el 60% experimentaron oscilaciones tanto <10g/dl como >12g/dl.
Estabilidad de la Hb (intervalo 10-12g/dl) en pacientes estables tratados con AEE a lo largo del seguimiento, estratificados según tipo de tratamiento y estadio de la ERC
| Descriptivos | ERC-ND (3a-5) con anemia y AEE | ERC-ND (3a) con anemia y AEE | ERC-ND (3b) con anemia y AEE | ERC-ND (4) con anemia y AEE | ERC-ND (5) con anemia y AEE | ERC-D con anemia y AEE | ERC-D con anemia en hemodiálisis y AEE | ERC-D con anemia en diálisis peritoneal y AEE |
|---|---|---|---|---|---|---|---|---|
| Tratamiento con AEE | ||||||||
| n válida (%) | 3.378 (62,4) | 937 (66,6) | 1.241 (65,4) | 925 (58,1) | 275 (53,2) | 104 (34,3) | 49 (24,3) | 55 (54,5) |
| Pacientes que mantienen hemoglobina 10-12 g/dla, n (%) | 292 (8,6) | 98 (10,5) | 122 (9,8) | 59 (6,4) | 13 (4,7) | 5 (4,8) | 3 (6,1) | 2 (3,6) |
| Hemoglobina inestableb, n (%) | 1.311 (38,8) | 351 (37,5) | 438 (35,3) | 388 (42,0) | 134 (48,7) | 69 (66,4) | 38 (77,6) | 31 (56,4) |
| Pacientes con subidas o bajadas puntuales de Hbc, n (%) | 1.775 (52,6) | 488 (52,1) | 681 (54,9) | 478 (51,7) | 128 (46,6) | 30 (28,9) | 8 (16,3) | 22 (40,0) |
| Tratamiento con hierro oral y AEE | ||||||||
| n válida (%) | 1.367 (25,3) | 316 (22,4) | 474 (25,0) | 438 (27,5) | 139 (26,9) | 18 (5,9) | 1 (0,5) | 17 (16,8) |
| Pacientes que mantienen hemoglobina 10-12 g/dla, n (%) | 111 (8,1) | 37 (11,7) | 39 (8,2) | 28 (6,4) | 7 (5,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Hemoglobina inestableb, n (%) | 517 (37,8) | 102 (32,3) | 178 (37,6) | 177 (40,4) | 60 (43,2) | 5 (27,8) | 0 (0,0) | 5 (29,4) |
| Pacientes con subidas o bajadas puntuales de Hbc, n (%) | 739 (54,1) | 177 (56,0) | 257 (54,2) | 233 (53,2) | 72 (51,8) | 13 (72,2) | 1 (100,0) | 12 (70,6) |
| Tratamiento con hierro i.v. y tratamiento con AEE | ||||||||
| n válida (%) | 632 (11,7) | 149 (10,6) | 171 (9,0) | 209 (13,1) | 103 (19,9) | 173 (57,1) | 146 (72,3) | 27 (26,7) |
| Pacientes que mantienen hemoglobina 10-12 g/dla, n (%) | 42 (6,7) | 14 (9,4) | 13 (7,6) | 9 (4,3) | 6 (5,8) | 3 (1,7) | 3 (2,1) | 0 (0,0) |
| Hemoglobina inestableb, n (%) | 240 (38,0) | 55 (36,9) | 62 (36,3) | 77 (36,8) | 46 (44,7) | 117 (67,6) | 102 (69,9) | 15 (55,6) |
| Pacientes con subidas o bajadas puntuales de Hbc, n (%) | 350 (55,4) | 80 (53,7) | 96 (56,1) | 123 (58,9) | 51 (49,5) | 53 (30,6) | 41 (28,1) | 12 (44,4) |
| Tratamiento con hierro oral e i.v. y tratamiento con AEE | ||||||||
| n válida (%) | 36 (0,7) | 6 (0,4) | 11 (0,6) | 19 (1,2) | 0 (0,0) | 8 (2,6) | 6 (3,0) | 2 (2,0) |
| Pacientes que mantienen hemoglobina 10-12 g/dla, n (%) | 4 (11,1) | 0 (0,0) | 1 (9,1) | 3 (15,8) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Hemoglobina inestableb, n (%) | 13 (36,1) | 3 (50,0) | 3 (27,3) | 7 (36,8) | 0 (0,0) | 4 (50,0) | 3 (50,0) | 1 (50,0) |
| Pacientes con subidas o bajadas puntuales de Hbc, n (%) | 19 (52,8) | 3 (50,0) | 7 (63,6) | 9 (47,4) | 0 (0,0) | 4 (50,0) | 3 (50,0) | 1 (50,0) |
AEE: agentes estimuladores de la eritropoyesis; D: en diálisis; ERC: enfermedad renal crónica; i.v.: intravenoso; ND: no en diálisis.
Los datos detallados relativos a las transfusiones en pacientes con anemia asociada a la ERC se muestran en la tabla 4. Con independencia del tratamiento, el 9,1 y el 53,3% de los pacientes con ERC-ND y ERC-D recibieron al menos una transfusión. Se observó una alta frecuencia de transfusiones de sangre en los pacientes anémicos tanto en el grupo ERC-ND como en el ERC-D, aunque se desconoce si estas transfusiones se debieron a la anemia renal o a otras causas, como por ejemplo una cirugía o una hemorragia aguda. El porcentaje de pacientes que recibieron al menos una transfusión sanguínea aumentó según lo hacía la gravedad de la enfermedad, coincidiendo con un número creciente de hospitalizaciones conforme se agravaba la enfermedad renal, y especialmente en diálisis.
DiscusiónEn este estudio de base poblacional se analizó la prevalencia y la incidencia de anemia, así como su tratamiento, en la población española. En el estudio RIKAS la prevalencia de ERC-ND estadios3-5 fue algo inferior a los estudios anteriores, aunque similar en número y distribución a la del estudio EPIRCE12.
Existen estudios acerca de la prevalencia de la anemia en la ERC en España. Sin embargo, estos no son recientes o se centran solo en ciertos subgrupos de pacientes. Además, la definición de la anemia no es consistente entre los diferentes estudios, o no se especifica, y en su mayoría se analizan pacientes atendidos en consultas externas de Nefrología, a diferencia de este estudio de base poblacional. Así, en el estudio MICENAS, la prevalencia de anemia en pacientes ERC-ND estadios3-5 en Cataluña fue del 58,5%16. En general, según progresó la enfermedad, los niveles medios de hemoglobina disminuyeron y aumentó el uso de AEE. No obstante, no hubo cambios en la prescripción de ferroterapia en función del estadio. En este estudio, en más de la mitad de los pacientes se pudo corregir la anemia con suplementación férrica unida a dosis moderadas de AEE. En el estudio observacional multicéntrico MERENA, de pacientes con ERC-ND en estadios3 y 4, presentaban anemia el 43,7 y el 58,1%, respectivamente14, de los cuales recibían tratamiento con AEE el 16 y el 34,1% de los pacientes, respectivamente. Guerrero et al.17 realizaron un estudio prospectivo en un centro de Huesca, obteniendo una prevalencia de anemia entre 288 pacientes mayores de 90años del 35,7% en estadios3a-5. Los resultados relativos a la prevalencia de anemia en pacientes ERC en nuestro estudio fueron consistentes con los estudios previos en España, aunque su prevalencia fue algo inferior. En este contexto, es importante destacar la base poblacional de nuestro estudio. En el ámbito internacional, esta prevalencia fue superior a la encontrada en el estudio de Stauffer y Fan21, de carácter poblacional, basado en datos del National Health and Nutrition Examination Survey (NHANES) de Estados Unidos, y parecida a la de los datos del registro sueco de enfermos renales recientemente publicado22. En general, la prevalencia aumentó con el estadio en pacientes ERC-ND, como en estudios previos. La anemia fue más prevalente entre los hombres que en las mujeres, coincidiendo con los estudios anteriores. Los datos demográficos de la población del estudio RIKAS son también coherentes con análisis previos. Además, las comorbilidades más comunes fueron la hipertensión, la dislipidemia, la diabetes mellitus y las enfermedades cardiovasculares.
Respecto a los datos de incidencia de anemia renal en España, en la literatura solo se encuentra el estudio NADIR, que evaluó la misma en pacientes con ERC-ND en estadio3 en un análisis prospectivo a 3años13,15. Durante el primer año del estudio, hasta al 12,4% de los sujetos se les diagnosticó anemia. A lo largo del seguimiento de 3años, la mitad progresaron a estadios4-5, y alrededor del 35% fueron diagnosticados de anemia (mayoritariamente de origen renal). Se detectó una asociación significativa entre la aparición de anemia y los niveles basales de hemoglobina, FGe y el sexo de los pacientes. Adicionalmente, el desarrollo de anemia se relacionó con una progresión más rápida de la enfermedad y un riesgo mayor de presentar un evento cardiovascular. Estos valores de incidencia son ligeramente superiores a los encontrados en nuestro estudio para dicho subgrupo (∼7 a 10%). Sin embargo, en nuestro estudio se analizó la incidencia de la anemia y tratamiento con AEE en todos los grupos de ERC-ND (3a-5) y ERC-D, y se trata de un estudio de base poblacional y no de pacientes seguidos en consultas externas de Nefrología. Hasta el ∼8% y el ∼61% de la población ERC-ND y ERC-D iniciaron el tratamiento con AEE durante el periodo del estudio.
Un hallazgo interesante de este estudio fue que los pacientes anémicos con ERC-ND presentaron una mayor prevalencia de inflamación que aquellos sin anemia (∼18% vs. ∼10%). Entre ellos, los pacientes tratados con AEE fueron la cohorte con mayor prevalencia de inflamación (∼29%). Aunque ello pudiera deberse, en parte, a una peor función renal en los pacientes anémicos (tratados o no con AEE), pues la prevalencia de anemia y tratamiento con AEE aumentaba con los estadios más avanzados de la enfermedad. Por otro lado, en el subgrupo de pacientes con ERC-D, todos los subgrupos presentaron una alta prevalencia de inflamación (aproximadamente un 50%). Estos datos son inferiores al estudio sueco para el subgrupo de ERC-ND, pero similares para el grupo de ERC-D22. La inflamación se ha asociado con una hiporrespuesta a AEE y la consiguiente necesidad de mayores dosis22,23.
Respecto al tratamiento, las guías KDIGO recomiendan la suplementación con hierro si el IST es <30% y la ferritina sérica <500ng/ml24. Por otro lado, la guía de la European Renal Best Practice (ERBP) recomienda suplementar si existe déficit absoluto de hierro (IST<20% y ferritina <100ng/ml en ERC-ND)25. Existe también la recomendación de comenzar el tratamiento si se quiere aumentar los niveles de Hb sin AEE y los niveles de ferritina <200μg/l (ferritina <300μg/l en diálisis) e IST <25% o reducir las dosis de AEE si la ferritina <300μg/l e IST <30%26,27. En nuestro estudio los valores medios de ferritina e IST fueron inferiores a lo recomendado en las guías, sugiriendo una infrautilización de la ferroterapia en esta población anémica con ERC tanto en no diálisis como en diálisis. En consecuencia, existe una oportunidad de mejora para optimizar el manejo de la anemia renal.
Con el fin de tratar la anemia, recibían hierro el 81,7% de pacientes con ERC-ND (oral 69,2% e intravenoso el 12,5%) y el 90,3% de pacientes con ERC-D (oral 11,4% e intravenoso el 68,9%) y AEE el 10,7% de ERC-ND y el 62,9% de ERC-D. Cabe comentar que se desconoce si los pacientes podrían haber recibido hierro intravenoso por otras causas distintas a la anemia renal, como por ejemplo por insuficiencia cardiaca. No obstante, el dato que se recogió fue el uso de hierro intravenoso en pacientes con anemia asociada a la ERC, por lo que parece razonable que se haya utilizado para la corrección de anemia mayoritariamente. Como en los estudios anteriores, los pacientes con ERC-ND recibían mayoritariamente hierro oral, como aconsejan las guías ERBP o del National Institute for Health and Care Excellence (NICE)25,28. Sin embargo, no se dispone de datos de dosis o de cumplimiento terapéutico, pero analizando los niveles medios alcanzados de ferritina e IST, probablemente los pacientes se beneficiarían de un mayor uso de la ferroterapia intravenosa, a pesar de su mayor uso en estadios4 y 5. La ferroterapia se prescribió de forma similar en todos los estadios de ERC-ND, en consonancia con lo observado en estudios previos16,22. Varios estudios clínicos y un metaanálisis en pacientes con ERC-ND han demostrado que la ferroterapia intravenosa es segura, y más eficaz y rápida que la oral, para conseguir aumentar los niveles de Hb y reducir las dosis de AEE29. En pacientes en diálisis, especialmente en HD, la mayoría recibieron hierro intravenoso, como aconsejan las guías.
El uso de AEE aumentó con la gravedad de la enfermedad, así como los requerimientos de dosis más altas, como puede verse en la figura 1. El IRE fue inferior en pacientes ERC-ND, y tendía a aumentar con la severidad de la enfermedad, siendo superior en los pacientes en hemodiálisis (tabla 5). Estos datos son similares a los obtenidos en el estudio sueco de Evans et al.22.
La variabilidad de la hemoglobina es frecuente en esta población, especialmente en aquellos tratados con AEE, y en algunos estudios, aunque no en todos, se ha asociado con una peor calidad de vida, un aumento de las hospitalizaciones, de las morbilidades y de la mortalidad3. En este estudio, una minoría de los pacientes anémicos con ERC consiguieron mantener los niveles objetivo en el rango 10-12g/dl durante el seguimiento. Entre los diferentes subgrupos, los pacientes en HD fueron los que presentaron mayores tasas de variabilidad, hecho que coincide con un estudio retrospectivo español en pacientes en diálisis30.
Por otro lado, la necesidad de transfusiones fue relativamente elevada en nuestro estudio (especialmente en ERC-D), a pesar de que las guías recomiendan un uso restrictivo de las transfusiones24. Aunque se desconocen las razones, presumiblemente los pacientes podrían haber recibido transfusiones por causas ajenas a la anemia asociada a la ERC. En este sentido se observó una mayor tasa de hospitalizaciones según la severidad de la disfunción renal y mayor en pacientes en diálisis. En general, cuantos más eventos agudos que requieran hospitalización, mayor es el riesgo de transfusiones. En este contexto, cabe recordar que deben evitarse las transfusiones por los riesgos intrínsecos, y especialmente en pacientes candidatos a recibir un trasplante renal.
La ausencia de aleatorización es una limitación intrínseca al diseño, pues se produce un sesgo de selección en los estudios observacionales, y por otra parte impide la demostración de una relación causal. Además, el tratamiento se evaluó en función de las prescripciones, sin información disponible acerca de la adherencia. Los pacientes podrían estar participando en un ensayo clínico y, por tanto, el patrón de tratamiento no sería un fiel reflejo de las pautas normales, aunque no se espera que influya significativamente en los resultados. Por añadidura, las áreas geográficas de España en la base de datos no son distinguibles. En el ámbito de las transfusiones, estas son altas en los pacientes ERC-ND estadio5 y ERC-D; sin embargo, la base de datos no recoge el motivo de las transfusiones, que podría no estar directamente relacionado con la ERC.
Entre las fortalezas del estudio se encuentra la amplia muestra utilizada, que es representativa de la población española. Adicionalmente, se han empleado datos actuales para calcular la prevalencia y la incidencia, en un escenario en el que las publicaciones no capturaban la realidad de la patología. Otro punto relevante es que se ha analizado la anemia asociada a ERC-ND (3a-5) y ERC-D en lugar de centrarse en un único subgrupo de pacientes, proporcionando por tanto una visión global de la enfermedad y su progresión. Cabe añadir la importancia de reflejar también los tratamientos que están siguiendo los pacientes en la actualidad, lo que permite analizar la práctica clínica real en España.
ConclusionesEl estudio RIKAS proporciona una evaluación epidemiológica reciente de la anemia en la ERC-ND (estadios 3a-5) y ERC-D (HD, DP) en España durante el periodo 2015-2017. La prevalencia de la anemia y la de la inflamación varían en función de la gravedad de la enfermedad. Finalmente, si bien los pacientes anémicos reciben ferroterapia oral o intravenosa, asociada o no a AEE, a largo plazo estos tratamientos resultan insuficientes para alcanzar los valores óptimos de parámetros férricos recomendados por las guías. En consecuencia, existe un amplio margen de mejora para optimizar el tratamiento en pacientes con anemia asociada a la ERC.
Consideraciones éticasEste estudio contó con la aprobación del Comité de ética de investigación con medicamentos del Consorci Sanitari de Terrassa.
FinanciaciónEste estudio fue patrocinado por Astellas Pharma Inc. El apoyo de redacción médica fue proporcionado por Sonia Romero Pérez, PhD, de Meisys-Mediación Científica S.L., financiado por Astellas Pharma S.A. Se obtuvo el permiso para este agradecimiento y ha sido incluido en la versión final del manuscrito.
Conflicto de interesesAleix Cases declara haber recibido una beca, honorarios por consultoría y ponencias de Vifor Pharma, honorarios por charlas y consultoría de Astellas, AstraZeneca y Novo Nordisk; honorarios por consultoría de GSK y Otsuka y honorarios por charlas de Amgen y Bayer. Elena González de Antona Sánchez y Giovanna Cadeddu son empleadas de Astellas Pharma S.A. Maria Mata Lorenzo es una empleada de Astellas Pharma Europe Ltd.
Al programa CERCA de la Generalitat de Catalunya.
Materiales suplementarios: 1) Perfil de tratamiento durante los 12 meses de seguimiento en pacientes con anemia bajo tratamiento con AEE; 2) Tipo de tratamiento con agentes estimuladores de eritropoyesis en pacientes anémicos durante el seguimiento; 3) Dosis media de agentes estimuladores de eritropoyesis en pacientes anémicos