Los microRNA (miRNA) son ARN endógenos de pequeño tamaño que regulan la expresión génica a través de la represión postranscripcional de sus ARN mensajeros diana. El estudio de los cambios en la expresión de ciertos miRNA en el riñón ha proporcionado evidencias sobre su papel patogénico y potencial terapéutico en nefrología. En esta revisión proponemos un abordaje de nanotecnología basado en la unión de análogos o inhibidores de miRNA formados por ácidos peptidonucleicos (PNA) a péptidos con una estructura transmembrana que es sensible a pH bajo, denominada pHLIP (del inglés pH [low] insertion peptide), apoyándonos en el concepto de que el pH acídico del microambiente tubular renal puede facilitar la concentración y la distribución del complejo pHLIP-PNA en este órgano. En este contexto hemos demostrado por primera vez que la administración dirigida de inhibidores de miR-33 con el sistema pHLIP previene eficazmente del desarrollo de fibrosis renal, abriendo las puertas de esta tecnología a nuevas estrategias de diagnóstico y tratamiento de enfermedades renales.
MicroRNAs (miRNAs) are small endogenous RNAs that regulate gene expression through post-transcriptional repression of their target messenger RNAs. A study of changes in expression of certain miRNAs in the kidney has supplied evidence on their pathogenic role and therapeutic potential in nephrology. This review proposes a nanotechnology approach based on the binding of analogs or inhibitors of miRNAs formed by peptide nucleic acids (PNAs) to peptides with a transmembrane structure sensitive to a low pH, called pHLIPs (pH [low] insertion peptides). The review draws on the concept that an acidic pH in the microenvironment of the renal tubule may facilitate concentration and distribution of the pHLIP-PNA complex in this organ. In this context, we have demonstrated for the first time that targeted administration of miR-33 inhibitors with the pHLIP system effectively prevents the development of renal fibrosis, thus opening up this technology to new strategies for diagnosis and treatment of kidney diseases.
- •
Los pHLIP son péptidos cortos, sensibles a pH, capaz de insertarse en la membrana plasmática en ambientes extracelulares acídicos, permitiendo liberar en el interior celular moléculas unidas a su extremo C-terminal.
- •
Los PNA son los análogos estructurales estables de ribonucleótidos más empleados en el uso de los ARN no codificantes como herramientas terapéuticas.
- •
Desarrollado con finalidad antitumoral, el anclaje de PNA al sistema pHLIP surge como una nueva tecnología para el transporte y distribución específica de antagomiRNA en tejido renal.
Los microRNA (miRNA) son una familia de pequeños ARN no codificantes de 20-25 nucleótidos de longitud que reprimen la traducción y/o inducen la degradación de sus ARN mensajeros (ARNm) diana mediante su unión a secuencias complementarias en la región3’ UTR1. En 1993 se describió el primer miRNA, Lin-4, procedente de Caenorhabditis elegans, y no fue hasta el año 2000 cuando se descubrió el primer miRNA procedente de mamífero, let-7. En la actualidad se han llegado a describir más de 1.982 miRNA en todo el genoma humano. La habilidad de un único miRNA de regular cientos de ARNm les confiere la capacidad de modular la expresión de más del 60% de los genes codificantes de proteínas (mirbase), interviniendo en una gran variedad de procesos celulares y fisiológicos, como ciclo celular, proliferación, apoptosis y metabolismo2.
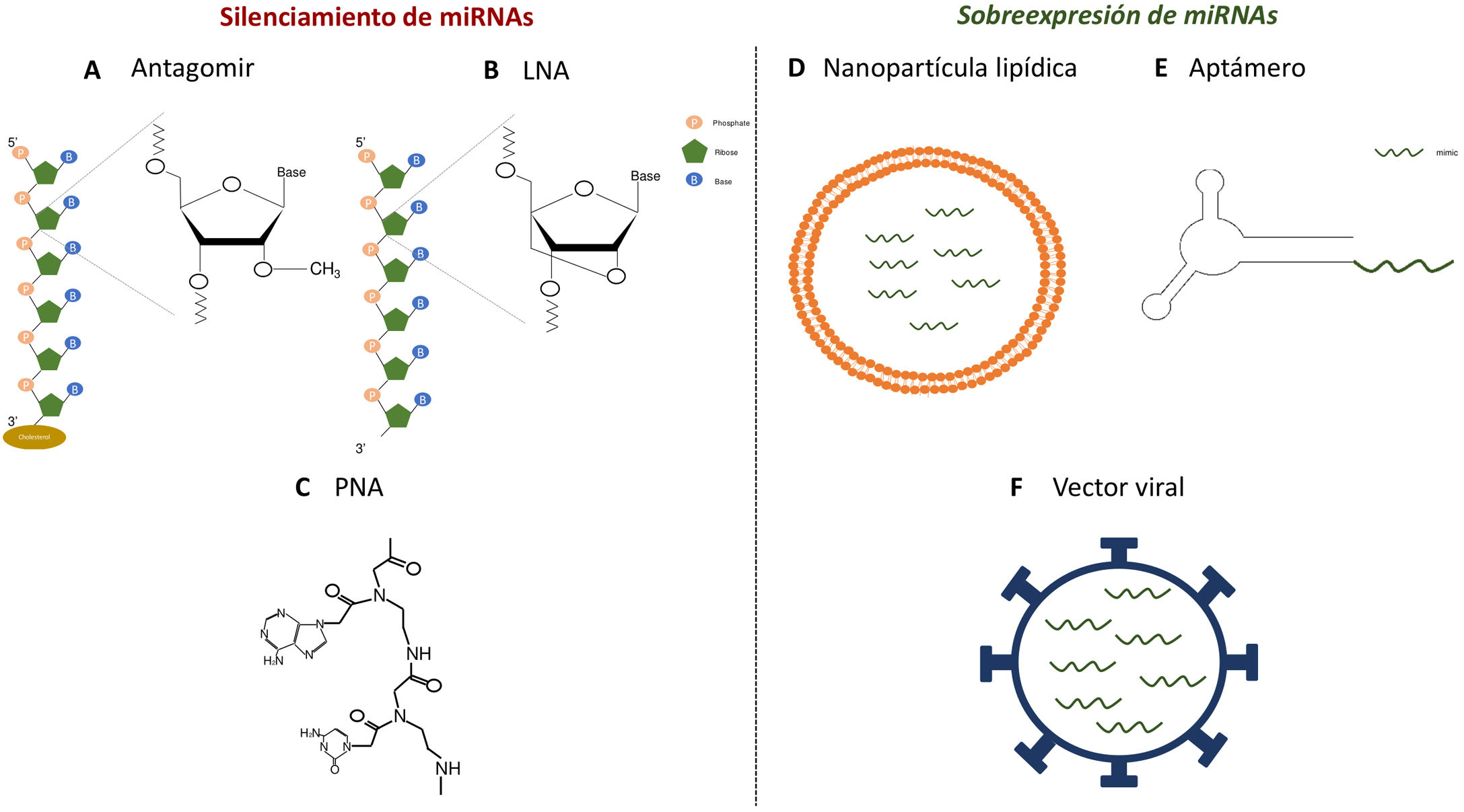
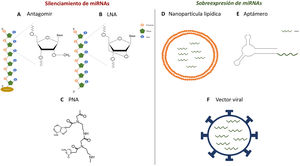
Diversos estudios funcionales realizados durante las dos últimas décadas han demostrado que las alteraciones en la expresión de miRNA pueden estar implicadas en el desarrollo de patologías como enfermedades metabólicas, fibrosis y cáncer3. Por ello, resulta de interés el desarrollo de estrategias que permitan utilizar los miRNA como dianas terapéuticas o biomarcadores, ya que pueden ser secretados a los fluidos corporales. La manipulación de sus niveles es uno de los aspectos más candentes en la investigación biomédica actual. Las estrategias más utilizadas para ello son el uso de agonistas (mimics), miRNA sintéticos de doble cadena con modificaciones químicas que favorecen su estabilidad y la captación celular para fines de sobreexpresión, así como el uso de antagomiR (anti-miR), consistentes en oligonucleótidos (secuencias cortas de nucleótidos) modificados que se unen al miRNA específico inhibiéndolo4. En estudios iniciales, en los que se intentó la administración de estas moléculas de forma sistémica o local, se observó que estas eran degradadas en el torrente sanguíneo, obteniendo una baja distribución en los distintos tejidos5. Por ello se han desarrollado diversas estrategias para mejorar la estabilidad de miRNA sintéticos e inhibidores y facilitar su transporte a las células empleando diferentes vectores, principalmente de tipo vírico, liposómico o basado en nanopartículas4. El empleo de oligonucleótidos modificados químicamente es una de estas estrategias. Así, los antagomiR, moléculas diseñadas para el silenciamiento de miRNA, son oligonucleótidos sintéticos que poseen un grupo esterol (colesterol) que permite su entrada en las células y metilaciones del grupo 2’-hidroxilo de las ribosas. Esta modificación química se encuentra comúnmente en ARN de pequeño tamaño en plantas y presenta un efecto protector frente a la degradación6. Krutzfeldt et al.7 consiguieron la inhibición completa de mir-122 en el hígado tras tres administraciones intravenosas de un antagomiR. Otras moléculas sintéticas empleadas son los locked-nucleic-acid-modified oligonucleotides (LNA), moléculas sintéticas formadas por nucleótidos de ARN modificado con un puente extra que conecta el oxígeno 2’ de la ribosa con el carbono 4’, y los ácidos peptidonucleicos (peptide nucleic acids [PNA]), polímeros sintéticos a los que se le ha sustituido los monosacáridos propios de los ácidos nucleicos por una estructura pseudopeptídica. Estas moléculas presentan una alta afinidad al miRNA diana, así como una alta estabilidad y distribución en ratón en gran variedad de tejidos. Sin embargo, carecen de la capacidad de traspasar la barrera hematoencefálica y no poseen especificidad de tejido (fig. 1)8,9. A diferencia de los inhibidores de miRNA, las modificaciones químicas no son susceptibles de ser aplicadas en oligonucleótidos agonistas de miRNA, ya que podrían modificar el perfil de sus genes diana10. Por ello, las estrategias más empleadas para la dispensación de miRNA miméticos involucran el uso de nanopartículas lipídicas, vectores virales o aptámeros, siendo estos últimos oligonucleótidos de cadena simple que pueden interaccionar con receptores presentes en la superficie de las células, permitiendo la entrada del miRNA mimic al que va anclado11,12. Estas estrategias presentan una alta estabilidad, pero la distribución a los tejidos es limitada, siendo los pulmones, el hígado, las células endoteliales y diversos tumores los que presentan un mayor grado de expresión de los miRNA mimics suministrados.
Estrategias para la administración de antagonistas o agonistas de miRNA in vivo. A-C)Estructura química de los análogos de ácidos nucleicos: antagomiR (A), LNA (B) y PNA (C), empleados como estrategias de silenciamiento de miRNA in vivo. D-F)Modelos esquemáticos de nanopartículas lipídicas (D), aptámeros (E) y vectores virales (F) para la dispensación de miméticos in vivo.
En el riñón, la expresión alterada de diversos miRNA se ha relacionado con el desarrollo de diversas patologías. Ejemplo de ello son miR-214 y miR-21, cuya expresión aumenta en modelos de daño renal13,14. Por el contrario, una disminución de la expresión de miR-17 y miR-200 se relaciona con la enfermedad renal poliquística15,16, mientras que la expresión de miR-29 es suprimida por TGF-β17, promoviendo el desarrollo de fibrosis renal. En trabajos recientes se inhibió la expresión de miRNA en riñones de ratones con nefropatía diabética mediante la administración sistémica de antagomirs o LNA18-20. En el caso de miR-21, un miRNA implicado en la fibrogénesis de diferentes órganos, se están estudiando en fase clínicaII inhibidores terapéuticos de miR-21 basados en oligonucleótidos modificados químicamente para el tratamiento de la enfermedad de Alport21. Asimismo, en otros estudios se restauraron los niveles de microRNA en el riñón. Se consiguió incrementar la expresión renal de miR-9-5p en modelos de ratón mediante la dispensación retroorbital de vectores virales y de miR-146a mediante nanopartículas22,23. Sin embargo, la principal limitación de las estrategias empleadas fue la baja distribución de los oligonucleótidos en el tejido renal. Además, debido a que los miRNA regulan cientos de ARNm involucrados en gran variedad de procesos presentes en diferentes tipos celulares y tisulares, la administración sistémica, no específica de tejido, de un miRNA o un antagomiR podría tener importantes efectos secundarios no deseados5. Por ello, resulta de gran interés el desarrollo de estrategias que permitan el incremento de la distribución de antagomiR o miRNA miméticos de forma específica en el riñón que posibilite nuevas vías de tratamiento en patología renal.
Síntesis y aplicaciones de los PNALos PNA son compuestos de origen sintético que contienen una secuencia de nucleobases fijada sobre una cadena de poli-N-(2-aminoetil)glicina24. La complementariedad de las bases del PNA con aquellas de un ADN o ARN permite la formación de dímeros estables, con amplias aplicaciones en la regulación de la funcionalidad de los ácidos nucleicos (expresión génica, terapias antisentido) o como herramientas de diagnóstico (detección de ácidos nucleicos)25.
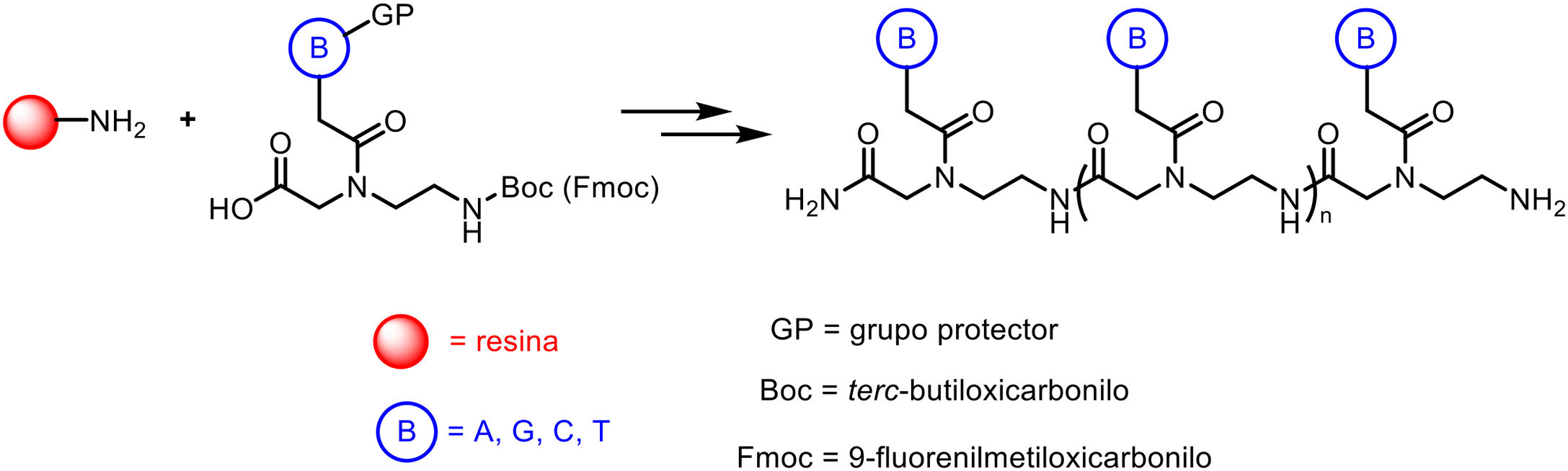
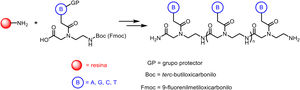
La preparación de PNA se lleva a cabo habitualmente por medio de técnicas de síntesis en fase sólida a través de la formación de enlaces peptídicos, de manera análoga a los péptidos convencionales e incluso a través de procedimientos automatizados. Los monómeros requeridos para la síntesis están disponibles comercialmente, conteniendo cada una de las cuatro bases canónicas y grupos protectores apropiados como terc-butiloxicarbonilo (Boc) o 9-fluorenilmetiloxicarbonilo (Fmoc). Estos grupos protectores de aminas presentes en el extremo N-terminal y en la cadena lateral de los monómeros de PNA son necesarios para la síntesis en fase sólida de sus polímeros, basada en la incorporación de monómeros de PNA al extremo N-terminal del polímero naciente anclado a un soporte, a través de ciclos de reacciones alternas de desprotección y acoplamiento. Así mismo, estos grupos protectores son necesarios para evitar reacciones secundarias no deseadas con las diversas cadenas laterales de aminoácidos. El sistema de protección N-terminal Boc se elimina con ácido trifluoroacético (TFA), formando un grupo amino cargado positivamente, que se neutraliza y acopla al aminoácido activado entrante. La eliminación final del péptido del soporte sólido se produce simultáneamente a la desprotección de la cadena lateral usando fluoruro de hidrógeno anhidro. Este es el enfoque elegido para sintetizar péptidos que contienen restos sensibles a las bases, ya que en el caso del sistema Fmoc la desprotección utiliza una base, típicamente 20-50% de piperidina en N,N-dimetilformamida, mientras que la escisión ácida final se produce en condiciones ácidas más suaves (TFA).
La adecuada elección de resinas, espaciadores (linkers) y disolventes, así como el empleo de técnicas como la irradiación por microondas, permiten el acceso a cadenas de PNA que contienen 15-20 monómeros, por lo general con buenos rendimientos y elevadas purezas (fig. 2).
La principal ventaja de las cadenas de PNA en comparación con los correspondientes oligonucleótidos es su elevada estabilidad metabólica frente a la acción tanto de las nucleasas como de las proteasas. Sin embargo, los PNA exhiben una pobre permeabilidad debido a su carácter esencialmente lipófilo, a lo que también contribuye su flexibilidad conformacional. Para solventar esta limitación se han descrito distintas modificaciones en la estructura de los PNA, tanto en la cadena polipeptídica (introducción de sustituyentes adicionales y/o elementos de quiralidad) como en las propias bases nitrogenadas, con el propósito de disminuir la movilidad conformacional y a su vez mejorar la afinidad en la formación de estructuras híbridas con ARN o ADN. Recientemente se ha propuesto también la introducción selectiva de aminoácidos intercalados en un esqueleto de PNA, de manera que la información que codifican sea utilizada como potencial elemento de autoensamblaje estructural. De esta forma, la incorporación de cadenas hidrofóbicas o hidrofílicas de aminoácidos permitiría modular la estructura secundaria del esqueleto de PNA y la formación de agregados anfipáticos micelares, controlando la solubilidad y la permeabilidad celular de estas cadenas de PNA. Así mismo, la unión específica de moléculas de ADN o ARN con secuencia complementaria a la codificada por las cadenas de PNA podría permitir un desensamblaje controlado de estas estructuras26.
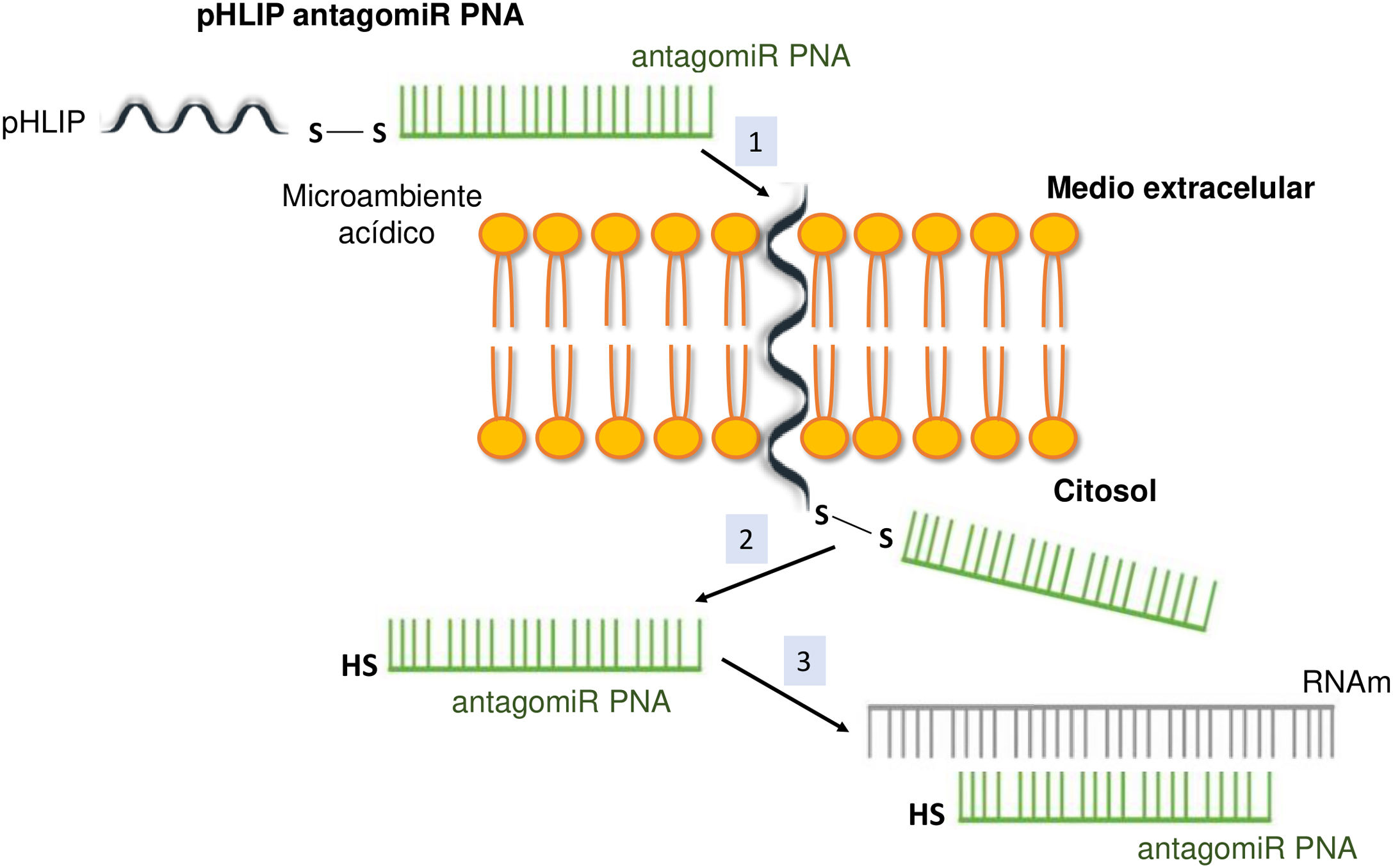
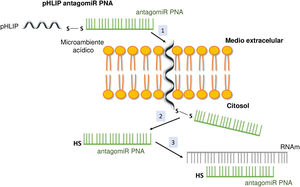
Sistema de pH (low) insertion peptide (pHLIP)Hasta la fecha, la manera más eficaz de lograr una buena permeabilidad celular en un PNA implica la formación de conjugados. En este contexto, determinados compuestos peptídicos denominados péptidos de penetración celular (CPP) presentan la capacidad de atravesar las membranas celulares utilizando procesos como la translocación directa o la endocitosis, y han sido utilizados con éxito en el transporte de PNA27. Otras posibilidades estudiadas han sido los complejos de PNA con liposomas o su vehiculización soportados sobre óxido de grafeno28. Los CPP son péptidos de 6-30 aminoácidos, mayoritariamente de carga positiva y naturaleza anfipática, que permiten la internalización celular de macromoléculas, polipéptidos y oligonucleótidos con alta eficacia y baja toxicidad. Algunos CPP derivan de biomoléculas naturales (p.ej., Tat, derivada de una proteína del VIH-1), mientras que otros (p.ej., poliarginina) se obtienen por métodos sintéticos. Las uniones entre los CPP y las moléculas transportadas pueden ser de naturaleza covalente (conjugación con sulfato de sulfosuccinimidilo, carbodiimida y tiol-amina) o no covalente (interacciones biotina-estreptavidina, electrostáticas y de afinidad con metales)29. Directamente relacionada con los CPP está la nanotecnología basada en péptidos con una estructura transmembrana que es sensible a pH ácido, denominada pHLIP (del inglés pH [low] insertion peptide). Estos contienen una secuencia de 35-40 aminoácidos, y no suelen presentar estructura secundaria definida en medio neutro o ligeramente básico. A un pH más ácido, los residuos del pHLIP protonables y los cargados negativamente se vuelven neutros, aumentando la hidrofobicidad global del pHLIP y, como consecuencia, su afinidad por la membrana plasmática. Además, la presencia de residuos hidrofóbicos en la región central de secuencia posibilita que a este pH se forme una estructura helicoidal que es capaz de intercalarse en la membrana celular de manera unidireccional. Por tanto, la conjugación de determinadas moléculas, entre las que se encuentran los antagomiR, al extremo C-terminal en un residuo de cisteína o lisina de estos péptidos, mediante un puente disulfuro (estable fuera de la célula, pero lábil en el citoplasma debido al ambiente reductor), permite su transporte selectivo a través de membranas celulares de manera no endocítica, en función de pequeños cambios en la acidez extracelular. La cinética de inserción en la membrana puede modularse por la secuencia de aminoácidos del péptido. Tras la liberación de la molécula, al exponerse el residuo del extremo C-terminal del pHLIP al pH normal de la célula, este se desprotona, provocando el desanclaje del péptido de la membrana (fig. 3)30.
El sistema de pHLIP fue desarrollado con finalidad antitumoral explorando la propiedad del entorno acídico de ciertos tumores para liberar en el interior celular moléculas de PNA31. En este trabajo se describe cómo se consiguió un transporte dirigido eficaz de anti-miR-155 hacia un tumor linfático murino, constituyendo un hito importante en la terapia antitumoral basada en miRNA. Además, se ha observado una acumulación elevada de este complejo en tejidos con inflamación y en el riñón en la misma magnitud que en los tumores. Este último presenta una tasa alta de catabolismo para proteínas de bajo peso molecular y ciertas regiones acídicas en el intersticio tubular cortical32,33. Por otra parte, la homeostasis ácido-base en mamíferos superiores exige la formación de una orina ácida (pH∼5). Ello se logra a través de la reabsorción del bicarbonato en el túbulo proximal y la secreción de protones (H+) a lo largo de la nefrona, en particular en las regiones del túbulo proximal y distal y el túbulo colector, mediante el concurso de transportadores e intercambiadores con especificidad celular. Ello da lugar a un fluido tubular acídico y a un tejido circundante túbulo-intersticial acídico en algunas regiones del riñón34. La presumible ventaja biológica proporcionada por el microambiente acídico de determinadas estructuras renales nos llevó a proponer un abordaje de nanotecnología basado en la unión de antagomiR a péptidos pHLIP para vehiculizarlos de manera selectiva al tejido renal en el tratamiento de la enfermedad renal crónica (ERC). De este modo, se reduciría la eliminación de estas moléculas por vía hepática, facilitando su entrada en las células mediante una ruta no endocítica o mediada por receptores. Además, tanto el hecho de que la inflamación crónica está íntimamente relacionada con el desarrollo y posterior progresión de la fibrosis renal, como los cambios metabólicos asociados que sufren los fibroblastos renales por los que pasan de obtener energía por la vía de oxidación de los ácidos grasos a hacerlo mediante un proceso glicolítico, conferiría una ventaja añadida al uso del sistema pHLIP35-37.
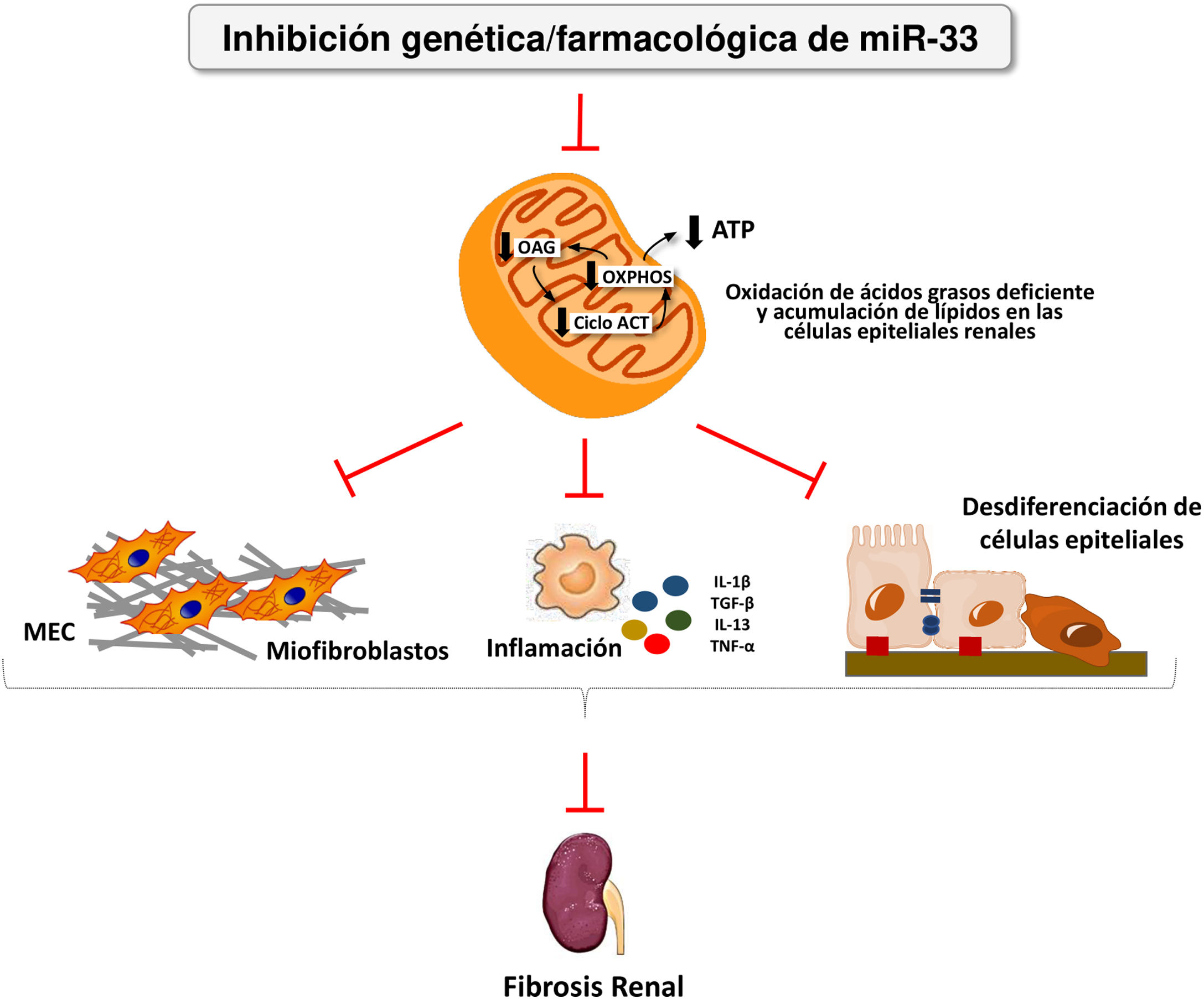
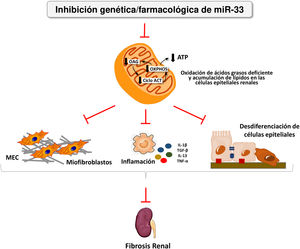
Nosotros hemos aplicado por primera vez el sistema de pHLIP para la administración dirigida al riñón de inhibidores de miR-33 con el fin de determinar si la inhibición de este microRNA, clave en el metabolismo lipídico, podría ser una estrategia terapéutica eficaz para prevenir el daño renal38. En este trabajo demostramos la acumulación renal y la captación de las construcciones de pHLIP fluorescentes en células tubulares primarias, induciendo la expresión de genes diana de miR-33 implicados en la oxidación de ácidos grasos. De manera similar a lo observado en animales miR-33-/-, el tratamiento con construcciones de anti-miR-33pHLIP previno la inducción de genes implicados tanto en la fibrosis como en la inflamación en el riñón después del tratamiento en los modelos de obstrucción unilateral del uréter y de nefropatía inducida por ácido fólico, así como el deterioro de la función renal. Esta prueba de concepto apoya el desarrollo de estrategias terapéuticas encaminadas a reducir el potencial papel pro-fibrogénico de los miRNA en la enfermedad renal (fig. 4).
miR-33 como nuevo regulador del metabolismo lipídico durante la fibrosis renal. La pérdida de miR-33 mejora la oxidación de ácidos grasos, previene la desdiferenciación de las células renales epiteliales y la acumulación de matriz extracelular, atenuando la fibrosis renal.
ATP: adenosín trifosfato; Ciclo ACT: ciclo de los ácidos tricarboxílicos; MEC: matriz extracelular; OAG: oxidación de ácidos grasos; OXPHOS: fosforilación oxidativa.
Los PNA son los análogos estructurales estables de ribonucleótidos más empleados en el uso de los ARN no codificantes como herramientas terapéuticas24,39. La vehiculización de moléculas de PNA con el sistema pHLIP in vivo podría representar un método eficiente y seguro, superando las principales limitaciones de las estrategias de regulación génica basadas en el uso de los miRNA, como son la especificidad de órgano y la biodisponibilidad de los productos administrados31. Se ha estudiado que el sistema pHLIP dispensa eficazmente PNA de hasta −7kDa de manera dependiente de pH, reduciéndose esta limitación con moléculas más hidrofóbicas40. Su acumulación en el riñón lo sitúa como una herramienta terapéutica potente y novedosa para la prevención o el tratamiento de múltiples patologías relacionadas con este órgano38. Sin embargo, deben señalarse algunas limitaciones. En estudios con animales se ha observado que la modificación del pH del agua de bebida regula la presencia del péptido en el riñón. De esta forma, la administración de bicarbonato reduce su acumulación en este órgano, lo que limitaría la modulación por pH en esta localización32,41. Además, el hecho de que este péptido esté formado por D-aminoácidos en vez de L-aminoácidos hace que presente la misma afinidad por la bicapa lipídica pero reduce su presencia en el riñón, posiblemente debido a su mayor estabilidad en la sangre32. Así mismo, un estudio reciente sugiere que un tamaño mayor de las construcciones reduce su penetración a través de la barrera de filtración glomerular. Una menor velocidad en la cinética de inserción en la membrana también reduce la probabilidad de que se concentren en el tejido renal y se excreten por la orina40.
Si bien esta metodología ha sido optimizada para antagomiR, no se ha descrito ningún obstáculo a priori para desarrollar su uso con miRNA, ya que la distribución del complejo PNA mediante pHLIP no parece afectarse por la secuencia nucleotídica. Además, este sistema presenta una serie de propiedades que le otorgan versatilidad. Permite el anclaje a moléculas fluorescentes con el fin de monitorizar la distribución del péptido42, mientras que la variación de su secuencia permite el ajuste de sus propiedades farmacocinéticas y sus células diana. La translocación del péptido es rápida (segundos a minutos) y dependiente del pH y de la concentración, la cual se reduce con el empleo de estos estos conjugados en comparación con el uso de antagomiR de manera libre7,43. En los estudios realizados se han empleado una administración intravenosa de las construcciones anti-miR-33pHLIP a una concentración de 1mg/kg de peso corporal en 4dosis para el tratamiento de la fibrosis renal38 y en 2dosis para el tratamiento del linfoma31. En otros ensayos enfocados al diagnóstico se emplearon péptidos pHLIP unidos a una molécula fluorescente a concentraciones de 1μM por vía intravenosa para la detección de regiones isquémicas en el miocardio44 e intraperitoneal a 100μM en 3dosis en caso de infección pulmonar45. Se han llegado a realizar estudios de toxicidad con concentraciones de hasta 4mg/kg de peso corporal con construcciones pHLIP llevando a cabo una monitorización de los animales durante 2meses, en los que no se detectaron cambios fisiológicos o de comportamiento32. El pHLIP, en comparación con los péptidos que penetran en las células, permanece en la membrana celular después de la inserción, translocando un extremo al citoplasma y dejando el otro extremo en el espacio extracelular. Por lo tanto, el péptido pHLIP posee capacidades de entrega dual: no solo puede inyectar y liberar moléculas en el citoplasma, sino que también permite el transporte a la membrana celular de moléculas hidrofóbicas unidas al extremo N-terminal del pHLIP46.
Aunque prometedor, el empleo del sistema pHLIP como herramienta en el pronóstico, diagnóstico y tratamiento de la patología renal es todavía un reto, siendo necesarios más estudios experimentales de vehiculización de PNA en modelos específicos de enfermedad renal, un estudio detallado de su farmacocinética y su farmacodinámica, así como su introducción en ensayos clínicos con aplicación a los miRNA más explorados. En el desarrollo de esta aplicación los aspectos más limitantes se relacionan con la especificidad y la sensibilidad del sistema. Entre ellos se sitúa la acumulación no dirigida hacia tejidos con un microambiente ácido inducido por situaciones de isquemia, inflamación o infección44,45. Dado que pequeños cambios de pH pueden dar lugar a un efecto biológico significativo, alterando las funciones y la supervivencia celular, es necesario realizar un ajuste más preciso de las propiedades químicas de este sistema de transporte para mejorar su sensibilidad47. Otro aspecto a tener en cuenta en su diseño es el hecho de que a menudo el pH es más bajo en las superficies de las células en comparación con el pH del espacio extracelular48, así como el diferente nivel de acidificación de las diferentes regiones del riñón y la dinámica de cambio de pH en la transición de tejido renal sano a dañado, particular de cada tipo de lesión49,50. Así, los microambientes hipóxicos o los cambios en el metabolismo celular en tejidos dañados con frecuencia promueven cambios en la acidificación del ambiente extracelular, de modo que la acidosis podría ser también un marcador útil para el diagnóstico por imagen de diferentes estados de enfermedad, incluida la renal, empleando el sistema pHLIP acoplado a moléculas fácilmente detectables33.
FinanciaciónEste trabajo ha sido financiado por proyectos del Ministerio de Economía y Competitividad (MINECO), SAF2012-31388 (SL), SAF2015-66107-R (SL), PI17/01513 (DRP) y CTQ2017-85263-R (JJV), cofinanciados por los Fondos de Desarrollo Regional Europeo, Instituto de Salud CarlosIII REDinREN RD12/0021/0009 (SL), RD16/0009/0016 (DRP) y RD16/0009/0015 (JJV), Comunidad de Madrid «NOVELREN» B2017/BMD-3751 (SL, DRP y JJV), Sociedad Española de Nefrología (Fundación Senefro 2017) (SL) y Fundación Renal «Iñigo Alvarez de Toledo» (SL), todas de España. El CBMSO recibe apoyo institucional de la Fundación «Ramón Areces». Este trabajo también fue apoyado por subvenciones del NIH (R35HL135820), la American Heart Association (16EIA27550005) y la Foundation Leducq Transatlantic Network of Excellence in Cardiovascular Research MicroRNA-based Therapeutic Strategies in Vascular Disease (CFH).
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses relacionados con los contenidos de este artículo.