El uso de fármacos inhibidores de la proprotein convertase subtilisin/kexin type 9 (iPCSK9) ha supuesto un cambio en el tratamiento de la dislipidemia en sus efectos sobre los eventos cardiovasculares. Actualmente, disponemos de 2principios activos comercializados (evolocumab y alirocumab) que tienen indicación en los pacientes que no alcanzan unos valores de lipoproteína de baja densidad (LDL) inferior a 100mg/dl habiendo presentado un evento cardiovascular previo y con dosis máximas o intolerancia a las estatinas. Los ensayos clínicos con iPCSK9 han incluido a pacientes con enfermedad renal, aunque con límites en el filtrado glomerular de hasta 20ml/min/1,73 m2 en el menos restrictivo de ellos. Los subanálisis de estos ensayos clínicos han demostrado eficacia en los pacientes con insuficiencia renal, tanto en la mejoría del perfil lipídico como en la reducción de eventos cardiovasculares. Derivado de su intenso efecto en la reducción de colesterol LDL han surgido algunas dudas sobre su seguridad que actualmente están resueltas y que confieren a los iPCSK9 un evidente beneficio cardiovascular también pacientes con enfermedad renal.
The use of proprotein convertase subtilisin/kexin type 9 inhibitors (PCSK9i) has changed the clinical practice of dyslipidemia and their effects in cardiovascular events. Nowadays 2active principles have been commercialized (evolocumab and alircumab) with indication in patients with low-density lipoprotein (LDL) cholesterol over 100mg/dl, history of cardiovascular events and higher statins doses prescribed. Clinical trials with PCSK9i have included chronic kidney disease (CKD) patients, although glomerular filtration rate has been limited up to 20ml/min/1,73m2 or higher. The published sub-analysis of them have demonstrated at least the same efficacy (in reduction of LDL and cardiovascular events) and safety in patients with CKD. However, as these drugs are very powerful in reducing LDL cholesterol, some safety concerns appeared in the past. Once safety is probed, we conclude that PCSK9i are beneficial for CKD patients.
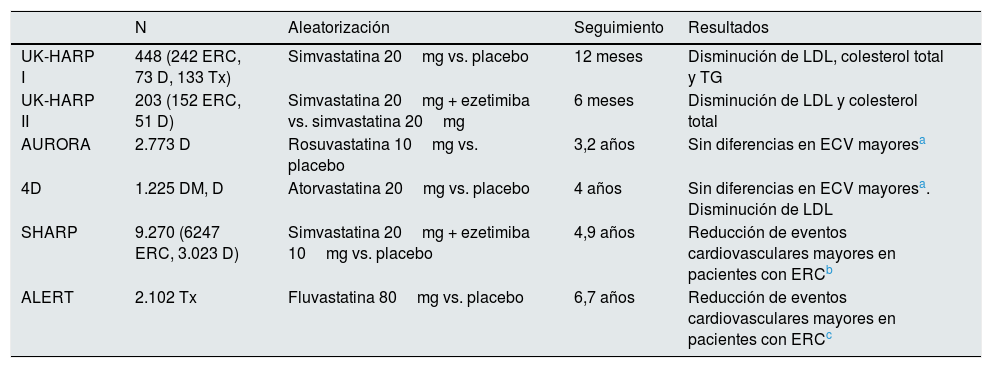
La primera causa de mortalidad en los pacientes con enfermedad renal crónica (ERC) en el mundo es la cardiovascular1,2. Los pacientes con disfunción renal presentan un elevado riesgo cardiovascular debido a una conjunción de factores clásicos y no clásicos3. Dentro de los factores de riesgo cardiovascular tradicionales, la dislipidemia se ha asociado (no sin cierta controversia) a un peor pronóstico cardiovascular en pacientes con ERC y portadores de un trasplante renal, pero no en los pacientes en diálisis (tabla 1)4-9.
Ensayos clínicos de pacientes con enfermedad renal crónica
| N | Aleatorización | Seguimiento | Resultados | |
|---|---|---|---|---|
| UK-HARP I | 448 (242 ERC, 73 D, 133 Tx) | Simvastatina 20mg vs. placebo | 12 meses | Disminución de LDL, colesterol total y TG |
| UK-HARP II | 203 (152 ERC, 51 D) | Simvastatina 20mg + ezetimiba vs. simvastatina 20mg | 6 meses | Disminución de LDL y colesterol total |
| AURORA | 2.773 D | Rosuvastatina 10mg vs. placebo | 3,2 años | Sin diferencias en ECV mayoresa |
| 4D | 1.225 DM, D | Atorvastatina 20mg vs. placebo | 4 años | Sin diferencias en ECV mayoresa. Disminución de LDL |
| SHARP | 9.270 (6247 ERC, 3.023 D) | Simvastatina 20mg + ezetimiba 10mg vs. placebo | 4,9 años | Reducción de eventos cardiovasculares mayores en pacientes con ERCb |
| ALERT | 2.102 Tx | Fluvastatina 80mg vs. placebo | 6,7 años | Reducción de eventos cardiovasculares mayores en pacientes con ERCc |
D: diálisis; DM: diabetes mellitus; ERC: enfermedad renal crónica; ECV: eventos cardiovasculares; TG: triglicéridos; Tx: trasplante.
Por dicho motivo, las actuales guías de Nefrología recomiendan de manera prácticamente universal el uso de estatinas o estatinas con ezetimiba en los pacientes con ERC pero no en los que se encuentren en algún tipo de terapia renal sustitutiva (salvo que ya la tuvieran prescrita previamente). La recomendación se extiende con menos evidencia a los pacientes portadores de trasplante renal10.
La comercialización de los nuevos fármacos inhibidores de la proprotein convertase subtilisin/kexin type 9 (iPCSK9) sumada a la reciente revisión de las guías europeas de cardiología y de ateroesclerosis, con recomendaciones concretas en la población renal, ha propuesto un cambio en el paradigma del tratamiento de la dislipidemia. Además, la capacidad de estos agentes para disminuir las cifras de lipoproteína de baja densidad (LDL) puede generar ciertas dudas en la seguridad al alcanzar estos niveles extremadamente bajos.
Efectos renales de la dislipidemia: la nefrotoxicidad lipoideaLos efectos bilaterales de la dislipidemia en el riñón y de las enfermedades renales sobre el perfil lipídico han sido estudiados mayoritariamente en el síndrome nefrótico11. En este, las lipoproteínas se alteran tanto en cantidad como en composición. Mientras que las moléculas de lipoproteínas de alta densidad (HDL) colesterol no se alteran especialmente en el síndrome nefrótico, las concentraciones de colesterol LDL, lipoproteínas de muy baja densidad y triglicéridos se encuentran elevadas. El mecanismo propuesto incluye defectos en el aclaramiento de las lipoproteínas (por disminución de la actividad de la lipoproteinlipasa hepática y tisular) pero también un aumento en la enzima PCSK9 responsable del reciclaje de colesterol LDL hepático11,12. La propia insuficiencia renal también genera cambios en el perfil lipídico convirtiéndolo en más aterogénico. Las alteraciones consistentes en disminución de HDL, aumento de triglicéridos y oxidación de las partículas de LDL se hacen más evidentes con el deterioro del filtrado glomerular (FG)13,14.
Por otro lado, los lípidos se pueden depositar en el riñón conduciendo a algunas alteraciones que se engloban bajo el término de nefrotoxicidad lipoidea11. Los valores elevados de colesterol LDL y la oxidación de estas partículas son atrapadas por las células mesangiales promoviendo su proliferación y, finalmente, la esclerosis glomerular. Los ácidos grasos libres han demostrado su capacidad para inducir daño directo sobre el podocito, sobre todo en presencia de albuminuria15. Además, los ácidos grasos saturados pueden filtrarse provocando daño tubulointersticial16.
Todas estas acciones tóxicas renales de las diferentes partículas del metabolismo lipídico se acrecientan cuando a la dislipidemia se asocia obesidad por aumento del estrés oxidativo, la inflamación o la sobreactivación del sistema renina-angiotensina-aldosterona17.
En conjunto, estas alteraciones teóricamente tendrían la capacidad de promover el desarrollo de insuficiencia renal progresiva. Sin embargo, los estudios clínicos publicados presentan resultados contradictorios. Por un lado, la asociación entre incidencia de ERC y alteraciones del perfil lipídico en población general sí ha sido probada en estudios epidemiológicos18. Por otro lado, la capacidad predictiva del perfil lipídico para agravar la progresión de la insuficiencia renal parece probada en asociación con obesidad, pero es dudosa cuando se analiza de manera independiente19,20.
Recomendaciones de las guías clínicasLas guías clínicas publicadas hasta la fecha son muy controvertidas en cuanto al manejo y las cifras de LDL objetivo en los pacientes con insuficiencia renal (tabla 2)21. Basándonos en las guías KDIGO, los pacientes con ERC deben recibir una estatina en cualquier situación sin necesidad de monitorizar los valores de colesterol LDL10. Esta estrategia, conocida como «fire and forget» se contrapone con lo que establecen como recomendación las recientemente publicadas guías europeas de Cardiología y Ateroesclerosis22. En ellas, la presencia de ERC supone elevar el riesgo cardiovascular de los pacientes a alto en aquellos con FG estimado (FGe) entre 30 y 59ml/min/m2 y marcan un objetivo de LDL inferior a 70mg/dl, y a muy alto en FGe inferior a 30ml/min/m2, situando el objetivo de colesterol LDL en 55mg/dl. En estudios previos a la publicación de las últimas guías se pone de manifiesto la dificultad que supone alcanzar estos objetivos en la gran mayoría de los pacientes con ERC. Hasta el 60% de la población con insuficiencia renal es incapaz de lograr un LDL inferior a 70mg/dl, por lo que parece evidente que las estatinas pueden no ser suficientes en el manejo de la dislipidemia en dichos pacientes23,24.
Recomendaciones de las guías clínicas de dislipidemia en pacientes con enfermedad renal
| Indicación de tratamiento | Objetivo de tratamiento | |
|---|---|---|
| KDIGO 2013 | Pacientes mayores de 50 años con ERC (G3a-G5) sin necesidad de TRSPacientes 18-49 años con ERC (G3a-G5) sin necesidad de TRS y uno de los siguientes:Enfermedad coronariaDiabetes mellitusIctusRCV estimado > 10%Pacientes portadores de trasplante renal | No precisa monitorización (fire and forget) |
| ESC/EAS 2019 | En función del riesgo cardiovascular:Alto: FGe 30-55 ml/min/m2Muy alto: FGe < 30 ml/min/m2 | Reducción LDL ≥ 50% y:LDL < 70 mg/dlLDL < 55 mg/dl |
| SEA 2019 | Prevención primaria en pacientes con ERC ≥ grado 3bPrevención secundaria en pacientes ERC ≥ grado 3b | LDL < 130 mg/dlaLDL < 70 mg/dl |
ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; KDIGO: Kidney Disease: Improving Global Outcomes; LDL: low-density lipoprotein colesterol; NLA: National Lipid Association; SEA: Sociedad Española de Arterioesclerosis.
La Sociedad Española de Ateroesclerosis acaba de publicar las recomendaciones en las que, además de lo previo, incluye a los pacientes con ERC grado 3b o superior en el subgrupo de pacientes candidatos a tratamiento con iPCSK9 en prevención primaria si no alcanzan LDL inferior a 130mg/dl con estatinas25.
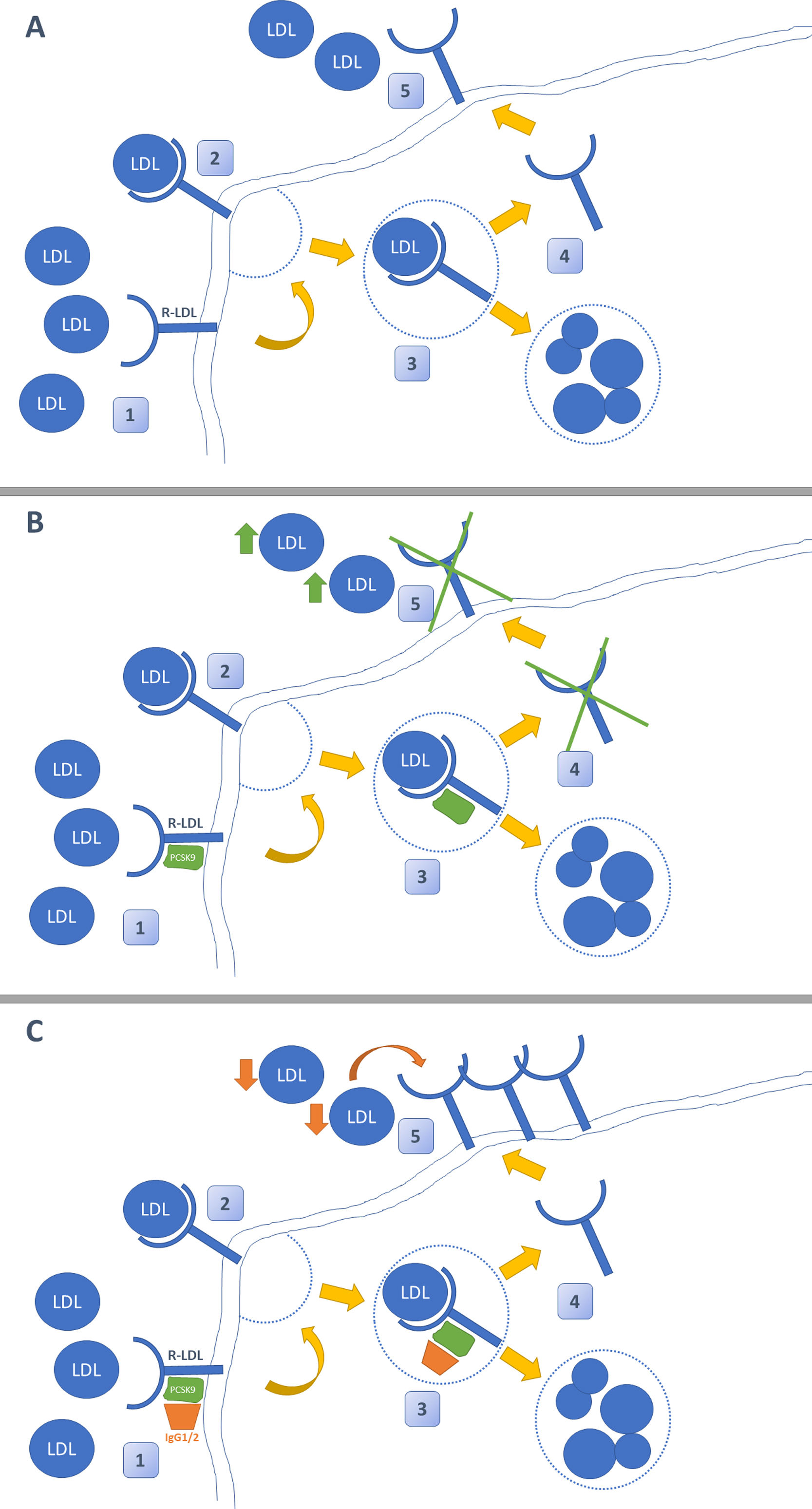
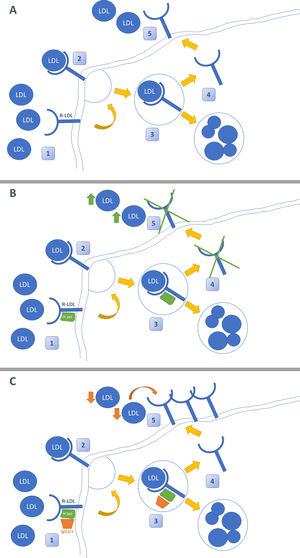
Inhibidores PCSK-9: evidencias en el paciente renalLa irrupción de los nuevos fármacos hipolipidemiantes ha supuesto una revolución en el tratamiento de la dislipidemia. Su mecanismo de acción radica en el bloqueo mediante un anticuerpo monoclonal de la proteína enzimática PCSK9, cuya función principal es bloquear el reciclaje de los receptores de LDL (R-LDL). Cuando se administran anticuerpos iPCSK9, los R-LDL se internalizan en el hepatocito junto con una molécula de LDL. Una vez dentro de él, en ausencia de PCSK9, se separan de manera que la molécula de LDL se degrada y R-LDL se recicla y puede volver a la superficie para seguir captando moléculas de LDL (fig. 1)26. La indicación actual del uso de iPCSK9 se resume en la tabla 327,28.
Mecanismo de acción de los iPCSK9. En la figura A se muestra la ruta habitual del metabolismo del colesterol LDL en el hígado. Este llega al hepatocito, donde se internaliza tras unirse a su receptor de LDL (R-LDL). Posteriormente, se separa de manera que LDL se degrada en el lisosoma y el R-LDL puede reciclarse para volver a exponerse en la superficie y volver a captar más moléculas de LDL. La figura B demuestra la acción de PCSK-9. Esta enzima se une de manera no covalente al R-LDL y a LDL, obligando a la degradación de ambas en los lisosomas e impidiendo el reciclaje de R-LDL. En la figura C se muestra el efecto de los inhibidores de PCSK-9. Estos son anticuerpos monoclonales (IgG1/2) que se unen a PCSK-9 y evitan que este ejerza su función sobre R-LDL y LDL. El uso de iPCSK9 favorece el reciclaje continuo de R-LDL y la captación de moléculas de LDL de manera más pronunciada.
Indicación del uso de iPCSK9 según el informe de posicionamiento
| Criterio | LDL requerido | Fármaco iPCSK9 | |
|---|---|---|---|
| Pacientes con hipercolesterolemia familiar homocigota | Edad ≥ 12 años y uno de los siguientes:Intolerancia a las estatinasDosis máxima de estatinas | 100 mg/dl | Evolocumab (Repatha®) |
| Pacientes con hipercolesterolemia familiar heterocigota | Uno de los siguientes:Intolerancia a las estatinasDosis máxima de estatinas | 100 mg/dl | Evolocumab (Repatha®)Alirocumab (Praulent®) |
| Pacientes con hipercolesterolemia primaria no familiar o dislipidemia mixta | Enfermedad vascular ateroescerótica y uno de los siguientes:Intolerancia a las estatinasDosis máxima de estatinas | 100 mg/dl | Evolocumab (Repatha®)Alirocumab (Praulent®) |
Los iPCSK9 comercializados (evolocumab y alirocumab) han sido capaces de demostrar su capacidad para disminuir las cifras de colesterol LDL en sendos ensayos clínicos (DESCARTES y ODYSSEY)29,30. En ambos se han publicado los resultados en la población con enfermedad renal (FGe > 30ml/min/1,73 m2), evidenciándose una eficacia similar al resto de los sujetos de los estudios y que supera el 50% de reducción en las cifras de colesterol LDL31,32. El efecto de los iPCSK sobre el metabolismo lipídico va más allá del mero control de LDL. En el estudio LAPLACE-2 la adición de evolocumab a una estatina de media o alta potencia en pacientes con hipercolesterolemia primaria resultó en una mejoría de los valores de colesterol no HDL, apolipoproteína B, triglicéridos y lipoproteína (a) e incluso en un modesto incremento de colesterol HDL (5-10%)33.
Reducción de eventos cardiovascularesEn cuanto a su potencial beneficio en la reducción de eventos cardiovasculares mayores, los ensayos clínicos FOURIER y ODYSSEY-OUTCOMES demostraron la efectividad de evolocumab y alirocumab, respectivamente, en prevención secundaria en pacientes de alto o muy alto riesgo cardiovascular con cifras de colesterol LDL por encima de 70mg/dl34,35. En ambos estudios se incluyó a pacientes con ERC, siendo un criterio de exclusión en el FOURIER un FGe < 20ml/min/1,73 m2 e inferior a 30ml/min/1,73 m2 en el ODYSSEY OUTCOMES. Recientemente, se ha publicado un análisis de eficacia y seguridad de evolocumab en los pacientes que basalmente tenían ERC en el estudio FOURIER. De los 27.564 pacientes incluidos en dicho estudio, 15.034 tenían una ERC grado 2 y 4.443 ERC grado 3 o superior. Los resultados demostraron que evolocumab era al menos igual de eficaz en la reducción de eventos cardiovasculares mayores en los pacientes con ERC frente a los que tenían función renal preservada, con una reducción absoluta del riesgo mayor a medida que disminuía el FGe31. No se objetivó una mayor tasa de eventos adversos (incluyendo cambios en la función renal) en los pacientes con ERC, salvo en los casos de rabdomiólisis que aparecieron con más frecuencia en los pacientes con grado 3 o superior31.
En el momento actual, no disponemos de ningún ensayo clínico específico para población con enfermedad renal que evalúe la eficacia de los iPCSK9 ni en eventos cardiovasculares ni en parámetros de función renal. Además, ningún estudio ha subanalizado a los pacientes con FGe < 20ml/min/1,73 m2 ni a los portadores de un trasplante renal por lo que aún quedan lagunas en esos grupos de pacientes36.
Seguridad de niveles muy bajos de LDLLa estrategia de disminuir las cifras de colesterol LDL a lo mínimo posible («the lower the better») con el objetivo de reducir al máximo el riesgo de eventos cardiovasculares ha planteado dudas sobre su seguridad37. Desde un punto de vista fisiológico, el colesterol es necesario para la fabricación de membranas celulares y el potencial efecto hipolipidemiante extremo de los iPCSK9ha puesto de manifiesto la necesidad de evaluar los efectos de cifras extremadamente bajas sobre el metabolismo celular.
Los efectos adversos más estudiados en relación con los niveles bajos de LDL han sido la miopatía, el deterioro cognitivo, la aparición de cataratas, la diabetes de novo y, sobre todo, la incidencia de ictus hemorrágicos.
Dos estudios (un subanálisis del FOURIER y un metaanálisis basado en 14 ensayos clínicos con alirocumab) han publicado datos específicos sobre los efectos de los iPCSK9 en pacientes que alcanzan niveles muy bajos de colesterol LDL38,39. En ambos se demuestra la seguridad de los iPCSK9 incluso cuando se alcanzan valores de LDL por debajo de 20mg/dl para el caso de evolocumab y de 15mg/dl para alirocumab. Únicamente cabe destacar que se produjo un aumento de la incidencia de cataratas en los pacientes con LDL inferior a 25mg/dl frente al resto de grupos, aunque no en mayor cuantía al compararlo con placebo37.
El efecto adverso más temido se deriva de la asociación epidemiológica entre valores muy bajos de LDL e ictus hemorrágico40. La explicación fisiopatológica radica en la necesidad de cantidades elevadas de colesterol para la estructura de las paredes vasculares cerebrales. Sin embargo, los datos referentes a esta asociación son meramente observacionales y ninguno de los subanálisis publicados con iPCSK9ha sido capaz de confirmarlos38,39. Además, cuando se ha analizado a poblaciones especiales que genéticamente presentan cifras muy bajas de LDL (por alteraciones en genes que aumentan la expresión de RLDL como PCSK9 o HMGCoA) se confirma la falta de asociación con ictus hemorrágicos41,42.
El deterioro cognitivo fue estudiado a raíz de una alerta de la Food and Drug Administration publicada en 2012 sobre el uso de estatinas y niveles bajos de LDL43. El estudio EBBINGHAUS analizó mediante un test cognitivo, Cambridge Neuropsychological Test Automated Battery, la evolución cognitiva durante 19 meses de los pacientes del estudio FOURIER sin encontrar ninguna diferencia entre los grupos que recibieron el fármaco y el grupo placebo44.
Finalmente, el estudio OSLER con un seguimiento de 5 años (la experiencia más larga con iPSCK9 publicada hasta la fecha) ha demostrado la eficacia y la seguridad de evolocumab sin aumento de reacciones adversas (incluyendo el desarrollo de anticuerpos) frente a placebo, lo que termina de confirmar la seguridad de los niveles bajos de LDL mantenidos y la de los iPCSK9 propiamente dicha45.
ConclusionesEl uso de iPCSK9 en pacientes con enfermedad renal es seguro y eficaz en la mejoría del perfil lipídico. Se precisa de ensayos clínicos en población con insuficiencia renal para valorar el impacto de su uso en la supervivencia global y en la reducción de los eventos cardiovasculares.
Conflicto de interesesBQ y VAC han realizado ponencias remuneradas para Amgen S.A.®.