En los últimos tiempos, la exposición a determinadas sustancias químicas se ha instalado en nuestra vida diaria. Tal es el caso del bisfenol A (BFA), 2,2-bis-(4-hidroxifenil)-propano, molécula utilizada en la síntesis de plásticos de policarbonato y en las resinas epoxi. Su uso está muy extendido en la fabricación de biberones, botellas para agua, refrescos, así como en el recubrimiento interno de latas y otros contenedores de comida y bebida. No es extraño pues, que se fabricaran en 2009 alrededor de 6.000.000 de toneladas métricas de BFA a nivel mundial1.
Numerosos estudios han demostrado que más del 90% de la población estadounidense tiene niveles detectables de este compuesto en orina y que la exposición de la población supera la dosis de referencia de 50μg por kg de peso y día2. En un reciente estudio realizado en España, Cutanda et al.3 señalan la presencia de BFA en la orina en el 97% de la población estudiada.
La exposición a BFA ocurre preferentemente por vía oral, pero también debido a los selladores dentales, a través de la piel y por inhalación de productos de limpieza. Más preocupante aún es la detección de agua subterránea y de ríos contaminados con BFA según estudios realizados en diversos países como España4, China y Japón5.
Numerosos trabajos1,5-8 consideran al BFA como un disruptor endocrino y han estudiado la posible relación entre la actividad estrogénica (xenoestrógeno) del BFA y distintas alteraciones endocrino-metabólicas entre las que caben destacar trastornos hepáticos, tiroideos, obesidad, resistencia a la insulina y aumento a la susceptibilidad a la diabetes9.
Pero desde el punto de vista nefrovascular, las primeras alarmas aparecieron en 2008 cuando Lang et al.10 hallaron una correlación significativa entre una elevada excreción urinaria de BFA en sujetos con diabetes tipo 2 y enfermedades cardiovasculares8,10. En la presente revisión se analizará primeramente el papel crítico de la función renal en la excreción del BFA y, posteriormente, se revisarán las evidencias experimentales que aportan una sólida base científica a los estudios clínicos translacionales que implican al BFA en el daño nefrovascular.
Acumulación de bisfenol A en pacientes con enfermedad renal crónicaSe ha establecido que, después de la ingestión, el BFA es conjugado en el hígado con ácido glucurónico, donde pierde la actividad estrogénica y es excretado al intestino. Tanto el BFA como sus metabolitos son excretados en la orina1,2,3,6. Por ello, los pacientes con enfermedad renal crónica (ERC) presentan niveles más elevados de BFA que los de la población general11, habiendo observado una correlación negativa entre el aumento del BFA sérico y el filtrado glomerular estimado7. En un estudio más reciente, Krieter et al. analizaron una cohorte de 152 pacientes con ERC y 24 sujetos controles y observaron aumentos significativos en la concentración plasmática de BFA a partir del estadio 3 de la enfermedad, siendo máxima en pacientes en estadio 5 (diálisis), en los que se han observado valores hasta 6 veces superiores a la población sin enfermedad renal11,12.
En el momento actual no se ha establecido el papel real de la diálisis en la depuración del BFA. Se trata de un tema complejo dado que, por una parte, las propias membranas de diálisis contienen cantidades variables de BFA. Este hecho ha sido probado por algunos autores en trabajos que demuestran la presencia de BFA en los efluentes de membranas de polimetilmetacrilato, celulosa, triacetato de celulosa, polímeros de poliéster y polisulfona, particularmente en esta última11–13. Por otra parte, se ha demostrado que los niveles de BFA pueden subir o mantenerse estables tras la sesión de hemodiálisis. Esto podría deberse a que el BFA presenta una alta unión a las proteínas séricas, aproximadamente del 75%11. Tampoco son concluyentes los datos sobre el papel de la diuresis residual en la excreción de BFA en la ERC11. Se necesitarán, por tanto, futuros estudios para clarificar las posibles implicaciones fisiopatológicas de la acumulación de BFA en la ERC, así como para evaluar si debería incluirse al BFA en la larga lista de toxinas urémicas.
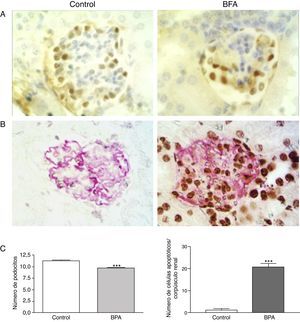
El bisfenol A induce podocitopatía y proteinuriaEn un estudio reciente se ha descrito un nuevo tipo de podocitopatía inducida por el BFA14. Olea-Herrero et al. observaron que el BFA es capaz de inducir hipertrofia y apoptosis en podocitos murinos en cultivo. Estos efectos se acompañaron de un aumento en la síntesis de moléculas clásicamente implicadas en la patogenia de la glomeruloesclerosis, tales como el inhibidor de cinasas dependiente de ciclinas p27kip1, el sistema TGF-β y del colágeno iv. En estas células, además, el BFA disminuyó la síntesis de nefrina y podocina, proteínas de la hendidura de filtración involucradas tanto en los mecanismos de proteinuria como en la supervivencia de los podocitos. Tal como cabría esperar de estos resultados in vitro, los riñones de los animales tratados con BFA desarrollaron hipertrofia, hiperfiltración y proteinuria. Junto al aumento en la expresión de p27kip1, TGF-β y de colágeno iv en los riñones, se observó expansión mesangial y disminución del número de podocitos por apoptosis (fig. 1), mientras que la microscopia electrónica mostró hipertrofia de podocitos y pedicelos. Cabe destacar que, aun cuando los animales tratados con BFA no desarrollaron hiperglucemia, sus riñones presentaron cambios funcionales y estructurales similares a los que ocurren en la etapa inicial de la nefropatía diabética (ND). Aunque existen limitaciones en el uso de modelos animales para desarrollar fallo renal o cambios histomorfológicos renales a largo plazo15, estos hallazgos podrían tener implicaciones fisiopatológicas, dado que la proteinuria es un buen predictor de la progresión de la enfermedad renal16.
El BFA produce podocitopenia en ratones. A) Inmunohistoquímica para WT-1. En los ratones tratados con BFA el número de podocitos (núcleos en marrón) fue menor que en los controles. X300. B) Ensayo TUNEL (núcleos negros) combinado con inmunohistoquímica para podocina (expansiones grises). Los corpúsculos renales de los ratones tratados con BFA mostraron un mayor número de podocitos apoptóticos que los controles X300. C) Izquierda, gráfico que representa el análisis estadístico del número de podocitos. Derecha, histograma que representa el número de células apoptóticas en ratones control y ratones tratados con BFA.
***p<0,001 usando el test ANOVA para el análisis de la varianza.
Fuente: Olea-Herrero et al.14. Reproducido con permiso.
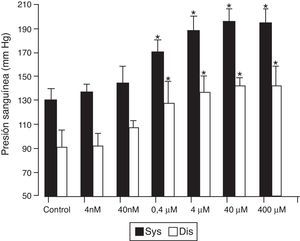
En estudios posteriores17 se ha demostrado que animales tratados con BFA desarrollan hipertensión arterial y disfunción endotelial en forma dosis dependiente, efecto que comenzó a observarse con dosis menores de la mitad de las consideradas seguras (fig. 2). El análisis de expresión génica por microarrays en células endoteliales murinas tratadas con BFA demostró la activación de genes implicados en la regulación vascular como la angiotensina ii y la calcio-calmodulina cinasa ii (CaMKII). Posteriormente se comprobó que esta activación ocurre también in vivo y es responsable de la disfunción endotelial e hipertensión inducida por el BFA, dado que la activación de la CaMKII promueve el desacople enzimático de la óxido nítrico sintasa endotelial, lo que conduce a la producción de radicales libres del oxi¿geno en vez de óxido ni¿trico, principal factor vasodilatador y protector del endotelio. Este aumento en la producción de radicales libres del oxi¿geno indica que el BFA, además de inducir hipertensión, podría participar en los mecanismos de daño vascular así como en la progresión de la lesión arteriosclerótica.
El BFA induce hipertensión en ratones. Los ratones fueron tratados con BFA a las dosis indicadas o con nada (controles). La presión sanguínea se evaluó 30 días después de la administración del BFA.
*p<0,05 respecto a su correspondiente control (n=10).
Fuente: Saura et al.17. Reproducido con permiso.
En recientes trabajos se ha enfatizado la importancia de los modelos experimentales en roedores para estudiar la toxicidad de BFA, importancia puesta aún más de manifiesto por el hecho de que el BFA posee igual potencia en células humanas y animales18. Cobran por ello especial relevancia los datos experimentales que implican al BFA en el daño nefrovascular. Es importante destacar, asimismo, que estos datos experimentales están avalados por estudios epidemiológicos realizados en la población de Nueva York19, Shanghái20 y Seúl21, en los que se describe que la exposición humana al BFA está asociada al aumento en la excreción urinaria de proteínas y a la hipertensión arterial.
Desde un punto de vista nefrológico, cabe destacar 2 grandes estudios poblaciones, uno de ellos en población china adulta (n=3.077)20 y otro que incluye a 710 niños americanos19. En ambos trabajos se demuestra la existencia de una asociación estadísticamente significativa entre la excreción urinaria de BFA y la albuminuria. Esta asociación no se modificó en los diferentes sexos, en los diabéticos, en los fumadores, hipertensos ni en los que tenían ERC. Aunque los autores de ambos trabajos especulan sobre el posible papel del estrés oxidativo y de la disfunción endotelial para justificar dichos hallazgos, los datos experimentales actualmente señalan que incluso una albuminuria de bajo grado asociada con exposición al BFA podría promover una podocitopatía de pronóstico incierto (o al menos aún inexplorado), indicando la necesidad de realizar futuros estudios, así como de reevaluar la conveniencia de prevenir o limitar la exposición al BFA.
Desde un punto de vista cardiovascular numerosos estudios clínicos y epidemiológicos han demostrado que la exposición al BFA se asocia a hipertensión y daño vascular22–25. Así, Shankar y Teppala22 hallaron en una muestra representativa de la población adulta de EE. UU. que altos valores de excreción de urinaria de BFA se asocian a hipertensión arterial de forma independiente de otros factores de riego tradicionales. Resultados similares has sido hallados en la población adulta de Seúl, donde realizaron 1.511 análisis en 521 sujetos24. Asimismo, Bae y Hong21 estudiaron el efecto agudo de la exposición oral al BFA en 60 sujetos tras ingestas de 2 envases de una misma sustancia (leche de soja) envasada en lata o en botella. En los primeros observaron una asociación entre BFA urinario alto y aumento de presión arterial a las 2 h de la toma.
Existen, además, diversos trabajos que correlacionan la exposición al BFA y el daño vascular. Melzer et al.24 en Norfolk (Reino Unido) evaluaron 758 casos de enfermedad coronaria y 861 sujetos controles con un seguimiento de 10,8 años y demostraron una asociación significativa entre una alta excreción urinaria de BFA y episodios de enfermedad coronaria. Resultados similares has sido publicados en estudios de la National Health and Nutritional Survey (NHANES) de EE. UU.25 donde los autores, tras analizar a 745 sujetos, hallaron una asociación significativa entre la excreción urinaria de BFA y la enfermedad arterial periférica de forma independiente a los factores de riesgo tradicionales.
Las implicaciones de estos hallazgos son evidentes debido tanto a la alta incidencia en la población como a la morbimortalidad de la enfermedad nefrovascular. Está bien establecido que las enfermedades cardiovasculares son la causa más frecuente de muerte en los países desarrollados, donde aproximadamente un cuarto de la población sufre alguna de estas enfermedades17,21–25. Lo mismo podría ocurrir en la ERC, en la que el BFA se acumula y podría ser incluido como toxina urémica.
Aunque es difícil caracterizar con certeza la concentración de BFA potencialmente peligrosa, cabe mencionar los hallazgos de 2 trabajos independientes en los que el consumo de una dosis diaria de bebida enlatada produce al cabo de 321 a 526 días un aumento en la excreción urinaria de BFA superior al 1.000% (sobre 20ng/ml), mientras que Li et al.20 describieron que la exposición a BFA estaba asociada a la presencia de albuminuria en adultos, presentando estos una concentración media de BFA en orina de 1ng/ml. Por lo tanto, la exposición al BFA demostrada en repetidos estudios epidemiológicos, realizados mayoritariamente en países desarrollados27, está en el rango de las asociadas a proteinuria e hipertensión.
Por otra parte, desde finales del siglo pasado hasta la actualidad se ha detectado una epidemia mundial de diabetes tipo 2, principal causa de ERC en los países desarrollados. Datos del Registro de la Sociedad Espan¿ola de Nefrologi¿a han estimado que el 21% de los pacientes con ERC son debidos a ND26. Aunque clásicamente se ha considerado a la ND como una enfermedad metabólica, estudios de Navarro et al.28 demuestran la presencia de un componente inflamatorio renal en la ND. Dado que solo el 20-40% de los pacientes con diabetes desarrollan nefropatía, se ha señalado la existencia de otros factores —genéticos— inductores, aún por descubrir29. Las investigaciones actuales permiten hipotetizar que el factor ambiental BFA podría inducir o potenciar en el riñón algunos de los cambios que ocurren en la diabetes mellitus. Cabe destacar, finalmente, que la agencia FDA de EE. UU. ha propuesto financiar la investigación del BFA30.
ConclusionesLos datos científicos disponibles permiten señalar al BFA como un nuevo factor ambiental implicado en el daño nefrovascular, caracterizado por podocitopatía con proteinuria, hipertensión arterial y disfunción vascular. Estos datos avalan, además, la necesidad de realizar estudios translacionales para intentar clarificar el papel potencial del BFA en la hipertensión y en la progresión de las enfermedades renales, particularmente en pacientes diabéticos.
Este trabajo ha recibido financiación del Ministerio de Ciencia e Innovación (SAF2009-12009-C02-01) y del Instituto de Salud Carlos III-FEDER (PI12/02825) a RJB. Del Ministerio de Economía y Competitividad (SAF 2012-35141) y Ayudas Fundación Senefro 2012 a MS. Del Ministerio de Economía y Competitividad (SAF 2008-04629 y SAF 2011-28375), Instituto de Salud Carlos III-FEDER (PI14/02022) a CZ.
N. Olea tiene un contrato de investigación de la Comunidad Autónoma de Madrid–Programa de Actividades I+D en Biociencias 2010 (S2010/BMD-2378). P. Reventún tiene un contrato de investigación del Ministerio de Economía y Competitividad.