INTRODUCCIÓN
La aparición de proteinuria y deterioro de la función renal en una persona diabética suele atribuirse generalmente aldesarrollo de nefropatía diabética1, pero los diabéticos también pueden presentar enfermedades glomerulares primarias, en especial cuando se produce una evolución atípica2. La ausencia de retinopatía o neuropatía diabéticas, el deterioro brusco de la función renal o la presencia de hematuria o proteinuria en rango nefrótico son factores que obligan a realizar un diagnóstico diferencial con dichas enfermedades2-5. La biopsia renal es fundamental para alcanzar un diagnóstico de certeza. La glomerulonefritis membranosa (GNM) es la causa más frecuente de síndrome nefrótico en el adulto, y una de las glomerulonefritis primarias más frecuentes en el diabético3-5; su diagnóstico y adecuado tratamiento inmunosupresor mejora los porcentajes de remisión de la enfermedad6. En los últimos años, el micofenolato mofetil (MMF), ampliamente empleado en la inmunosupresión del trasplante renal, se está convirtiendo en un fármaco atractivo para el tratamiento de las glomerulonefritis primarias7, debido a su eficacia y escasos efectos adversos. Presentamos el caso de una mujer anciana diabética que desarrolló un síndrome nefrótico con deterioro brusco de su función renal.
CASO CLÍNICO
Una mujer de 80 años (60,6 kg, 1,45 m, superficie corporal 1,56 m2), con antecedentes personales de diabetes mellitus desde hacía 7 años con óptimo control glucémico y sin retinopatía diabética, hipertensión arterial de unos 2 años de evolución, hipercolesterolemia y un accidente isquémico transitorio sin secuelas neurológicas 6 meses antes, acudió en noviembre de 2005 a urgencias por presentar desde hacía 2 meses edema en las extremidades inferiores y superiores que había aumentado en los últimos días, con edema palpebral matutino y descenso de diuresis. Presentaba disnea para moderados esfuerzos, sin ortopnea. Nicturia de dos-tres ocasiones. Negaba la toma de fármacos distintos a los pautados ni la realización de exploraciones diagnósticas con empleo de contrastes.
Hacía 2 meses había sido valorada por primera vez en un servicio de nefrología de otro hospital debido a estos síntomas. Se le solicitó un estudio analítico y 15 días antes de acudir a urgencias se le habían comunicado los resultados. En el control analítico realizado mostraba una creatinina sérica (sCr) de 2,6 mg/dl (aclaramiento de creatinina 15 ml/min), proteínas séricas totales 4,6 g/dl, y una proteinuria de 8,2 g/día (4 meses antes, en un control ambulatorio realizado por su médico de atención primaria, presentaba sCr 1,9 mg/dl y albuminuria de 366 mg/día). La paciente fue diagnosticada de nefropatía diabética con enfermedad renal crónica en estadio 4. Se había incrementado el tratamiento hipotensor y diurético, añadiendo espironolactona e incrementando las dosis de furosemida, de tal forma que en el momento actual estaba tomando glicazida 40 mg/día, irbesartán 300 mg/día, diltiazem 120 mg/12 horas, furosemida 160 mg/día, espironolactona 100 mg/día, atorvastatina 20 mg/día y ácido acetilsalicílico 100 mg/día.
En la exploración física destacaba la presencia de edema con fóvea hasta la raíz de miembros inferiores, pared abdominal y dorso de las manos, sin otros datos de interés.
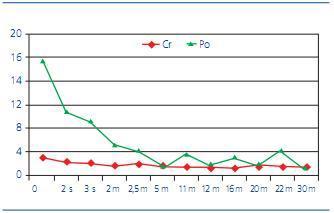
A su ingreso, los análisis revelaron una sCr de 3,04 mg/dl, proteínas séricas totales 3,9 g/dl, iones dentro de los límites normales, proteinuria de 13,9 g/día, con un sedimento anodino, anemia normocítica y normocrómica con Hb 8,5 g/dl. ANA y ANCA fueron negativos. Ante la sospecha clínica de glomerulonefritis rápidamente progresiva se inició tratamiento con bolos de corticoides (metilprednisolona 500 mg/día, 3 días), continuando con prednisona 1 mg/kg/día. Durante su ingreso presentó una discreta mejoría de la función renal, siendo la sCr a los 12 días de 2,6 mg/dl.
Ante la evolución atípica de la paciente dada la aparición brusca de proteinuria en rango nefrótico y el deterioro de función renal, y con el fin de descartar patología glomerular primaria, se decidió la realización de una biopsia renal. En la microscopia óptica se objetivó la presencia de spikes prominentes en la membrana basal glomerular, y focos de fibrosis e infiltrado inflamatorio crónico tubulointersticial. La inmunofluorescencia mostró un depósito difuso y global de IgG a lo largo de las asas capilares. No se realizó microscopia electrónica. El informe anatomo patológico estableció el diagnóstico de GM en estadio II.
Dos meses más tarde, la paciente presentaba una proteinuria de 4,62 g/día, con una sCr de 1,4 mg/dl. Con el fin de disminuir los corticoides debido a la aparición de efectos secundarios en la paciente, ya que desarrolló facies cushingoide y mal control glucémico que requirió insulinización, se introdujo MMF a dosis de 250 mg/12 horas.
A los 6 meses, la paciente alcanzó de nuevo un óptimo control diabético (HbA1c 4,9%), con desaparición del edema, y su proteinuria había descendido a 1,36 g/día. Al año de seguimiento, su sCr era 1,3 mg/dl y su proteinuria de 1,58 g/día. A los 30 meses, su sCr era 1,11 mg/dl, y su proteinuria de 0,85 g/día. Estaba recibiendo tratamiento con glibenclamida 2,5 mg/día, prednisona 5 mg/día, MMF 250 mg/12 horas, valsartán 160 mg, hidroclorotiazida 12,5 mg/día, enalapril 20 mg/12 horas, manidipino 20 mg/día, y clopidogrel 75 mg/día. Durante el seguimiento, la paciente presentó buena tolerancia a MMF, sin aparición de efectos adversos.
CONCLUSIONES
Describimos un caso de síndrome nefrótico y deterioro de función renal en una mujer diabética anciana que había sido diagnosticada de nefropatía diabética. Ésta se fundamenta en un diagnóstico clínico basado en la progresiva aparición de proteinuria y deterioro de la función renal.
Deberíamos pensar en otras enfermedades glomerulares distintas a la nefropatía diabética en ausencia de retinopatía o neuropatía diabéticas, deterioro rápido de función renal, presencia de microhematuria o macrohematuria, y aparición reciente de síndrome nefrótico2-5. La prevalencia de patología glomerular en pacientes diabéticos se estima entre el 47 y el 57%2,4, dependiendo de los trabajos y en pacientes diabéticos seleccionados por sospecha clínica podría ser mayor. Así, Pham et al. encuentran un 72,5% de patología glomerular en diabéticos que se sometieron a una biopsia renal3. Recientemente, Zhou et al. han desarrollado un modelo cuantitativo para el diagnóstico diferencial entre la nefropatía diabética y las enfermedades glomerulares primitivas5. En nuestro caso, el óptimo control diabético, la ausencia de retinopatía diabética y la brusca aparición de proteinuria franca con deterioro de función renal nos hicieron sospechar la posibilidad de que existiera una glomerulonefritis primaria. La GNM es la glomerulonefritis primarias más frecuente en pacientes diabéticos. Su diagnóstico precoz con el fin de iniciar tratamiento inmunosupresor adecuado conduce a incrementar el porcentaje de respuestas, alcanzar su remisión parcial o completa y prolongar la supervivencia renal. El tratamiento único con corticoides no ha demostrado beneficios en el curso natural de la GNM6. En pacientes con enfermedad renal avanzada, existen estudios que incluyen a pocos pacientes mostrando el beneficio del empleo de fármacos inmunosupresores8. No existe actualmente ningún estudio aleatorizado que compare la eficacia de diferentes pautas inmunosupresoras. En la última década se han publicado varios trabajos que han comunicado los beneficios del empleo de MMF como tratamiento de inducción o de rescate en pacientes con GNM y disfunción renal9-12. Así, la Sociedad Española de Nefrología recomienda el uso de MMF en esta situación, con un nivel de evidencia C13. Lai indica un algoritmo terapéutico en el que MMF sería una alternativa a los agentes citotóxicos en pacientes con insuficiencia renal14. Miller et al. refieren la respuesta al tratamiento de pacientes con insuficiencia renal, usando MMF a dosis comprendidas entre 0,5 y 2 g/día durante años10. En nuestro caso decidimos utilizar dosis bajas de MMF debido a su eficacia y seguridad con el fin de ahorrar corticoides, ya que se trataba de una mujer anciana y con una baja superficie corporal. La paciente presentó una mejoría de la función renal con remisión parcial de la proteinuria después de 2,5 años de tratamiento con dosis bajas de MMF.
En conclusión, en diabéticos seleccionados se debería descartar la posibilidad de patología glomerular primaria. El tratamiento mantenido con dosis bajas de MMF en pacientes ancianos con GNM y deterioro de función renal puede ser una alternativa inmunosupresora eficaz y segura.
Figura 1. Evolución de los niveles de creatinina sérica (Cr) en mg/dl y proteinuria (Po) en gramos/día desde su ingreso