Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) han demostrado su beneficio cardiovascular y renal en pacientes con diabetes mellitus tipo 2, insuficiencia cardiaca (IC) o enfermedad renal crónica (ERC). Desde los primeros estudios, con estos fármacos se objetivó un incremento inicial de los niveles de hemoglobina/hematocrito que se atribuyó a un aumento de la hemoconcentración asociados a su efecto diurético, aunque pronto se constató que aumentaban los niveles de eritropoyetina (EPO) y eritropoyesis, mejorando el metabolismo férrico. Los estudios de mediación objetivaron que el incremento de hemoglobina se asociaba estrechamente con los beneficios cardiorrenales de estas sustancias. En la presente revisión se discuten los mecanismos de mejora de la eritropoyesis y la implicación del aumento de hemoglobina sobre el beneficio pronóstico cardiorrenal de estos medicamentos.
Sodium-glucose cotransporter 2 inhibitors (SGLT2i) have demonstrated cardiovascular and renal benefits in patients with type 2 diabetes mellitus, heart failure, or chronic kidney disease. Since the first studies with these drugs, an initial increase in hemoglobin/hematocrit levels was observed, which was attributed to an increase in hemoconcentration associated with its diuretic effect, although it was soon seen that these drugs increased erythropoietin levels and erythropoiesis, and improved iron metabolism. Mediation studies found that the increase in hemoglobin was strongly associated with the cardiorenal benefits of these drugs. In this review, we discuss the mechanisms for improving erythropoiesis and the implication of the increase in hemoglobin on the cardiorenal prognostic benefit of these drugs.
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) fueron introducidos inicialmente para el tratamiento de la diabetes mellitus tipo 2. Los estudios de seguridad cardiovascular en pacientes diabéticos tipo 2 demostraron que estos fármacos disminuían el riesgo de eventos cardiovasculares (especialmente de insuficiencia cardiaca [IC] congestiva)1–5 y de progresión de la enfermedad renal crónica (ERC), así como de reducción/regresión de la albuminuria o de prevenir su desarrollo6–10.
A raíz de ello se realizaron estudios para demostrar su beneficio en pacientes con IC, tanto en diabéticos como no diabéticos, demostrando, asimismo, su beneficio, con una reducción del número de hospitalizaciones por IC y la mortalidad cardiovascular en esta población, tanto en aquellos con fracción de eyección reducida, como preservada11–15 independientemente de que fuesen diabéticos o no o presentaran ERC o no16.
En pacientes con ERC, tanto diabéticos como no diabéticos, los iSGLT2 también han demostrado reducir la progresión de la ERC y la albuminuria en dicha población17–20. Además, en este escenario han mostrado disminuir el riesgo de hospitalización por IC y de mortalidad cardiovascular5,20, así como del riesgo de fracaso renal agudo20.
Efecto de los inhibidores del cotransportador sodio-glucosa tipo 2 sobre la eritropoyesisEritropoyetinaDesde los primeros ensayos clínicos en pacientes con diabetes mellitus tipo 2 se constató un aumento precoz y sostenido de los niveles de hemoglobina/hematocrito en los tratados con estos fármacos21–24, hecho que posteriormente se ha confirmado en los ensayos clínicos en IC25–28 y ERC29–31.
Los cambios de hemoglobina/hematocrito durante el tratamiento con iSGLT2, inicialmente se atribuyeron a la hemoconcentración debido a su efecto diurético y al descenso del volumen plasmático28, aunque pronto se sugirió que otros mecanismos podrían estar implicados, dado que su aumento excedía lo esperable por la contracción del volumen plasmático inicial y su poca relación temporal con la misma22,29.
En este sentido, se ha observado un incremento inicial de los niveles de eritropoyetina (EPO) y/o del recuento reticulocitario con el uso de estos agentes, tanto en pacientes con función renal preservada24,28,32–38, como reducida29, confirmando su efecto directo positivo sobre la eritropoyesis. Recientemente, en un análisis post hoc del estudio Dapagliflozin on Renal Outcomes and cardiovascular Mortality in Patients With Chronic Kidney Disease (DAPA-CKD) se ha detectado que el aumento del hematocrito fue gradual y alcanzó un máximo alrededor de cuatro meses después del inicio del tratamiento con dapagliflozina, lo que descarta su relación independiente del descenso inicial de la volemia31. El aumento de la eritropoyesis con estos fármacos podría deberse a la reversión de la hipoxia tisular relativa en el túbulo proximal como resultado de la disminución de la actividad de la bomba Na+/K+ ATPasa, secundaria a la disminución de la reabsorción de sodio por la inhibición de cotransportador sodio-glucosa tipo 2 (SGLT2). En la diabetes mellitus la expresión de SGLT2 está aumentada. Algunos estudios han demostrado que el daño repetido o la hipoxia a nivel del túbulo proximal renal puede conducir a la desdiferenciación de las células productoras de EPO y su conversión en miofibroblastos, que pierden su capacidad de producir esta hormona. Así pues, se normalizaría la oxigenación cortical renal a este nivel, mejorando el estrés metabólico y la función tubulointersticial, restaurándose la capacidad de producción de EPO por los fibroblastos peritubulares, estimulando la eritropoyesis39. Además, la inhibición de la reabsorción de glucosa y sodio por parte de SGLT2 en los segmentos posteriores de la nefrona, favorece su recuperación más distal (p. ej., SGLT1). De esta manera se beneficia la hipoxia a nivel medular renal, estimulando la producción de EPO por los fibroblastos intersticiales a este nivel39. De forma similar, la ERC por nefroangioesclerosis se caracteriza por un incremento de la actividad nerviosa simpática y activación del sistema renina-angiotensina-aldosterona (SRAA), lo cual aumenta la reabsorción de sodio en el túbulo proximal y por ende el consumo de oxígeno; además, disminuye la llegada de sodio a la nefrona distal, activando el feedback túbulo-glomerular.
Otro posible efecto sería la estimulación de la síntesis de vasopresina por los iSGLT240, pues se ha visto que esta hormona aumenta el recuento de hematíes y estimula la eritropoyesis por un mecanismo independiente de EPO en estudios experimentales41.
Finalmente, los efectos antiinflamatorios de los iSGLT2 podrían mejorar la eritropoyesis al aumentar la producción de EPO y la respuesta a la misma en los eritroblastos de la médula ósea42.
FerrocinéticaSon numerosos los efectos de estos fármacos sobre el metabolismo del hierro.
Varias investigaciones observan una disminución de los niveles de hepcidina, lo que podría favorecer la absorción intestinal de hierro y su movilización desde los depósitos, incrementando su disponibilidad para la eritropoyesis28,34,35. Del mismo modo, son diversos los estudios que muestran una reducción significativa de los niveles de ferritina29,33–35,43,44. La eritroferrona, producida en las células precursoras eritroides, actúa en el hígado disminuyendo la expresión de hepcidina. En dos estudios se ha observado un aumento de los niveles de eritroferrona con iSGLT234, aunque en uno no alcanzó significación estadística28.
Asimismo, se ha descrito un aumento de los niveles de transferrina o la capacidad total de fijación de hierro en algunos estudios34,35,43 o del receptor soluble de transferrina con el tratamiento con iSGLT235,44, así como una disminución del índice de saturación de transferrina34,35,43, aunque no en todos los estudios29,33. Del mismo modo, se ha observado un aumento en la expresión de receptores de transferrina tipos 1 y 2 en células mononucleares34.
Todos estos cambios son compatibles con una mejora del déficit funcional de hierro y un aumento en la disponibilidad/utilización intracelular de hierro, hecho que favorecería la eritropoyesis y la eficiencia metabólica miocárdica45. En este sentido, un reciente análisis de un ensayo clínico en pacientes con IC y fracción de eyección reducida mostró que el tratamiento con dapagliflozina se asoció a disminución de ferritina y aumento de receptor soluble de transferrina. La magnitud de estos cambios se relacionó a la magnitud del incremento de la capacidad funcional máxima a corto plazo44.
Mediadores de los beneficios cardiorrenales de los inhibidores del cotransportador sodio-glucosa tipo 2 en los ensayos clínicos pivotalesEn pacientes diabéticos la anemia aparece más precozmente en el curso de la enfermedad renal y es de mayor gravedad que en aquellos sin diabetes46. La presencia de anemia se asocia con un peor pronóstico en diabéticos47 con IC26,27,48 y ERC31,49–51. Asimismo, la anemia se ha mostrado como un factor de progresión a ERC terminal31,50,51.
En los estudios antes mencionados se constató que el tratamiento con iSGLT2 reducía la prevalencia de anemia y el riesgo de su desarrollo posterior en pacientes diabéticos22–24, con IC26,27 o con ERC29–31
Curiosamente, los análisis de mediación realizados en los diferentes estudios de seguridad cardiovascular o renal de los iSGLT2 indican de forma consistente que los principales mediadores de los beneficios cardiovasculares52–55 y renales55,56 de los iSGLT2 son los aumentos de la hemoglobina/hematocrito, así como los descensos de ácido úrico, o del cociente albúmina-creatinina en orina. Aunque ser un potencial mediador no implica causalidad, es destacable que la mayoría de los estudios coinciden en los marcadores de protección cardiovascular y renal durante el tratamiento con estos fármacos. En pacientes con IC el aumento de la hemoglobina con iSGLT2 precede, predice y se asocia estrechamente con la reducción del riesgo de eventos53–55 y la corrección de la anemia con iSGLT2 se asocia con un mejor pronóstico que en aquellos en los que persiste la misma27. En el estudio DAPA-CKD el beneficio sobre los eventos renales con dapagliflozina fue mayor en los sujetos anémicos que en los no anémicos31. En cuanto a parámetros funcionales, el incremento de hemoglobina durante el tratamiento con iSGLT2 también se ha relacionado con mejora del consumo de oxígeno, mejoría de la calidad de vida y disminución de péptidos natriuréticos en pacientes con IC57.
Sin embargo, es poco probable que los beneficios cardiovasculares y renales con los iSGLT2 puedan atribuirse al incremento de la hemoglobina/hematocrito, pues estudios previos con agentes estimuladores de la eritropoyesis no han demostrado un beneficio de la normalización de la hemoglobina sobre eventos cardiovasculares, incluyendo la IC, o renales en pacientes con ERC58 y sí un aumento de efectos adversos. En el estudio Reduction of Events by Darbepoetin Alfa in Heart Failure (RED-HF) el tratamiento con darbepoetina no redujo el riesgo de muerte u hospitalización por IC, en cambio se asoció a un incremento de eventos trombóticos59, contrariamente a lo observado con los iSGLT2.
Más recientemente, los inhibidores de la prolil-hidroxilasa del factor inducible por hipoxia (HIF-PHI) para el tratamiento de la anemia renal tampoco han demostrado un beneficio sobre eventos cardiovasculares o renales en pacientes con ERC en diálisis o no, con respecto a los agentes estimuladores de la eritropoyesis, pese a la mejora de la ferrocinética y de conseguir los mismos niveles de hemoglobina con niveles de EPO circulantes dentro de un rango más fisiológico60. Todo ello sugiere que los beneficios clínicos observados en pacientes en tratamiento con iSGLT2 y su relación con el aumento de hemoglobina y hematocrito obedecen a mecanismos fisiopatológicos múltiples y complejos, mucha más allá del beneficio directo del incremento de la hemoglobina. Aunque no pueda descartarse totalmente que la mejora de la hemoglobina, y el consiguiente avance del aporte de oxígeno tisular tenga un beneficio cardiovascular y renal, que se vea atenuado por el efecto confusor de los efectos adversos cardiovasculares del tratamiento con agentes estimuladores de la eritropoyesis o con los HIF-PHI.
Muy recientemente, un estudio de mediación del estudio Canafliglozin and Renal Events in Diabetes With Established Nephropathy Clinical Evaluation (CREDENCE) ha observado que el beneficio del aumento de parámetros hematológicos es mayor en pacientes con menor albuminuria, mientras en aquellos con albuminuria > 300m mg/g se asociaría a la reducción de la albuminuria, aunque existe un efecto complementario entre ambos61.
Potenciales mecanismos que explican la asociación entre cambios en la hemoglobina/hematocrito y beneficios cardiorrenales de los inhibidores del cotransportador sodio-glucosa tipo 2A muy corto plazo, la hemoconcentración, secundaria a su efecto predominantemente acuarético, podría ser el mecanismo que explique en gran medida el incremento inicial de hemoglobina y hematocrito. En este sentido un reciente trabajo realizado en pacientes con IC y fracción de eyección reducida, demostró una relación inversa entre el aumento de hemoglobina y la disminución inicial del filtrado glomerular observado en estos (otro bien conocido parámetro de hemoconcentración en los pacientes tratados con estrategias diuréticas vigorosas)62. Esta relación desapareció a los tres meses, sugiriendo que existen otros mecanismos implicados en el incremento de hemoglobina a medio y largo plazo, como ya se ha comentado anteriormente62.
Igualmente, los iSGLT2 aumentarían los niveles de hemoglobina principalmente estimulando la producción endógena de EPO y mejorando la ferrocinética a través de la estimulación de la vía del factor inducible por hipoxia (HIF), compartiendo en parte mecanismos comunes con los HIF-PHI. Sin embargo, los iSGLT2 y los HIF-PHI difieren en algunos aspectos.
Los inhibidores de HIF-PHI actúan inhibiendo varias PHI (incluyendo PHD1, PHD2 y PHD3), inhibiendo así la degradación tanto de HIF-1 como de HIF-263. De ellos, HIF-2 es el principal estímulo fisiológico a la producción de EPO y también controla la expresión de genes implicados en la absorción y distribución de hierro a los tejidos (como la médula ósea)64. La activación de HIF-1 no sería necesaria y podría ser en cierto modo contraproducente, dado que la activación prolongada de este factor de transcripción favorece las vías proinflamatorias y acelera la progresión de la lesión cardiaca y renal o la angiogénesis65.
Además, los iSGLT2 disminuyen los niveles de HIF-134,66. Por el contrario, HIF-2 reduce el estrés celular y la inflamación y tiene efectos citoprotectores a nivel cardiaco y renal65. Los iSGLT2 incrementan sirtuina-167, activando directa y selectivamente HIF-2. Se ha demostrado que los inhibidores de SGLT2 aumentan HIF-2 a nivel cardiaco, contribuyendo potencialmente a sus acciones antifibróticas68.
Otra acción sugerida en recientes estudios sería el beneficio sobre la producción de EPO y la eritropoyesis por una mejora de la función tubulointersticial69.
Más recientemente estudios de proteómica arrojan luz sobre potenciales mecanismos implicados en la protección cardiorrenal de los iSGLT2, entre los cuales estaría el aumento de los niveles de EPO, pero también efectos beneficiosos sobre proteínas implicadas en la contracción/relajaciones cardiacas, metabolismo del hierro, efectos metabólicos o sobre mecanismos de protección cardiorrenal, como la promoción de la autofagia o la disminución del estrés oxidativo, la inflamación o la fibrosis70–72.
En este sentido, en un análisis del estudio Myocardial-IRON, la repleción miocárdica de hierro tras la administración de hierro carboximaltosa IV fue superior en el subgrupo de pacientes que recibían iSGLT273, sugiriendo que también podrían mejorar la ferrocinética miocárdica, apoyando los resultados de estudios previos44.
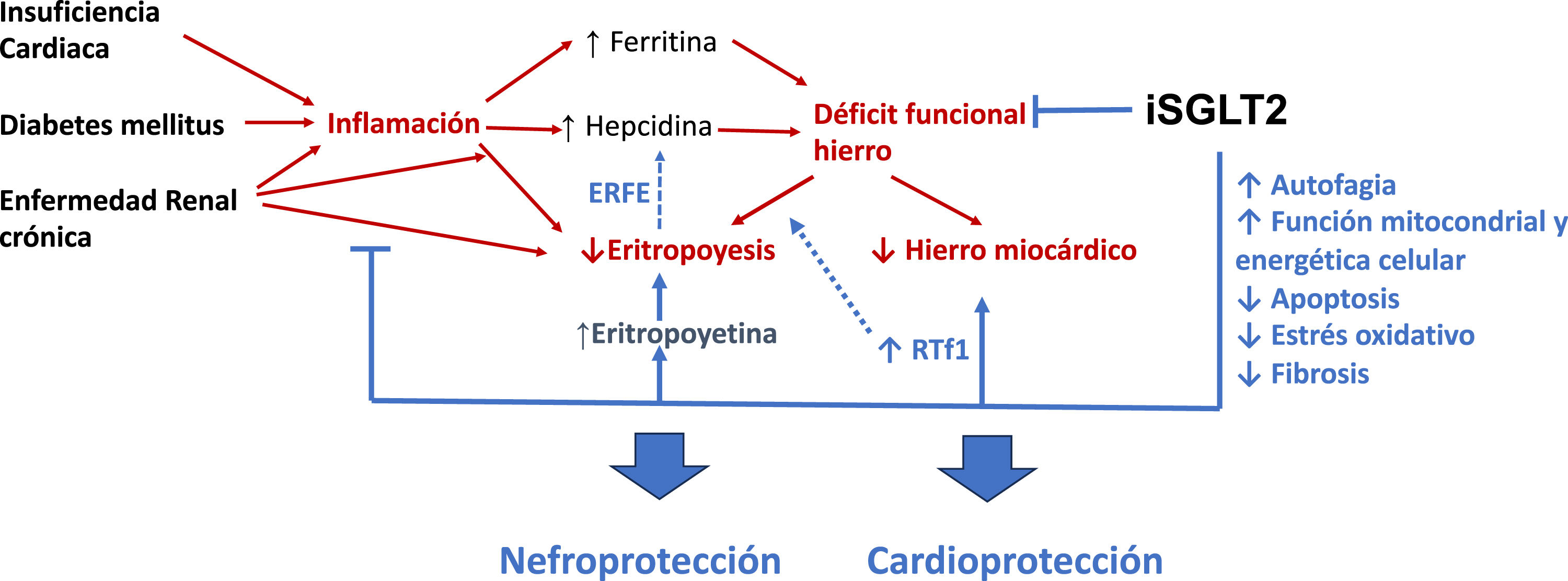
En la figura 1 se puede observar en forma de esquema los efectos beneficiosos de los iSGLT2 más allá del aumento de la eritropoyesis74,75.
Efectos beneficiosos de los iSGLT2 más allá del aumento de la eritropoyesis. Efectos indirectos en riñón y corazón74,75.
La insuficiencia cardiaca, la diabetes mellitus y la enfermedad renal crónica favorecen la inflamación, lo que aumenta los niveles de hepcidina. Ello favorece el déficit funcional de hierro, disminuyendo la disponibilidad de hierro en la médula ósea y a nivel miocárdico. Asimismo, la inflamación reduce la eritropoyesis al inhibir la síntesis de eritropoyetina y sus efectos sobre la eritropoyesis.
Los iSGLT2 mejoran la inflamación, el déficit funcional de hierro y aumentan los niveles de eritropoyetina, mejorando la eritropoyesis. Además, optimizan la autofagia, la función mitocondrial y disminuyen la apoptosis, el estrés oxidativo y la fibrosis, lo que se traduce en la nefro y cardioprotección de estos fármacos.
iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; ERFE: eritroferrona; RTf1: receptor de transferrina tipo 1.
Flechas rojas: efectos deletéreos. Flechas azules: efectos positivos.
En conclusión, el tratamiento con iSGLT2 se asocia con un aumento de los niveles de hemoglobina del orden de 0,5-0,7 g/dL, o su equivalente en hematocrito, debido a mecanismos probablemente multifactoriales. Entre estos destaca una mejoría de la eritropoyesis y de la ferrocinética sistémica. Este incremento de la hemoglobina se asocia en estudios de mediación con un mejor pronóstico cardiorrenal, lo que sugiere que tanto el incremento de la hemoglobina como de hematocrito podrían actuar como parámetros de monitorización de respuesta.
En el reciente congreso de la ASN (American Society of Nephrology) 2023 se han presentado los análisis de mediación del estudio DAPA-CKD, confirmando que el beneficio sobre el evento primario renal se explicaba principalmente por el aumento del hematocrito (35,5%) y la reducción de la albuminuria (35,4%), el efecto beneficioso del aumento del hematocrito se objetivó tanto en pacientes diabéticos, como no diabéticos76.
Asimismo, en un reciente estudio retrospectivo en pacientes con insuficiencia cardiaca con fracción de eyección reducida y déficit de hierro, el incremento de los niveles de hemoglobina tras la administración de hierro IV fueron superiores en los pacientes tratados con iSGLT2 que en aquellos no tratados77. Se ha sugerido que el aumento de hemoglobina podría incrementar la viscosidad sanguínea y aumentar el riesgo de eventos cardiovasculares78. Alternativamente, el déficit de hierro aumenta el numero y actividad de las plaquetas. Igualmente la transferrina ha demostrado su implicación en la trombosis79,80, por lo que se necesitan estudios sobre la eficacia y seguridad de la administración de hierro IV en pacientes con insuficiencia cardíaca y déficit de hierro tratados con iSGLT2.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.