La hiperpotasemia es una alteración electrolítica frecuente con consecuencias potencialmente graves a corto, medio y largo plazo, tanto en términos de morbilidad y mortalidad como de consumo de recursos del Sistema Nacional de Salud. El abordaje de la hiperpotasemia por diversas especialidades médicas y la reciente disponibilidad de nuevos tratamientos farmacológicos específicos hace necesaria una acción unificada y actualizada. El presente documento de consenso entre las sociedades científicas más directamente implicadas en el abordaje de la hiperpotasemia (Sociedad Española de Cardiología, Sociedad Española de Endocrinología y Nutrición, Sociedad Española de Medicina Interna, Sociedad Española de Medicina de Urgencias y Emergencias y Sociedad Española de Nefrología) repasa, en primer lugar, aspectos básicos del balance de potasio y de la potasemia, centrándose posteriormente en el concepto, epidemiología, fisiopatología, y abordaje diagnóstico y terapéutico de la hiperpotasemia. Se han revisado las evidencias y los principales estudios publicados con el objetivo de que sea una herramienta útil en el abordaje multidisciplinar del paciente con hiperpotasemia.
Hyperkalaemia is a common electrolyte imbalance with potentially serious short-, medium- and long-term consequences on morbidity and mortality rates and the use of national health service resources. The fact that different medical specialities can manage hyperkalaemia makes it important to have a unified approach, and the recent availability of new specific drug treatments means that the approach needs to be updated. This consensus document from the scientific societies most directly involved in the management of hyperkalaemia (Sociedad Española de Cardiología [Spanish Society of Cardiology], Sociedad Española de Endocrinología y Nutrición [Spanish Society of Endocrinology and Nutrition], Sociedad Española de Medicina Interna [Spanish Society of Internal Medicine], Sociedad Española de Medicina de Urgencias y Emergencias [Spanish Society of Emergency Medicine and Emergencies] and Sociedad Española de Nefrología [Spanish Society of Nephrology]) first of all reviews basic aspects of potassium balance and blood potassium. Then it goes on to focus on the concept, epidemiology, pathophysiology and diagnostic and therapeutic approaches to hyperkalaemia. The available evidence and the main published studies have been reviewed with the aim of providing a useful tool in the multidisciplinary approach to patients with hyperkalaemia.
La hiperpotasemia es una alteración electrolítica frecuente con consecuencias potencialmente graves a corto, medio y largo plazo, tanto en términos de morbilidad y mortalidad como de consumo de recursos del Sistema Nacional de Salud. El envejecimiento progresivo de la población, la creciente incidencia de la diabetes mellitus, la enfermedad renal crónica (ERC) y las enfermedades cardiovasculares (ECV), con especial protagonismo para la insuficiencia cardiaca, así como el uso cada vez más habitual de fármacos entre cuyos efectos adversos se encuentra el incremento de la concentración sérica de potasio, determinan que la hiperpotasemia sea cada vez más frecuente en la actividad clínica diaria.
El abordaje de la hiperpotasemia por diversas especialidades médicas y la reciente disponibilidad de nuevos tratamientos farmacológicos específicos hace necesaria una acción unificada y actualizada. Desde esta necesidad surge la iniciativa de generar un consenso entre las sociedades científicas más directamente implicadas en el abordaje de la hiperpotasemia y que firman el presente documento: Sociedad Española de Cardiología, Sociedad Española de Endocrinología y Nutrición, Sociedad Española de Medicina Interna, Sociedad Española de Medicina de Urgencias y Emergencias y Sociedad Española de Nefrología. Cada sociedad ha nombrado a representantes que han participado en la redacción del documento y que figuran como autores. El texto final es el resultado de la discusión y aprobación por todos ellos.
Este documento de consenso repasa, en primer lugar, aspectos básicos del balance de potasio y de la potasemia, y luego se centra en el concepto, la epidemiología, la fisiopatología y el abordaje diagnóstico y terapéutico de la hiperpotasemia. Se han revisado las evidencias y los principales estudios publicados con el objetivo de que sea una herramienta útil en el abordaje multidisciplinar del paciente con hiperpotasemia.
Aspectos básicos del balance de potasio y la potasemiaEl potasio es el tercer mineral más abundante en el ser humano, siendo el mantenimiento de una concentración adecuada de potasio, tanto dentro como fuera de las células, esencial para diversas funciones, incluyendo la conservación del potencial de membrana en los tejidos excitables. Múltiples mecanismos mantienen la homeostasis de potasio y la potasemia en márgenes muy estrechos. La alteración de alguno de estos mecanismos puede precipitar la aparición de hiper o hipopotasemia. Los principales factores que influyen en la potasemia son la ingesta dietética, el trasiego transcelular y la eliminación urinaria de potasio.
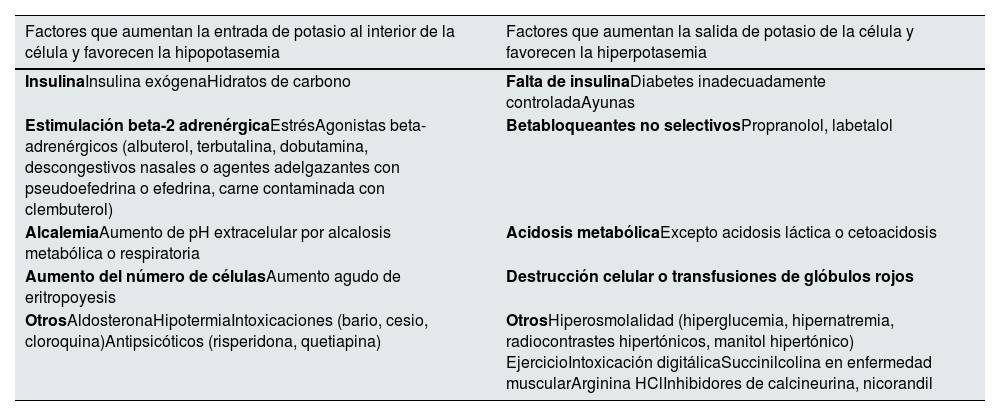
Homeostasis de la concentración intracelular y extracelular de potasioEl potasio es el principal catión intracelular. La potasemia está regulada por la entrada y salida de potasio de la célula1. El potasio procedente de la dieta se absorbe rápidamente de forma pasiva por el intestino delgado y se acumula intracelularmente antes de excretarse en orina. Diversos factores modifican su flujo transcelular. La insulina y la actividad beta-2-adrenérgica introducen potasio dentro de la célula, reduciendo la potasemia, mientras que el ejercicio, la acidosis metabólica, la hiperglucemia, la hiperosmolaridad y la destrucción tisular liberan potasio de las células, aumentando su concentración sérica. Aunque la potasemia suele mantenerse en el rango de la normalidad a pesar de las variaciones fisiológicas relacionadas con la dieta y la actividad física, incluso durante el ayuno prolongado (niveles bajos de insulina) o el ejercicio físico extremo, estas oscilaciones podrían adquirir relevancia clínica en pacientes con hipo o hiperpotasemia2–4. Por último, diversos medicamentos interfieren con el trasiego transcelular de potasio (tabla 1)5,6.
Regulación del movimiento transcelular de potasio
| Factores que aumentan la entrada de potasio al interior de la célula y favorecen la hipopotasemia | Factores que aumentan la salida de potasio de la célula y favorecen la hiperpotasemia |
|---|---|
| InsulinaInsulina exógenaHidratos de carbono | Falta de insulinaDiabetes inadecuadamente controladaAyunas |
| Estimulación beta-2 adrenérgicaEstrésAgonistas beta-adrenérgicos (albuterol, terbutalina, dobutamina, descongestivos nasales o agentes adelgazantes con pseudoefedrina o efedrina, carne contaminada con clembuterol) | Betabloqueantes no selectivosPropranolol, labetalol |
| AlcalemiaAumento de pH extracelular por alcalosis metabólica o respiratoria | Acidosis metabólicaExcepto acidosis láctica o cetoacidosis |
| Aumento del número de célulasAumento agudo de eritropoyesis | Destrucción celular o transfusiones de glóbulos rojos |
| OtrosAldosteronaHipotermiaIntoxicaciones (bario, cesio, cloroquina)Antipsicóticos (risperidona, quetiapina) | OtrosHiperosmolalidad (hiperglucemia, hipernatremia, radiocontrastes hipertónicos, manitol hipertónico) EjercicioIntoxicación digitálicaSuccinilcolina en enfermedad muscularArginina HClInhibidores de calcineurina, nicorandil |
La ingesta diaria recomendada de potasio es de alrededor de 3.500 mg (90 mEq, 90 mmol), requerimientos que se alcanzan con facilidad con la ingesta habitual, dada su amplia distribución en múltiples alimentos y bebidas7,8.
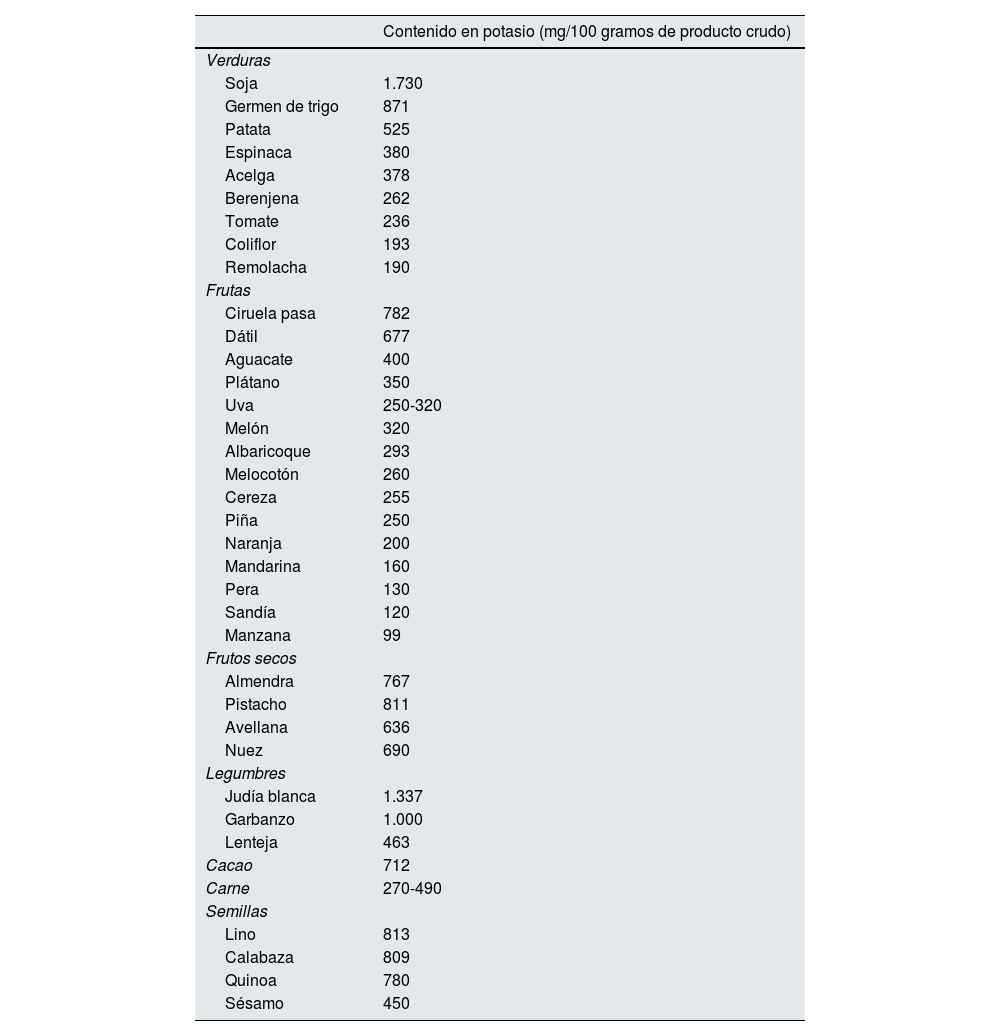
Los alimentos más ricos en potasio son las frutas y las verduras, aunque también está presente en la carne, los frutos secos, las legumbres, las semillas o el cacao (tabla 2). Otra fuente importante de potasio son las sales de potasio, utilizadas como sustitutivo de la sal común9,10. El uso de estas sales puede aumentar después de que un ensayo clínico reciente demostrara que su uso disminuye los eventos cardiovasculares y la muerte por cualquier causa en pacientes hipertensos con antecedente de ictus o edad igual o superior a 60 años11. Las fuentes vegetales de potasio son además fuente de alcalinos alimentarios, que pueden combatir la acidosis metabólica en la ERC, contribuyendo a mantener el potasio dentro de la célula.
Alimentos con alto contenido en potasio. Con fondo verde, algunos ejemplos de frutas con un contenido en potasio más bajo
| Contenido en potasio (mg/100 gramos de producto crudo) | |
|---|---|
| Verduras | |
| Soja | 1.730 |
| Germen de trigo | 871 |
| Patata | 525 |
| Espinaca | 380 |
| Acelga | 378 |
| Berenjena | 262 |
| Tomate | 236 |
| Coliflor | 193 |
| Remolacha | 190 |
| Frutas | |
| Ciruela pasa | 782 |
| Dátil | 677 |
| Aguacate | 400 |
| Plátano | 350 |
| Uva | 250-320 |
| Melón | 320 |
| Albaricoque | 293 |
| Melocotón | 260 |
| Cereza | 255 |
| Piña | 250 |
| Naranja | 200 |
| Mandarina | 160 |
| Pera | 130 |
| Sandía | 120 |
| Manzana | 99 |
| Frutos secos | |
| Almendra | 767 |
| Pistacho | 811 |
| Avellana | 636 |
| Nuez | 690 |
| Legumbres | |
| Judía blanca | 1.337 |
| Garbanzo | 1.000 |
| Lenteja | 463 |
| Cacao | 712 |
| Carne | 270-490 |
| Semillas | |
| Lino | 813 |
| Calabaza | 809 |
| Quinoa | 780 |
| Sésamo | 450 |
Fuente: Base de datos española de composición de alimentos (BEDCA) (disponible en: https://www.bedca.net/)
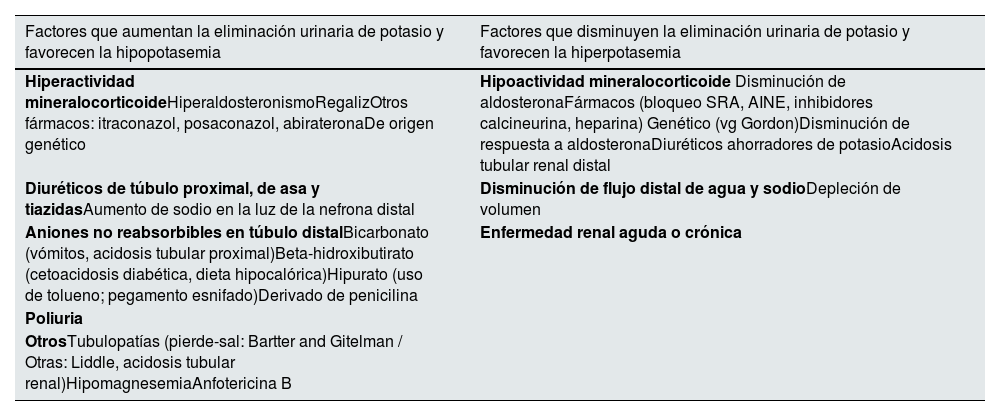
El potasio sale del organismo de forma regulada en la orina y de forma no regulada en las heces, vómito o sudor. La excreción urinaria de potasio está regulada a nivel de la nefrona distal6,7. La aldosterona promueve la secreción de potasio por las células principales del segmento conector y del tubo colector cortical, que lo intercambian por la reabsorción de sodio desde la luz tubular. Este proceso puede inhibirse, aun en presencia de hiperpotasemia, por fármacos que disminuyan los niveles o bloqueen la acción de la aldosterona, por disminución del sodio disponible en la luz de la nefrona distal o por la incapacidad de las células principales para reabsorber sodio (tabla 3). Por el contrario, el aumento de la disponibilidad de sodio en la nefrona distal (por ejemplo, por diuréticos que inhiban la reabsorción de sodio en segmentos más proximales de la nefrona) favorece la reabsorción de sodio en intercambio por potasio, que se secreta a la orina, incluso en presencia de hipopotasemia. La poliuria interfiere con la capacidad del riñón para retener potasio, ya que hay una concentración mínima de potasio urinario, y un volumen alto de orina se acompaña de una pérdida urinaria de potasio más elevada(tabla 3). La pérdida excesiva no regulada de potasio en las secreciones digestivas o en el sudor puede favorecer la hipopotasemia.
Regulación de la excreción renal de potasio
| Factores que aumentan la eliminación urinaria de potasio y favorecen la hipopotasemia | Factores que disminuyen la eliminación urinaria de potasio y favorecen la hiperpotasemia |
|---|---|
| Hiperactividad mineralocorticoideHiperaldosteronismoRegalizOtros fármacos: itraconazol, posaconazol, abirateronaDe origen genético | Hipoactividad mineralocorticoide Disminución de aldosteronaFármacos (bloqueo SRA, AINE, inhibidores calcineurina, heparina) Genético (vg Gordon)Disminución de respuesta a aldosteronaDiuréticos ahorradores de potasioAcidosis tubular renal distal |
| Diuréticos de túbulo proximal, de asa y tiazidasAumento de sodio en la luz de la nefrona distal | Disminución de flujo distal de agua y sodioDepleción de volumen |
| Aniones no reabsorbibles en túbulo distalBicarbonato (vómitos, acidosis tubular proximal)Beta-hidroxibutirato (cetoacidosis diabética, dieta hipocalórica)Hipurato (uso de tolueno; pegamento esnifado)Derivado de penicilina | Enfermedad renal aguda o crónica |
| Poliuria | |
| OtrosTubulopatías (pierde-sal: Bartter and Gitelman / Otras: Liddle, acidosis tubular renal)HipomagnesemiaAnfotericina B |
No existe una definición universalmente aceptada de hiperpotasemia. Los laboratorios ofrecen un rango de la normalidad basado en la distribución de la potasemia en la población general, pero sería deseable evolucionar a una definición de hiperpotasemia basada en el riesgo para la salud. La reciente conferencia Kidney Disease Improving Global Outcomes (KDIGO) definió hiperpotasemia como la potasemia por encima de la normalidad, teniendo en cuenta que los niveles séricos son 0,1-0,7 mEq/L más altos que los plasmáticos, por lo que los laboratorios deberían indicar en qué fluido se midió y cuáles son los valores de normalidad para cada fluido12. En los análisis de rutina se suele usar suero, mientras que en los análisis de los servicios de urgencias se suele emplear plasma por la mayor rapidez de preparación de la muestra. En cualquier caso, KDIGO sugiere clasificar la hiperpotasemia aguda en leve, moderada o grave en función de los niveles de potasio y de la repercusión electrocardiográfica, usando puntos de corte en 5,0 mEq/L (o el límite superior de la normalidad del laboratorio), 6,0 mEq/L y 6,5 mEq/L, respectivamente (tabla 4). Se considera hiperpotasemia aguda cuando esta no era conocida previamente, no habiendo consenso sobre la magnitud, duración y frecuencia de los valores elevados de potasio que definen la hiperpotasemia crónica.
Definición y gravedad de la hiperpotasemia aguda según opinión de expertos KDIGO
| Cambios ECG | Potasemia (mEq/L) | ||
|---|---|---|---|
| 5,0 (o límite superior de la normalidad) a 5,9 | 6,0–6,4 | ≥ 6,5 | |
| Sí | Moderada | Grave | Grave |
| No | Leve | Moderada | Grave |
ECG: electrocardiograma
Basado en referencia 12
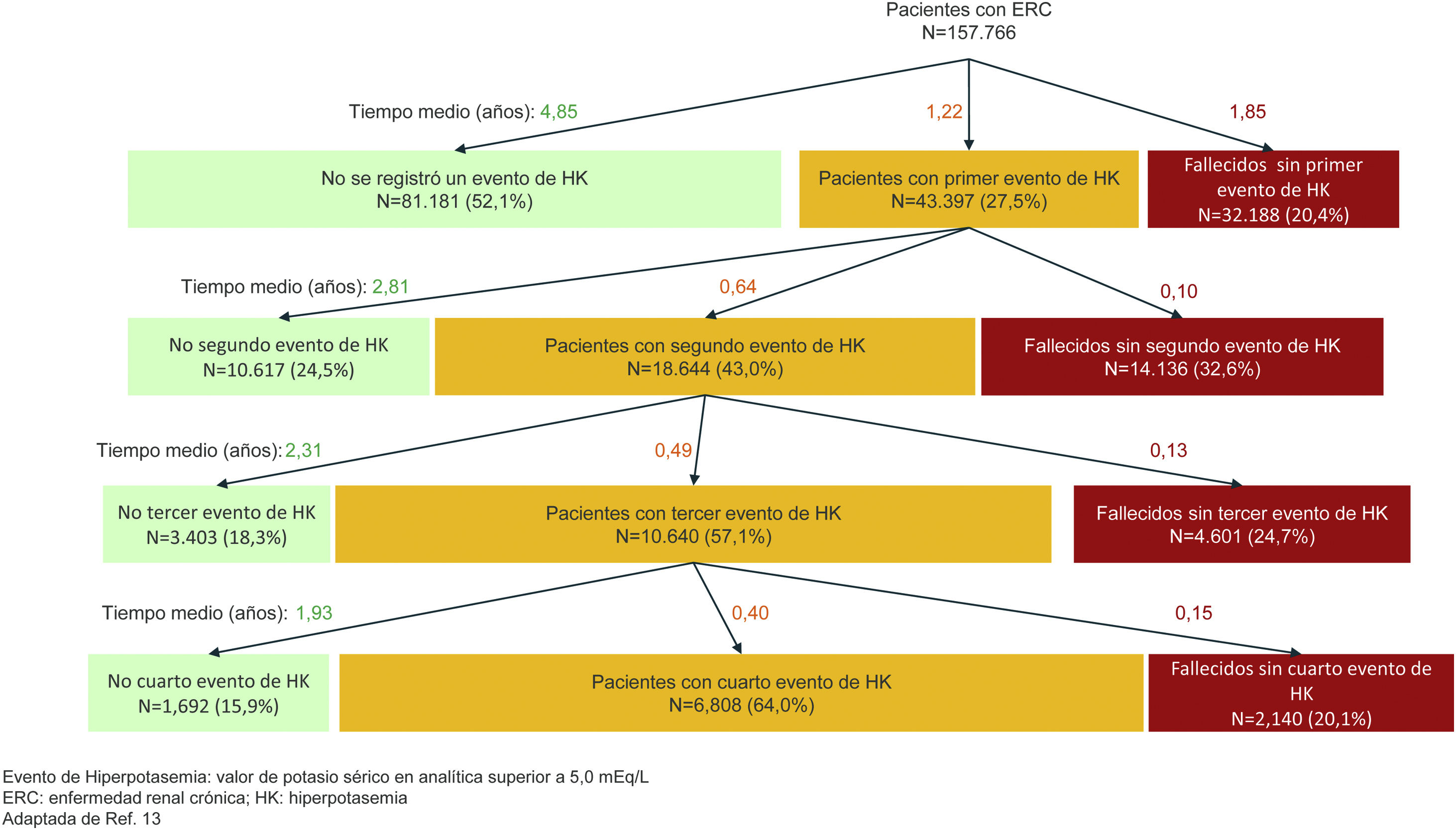
En laboratorios clínicos, la prevalencia de hiperpotasemia, definida como potasemia mayor de 5,0 mEq/L, es alrededor de 3-4% en poblaciones no seleccionadas, pero aumenta mucho en poblaciones con factores predisponentes. La máxima prevalencia se observa en pacientes en hemodiálisis. Un estudio reciente en pacientes con ERC y filtrado glomerular (FG) inferior a 60 mL/min/1,73 m2 ilustra la historia natural de la hiperpotasemia como un fenómeno recurrente, con aumento progresivo del riesgo de recurrencia y con plazos hasta la nueva recurrencia progresivamente menores (fig. 1)13. La incidencia de hiperpotasemia con potasemia superior a 5,0 mEq/L fue de 9, 18, 31 y 42% en un año, en las personas con FG de 45-59, 30-44, 15-29 y < 15 mL/min/1,73 m2, respectivamente13. En este sentido, la incapacidad del riñón para eliminar adecuadamente el potasio de la dieta es el principal factor predisponente, bien porque haya una ERC u otras condiciones que limitan la excreción renal de potasio, o bien por la toma de fármacos que interfieren con su eliminación renal, de los cuales los principales son los bloqueantes del sistema renina-angiotensina (SRA), los diuréticos ahorradores de potasio y los antagonistas del receptor mineralocorticoide (ARM) (tabla 5). La hiperpotasemia es especialmente frecuente si se combinan varios de estos factores.
Incidencia del primer episodio de hiperpotasemia y recurrencia de la hiperpotasemia en pacientes con ERC (adaptado de Thomsen RW, et al.13).
Condiciones y fármacos asociados a hiperpotasemia
| Condiciones |
| Enfermedad renal crónica: baja tasa de filtración glomerular y/o proteinuria elevada |
| Diabetes mellitus |
| Enfermedad cardiovascular |
| Insuficiencia cardíaca congestiva |
| Arteriopatía coronaria |
| Enfermedad arterial periférica |
| Malignidad |
| Anemia |
| Hiperlipidemia |
| Acidosis metabólica (no orgánica) |
| Reducción de la secreción o de la respuesta a la aldosterona |
| Tubulopatía: acidosis tubular renal dependiente de voltaje o alteración selectiva de la secreción de potasio |
| Gota |
| Ureteroyeyunostomía |
| Desintegración de células o tejidos (p. ej., rabdomiólisis, hemólisis) |
| Ejercicio |
| Fármacos |
| Inhibidores del sistema renina-angiotensina-aldosterona |
| Diuréticos ahorradores de potasio |
| β-bloqueantes |
| Antiinflamatorios no esteroideos |
| Suplementos de potasio o sales que contienen cloruro potásico |
| Inhibidores de la calcineurina (ciclosporina, tacrolimus) |
| Manitol |
| Heparina |
| Digital |
| Penicilina G |
| Succinilcolina |
| Octreotide |
| Diazóxido |
| Minoxidil |
| Anestésicos volátiles (p. ej., isoflurano) |
La hiperpotasemia se asocia a peores resultados en salud. La hiperpotasemia aguda grave puede ser letal, además, la hiperpotasemia se asocia a un aumento del riesgo de hospitalizaciones (incluyendo aumento de eventos cardiacos, arritmias ventriculares, paro cardiaco y cuidados intensivos) y muerte en los siguientes seis meses, que oscila entre dos y cinco veces la observada en los controles, incluso en poblaciones en las que se podría presuponer una mayor tolerancia a la hiperpotasemia, como son los pacientes con ERC12. La asociación entre hiperpotasemia y eventos podría tener varias causas, incluyendo causalidad por sí misma (por ejemplo, arritmias ventriculares malignas), o causas relacionadas como el uso subóptimo de medicamentos con reconocidos beneficios cardiovasculares y renales, como los bloqueantes del SRA o los ARM, la conjunción de comorbilidades o incluso la prescripción de dietas pobres en potasio que sean poco cardiosaludables.
Abordaje diagnóstico de la hiperpotasemiaTiene dos aspectos:
Diagnosticar la hiperpotasemia y su gravedad. Los criterios para la clasificación de la gravedad de la hiperpotasemia, según KDIGO, se detallan en el apartado anterior12 (tabla 4). La hiperpotasemia grave o con repercusión electrocardiográfica es una emergencia que requiere de tratamiento inmediato14. Otras situaciones que también pueden considerarse como una emergencia hiperpotasémica son la presencia de síntomas clínicos (especialmente debilidad o parálisis muscular), una hiperpotasemia grave (potasemia > 6,5 mEq/L), especialmente si hay hemorragia digestiva o destrucción tisular (que favorece que siga habiendo un aporte descontrolado de potasio al espacio extracelular), aun en ausencia de signos o síntomas, y también algunos casos de hiperpotasemia menos grave (> 5,5 mEq/L) que se prevea que puede empeorar a corto plazo por situaciones como insuficiencia renal, destrucción tisular, presencia de acidosis metabólica o respiratoria, o absorción continua de potasio a nivel digestivo por hemorragia gastrointestinal15.
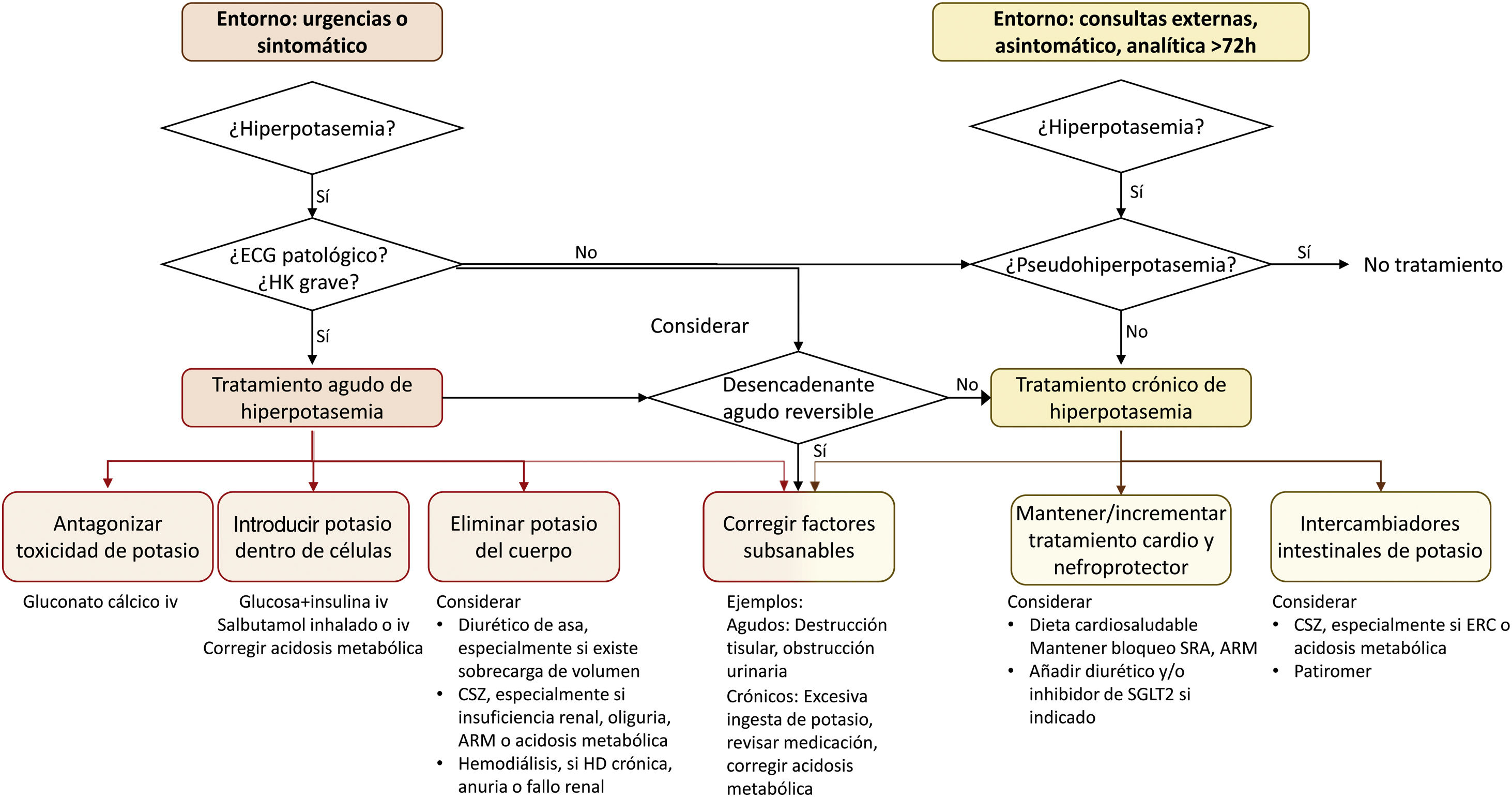
Diagnóstico etiológico de la hiperpotasemia (fig. 2), basado en la evaluación de la función renal, los antecedentes de factores de riesgo de disfunción renal, uso de fármacos, diuresis, presión arterial y estado de hidratación. En ausencia de otro factor de riesgo, la cantidad de potasio dietético es una causa muy infrecuente de hiperpotasemia.
Algoritmo terapéutico de la hiperpotasemia. Se distinguen dos situaciones clínicas en las que se puede observar hiperpotasemia y que requieren tratamiento agudo y tratamiento crónico, respectivamente; aunque en ausencia de un factor desencadenante claro que sea transitorio, toda hiperpotasemia grave requiere medidas crónicas para evitar nuevos episodios. Estas medidas crónicas deben priorizar mantener o incrementar la cardio-nefroprotección siempre que sea posible.
CSZ: ciclosilicato de sodio y zirconio; ERC: enfermedad renal crónica, HK: hiperpotasemia; ECG: electrocardiograma; ARM: antagonista de receptor mineralocorticoide, SRA: sistema renina-angiotensina; SGLT2: sodium-glucose cotransporter-2.
Hay que descartar pseudohiperpotasemia, en donde la hiperpotasemia se debe a una toma inadecuada de la muestra (excesiva contracción muscular durante la venopunción, contaminación de la muestra con soluciones o nutriciones parenterales) o a la salida del potasio de las células después de la toma de la muestra, como hemólisis cuando hay un gran número de células sanguíneas (eritrocitosis, leucocitosis, trombocitosis) o en personas con determinadas variantes genéticas16. Se debe sospechar pseudohiperpotasemia cuando no hay causa aparente para la hiperpotasemia y no existe repercusión clínica ni electrocardiográfica.
Un incremento agudo de la potasemia puede deberse a redistribución por liberación del potasio intracelular, cuya causa se suele identificar mediante la historia clínica, como el síndrome de lisis tumoral, la acidosis metabólica o la cetoacidosis diabética17. Si la hiperpotasemia es persistente, probablemente se deberá a una reducción de la excreción urinaria de potasio secundaria a una inapropiada respuesta a la aldosterona (por menor secreción o por resistencia), a enfermedad renal aguda o crónica, o a una disminución del volumen circulante eficaz como ocurre en la depleción de volumen, en la insuficiencia cardiaca o en la cirrosis.
En la hiperpotasemia persistente sin insuficiencia renal, el análisis de electrolitos en orina puede ayudar a determinar la causa. La excreción urinaria de potasio en orina de 24 h está condicionada por la ingesta de potasio dietético, que por sí sola no suele producir hiperpotasemia en individuos sanos18. Una determinación de sodio bajo en orina orienta a una disminución del volumen circulante eficaz. El grado de actividad de la aldosterona se podría estimar a partir de la concentración de potasio en el túbulo colector. Durante años se usó el gradiente transtubular de potasio (TTKG):
(K+[orina] / K+[plasma]) * (OSMOLARIDAD[plasma] / OSMOLARIDAD[orina]).
Un TTKG < 6 en presencia de hiperpotasemia indicaría una insuficiente respuesta a aldosterona o hipoaldosteronismo, que debería evaluarse mediante la respuesta del TTKG a la administración de mineralocorticoides19. Sin embargo, los autores de la ecuación indicaron posteriormente que los postulados teóricos en los que se basa podrían no ser válidos, ya que no considera el efecto de la reabsorción tubular distal de urea sobre la excreción de potasio20. En cualquier caso, si la hiperpotasemia es persistente y no se objetiva causa, se debe estudiar un posible hipoaldosteronismo.
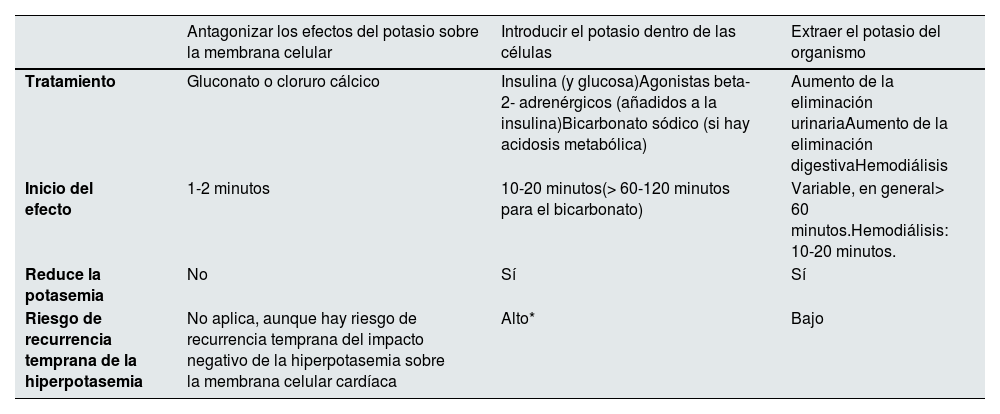
Tratamiento de la hiperpotasemiaTratamiento agudo de la hiperpotasemia graveEl tratamiento pretende evitar la letalidad aguda de la hiperpotasemia y disminuir la potasemia mediante tres tipos de maniobras15: 1) antagonizar los efectos del potasio sobre la membrana celular; 2) introducir el potasio dentro de las células; 3) sacar el potasio del organismo (Box 1, tabla 6). Solo las dos últimas reducen la potasemia.
Tratamiento agudo de la hiperpotasemia grave
| Antagonizar los efectos del potasio sobre la membrana celular | Introducir el potasio dentro de las células | Extraer el potasio del organismo | |
|---|---|---|---|
| Tratamiento | Gluconato o cloruro cálcico | Insulina (y glucosa)Agonistas beta-2- adrenérgicos (añadidos a la insulina)Bicarbonato sódico (si hay acidosis metabólica) | Aumento de la eliminación urinariaAumento de la eliminación digestivaHemodiálisis |
| Inicio del efecto | 1-2 minutos | 10-20 minutos(> 60-120 minutos para el bicarbonato) | Variable, en general> 60 minutos.Hemodiálisis: 10-20 minutos. |
| Reduce la potasemia | No | Sí | Sí |
| Riesgo de recurrencia temprana de la hiperpotasemia | No aplica, aunque hay riesgo de recurrencia temprana del impacto negativo de la hiperpotasemia sobre la membrana celular cardíaca | Alto* | Bajo |
*Si no se extrae el potasio del organismo y el defecto primario no era un aumento de salida de potasio desde dentro de la célula.
El calcio antagoniza el efecto del potasio sobre la membrana celular cardiaca. El comienzo de acción del calcio es de pocos minutos, pero dura solamente de 30 a 60 min, lo que obliga a utilizarlo en combinación con otras estrategias. Está disponible en dos preparados: gluconato y cloruro cálcico. Se prefiere 1.000 mg de gluconato cálcico administrado i.v. en dos a tres minutos con monitorización cardiaca por mayor comodidad de uso y menor efecto lesivo sobre las venas si se extravasa. Si la emergencia persiste, se puede repetir la administración de calcio cada 30-60 min si no hay un incremento de la calcemia.
Introducir el potasio dentro de las célulasLa administración de insulina y/o agonistas beta-2-adrenérgicos y/o bicarbonato sódico (este último solo si existe acidosis metabólica) favorece la entrada de potasio dentro de la célula.
La insulina activa la bomba de intercambio sodio-potasio-ATPasa (Na/K-ATPasa) en la membrana celular, especialmente de la célula muscular. Es la medida más eficaz. Su efecto comienza en 10-20 min y dura hasta seis horas. La insulina generalmente se administra con glucosa para prevenir hipoglucemias o sola si la glucemia es mayor de 250 mg/dL. Una de las pautas más extendidas es la administración intravenosa de 10 unidades de insulina en 500 mL de suero glucosado al 10% durante una hora. El objetivo es mantener el efecto de la insulina y evitar la aparición de hipoglucemia.
Los agonistas beta-2-adrenérgicos también activan la bomba Na/K-ATPasa. Son eficaces tanto inhalados como en administración intravenosa y están indicados como complemento a la administración de insulina. Suele emplearse el salbutamol, 10-20 mg en 10 min si es inhalado (una dosis muy superior a la administrada en el tratamiento del broncoespasmo), o 0,5 mg en 100 mL de glucosa a 5% en 15 min si es por vía intravenosa. Su acción se inicia en 10 min si es inhalado y 15 min si es intravenoso, durando tres horas. Puede producir taquicardia. La combinación de insulina y agonistas beta-2-adrenérgicos tienen un efecto aditivo sobre la reducción de la potasemia, por lo que es más eficaz que su empleo por separado.
El bicarbonato sódico se añade a las medidas anteriores solo si existe acidosis metabólica. No se considera una medida fundamental al tener mucho menos efecto, y más tardío, que las otras maniobras.
Extraer el potasio del organismoSe puede conseguir por tres vías: incremento de la eliminación urinaria, de la eliminación digestiva o mediante diálisis.
- •
Aumento de eliminación urinaria. Solo los diuréticos de asa tienen un inicio y magnitud de acción que les permite ser útiles en el tratamiento agudo de la hiperpotasemia en pacientes con función renal normal o ligeramente deteriorada, pero podrían no ser eficaces si la insuficiencia renal es grave. La administración concomitante de diuréticos de asa o tiazídicos podría tener un efecto coadyuvante, especialmente en pacientes con hipervolemia21.
- •
Aumento de eliminación digestiva. Hay tres opciones:
- 1.
Resinas de intercambio iónico como el poliestireno sulfonato sódico o cálcico. Su empleo en situaciones de hiperpotasemia aguda es limitado, dado su lento inicio de acción y ausencia de ensayos clínicos que hayan demostrado eficacia. En un ensayo clínico controlado con placebo, la asociación de resinsodio con catárticos no redujo la potasemia más que placebo en las 12 h siguientes 22.
- 2.
Patiromer. Es un polímero no absorbible que contiene un complejo calcio-sorbitol. Captura potasio en el colon en intercambio por calcio, teniendo también capacidad de captar magnesio. Reduce así la concentración de potasio libre en la luz intestinal y aumenta su excreción fecal. Hay tres presentaciones autorizadas en forma de polvo para suspensión oral de 8,4, 16,8 y 25,2 g. REDUCE fue un estudio piloto abierto unicéntrico, que aleatorizó a 43 pacientes en hemodiálisis con potasemia ≥ 6,0 mEq/L a tratamiento habitual con o sin (grupo control sin placebo) la adición de 25,2 g de patiromer, siendo finalmente evaluados 30 pacientes23 (NCT02933450). El objetivo primario fue la potasemia a las seis horas, no observándose diferencias entre los grupos: patiromer 5,8 mEq/L (intervalo de confianza de 95% [IC 95%] 5,4-6,1 mEq/L) y control 6,3 mEq/L (IC 95%, 6,0-6,6 mEq/L). Sin embargo, a las dos horas, la potasemia fue menor en el grupo de patiromer que en el grupo control: 5,9 mEq/L (IC 95%, 5,6-6,1 mEq/L) vs. 6,5 mEq/L (IC 95%, 6,2-6,7 mEq/L), siendo la concentración basal de potasio de 6,4 ± 0,5 y 6,7 ± 0,5 mEq/L, respectivamente. La escasa eficacia del «tratamiento habitual» se explica porque solo consistió en insulina (33% de pacientes) o beta-adrenérgicos antes de las dos horas en menos de la mitad de los pacientes, mientras que en ese periodo los pacientes aleatorizados a patiromer también habían recibido insulina (40%) o beta-adrenérgicos. Es decir, a las dos horas se comparó patiromer con no intervención en más de la mitad de los pacientes.
- 3.
Ciclosilicato de sodio y zirconio (CSZ). Es un captor de potasio cristalino, no polimérico y no absorbible. El estudio ENERGIZE (NCT03337477)24 fue un ensayo clínico en fase 2, multicéntrico, doble ciego y controlado con placebo, donde se evaluó la eficacia del CSZ en el tratamiento de emergencia de la hiperpotasemia, añadido a glucosa e insulina, siendo el objetivo primario el cambio en la potasemia a las cuatro horas. Se incluyeron pacientes con edad ≥ 18 años admitidos en un Servicio de Urgencias y con una potasemia ≥ 5,8 mEq/L medida usando un analizador rápido i-STAT (Abbott Point of Care, Inc. Chicago, IL, EE. UU.), confirmado por una determinación simultánea de potasio sérico en un laboratorio central. Aunque se estimó un tamaño muestral de 132 participantes para lograr una adecuada potencia estadística, solamente se aleatorizaron 70 pacientes a recibir 10 g CSZ (repetibles a las cuatro y 10 h) o placebo. En total, 30,3% (10/33) y 43,2% (16/37) de los pacientes randomizados a CSZ y placebo, respectivamente, discontinuaron el tratamiento. La tasa de finalización del tratamiento fue de 57,6% en el grupo CSZ y de 45,9% en el grupo placebo. A las cuatro horas no hubo diferencias significativas en la reducción del potasio sérico entre ambos grupos: cambio medio (mínimos cuadrados) ajustado por covariables de -0,41 ± 0,11 vs. -0,27 ± 0,10 mEq/L, en CSZ y placebo respectivamente (diferencia -0,13 mEq/L; IC 95%, -0,44 a 0,17). Aproximadamente la mitad de los pacientes que recibían tratamiento en cada grupo (57,6% en el grupo CSZ y 45,9% en el grupo placebo) no tenían a las cuatro horas una medición central del potasio sérico, usándose el valor obtenido con el i-STAT ajustados para corregir la diferencia entre ambos métodos. Seis pacientes en el grupo CSZ (18,2%) y 10 (27%) en el grupo placebo carecían de determinación de potasio sérico por ambos métodos, siendo los datos imputados usando la última determinación realizada hasta cuatro horas inclusive. Los autores reconocen como limitación adicional las potenciales diferencias en las estrategias terapéuticas entre los distintos centros en relación con el empleo de terapias de rescate. En la valoración del nivel de potasio, a las dos horas hubo una mayor reducción de la potasemia en los pacientes aleatorizados a CSZ comparado con placebo: -0,72 ± 0,12 vs. -0,36 ± 0,11 mEq/L (diferencia -0,35 mEq/L; IC 95%, -0,68 a -0,02). Finalmente, en relación con aspectos de seguridad, una proporción similar de pacientes experimentaron efectos adversos en ambos grupos en las primeras 24 h, siendo a partir de ese momento más frecuentes en aquellos que recibieron CSZ (24,1 vs. 9,1%). No hubo diferencias en cuanto a efectos adversos severos. Como resumen de este apartado, CSZ es la única intervención para aumentar la eliminación digestiva de potasio que ha sido evaluada en un ensayo clínico controlado por placebo en el tratamiento agudo de la hiperpotasemia como estrategia añadida a las habitualmente usadas para introducir el potasio dentro de las células, demostrando disminuir más la potasemia a tiempos tempranos (dos horas) que placebo (Box 2). Se encuentra actualmente en marcha el estudio PLATINUM, un ensayo clínico multicéntrico, randomizado, controlado por placebo, que evalúa aspectos relacionados con el uso de Patiromer en el contexto de la hiperpotasemia en los servicios de urgencia.
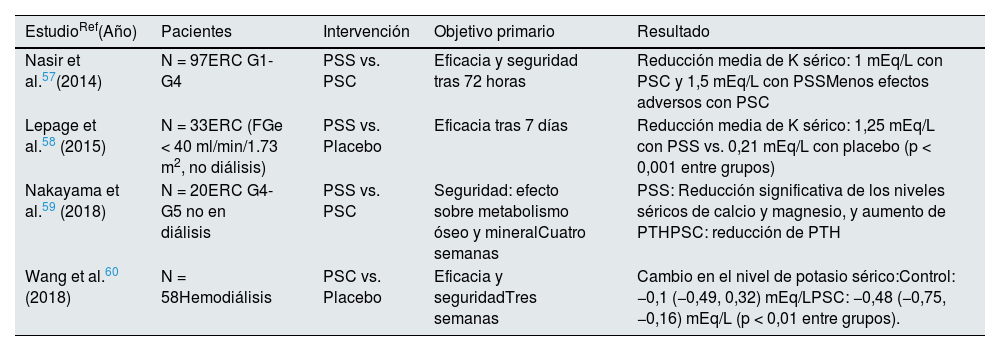
Tabla 8.Ensayos clínicos con resinas de intercambio catiónico en el tratamiento de la hiperpotasemia
EstudioRef(Año) Pacientes Intervención Objetivo primario Resultado Nasir et al.57(2014) N = 97ERC G1-G4 PSS vs. PSC Eficacia y seguridad tras 72 horas Reducción media de K sérico: 1 mEq/L con PSC y 1,5 mEq/L con PSSMenos efectos adversos con PSC Lepage et al.58 (2015) N = 33ERC (FGe < 40 ml/min/1.73 m2, no diálisis) PSS vs. Placebo Eficacia tras 7 días Reducción media de K sérico: 1,25 mEq/L con PSS vs. 0,21 mEq/L con placebo (p < 0,001 entre grupos) Nakayama et al.59 (2018) N = 20ERC G4-G5 no en diálisis PSS vs. PSC Seguridad: efecto sobre metabolismo óseo y mineralCuatro semanas PSS: Reducción significativa de los niveles séricos de calcio y magnesio, y aumento de PTHPSC: reducción de PTH Wang et al.60 (2018) N = 58Hemodiálisis PSC vs. Placebo Eficacia y seguridadTres semanas Cambio en el nivel de potasio sérico:Control: −0,1 (−0,49, 0,32) mEq/LPSC: −0,48 (−0,75,−0,16) mEq/L (p < 0,01 entre grupos). ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; PSC: poliestireno sulfonato cálcico: PSS: poliestireno sulfonato sódico; PTH: hormona paratiroidea.
- •
Hemodiálisis. En una emergencia hiperpotasémica, especialmente en pacientes que están en programas de diálisis crónica, la hemodiálisis es el tratamiento de elección25, ya que es la estrategia más rápida y eficiente para reducir la potasemia, debiendo ser aplicada a la mayor brevedad, aunque el empleo de la hemodiálisis no excluye que se puedan aplicar las medidas anteriormente comentadas. En los pacientes con ERC avanzada, que todavía no se encuentren en programas de diálisis, hay que considerar la hemodiálisis, para lo cual será necesario canalizar un acceso vascular adecuado para dializar. En general, y en función de la concentración basal de potasemia, las alteraciones asociadas a la hiperpotasemia se resuelven en los primeros 30-60 min de hemodiálisis.
Excepto cuando hay una clara causa transitoria y aislada que desencadena el episodio de hiperpotasemia, en general los pacientes con hiperpotasemia grave tienen un elevado riesgo de hiperpotasemia recurrente, debido a la cronicidad de los factores predisponentes habituales (ERC, insuficiencia cardiaca, diabetes y sus tratamientos) y precisan una intervención crónica. En este campo se han producido novedades recientemente (Box 3) que han cambiado el abordaje terapéutico de esta complicación (Box 4).
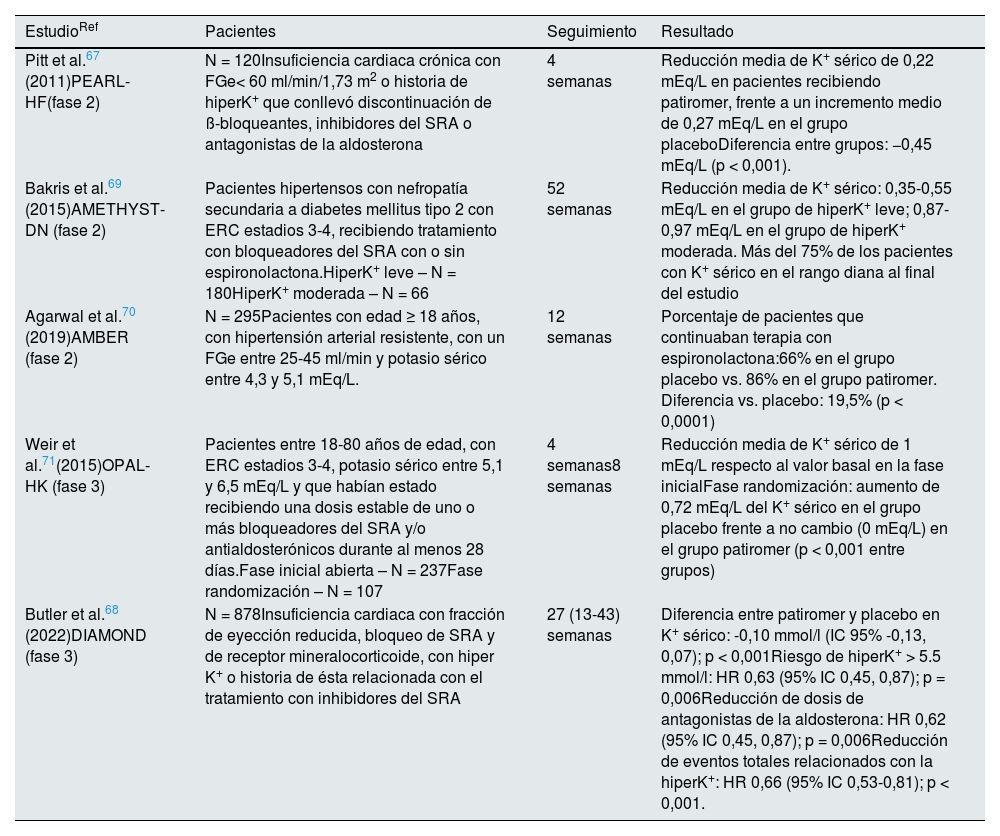
Ensayos clínicos fase 2/3 con patiromer
| EstudioRef | Pacientes | Seguimiento | Resultado |
|---|---|---|---|
| Pitt et al.67 (2011)PEARL-HF(fase 2) | N = 120Insuficiencia cardiaca crónica con FGe< 60 ml/min/1,73 m2 o historia de hiperK+ que conllevó discontinuación de ß-bloqueantes, inhibidores del SRA o antagonistas de la aldosterona | 4 semanas | Reducción media de K+ sérico de 0,22 mEq/L en pacientes recibiendo patiromer, frente a un incremento medio de 0,27 mEq/L en el grupo placeboDiferencia entre grupos: −0,45 mEq/L (p < 0,001). |
| Bakris et al.69 (2015)AMETHYST-DN (fase 2) | Pacientes hipertensos con nefropatía secundaria a diabetes mellitus tipo 2 con ERC estadios 3-4, recibiendo tratamiento con bloqueadores del SRA con o sin espironolactona.HiperK+ leve – N = 180HiperK+ moderada – N = 66 | 52 semanas | Reducción media de K+ sérico: 0,35-0,55 mEq/L en el grupo de hiperK+ leve; 0,87-0,97 mEq/L en el grupo de hiperK+ moderada. Más del 75% de los pacientes con K+ sérico en el rango diana al final del estudio |
| Agarwal et al.70 (2019)AMBER (fase 2) | N = 295Pacientes con edad ≥ 18 años, con hipertensión arterial resistente, con un FGe entre 25-45 ml/min y potasio sérico entre 4,3 y 5,1 mEq/L. | 12 semanas | Porcentaje de pacientes que continuaban terapia con espironolactona:66% en el grupo placebo vs. 86% en el grupo patiromer. Diferencia vs. placebo: 19,5% (p < 0,0001) |
| Weir et al.71(2015)OPAL-HK (fase 3) | Pacientes entre 18-80 años de edad, con ERC estadios 3-4, potasio sérico entre 5,1 y 6,5 mEq/L y que habían estado recibiendo una dosis estable de uno o más bloqueadores del SRA y/o antialdosterónicos durante al menos 28 días.Fase inicial abierta – N = 237Fase randomización – N = 107 | 4 semanas8 semanas | Reducción media de K+ sérico de 1 mEq/L respecto al valor basal en la fase inicialFase randomización: aumento de 0,72 mEq/L del K+ sérico en el grupo placebo frente a no cambio (0 mEq/L) en el grupo patiromer (p < 0,001 entre grupos) |
| Butler et al.68 (2022)DIAMOND (fase 3) | N = 878Insuficiencia cardiaca con fracción de eyección reducida, bloqueo de SRA y de receptor mineralocorticoide, con hiper K+ o historia de ésta relacionada con el tratamiento con inhibidores del SRA | 27 (13-43) semanas | Diferencia entre patiromer y placebo en K+ sérico: -0,10 mmol/l (IC 95% -0,13, 0,07); p < 0,001Riesgo de hiperK+ > 5.5 mmol/l: HR 0,63 (95% IC 0,45, 0,87); p = 0,006Reducción de dosis de antagonistas de la aldosterona: HR 0,62 (95% IC 0,45, 0,87); p = 0,006Reducción de eventos totales relacionados con la hiperK+: HR 0,66 (95% IC 0,53-0,81); p < 0,001. |
ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; HiperK+: hiperpotasemia; SRA: sistema renina-angiotensina.
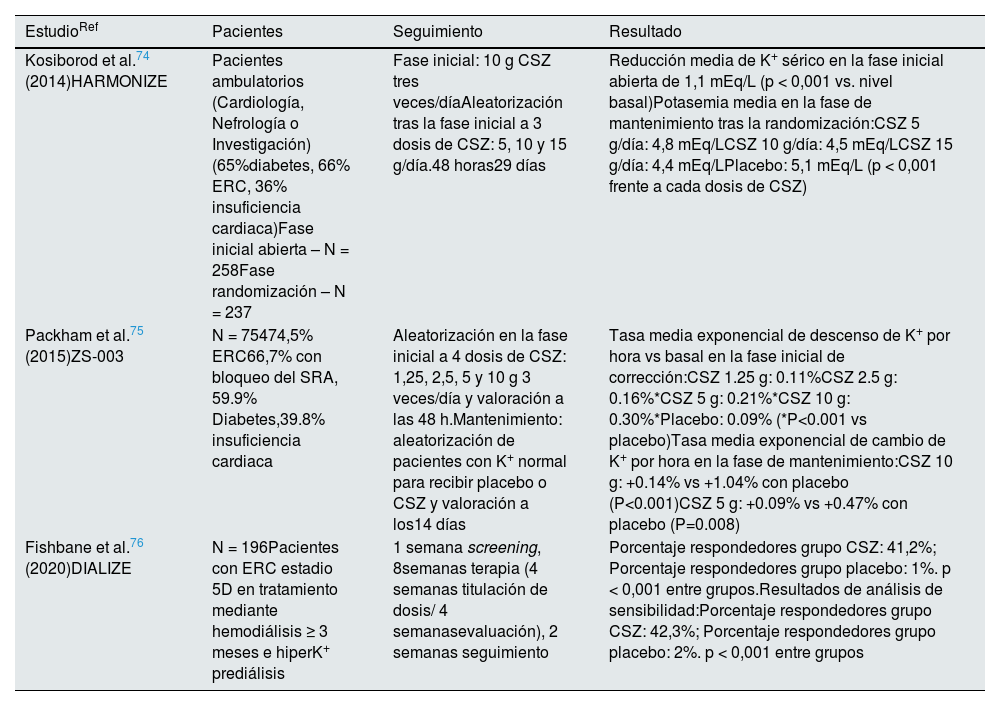
Ensayos clínicos fase 3 con ciclosilicato de sodio-zirconio (CSZ)
| EstudioRef | Pacientes | Seguimiento | Resultado | |
|---|---|---|---|---|
| Kosiborod et al.74 (2014)HARMONIZE | Pacientes ambulatorios (Cardiología, Nefrología o Investigación) (65%diabetes, 66% ERC, 36% insuficiencia cardiaca)Fase inicial abierta – N = 258Fase randomización – N = 237 | Fase inicial: 10 g CSZ tres veces/díaAleatorización tras la fase inicial a 3 dosis de CSZ: 5, 10 y 15 g/día.48 horas29 días | Reducción media de K+ sérico en la fase inicial abierta de 1,1 mEq/L (p < 0,001 vs. nivel basal)Potasemia media en la fase de mantenimiento tras la randomización:CSZ 5 g/día: 4,8 mEq/LCSZ 10 g/día: 4,5 mEq/LCSZ 15 g/día: 4,4 mEq/LPlacebo: 5,1 mEq/L (p < 0,001 frente a cada dosis de CSZ) | |
| Packham et al.75 (2015)ZS-003 | N = 75474,5% ERC66,7% con bloqueo del SRA, 59.9% Diabetes,39.8% insuficiencia cardiaca | Aleatorización en la fase inicial a 4 dosis de CSZ: 1,25, 2,5, 5 y 10 g 3 veces/día y valoración a las 48 h.Mantenimiento: aleatorización de pacientes con K+ normal para recibir placebo o CSZ y valoración a los14 días | Tasa media exponencial de descenso de K+ por hora vs basal en la fase inicial de corrección:CSZ 1.25 g: 0.11%CSZ 2.5 g: 0.16%*CSZ 5 g: 0.21%*CSZ 10 g: 0.30%*Placebo: 0.09% (*P<0.001 vs placebo)Tasa media exponencial de cambio de K+ por hora en la fase de mantenimiento:CSZ 10 g: +0.14% vs +1.04% con placebo (P<0.001)CSZ 5 g: +0.09% vs +0.47% con placebo (P=0.008) | |
| Fishbane et al.76 (2020)DIALIZE | N = 196Pacientes con ERC estadio 5D en tratamiento mediante hemodiálisis ≥ 3 meses e hiperK+ prediálisis | 1 semana screening, 8semanas terapia (4 semanas titulación de dosis/ 4 semanasevaluación), 2 semanas seguimiento | Porcentaje respondedores grupo CSZ: 41,2%; Porcentaje respondedores grupo placebo: 1%. p < 0,001 entre grupos.Resultados de análisis de sensibilidad:Porcentaje respondedores grupo CSZ: 42,3%; Porcentaje respondedores grupo placebo: 2%. p < 0,001 entre grupos | |
ERC: enfermedad renal crónica; hiperK+: hiperpotasemia; SRA: sistema renina-angiotensina.
La reducción del contenido de potasio en la dieta es una medida prácticamente universal ante la hiperpotasemia, a pesar de que la mayoría de las recomendaciones de las guías de práctica clínica para el manejo dietético de la hiperpotasemia están basadas en opiniones de expertos, dada la limitada evidencia y los sesgos de los estudios disponibles26. Un metaanálisis reciente reveló que la restricción dietética de potasio con el objetivo de reducir la potasemia presenta una evidencia de muy baja calidad, no pudiendo concluirse que disminuya el riesgo de muerte ni enlentezca la progresión de la ERC27.
La reducción de la carga de potasio de la dieta se debe integrar con el resto de los objetivos nutricionales del paciente con ERC (aporte proteico adecuado, ingesta elevada de fibra y patrón dietético cardiovascular saludable) mediante las siguientes estrategias28:
Educación nutricional para conocer los alimentos con mayor contenido en potasio, recomendaciones sobre la alimentación necesaria para mantener un buen estado nutricional en la ERC e indicaciones sobre la clasificación de alimentos en función de la cantidad de potasio en relación con la fibra. En este sentido se debe formar al paciente para que aprenda a interpretar las fichas nutricionales y el etiquetado de los alimentos, con el fin de que pueda elegir los alimentos más adecuados para su situación clínica.
Empleo de las técnicas culinarias adecuadas para la preparación de los alimentos que resulten en menor contenido en potasio, como la cocción en agua, olla a presión o en microondas para todos los alimentos, y el remojo prolongado en agua de tubérculos, raíces, hortalizas de hoja y crucíferas29.
Detección de las fuentes ocultas de potasio, como los sustitutos de la sal con bajo contenido en sodio (sin evidencia en pacientes con riesgo de hiperpotasemia), y determinados aditivos alimentarios, utilizados hasta en 40% de los productos procesados (fundamentalmente en derivados cárnicos, productos empanados, bebidas no alcohólicas, productos listos para el consumo y derivados de cereales)30. Los aditivos alimentarios empleados con más frecuencia que contienen potasio son E202, E252, E340, E450, E452, E508 y E95031. Es importante que el paciente los identifique mediante la inspección del etiquetado nutricional y restrinja su consumo.
Los alimentos ricos en potasio que de manera general se deben evitar para reducir el riesgo de hiperpotasemia se recogen en la tabla 2, que también incluye algunos ejemplos de alternativas bajas en potasio, debidamente señaladas.
El cumplimiento de una dieta baja en potasio no es fácil, dado que existen barreras como el consejo dietético fragmentado, la contraindicación de pautas de alimentación saludable y los potenciales cambios en el apetito y el sabor32. Las estrategias de educación centradas en el paciente, la motivación para el trasplante o el retraso de la diálisis, y la visualización de la acomodación a las restricciones suelen facilitar la adaptación a estas pautas dietéticas33.
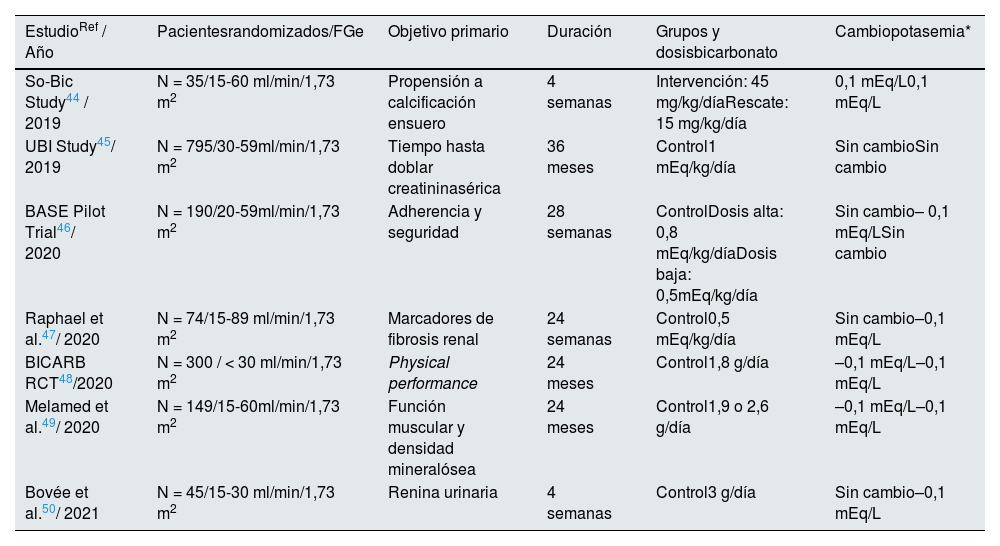
Favorecer la entrada del potasio en las célulasEn condiciones fisiológicas, los factores que más aumentan la captación de potasio por las células, ya que estimulan la Na-K-ATPasa, son la insulina, la estimulación beta-adrenérgica y, en menor medida, la aldosterona34–37 (tabla 1). De forma crónica, un adecuado control de la diabetes y la corrección de la acidosis metabólica pueden ayudar a tratar la hiperpotasemia, especialmente en la ERC, que se caracteriza por el desarrollo de acidosis metabólica38,39. Las guías KDIGO sugieren el tratamiento con suplementos orales de bicarbonato sódico, a menos que exista contraindicación, cuando la concentración sérica de bicarbonato es inferior a 22 mEq/L, para mantener el bicarbonato sérico en el rango normal, independientemente de la potasemia40. Esta aproximación evita que la acidosis metabólica libere potasio desde el interior de la célula al espacio extracelular, lo que favorece su eliminación urinaria41. En un reciente estudio multicéntrico observacional de más de 500 pacientes con ERC no en diálisis (66,7% con categoría G3b-G5), los pacientes con hiperpotasemia incidente o persistente en 12 meses se caracterizaron por presentar una menor concentración sérica de bicarbonato, mientras que la prescripción de bicarbonato sódico se asoció con una reducción de la potasemia42. Asimismo, los resultados de ensayos clínicos muestran que el CSZ corrige la acidosis metabólica en pacientes con ERC, disminuyendo el porcentaje de pacientes con un bicarbonato sérico < 22 mEq/L tras 29 días de tratamiento, desde un 39,4 a 17,2%43. Sin embargo, no hay ensayos clínicos específicamente diseñados para evaluar el efecto del bicarbonato sódico sobre los niveles séricos de potasio o sobre la incidencia de hiperpotasemia, siendo la información existente derivada de objetivos secundarios o exploratorios44–50 (tabla 7).
Ensayos clínicos randomizados con suplementación oral de bicarbonato en pacientes con enfermedad renal crónica no en diálisis con resultados de potasio sérico
| EstudioRef / Año | Pacientesrandomizados/FGe | Objetivo primario | Duración | Grupos y dosisbicarbonato | Cambiopotasemia* |
|---|---|---|---|---|---|
| So-Bic Study44 / 2019 | N = 35/15-60 ml/min/1,73 m2 | Propensión a calcificación ensuero | 4 semanas | Intervención: 45 mg/kg/díaRescate: 15 mg/kg/día | 0,1 mEq/L0,1 mEq/L |
| UBI Study45/ 2019 | N = 795/30-59ml/min/1,73 m2 | Tiempo hasta doblar creatininasérica | 36 meses | Control1 mEq/kg/día | Sin cambioSin cambio |
| BASE Pilot Trial46/ 2020 | N = 190/20-59ml/min/1,73 m2 | Adherencia y seguridad | 28 semanas | ControlDosis alta: 0,8 mEq/kg/díaDosis baja: 0,5mEq/kg/día | Sin cambio– 0,1 mEq/LSin cambio |
| Raphael et al.47/ 2020 | N = 74/15-89 ml/min/1,73 m2 | Marcadores de fibrosis renal | 24 semanas | Control0,5 mEq/kg/día | Sin cambio–0,1 mEq/L |
| BICARB RCT48/2020 | N = 300 / < 30 ml/min/1,73 m2 | Physical performance | 24 meses | Control1,8 g/día | –0,1 mEq/L–0,1 mEq/L |
| Melamed et al.49/ 2020 | N = 149/15-60ml/min/1,73 m2 | Función muscular y densidad mineralósea | 24 meses | Control1,9 o 2,6 g/día | –0,1 mEq/L–0,1 mEq/L |
| Bovée et al.50/ 2021 | N = 45/15-30 ml/min/1,73 m2 | Renina urinaria | 4 semanas | Control3 g/día | Sin cambio–0,1 mEq/L |
*Sin diferencia entre grupos ni respecto a valores basales
Las tiazidas y los diuréticos de asa aumentan la excreción urinaria de potasio y pueden causar hipopotasemia cuando se usan para otras indicaciones. No se suelen usar con el único objetivo de tratar la hiperpotasemia crónica, ya que pueden producir depleción de volumen que puede incluso llegar a causar fracaso renal agudo y también alteraciones hidroelectrolíticas (por ejemplo, las tiazidas pueden causar hiponatremia). Sin embargo, se pueden usar en casos de hiperpotasemia crónica cuando se espera un beneficio adicional de su uso como un mejor control de la hipertensión arterial, de la insuficiencia cardiaca e incluso una mayor disminución de la albuminuria, especialmente en pacientes con estas comorbilidades en los que la combinación de diuréticos con bloqueo del SRA o ARM permite mantener el tratamiento con estos últimos51–54.
Los inhibidores del cotransportador sodio-glucosa tipo 2 (iSGLT2) también protegen de la hiperpotasemia en pacientes con bloqueo del SRA, además de mejorar el pronóstico renal y cardiovascular55. En un metaanálisis reciente de seis ensayos clínicos que incluyó 49.875 pacientes con diabetes tipo 2 y alto riesgo cardiovascular o ERC, los iSGLT2 disminuyeron en un16% el riesgo de hiperpotasemia grave (potasemia ≥ 6,0 mEq/L) sin aumentar el riesgo de hipopotasemia, con un efecto consistente en todos los subgrupos, incluidos los pacientes tratados con ARM54,56. El mecanismo no está completamente aclarado, pero probablemente depende, al menos en parte, del aumento del aporte de sodio a la luz de la nefrona distal, donde se reabsorbe en un intercambio por potasio, que se elimina en orina. Sería, pues, un mecanismo compartido con tiazidas y diuréticos de asa.
Limitar la absorción intestinal y aumentar la excreción digestiva de potasioEl empleo de fármacos que captan potasio, limitando su absorción intestinal y favoreciendo su eliminación con las heces, es una estrategia clave en el abordaje de la hiperpotasemia crónica.
Actualmente se dispone de tres opciones:
Resinas intercambiadoras de cationes (poliestireno sulfonato de sodio o de calcio). Captan potasio en la luz intestinal en intercambio con la liberación de sodio y calcio, respectivamente. Aunque existe una amplia experiencia clínica que apoya su eficacia, la evidencia científica procedente de ensayos clínicos controlados con placebo es muy limitada, así como el número de pacientes incluidos en estos estudios y el periodo de seguimiento, especialmente con el uso concomitante de inhibidores del SRA y ARM57–60 (tabla 8), por lo que el perfil de seguridad ha sido poco evaluado en tratamientos prolongados de más de tres semanas, lo que limita su uso para el tratamiento crónico de la hiperpotasemia en la práctica clínica contemporánea61. Su tolerancia digestiva es mala. Entre los frecuentes efectos secundarios de índole digestiva destacan el estreñimiento y las náuseas, lo que limita el cumplimiento terapéutico. Otros efectos secundarios también frecuentes son la hipercalcemia (poliestireno sulfonato de calcio) y la hipopotasemia, como consecuencia del mecanismo de acción. Mucho más raramente se han notificado casos de isquemia gastrointestinal, colitis isquémica, ulceración o necrosis del tracto gastrointestinal que pueden conducir a una perforación intestinal61,62.
En España hay dos preparados de poliestireno sulfonato de calcio. En uno de ellos, Resincalcio®, la dosis recomendada es de 15 g tres o cuatro veces al día, debiéndose suspender en caso de estreñimiento y estando contraindicado en «insuficiencia renal asociada a enfermedades tales como hiperparatiroidismo, mieloma múltiple, sarcoidosis o carcinoma metastásico». Como laxante está contraindicado el sorbitol (oral o rectal), ya que el uso concomitante con poliestireno sulfonato cálcico puede causar necrosis del colon61,63. En el otro preparado, Sorbisterit®, la dosis es de 20 g, de una a tres veces al día mezclado en unos 150 mL de líquido (es decir, de 150-450 mL/día), como mínimo tres horas antes o después de la administración oral de otros medicamentos o hasta seis horas en caso de gastroparesia, como puede ocurrir en la diabetes63.
La mala tolerancia y bajo cumplimiento observados clínicamente por los autores de este documento en su práctica clínica fueron confirmados recientemente en un ensayo clínico cruzado frente a patirómero: aunque a las dosis testadas (15 g tres veces al día para resinsodio y 16,8 g una vez al día para patirómero, ambos los días de no diálisis), resinsodio bajó más la potasemia que patirómero en pacientes en hemodiálisis a lo largo de cuatro semanas, pero la tolerancia de resinsodio fue menor y el incumplimiento terapéutico cuatro veces mayor, lo que genera dudas sobre el cumplimiento a más largo plazo (por ejemplo, años)64.
Patiromer. Se recomienda una dosis inicial de 8,4 g/día. El patiromer empieza a reducir la potasemia varias horas después de la ingesta, manteniéndose el efecto entre 12-24 h65. Patiromer es generalmente bien tolerado, siendo los efectos adversos comunicados más frecuentemente de tipo gastrointestinal (estreñimiento, diarrea, flatulencia y dolor abdominal) e hipomagnesemia65,66.
En ensayos clínicos, patiromer redujo la potasemia en diferentes perfiles de pacientes (tabla 9).
- -
Insuficiencia cardiaca. El estudio PEARL-HF67 evaluó el efecto sobre la potasemia en pacientes con insuficiencia cardiaca crónica que iniciaron tratamiento con espironolactona, observándose un descenso de la potasemia en el grupo de patiromer, con una diferencia respecto al placebo de -0,45 mEq/L (p < 0,001) y una menor incidencia de hiperpotasemia (7,3 vs. 24,5%, p = 0,01). La disminución de la potasemia con respecto al placebo fue más acusada (-0,52 mEq/L, p < 0,05) en los pacientes con ERC (n = 66), es decir, en el grupo con mayor riesgo de hiperpotasemia, en los que la incidencia de esta fue de 6,7 y 38,5% (p < 0,05) con patiromer y placebo, respectivamente. El estudio DIAMOND demostró la utilidad de este agente en la reducción de potasio, episodios adversos relacionados con la hiperpotasemia y mayor proporción de pacientes tratados con dosis óptimas de antialdosterónicos en pacientes con insuficiencia cardiaca con fracción de eyección reducida y antecedentes o episodio actual de hiperpotasemia68.
- -
ERC. Patiromer se ha estudiado en tres contextos: enfermedad renal diabética, hipertensión arterial resistente y ERC en general. El estudio AMETHYST-DN69 evaluó patiromer en pacientes con diabetes tipo 2, enfermedad renal diabética (ERC G3-G4: FGe entre 15 y 60 mL/min/1,73 m2) en tratamiento con bloqueadores del SRA, que presentaban hiperpotasemia leve (K sérico 5,1-5,9 mEq/L) y que fueron aleatorizados a patiromer a dosis crecientes (de 4,2 a 16,8 g dos veces al día). La potasemia disminuyó de 0,35 a 0,97 mEq/L, de forma proporcional al grado inicial de la hiperpotasemia y a la dosis de patiromer, y el descenso fue estadísticamente significativo en la primera determinación (aproximadamente a las 48 h) tras el inicio del fármaco. La proporción de pacientes que alcanzaron el rango objetivo de potasemia fue superior a 83% en la hiperpotasemia leve (K+ sérico 5,1-5,5 mEq/L) y superior a 77% en la hiperpotasemia moderada (K+ sérico 5,6-5,9 mEq/L).
AMBER70 aleatorizó a patiromer o placebo a pacientes con hipertensión arterial resistente y ERC G3b-G4 (FGe 25-45 mL/min), en los que se inició terapia con espironolactona. El objetivo primario fue la proporción de pacientes que seguía con espironolactona a las 12 semanas, lo que ocurrió en 98/166 (66%) pacientes con placebo y 126/147 (86%) pacientes con patiromer (diferencia entre grupos: 19,5%, p < 0,0001).
OPAL-HK71 fue un ensayo clínico fase 3 que aleatorizó a patiromer o placebo a pacientes con ERC G3-G4 en tratamiento con dosis estables de bloqueadores del SRA e hiperpotasemia. Una fase inicial y abierta trató con patiromer a 237 pacientes, en los que la potasemia bajó una media de -1,01 mEq/L (p < 0,001) a las cuatro semanas. En la segunda fase, 107 pacientes que habían alcanzado cifras de potasio en el rango diana (3,8-5,1 mEq/l) se aleatorizaron a continuar con patiromer o cambiar a placebo durante otras cuatro semanas. Al final de esta segunda fase, en el grupo placebo el incremento medio de potasemia fue mayor (p < 0,001) y la recurrencia de hiperpotasemia (60%) más frecuente que en el grupo patiromer (15%, p < 0,001).
Ciclosilicato de sodio y zirconio. El CSZ también ha demostrado su eficacia en el tratamiento crónico de la hiperpotasemia en una amplia tipología de pacientes. Las presentaciones autorizadas en España son de 5 y 10 g. Reduce rápidamente (a partir de la primera hora) el potasio sérico, con un tiempo medio de 2,2 h hasta alcanzar una potasemia normal, y con 98% de los pacientes alcanzando la normalización de la potasemia en las primeras 48 h72. Las reacciones adversas notificadas con mayor frecuencia son hipopotasemia (4,1%) y edema (5,7%). Este último se ha relacionado con el contenido de sodio de la molécula (cada 5 g de CSZ contienen aproximadamente 400 mg de sodio), que se intercambia con el potasio, siendo sobre todo observado con la presentación de 15 g/día, que no está autorizada en España72,73.
Los principales ensayos clínicos con CSZ se recogen en la tabla 10.
HARMONIZE74 estudió adultos con hiperpotasemia persistente atendidos ambulatoriamente en servicios de cardiología, nefrología e investigación, que recibieron 10 g de CSZ tres veces al día durante una fase inicial abierta de 48 h; 92% de los pacientes normalizaron la potasemia y fueron entonces aleatorizados a 5, 10 o 15 g diarios de CSZ o placebo durante cuatro semanas. La potasemia media a los 29 días fue significativamente inferior con las diferentes dosis de CSZ que con placebo (p < 0,001). La proporción de pacientes normopotasémicos fue mayor con CSZ (71, 76, y 85% para la dosis diaria de 5 g, 10 g y 15 g, respectivamente, frente a 48% en el grupo placebo), una diferencia estadísticamente significativa para cada dosis de CSZ vs. placebo.
Otro ensayo clínico fase 3 con 754 pacientes (74,5% con ERC, 66,7% en tratamiento con bloqueadores del SRA, 59,9% con diabetes y 39,8% con historia de insuficiencia cardiaca) confirmaron la reducción significativa de potasemia en 48 h con diferentes dosis de CSZ respecto al placebo y el mantenimiento del resultado hasta 14 días75.
DIALIZE76 fue un ensayo clínico fase 3b que incluyó 196 pacientes en hemodiálisis con hiperpotasemia persistente a pesar de diálisis adecuada. El objetivo primario de eficacia fue la proporción de pacientes con potasemia prediálisis entre 4,0 y 5,0 mEq/L sin terapia de rescate, que se alcanzó en 41% de pacientes con CSZ y en 1% de los del grupo placebo (p < 0,001).
En un estudio en fase 3 a largo plazo, la potasemia se normalizó en más de 99% de los pacientes en los primeros dos o tres días y la normopotasemia (K+ ≤ 5,1 mmol/L) se mantuvo en 87% de los participantes al final de un seguimiento de 12 meses72.
Además de limitar la absorción intestinal de potasio, el CSZ aporta beneficios frente a la acidosis metabólica, como se indica en el apartado correspondiente43.
Patiromer vs. CSZPatiromer y CSZ tienen una mejor tolerancia, eficacia y seguridad que las resinas catiónicas, favoreciendo el empleo de los inhibidores del SRA y ARM en patologías donde se ha demostrado su beneficio, como la hipertensión arterial, la ERC y la insuficiencia cardiaca77,78.
No hay ensayos clínicos que hayan comparado directamente patiromer y CSZ y las diferencias de diseño y contexto de los ensayos clínicos con cada fármaco dificultan la comparación. Un metaanálisis de seis estudios y 1.756 pacientes (654 en tratamiento con patiromer y 1.102 con CSZ) comparó la eficacia y seguridad de patiromer y CSZ en el tratamiento de la hiperpotasemia78. No se observaron diferencias basales en la edad de los pacientes, FGe ni potasemia, aunque había una menor proporción de pacientes con ERC, insuficiencia cardiaca y diabetes, y que recibían tratamiento con bloqueadores del SRA en los ensayos de CSZ. Con patiromer, el descenso medio en la potasemia a los tres días de tratamiento fue de 0,36 mEq/L, y con CSZ fue de 0,67 mEq/L a las 48 h; 7,6% de los pacientes con patiromer presentaron estreñimiento y 7,1% hipomagnesemia, mientras que en los que recibieron CSZ, 1,6% presentó diarrea y 0,9% edema79. En un metaanálisis más reciente, patiromer mostró menores tasas de hiperpotasemia con respecto al tratamiento estándar, sin diferencias en cuanto a efectos adversos o discontinuación del tratamiento por dichos efectos. En relación con CSZ, no existieron diferencias en la ocurrencia de hiperpotasemia o en la tasa global de efectos adversos, aunque sí existió una mayor frecuencia de edema en el grupo de CSZ80.
No existe buena evidencia sobre el impacto de patiromer y CSZ sobre la hiperpotasemia postprandial después de una ingesta elevada de potasio, a pesar de normalizar los niveles basales de potasemia81.
Tanto patiromer como CSZ se han demostrado eficaces en pacientes con trasplantes de órganos sólidos82.
Necesidades de investigaciónA pesar de los avances recientes en el tratamiento y mitigación de la hiperpotasemia, quedan aún preguntas por contestar cuya respuesta permitirá mejorar el pronóstico de los pacientes con alto riesgo de hiperpotasemia (Box 5).
Tratamiento agudo de la hiperpotasemia grave
| 1). Antagonizar los efectos del potasio sobre la membrana celular: gluconato o cloruro cálcico |
| 2). Introducir el potasio dentro de las células |
| a) Insulina (y glucosa) |
| b) Agonistas beta2-adrenérgicos |
| c) Considerar bicarbonato sódico si hay acidosis metabólica |
| 3). Sacar el potasio del organismo |
| a) Aumento de eliminación urinaria. Considerar diuréticos de asa y tiazidas, especialmente si hipervolemia. |
| b) Aumento de eliminación digestiva. Ciclosilicato de sodio y zirconio (CSZ) |
| c) Hemodializar si el paciente está en programa de hemodiálisis crónica y considerar hemodiálisis si insuficiencia renal grave aunque el paciente no esté en programa de hemodiálisis crónica |
Novedades en el tratamiento agudo de la hiperpotasemia grave
| 1). A las medidas clásicas disponibles para antagonizar los efectos del potasio sobre la membrana celular, introducir el potasio dentro de las células y sacar el potasio del organismo (Box 1), hay que añadir los nuevos captores orales de potasio, que pueden acelerar la salida del potasio del cuerpo en el tratamiento agudo de la hiperpotasemia mediante una vía no renal, siendo ésta una ventaja en pacientes con limitaciones para la excreción urinaria de potasio por anuria, oliguria, insuficiencia renal o actividad mantenida de antagonistas de receptores mineralocorticoide. |
| 2). En concreto, en pacientes con hiperpotasemia, el ciclosilicato de sodio y zirconio (CSZ) disminuyó más la potasemia a las dos horas cuando se añadió a glucosa e insulina que placebo, con glucosa e insulina en un ensayo clínico multicéntrico, doble ciego y controlado con placebo. |
Novedades recientes en el tratamiento crónico de la hiperpotasemia
| 1) La prescripción de inhibidores de SGLT2 permiten incrementar la protección renal y cardiovascular, al mismo tiempo que reducen el riesgo de hiperpotasemia en pacientes predispuestos con diabetes tipo 2 o enfermedad renal crónica o insuficiencia cardiaca |
| 2) El ciclosilicato de sodio y zirconio (CSZ) es seguro y eficaz en el tratamiento a largo plazo de la hiperpotasemia y contribuye a corregir la acidosis metabólica |
| 3) El patiromer es seguro y eficaz en el tratamiento a largo plazo de la hiperpotasemia |
Tratamiento crónico de la hiperpotasemia
| 1) Corregir factores subsanables: Disminuir la ingesta excesiva de potasio, revisar medicación, corregir la acidosis metabólica |
| 2) Mantener/incrementar tratamiento cardio y nefroprotector |
| a) Intentar mantener bloqueo del SRA y ARM, si están indicados |
| b) Valorar añadir diuréticos (en caso de hipertensión arterial, insuficiencia cardiaca, sobrecarga de volumen) y/o inhibidores de SGLT2 (en caso de insuficiencia cardiaca, diabetes tipo 2, enfermedad renal crónica) si están indicados para mejorar la protección cardiaca y renal al tiempo que disminuye riesgo de hiperpotasemia |
| 3) Sacar el potasio del organismo: captores intestinales de potasio |
| a) Ciclosilicato de sodio y zirconio (CSZ) |
| b) Patiromer |
| 4) Poliestirenosulfonato de calcio |
Necesidades de investigación
| ¿En qué pacientes con hiperpotasemia se puede sustituir una intervención aguda parenteral por una intervención aguda oral? |
| ¿Permiten los nuevos captores orales de potasio liberar al paciente renal de la dieta pobre en potasio y que haga una dieta más cardiosaludable? ¿Previenen la hiperpotasemia posprandial? |
| ¿Tienen patiromer y CSZ indicaciones preferentes diferenciales en el tratamiento de la hiperpotasemia crónica? |
| El uso de captores orales de potasio, ¿frena la progresión de la ERC? |
| El uso de captores orales de potasio, ¿mejora el pronóstico cardiorrenal a largo plazo? |
La hiperpotasemia es un hallazgo frecuente en la práctica clínica diaria que se asocia a peores resultados en salud, incluyendo aumento de la morbilidad y la mortalidad. Por ello, es fundamental realizar un diagnóstico precoz y etiológico de la misma, con el objetivo de tratar del modo más adecuado a cada paciente. Dado que la hiperpotasemia engloba diferentes mecanismos fisiopatológicos y causales, se beneficia de un abordaje y tratamiento multidisciplinar. En el momento actual, disponemos de múltiples opciones terapéuticas para el tratamiento de la hiperpotasemia que han demostrado su eficacia y seguridad en diversos grupos de pacientes, debiéndose usar en conjunción con el buen criterio clínico. A pesar de los avances de los últimos años en relación con la hiperpotasemia, existen todavía lagunas de conocimiento en este campo, que se deben de abordar y promover a través de la investigación, para mejorar el pronóstico del paciente con hiperpotasemia.
FinanciaciónNo ha habido financiación para la elaboración de este trabajo.
Conflictos de interésEl Dr. Alberto Ortiz ha recibido becas de Sanofi y tarifas por consultoría o conferencias o apoyo para viajes de Advicciene, Alexion, Astellas, AstraZeneca, Amicus, Amgen, Boehringer Ingelheim, Fresenius Medical Care, GSK, Bayer, Sanofi-Genzyme, Menarini, Mundipharma, Kyowa Kirin, Lilly, Freeline, Idorsia, Chiesi, Otsuka, Novo-Nordisk, Sysmex y Vifor Fresenius Medical Care Renal Pharma, es Director de la Cátedra AstraZeneca-UAM de enfermedad renal crónica y electrolitos y ha sido director de la Cátedra Mundipharma-UAM de enfermedad renal diabética. Tiene acciones en Telara Pharma.
El Dr. José Carlos Fernández García ha recibido becas de investigación de Menarini y de AstraZeneca, y honorarios por consultorías, ponencias y actividades de formación de Boehringer Ingelheim, Sanofi, Eli Lilly, Esteve y Novo-Nordisk.
El Dr. Jorge Gómez Cerezo ha recibido honorarios por consultorías y ponencias de Amgem, AstraZeneca, Sanofi, Bayer, Menarini. JGC es profesor titular de Medicina de la Universidad Europea de Madrid
El Dr. Francisco Pita Gutiérrez ha recibido honorarios por consultorías, ponencias y actividades de formación de Abbott, Fresenius Kabi, Nestlé Health Science y Nutricia.
El Dr. Juan F. Navarro González ha recibido becas de investigación de Abbvie, BioNet Medical, Boehringer Ingelheim, Sanofi, Shire y Vifor Pharma; y honorarios por consultorías, ponencias y actividades de formación de Abbvie, Amgen, AstraZeneca, Bayer, Bionet Medical, Boehringer Ingelheim, Eli Lilly, Esteve, Janssen, Menarini, MSD, Mundipharma, Novartis, Novo-Nordisk, Sanofi, Servier, Shire y Vifor Pharma. JFNG es editor académico de Journal of Clinical Medicine y editor asociado de Frontiers in Medicine, y miembro del Scientific Advisory Board de la European Renal Association.
Filiaciones autoresAlberto Ortiz. Servicio de Nefrología e Hipertensión, Instituto de Investigación Sanitaria Fundación Jiménez Díaz. Departamento de Medicina, Universidad Autónoma. Madrid.
Carmen del Arco Galán. Servicio de Urgencias, Hospital Universitario de la Princesa. Instituto de Investigación Sanitaria La Princesa. Facultad de Medicina de la Universidad Autónoma. Madrid.
José Carlos Fernández-García. Unidad de Gestión Clínica de Endocrinología y Nutrición, Hospital Regional Universitario de Málaga. Instituto de Investigación Biomédica de Málaga (IBIMA). Facultad de Medicina, Universidad de Málaga.
Jorge Gómez Cerezo. Servicio de Medicina Interna, Hospital Universitario Infanta Sofía. Universidad Europea de Madrid.
Rosa Iban Ochoa. Servicio de Urgencias, Hospital Universitario Río Hortega, Valladolid.
Julio Núñez. Servicio de Cardiología, Hospital Clínico Universitario de Valencia. Universidad de Valencia. INCLIVA. CIBER Enfermedades Cardiovasculares, Instituto de Salud Carlos III.
Francisco Pita Gutiérrez. Unidad de Nutrición Clínica y Dietética, Servicio de Endocrinología y Nutrición, Complexo Hospitalario Universitario A Coruña.
Juan F. Navarro-González. Unidad de Investigación y Servicio de Nefrología, Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife. RICORS2040, Instituto de Salud Carlos III, Madrid.
Isabel Comerma, Carmen Mon, Enrique Morales y Juan Payá aportaron comentarios durante la fase de revisión pública del documento, que fueron parcialmente adoptados.