El síndrome de encefalopatía posterior reversible es una entidad clínico-radiológica con presentación neurológica aguda o subaguda, asociada a la presencia de lesiones que afectan sobre todo a la sustancia blanca de las regiones cerebrales posteriores. Se asocia principalmente con hipertensión severa de rápido desarrollo, o con insuficiencia renal (aguda o crónica), aunque se ha descrito también como una complicación neurológica de varias entidades médicas. En los últimos años se está produciendo un aumento en el número de casos y publicaciones relacionadas, debido al avance de las técnicas diagnósticas de imagen. El hallazgo radiológico característico es la presencia en la resonancia magnética de lesiones hiperintensas en las secuencias T2 y FLAIR, frecuentemente bilaterales y localizadas en las regiones cerebrales posteriores, que se corresponden con zonas de edema vasogénico.
Poco se conoce de la fisiopatología del síndrome de encefalopatía posterior reversible. La teoría más aceptada, sobre todo en los casos con hipertensión asociada, es la de la pérdida de la autorregulación cerebral, que conduce a la aparición de edema vasogénico. Su característica principal es la reversibilidad, tanto de la clínica como de las lesiones cerebrales, con un diagnóstico precoz y adecuado.
Pese a la frecuente asociación con insuficiencia renal y con hipertensión severa, son pocos los casos publicados en pacientes de diálisis peritoneal. Presentamos aquí una revisión del síndrome de encefalopatía posterior reversible en pacientes en diálisis peritoneal y de la casuística publicada.
Posterior reversible encephalopathy syndrome is a clinical and radiological entity with acute or subacute neurological presentation associated with brain lesions that primarily affect the white matter of the posterior regions. It is often associated with the rapid onset of severe hypertension and/or with kidney failure (acute and chronic), but it has also been reported as a neurological complication in several medical conditions. In recent years, there has been an increase in the number of cases and related publications due to the advance of diagnostic imaging techniques. The characteristic radiological finding includes hyperintense lesions in T2- and FLAIR-weighted magnetic resonance imaging, which are often bilateral and located in the posterior cerebral regions and correspond to areas of vasogenic oedema.
Little is known about the pathophysiology of posterior reversible encephalopathy syndrome. The most accepted theory, especially in cases with associated hypertension, is the loss of cerebral self-regulation which leads to the onset of vasogenic oedema. The main feature of this syndrome is the reversibility of both symptoms and cerebral lesions with an early and appropriate diagnosis.
Despite the frequent association with kidney failure and severe hypertension, there are few cases reported in patients on peritoneal dialysis. This article presents a review of PRES in peritoneal dialysis patients in the published literature.
El síndrome de encefalopatía posterior reversible (PRES, en inglés) es una entidad clínico-radiológica con presentación neurológica aguda o subaguda, asociada a la presencia de lesiones cerebrales que afectan sobre todo a la sustancia blanca de las regiones posteriores. Su característica principal es la reversibilidad, tanto de la clínica como de las lesiones cerebrales, con un diagnóstico precoz y adecuado1-6.
El PRES se asocia principalmente con hipertensión arterial (HTA) severa de rápido desarrollo o con insuficiencia renal (aguda o crónica), aunque se ha descrito también como una complicación neurológica de varias entidades médicas como la eclampsia, vasculitis y conectivopatías, hemopatías, hepatopatías, hipercalcemia, uso de eritropoyetina y un amplio número de fármacos de tipo inmunosupresor o citotóxico1-6 (tabla 1).
Factores desencadenantes y asociados con el PRES
| Hipertensión arterial aguda |
| Enfermedades renales: insuficiencia renal (aguda o crónica), glomerulonefritis |
| Eclampsia |
| Sepsis y fallo multiorgánico |
| Enfermedades autoinmunes |
| Enfermedades hematológicas: SHU, enfermedad injerto contra huésped, PTT, anemia de células falciformes |
| Terapia inmunosupresora: ciclosporina, tacrolimus, interferón alfa |
| Citostáticos: adriamicina, vincristina, ciclosfosfamida, citarabina, cisplatino, metotrexato, inmunoglobulinas |
| Trasplantes: riñón, hígado, médula ósea |
| Miscelánea: cocaína, eritropoyetina, hipercalcemia postransfusional, porfiria aguda intermitente, VIH+, metilprednisolona, anfotericina B |
PTT: púrpura trombótica trombocitopénica; SHU: síndrome hemolítico urémico.
En cursiva los más frecuentes.
Pese a la frecuente asociación con HTA severa y con insuficiencia renal, sorprenden los pocos casos publicados en el contexto de la diálisis peritoneal (DP). Y sin embargo, algunos autores han señalado que esta técnica de diálisis pudiera ser otro factor desencadenante del cuadro7-9.
Fue descrita por primera vez en 199610, y su nomenclatura ha resultado controvertida11. Inicialmente bautizada como síndrome de leucoencefalopatía posterior reversible, se consideraba el cuadro como una variante de la encefalopatía hipertensiva. Sin embargo, como la afectación cerebral no siempre se limita a la sustancia blanca, está ganando aceptación el uso del término síndrome de encefalopatía posterior reversible (PRES en inglés). Pese a su denominación, puede afectar también a zonas cerebrales anteriores, y puede no ser reversible1,12,13.
Su incidencia y prevalencia no se conocen claramente, aunque en los últimos años se está produciendo un aumento en el número de casos y publicaciones relacionadas, debido sobre todo al avance de las técnicas diagnósticas de imagen. Parece ser ligeramente más frecuente en mujeres9,12, y muy frecuente en niños con insuficiencia renal14,15. Aunque se creía que el cuadro era monofásico, puede reaparecer si se repite el contexto precipitante16,17.
ClínicaLa sintomatología más frecuente incluye intensa cefalea, somnolencia o agitación, confusión mental, alteraciones visuales (generalmente visión borrosa, pero puede haber anopsias o ceguera cortical), síntomas neurológicos focales y convulsiones (reseñadas en el 90% de los casos; en muchas ocasiones son el primer síntoma), bien de tipo focal con generalización secundaria o bien generalizadas desde el principio. Otros síntomas menos frecuentes incluyen náuseas, vómitos y estatus epiléptico no convulsivo (que debe sospecharse en caso de repetición de movimientos estereotipados). El nivel de conciencia empeora progresivamente y puede llegar al estupor y al coma. La clínica se desarrolla en un plazo de horas y puede persistir durante semanas en función de su severidad y de la rapidez en la instauración del tratamiento1-6,9.
La HTA está presente en la mayoría de los casos, ya sea en pacientes normotensos con elevación aguda de la tensión arterial o en pacientes con HTA crónica agudizada. Se ha dicho que es la rapidez de la instauración más que el valor absoluto de las cifras tensionales lo que desencadena la entidad. El valor medio de la presión arterial sistólica habitualmente registrada oscila entre 170 y 200mmHg (aunque un 10-30% de los casos puede no alcanzar esas cifras)1,4,6,8. Un importante porcentaje de los casos publicados tienen insuficiencia renal, aguda o crónica, como enfermedad basal o en asociación o secundaria a otros procesos intercurrentes4.
El hallazgo radiológico característico es la presencia en la resonancia magnética de lesiones hiperintensas en las secuencias T2 y FLAIR, generalmente (aunque no siempre) bilaterales y localizadas en las regiones cerebrales posteriores, que se corresponden con zonas de edema vasogénico. Dichas lesiones son reversibles en un gran porcentaje de los casos, tras corregirse los factores etiológicos implicados.
Se han descrito 4patrones de afectación cerebral diferentes: el clásico y más frecuente patrón posterior con lesiones occipitoparietales; un patrón holohemisférico con una distribución lineal que abarca prácticamente todos los lóbulos, salvando los lóbulos temporales; un patrón frontal superior con afectación temporal variable y un patrón parcial y asimétrico con ausencia de afectación posterior o con afectación asimétrica9,12.
FisiopatologíaPoco se conoce de la fisiopatología del PRES1-6,8,9. La teoría más aceptada, sobre todo en los casos con HTA asociada, es la de la pérdida de la autorregulación cerebral que, en condiciones normales, mantiene constante el flujo sanguíneo cerebral mediante una vasoconstricción de las arteriolas cerebrales, protegiendo así al cerebro de cambios agudos en la presión sanguínea. Con presiones arteriales elevadas, dicha autorregulación falla y se produce una vasodilatación arteriolar y una disfunción endotelial que provocan trasudación capilar y una disrupción de la barrera hematoencefálica, con el resultado de la acumulación de líquido en el tejido cerebral circundante. La mayor afectación de los territorios cerebrales posteriores se debe a su menor inervación simpática perivascular (responsable de la respuesta miogénica protectora de las arteriolas cerebrales), por lo que son más susceptibles a cambios en la presión arterial.
Hay pacientes que desarrollan este síndrome con solo ligeras elevaciones de la presión arterial. En estos casos suelen concurrir otras circunstancias que favorecen o predisponen al daño de la barrera hematoencefálica o interfieren con el tono simpático, tales como sepsis, alteraciones electrolíticas, fiebre elevada o uso de ciertos fármacos.
Cuando el PRES se asocia con fármacos (principalmente inmunosupresores y citotóxicos) sin HTA asociada, la patogenia es más incierta. Se postula para estos casos un posible efecto citotóxico directo sobre el endotelio, o neurotoxicidad favorecida por otros factores intercurrentes como alteraciones bioquímicas, o edema sistémico2,3.
Otra teoría alternativa es que el PRES sea la consecuencia de un estado inflamatorio que provoca disfunción endotelial. Esto explicaría la asociación con procesos como sepsis, enfermedades autoinmunes o trasplantes. En estos casos, la vasoconstricción provocada por el estado inflamatorio se sumaría a la inicial del mecanismo de autorregulación y la isquemia resultante sería la causa de la alteración endotelial.
Recientemente se está comentando el posible papel de la hipomagnesemia como un nuevo factor desencandenante del PRES. Por su conocida función neuroprotectora, el sulfato de magnesio se usa de forma habitual y eficaz para prevenir las convulsiones en la preeclampsia. En recientes artículos se ha demostrado la frecuente asociación entre hipomagnesemia y PRES, y se ha explicado mediante esta alteración electrolítica el mecanismo favorecedor del PRES de los anticalcineuríticos18,19.
Además de la HTA, la insuficiencia renal es otro factor muy frecuentemente relacionado con el PRES, sobre todo en la población infantil4,16,17,20. La patogenia en esta situación parece multifactorial: las toxinas urémicas y el mal control de agua y sodio, y la frecuente asociación con hipoalbuminemia e hipertensión conducen a una menor presión osmótica y a una elevada presión hidrostática que aumentan la permeabilidad vascular. En este contexto, aumenta la susceptibilidad a cualquier afectación endotelial, ya sea por aumento de la presión arterial o por citotoxicidad. También influyen los frecuentes tratamientos asociados, como los estimuladores de la eritropoyesis (AAEE) que contribuyen a la hipertensión, o los anticalcineurínicos.
Diagnóstico y diagnóstico diferencialLa clínica neurológica puede indicar otras entidades como trombosis de senos cavernosos, enfermedades desmielinizantes, hemorragia intracraneal, encefalitis o ictus. La presentación repentina obliga a descartar procesos isquémicos, que pueden no diferenciarse en la TAC ni en la resonancia magnética convencional. En el PRES no suelen afectarse las regiones calcarinas ni las estructuras del lóbulo occipital paramediano y las lesiones pueden verse simultáneamente en zonas cerebrales dependientes de varias arterias cerebrales3. La precisión en el diagnóstico es importante, puesto que el control de la HTA no es el mismo en la fase aguda de los ictus que en el PRES.
Síndrome de encefalopatía posterior reversible y diálisis peritonealPese a los numerosos casos publicados en pacientes con insuficiencia renal, muchos de ellos en hemodiálisis13, son pocos los casos descritos en pacientes en DP. Lo que no deja de sorprender, puesto que, además de la insuficiencia renal y de la frecuente HTA, los pacientes suelen estar sobrehidratados y en esta técnica dialítica se pierde albúmina por el dializado. Una posible explicación que se nos ocurre podría ser la relativa estabilidad hemodinámica de los pacientes en DP frente a los cambios intermitentes que sufren los pacientes en hemodiálisis.
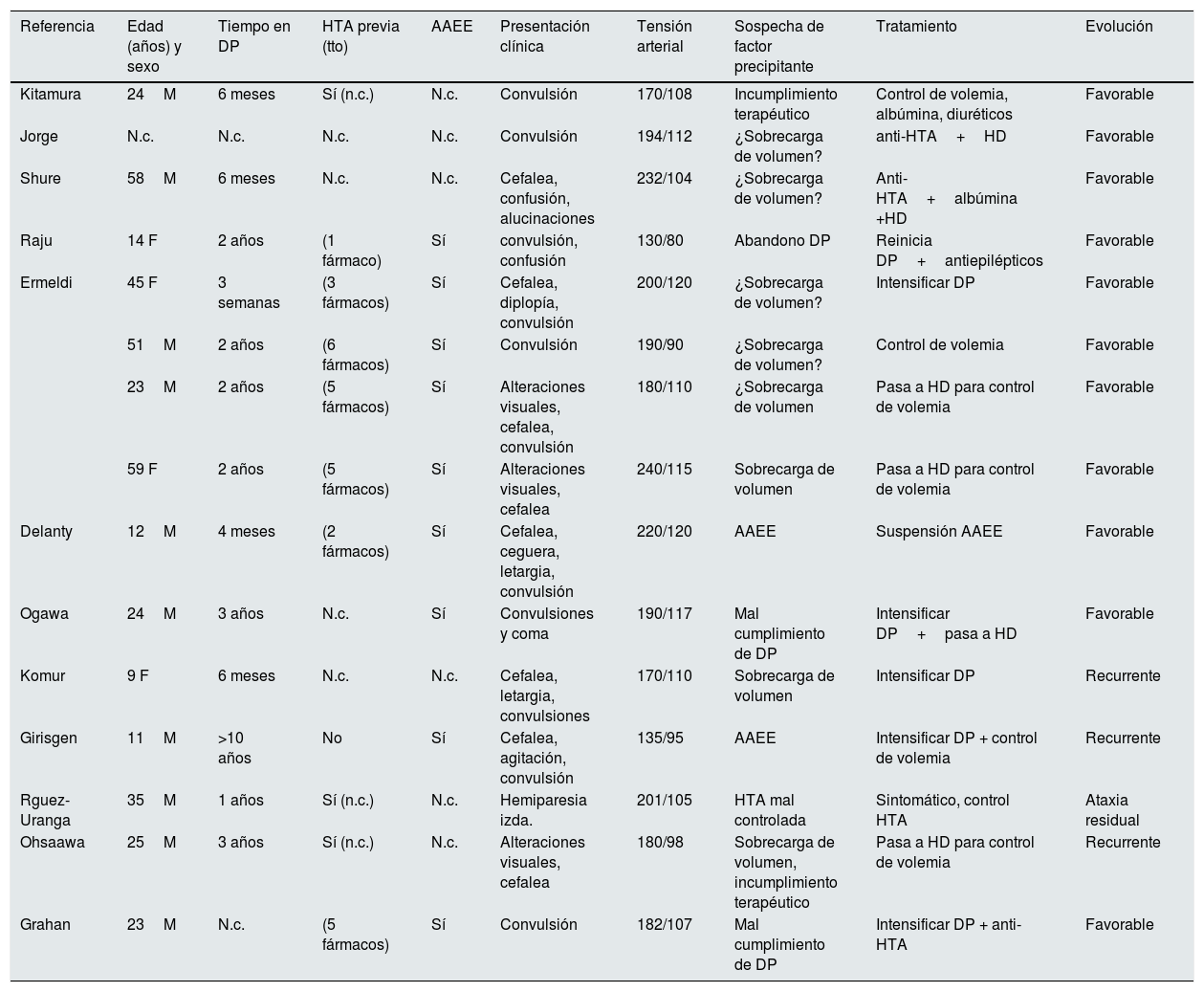
Revisando la literatura hemos encontrado poco más de una docena de casos de PRES en pacientes de DP7-9,16,17,20-26 (tabla 2). La mayoría eran varones (cuando en la literatura general predomina la afectación femenina) y jóvenes (entre 20 y 50 años,) con solo 5 casos infantiles y 3 mayores de 50 años. La permanencia en DP previa al episodio de PRES es de casi un año (rango entre 3 semanas y 3 años). Prácticamente todos los casos presentaron convulsiones como síntoma inicial y la mayoría recibían tratamiento anti-HTA. En varios de los casos se destaca la sobrecarga de volumen y el mal cumplimiento dialítico como factores propiciadores o agravantes, y en muchos de ellos se involucra a la eritropoyetina. Destacan 3casos de PRES recurrente16,17,20. El aumento de la dosis de DP y de ultrafiltración (o incluso el paso a hemodiálisis) se reseña en varios de los pacientes como parte del tratamiento. En general, todos los pacientes se recuperaron sin secuelas.
Resumen casos PRES y DP en la literatura
| Referencia | Edad (años) y sexo | Tiempo en DP | HTA previa (tto) | AAEE | Presentación clínica | Tensión arterial | Sospecha de factor precipitante | Tratamiento | Evolución |
|---|---|---|---|---|---|---|---|---|---|
| Kitamura | 24M | 6 meses | Sí (n.c.) | N.c. | Convulsión | 170/108 | Incumplimiento terapéutico | Control de volemia, albúmina, diuréticos | Favorable |
| Jorge | N.c. | N.c. | N.c. | N.c. | Convulsión | 194/112 | ¿Sobrecarga de volumen? | anti-HTA+HD | Favorable |
| Shure | 58M | 6 meses | N.c. | N.c. | Cefalea, confusión, alucinaciones | 232/104 | ¿Sobrecarga de volumen? | Anti-HTA+albúmina +HD | Favorable |
| Raju | 14 F | 2 años | (1 fármaco) | Sí | convulsión, confusión | 130/80 | Abandono DP | Reinicia DP+antiepilépticos | Favorable |
| Ermeldi | 45 F | 3 semanas | (3 fármacos) | Sí | Cefalea, diplopía, convulsión | 200/120 | ¿Sobrecarga de volumen? | Intensificar DP | Favorable |
| 51M | 2 años | (6 fármacos) | Sí | Convulsión | 190/90 | ¿Sobrecarga de volumen? | Control de volemia | Favorable | |
| 23M | 2 años | (5 fármacos) | Sí | Alteraciones visuales, cefalea, convulsión | 180/110 | ¿Sobrecarga de volumen | Pasa a HD para control de volemia | Favorable | |
| 59 F | 2 años | (5 fármacos) | Sí | Alteraciones visuales, cefalea | 240/115 | Sobrecarga de volumen | Pasa a HD para control de volemia | Favorable | |
| Delanty | 12M | 4 meses | (2 fármacos) | Sí | Cefalea, ceguera, letargia, convulsión | 220/120 | AAEE | Suspensión AAEE | Favorable |
| Ogawa | 24M | 3 años | N.c. | Sí | Convulsiones y coma | 190/117 | Mal cumplimiento de DP | Intensificar DP+pasa a HD | Favorable |
| Komur | 9 F | 6 meses | N.c. | N.c. | Cefalea, letargia, convulsiones | 170/110 | Sobrecarga de volumen | Intensificar DP | Recurrente |
| Girisgen | 11M | >10 años | No | Sí | Cefalea, agitación, convulsión | 135/95 | AAEE | Intensificar DP + control de volemia | Recurrente |
| Rguez-Uranga | 35M | 1 años | Sí (n.c.) | N.c. | Hemiparesia izda. | 201/105 | HTA mal controlada | Sintomático, control HTA | Ataxia residual |
| Ohsaawa | 25M | 3 años | Sí (n.c.) | N.c. | Alteraciones visuales, cefalea | 180/98 | Sobrecarga de volumen, incumplimiento terapéutico | Pasa a HD para control de volemia | Recurrente |
| Grahan | 23M | N.c. | (5 fármacos) | Sí | Convulsión | 182/107 | Mal cumplimiento de DP | Intensificar DP + anti-HTA | Favorable |
AAEE: agentes estimuladores de eritropoyesis; DP: diálisis peritoneal; F: femenino; HD: hemodiálisis; HTA: hipertensión arterial; M: masculino; N.c.: no consta; tto: tratamiento.
El tratamiento del PRES incluye terapias antihipertensivas, con el objetivo de obtener presiones arteriales medias entre 105 y 125mmHg, fármacos anticonvulsivantes, la suspensión de medicamentos sospechosos, la intensificación de la dosis de diálisis y de la ultrafiltración (cambiando incluso de modalidad de diálisis si es preciso) o el aporte de albúmina y magnesio. De la rapidez e intensidad de su instauración dependerá la resolución sin secuelas.
Conceptos claveEl PRES debe ser considerado en aquellos pacientes que se presenten con clínica neurológica aguda (cefalea intensa, convulsiones, alteraciones visuales y cambios en el nivel de conciencia), especialmente si se asocia con HTA o sobrecarga de volumen.
El PRES puede confirmarse con prontitud mediante la resonancia magnética. La rapidez en la instauración de un tratamiento adecuado es la clave para conseguir la reversibilidad del cuadro y evitar un daño cerebral permanente.
Los pacientes en DP reúnen varios factores que en teoría los hacen más susceptibles a padecer este cuadro. Sin embargo, y hasta ahora, son pocos los casos descritos en esta población, por lo que no se puede asegurar que constituyan un grupo de riesgo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.