La hipotensión arterial intradiálisis (HAID) es una complicación frecuente que se asocia a una mayor morbimortalidad en hemodiálisis, aunque es una tarea pendiente la uniformidad de criterios respecto a su definición. El objetivo del estudio es analizar las características de distintas definiciones de hipotensión y su relación con la morbimortalidad en una cohorte de pacientes en hemodiálisis.
MetodologíaEstudio observacional, con un seguimiento de 30 meses, que incluye 68 pacientes prevalentes en hemodiálisis con al menos 6 meses de tratamiento. Se recogieron parámetros de diálisis, y distintas definiciones de hipotensión, de 18 sesiones no consecutivas (las primeras 3 sesiones de cada mes de un período de 6 meses). Se definió como evento positivo de HAID si ocurría cualquier definición en más del 25% de las sesiones estudiadas. Se analizó el poder predictivo para cada definición de hipotensión (Nadir90, Nadir100, Fall20, Fall30, Fall20Nadir90, Fall30Nadir90, KDOQI, HEMO) mediante un análisis de supervivencia. Se estimó la relación con los eventos cardiovasculares no fatales y la mortalidad global mediante distintos modelos proporcionales de Cox.
ResultadosEncontramos definiciones de HAID que ocurrieron con una significativa mayor frecuencia (Nadir100: 339,8/1.000 sesiones; Nadir90: 172,3/1.000 sesiones) en comparación con otras (KDOQI: 98/1.000 sesiones; HEMO 129,9/1.000 sesiones). Con una media de seguimiento de 27,12±6,84 meses se registraron 13 eventos mortales. Un mayor número de sesiones con HAID conforme a la definición Nadir90 fue un factor predictor de mortalidad (Log rank 5,02, p=0,025), independiente según los modelos ajustados (HR: 3,23 [IC95%: 1,08-9,6], p=0,035). Las definiciones Nadir100 (HR: 4,54 [IC95%: 1,25-16,4], p=0,02) y Fall30Nadir90 (HR: 3,08 [IC95%: 1,07-8,8], p=0,03) fueron predictores independientes de eventos cardiovasculares no fatales en los modelos ajustados.
ConclusionesLa hipotensión intradiálisis, incluso asintomática, tiene poder predictivo de mortalidad y eventos cardiovasculares no fatales en pacientes prevalentes en hemodiálisis.
Intradialytic hypotension (IDH) is a common complication and is associated with higher morbidity and mortality in patients on haemodialysis. However, there is a lack of uniformity in definitions of IDH. The main objective of this study is to analyse clinical and dialysis related factors with several IDH definitions, and its relationship with morbidity and mortality in a cohort of haemodialysis patients.
MethodologyObservational study with a 30-month follow-up period that includes 68 prevalent patients on haemodialysis with at least six months of treatment. We analysed 18 non-consecutive dialysis sessions (first three of each month of a six-month period), and different definitions of IDH were recorded. A positive event of IDH was defined if any definition occurred in more than 25% of the sessions studied. Using survival analysis, we analysed the prediction capacity of each IDH definition (Nadir90, Nadir100, Fall20, Fall30, Fall20Nadir90, Fall30Nadir90, KDOQI, HEMO). The relationship with non-fatal cardiovascular disease and global mortality was estimated using different Cox proportional models.
ResultsWe found IDH definitions that occurred significantly more frequently (Nadir100: 339.8/1,000 sessions, Nadir90: 172.3/1,000 sessions) than others (KDOQI: 98/1,000 sessions, HEMO 129.9/1,000 sessions). We registered 13 fatal events with a mean follow-up of 27.12±6.84 months. A greater number of sessions with IDH according to the Nadir90 definition was a predictive factor of mortality (Log rank 5.02, p=0.025), independent according to adjusted models (HR: 3.23 [95% CI: 1.08-9.6], p=0.035). The definitions Nadir100 (HR: 4.54 [95% CI: 1.25-16.4], p=0.02) and Fall30Nadir90 (HR: 3.08 [95% CI: 1.07-8.8], p=0.03) were independent predictors of non-fatal cardiovascular disease in adjusted models.
ConclusionsIntradialytic hypotension, even asymptomatic, is a predictor of mortality and non-fatal cardiovascular disease in prevalent patients on haemodialysis.
La hipotensión arterial intradiálisis (HAID) es una complicación frecuente en hemodiálisis (HD), con una prevalencia que oscila entre el 5 y 30%1. Estas amplias diferencias se deben a la falta de uniformidad en los distintos estudios respecto a las definiciones de hipotensión utilizadas2. Recientemente se demuestra que las definiciones nadir tienen una asociación más consistente con la mortalidad en términos predictivos3 en comparación con definiciones clásicas, como las propuestas por las guías KDOQI (The National Kidney Foundation Disease Outcomes and Quality Initiative)4, o las «guías europeas de buenas prácticas»5. Además de las diferencias en prevalencia, la HAID suele presentar una alta variabilidad interpacientes1,6, lo que dificulta aún más definir qué debemos considerar hipotensión en diálisis.
La alta variabilidad de la presión arterial condicionada por la HD dificulta fijar objetivos de control de la presión arterial7. Usualmente la presión arterial tiende a estar más elevada en los períodos prediálisis, desciende durante la diálisis, para volver a ascender en el nuevo período interdiálisis2. Esta variabilidad es más marcada en pacientes con pautas convencionales (3 sesiones semanales), ya que aquellos con pautas de diálisis más intensivas como la HD diaria tienen un mejor control tensional sin llegar a precisar fármacos antihipertensivos7. Dentro de los factores paciente-dependientes que influyen en la predisposición a experimentar un episodio de hipotensión intradiálisis destacan la capacidad de respuesta cardíaca durante la ultrafiltración (UF), la función renal residual (FRR), entre otros8.
El objetivo del estudio fue analizar las características clínicas y relacionadas con la diálisis de distintas definiciones de HAID, y la relación con mortalidad en una cohorte de pacientes en HD.
MetodologíaDiseño del estudioEstudio observacional, con un seguimiento de 30 meses, que evalúa las características clínicas y relacionadas con las sesiones de diálisis de 68 pacientes prevalentes en HD. Se emplearon los siguientes criterios para definir la participación en el estudio. Criterios de inclusión: edad 18-80 años, pacientes prevalentes en HD que tengan al menos 6 meses de tratamiento renal sustitutivo, estabilidad clínica en los 3 meses previos al inicio del estudio (definido como ausencia de hospitalizaciones, cirugías o eventos clínicos) y firma del consentimiento informado. Criterios de exclusión: negativa a participar en el estudio y/o revocatoria del consentimiento informado. El estudio se ha realizado siguiendo las guías de buena práctica clínica, y el reclutamiento se inició después de recibir el visto bueno del Comité Ético y de Investigación Clínica.
Variables analizadasLas variables demográficas, clínicas, de laboratorio y de composición corporal recogidas fueron: edad, género, etiología de la enfermedad renal crónica (ERC), tiempo en diálisis, trasplantes previos, antecedentes de patología cardiovascular aterosclerótica (cardiopatía isquémica, enfermedad vascular periférica, isquemia mesentérica) y no aterosclerótica (insuficiencia cardíaca, arritmias); acceso vascular, y datos de composición corporal obtenidos mediante bioimpedanciometría espectroscópica multifrecuencia por Body Composition Monitor (FMC) en los 3 meses previos al inicio del estudio: sobrehidratación (OH), agua corporal total (TBW), agua extracelular (ECW), tejido magro y tejido graso. También se recogieron datos relacionados con los fármacos antihipertensivos (número de fármacos, clase de antihipertensivo: betabloqueantes, bloqueantes del sistema renina-angiotensina [BSRA], calcioantagonista, diuréticos, etc.). Los parámetros analíticos recogidos fueron los relacionados con la anemia (hemoglobina), metabolismo óseo-mineral (calcio, fósforo, PTH), inflamación (PCR de alta sensibilidad).
La medición de los parámetros de laboratorio se hizo mediante métodos estandarizados usando autoanalizadores. La PCR sérica se midió usando inmunoanálisis turbidométrico basado en látex mediante analizador Hitachi (Sigma Chemical Co., St. Louis, Missouri, EE.UU.).
Características de la hemodiálisisSe estudiaron de forma retrospectiva 18 sesiones no consecutivas de un período de 6 meses (primeras 3 sesiones de cada mes) en todos los pacientes según pauta habitual. La modalidad de diálisis [hemodiafiltración online (HDF-OL) y HD de alto flujo] y cada uno de los parámetros propios de la prescripción se basaron en el criterio médico, y de acuerdo con el protocolo de la unidad [flujo de sangre (Qb), flujo de baño de diálisis (Qd), temperatura de dializado (°C), conductividad (mSm/cm), composición del líquido de diálisis)]. Todos los pacientes se dializaron utilizando el monitor 5008CorDiax (FMC) en un esquema de 3 sesiones a la semana, de 240min. Se emplearon distintos dializadores según prescripción médica [FXCorDiax80, FXCorDiax600, FXCorDiax800, FXCorDiax1000 (FMC), Polyflux210H (Baxter)]. Se recogieron los datos relacionados con las sesiones de diálisis: flujo sanguíneo (Qb), temperatura de dializado, Kt/Vs [Monocompartimental de Daugirdas de segunda generación], transporte convectivo (litros/sesión), ganancia de peso interdiálisis (gramos), ratio de UF (ml/h/kg), ratio de reducción (RR) de urea y β2-microglobulina [RR (%): 100·(C1-C2)/C1, donde C1 corresponde a la concentración sérica inicial (prediálisis) y C2 a la concentración sérica final (posdiálisis)], entre otros.
Se han tenido en cuenta los cambios de peso seco (sesión por sesión) de cara a obtener la tasa de UF por sesión. Con estos datos calculamos el ratio de UF (ml/kg/h), y posteriormente se ha estimado la media (del ratio de UF) de las 18 sesiones por paciente analizadas.
Definiciones de hipotensión arterial intradiálisisSe monitorizó la presión arterial de acuerdo con el protocolo de la unidad de diálisis cada media hora, utilizando el sistema automatizado integrado en el monitor 5008CorDiax (FMC). Se verificó el número de sesiones donde se cumplía cada definición de hipotensión. Se calculó la media de episodios de hipotensión (según cada definición) de las 18 sesiones analizadas por paciente, y también se estimó como otra medida de frecuencia el número de episodios de hipotensión por cada 1.000 sesiones de diálisis. Definimos como evento positivo de HAID si se cumplía la definición en más del 25% de las sesiones analizadas, y obtuvimos la proporción de pacientes que cumplían esta definición de evento positivo con cada una de las definiciones de HAID empleadas en el estudio.
Las definiciones de HAID utilizadas fueron las más recogidas en la literatura3: Nadir90 [presión arterial sistólica (PAS) mínima intraHD<90mmHg], Nadir100 [PAS mínima intraHD<100mmHg], Fall20 [(PAS preHD–PAS mínima intraHD)≥20mmHg], Fall30 [(PAS preHD–PAS mínima intraHD)≥30mmHg], Fall20Nadir90 [(PAS preHD–PAS mínima intraHD)≥20mmHg y PAS mínima intraHD<90mmHg], Fall30Nadir90 [(PAS preHD–PAS mínima intraHD)≥30mmHg y PAS mínima intraHD<90mmHg], KDOQI [(PAS preHD–PAS mínima intraHD)≥20mmHg y síntomas atribuibles a la hipotensión], HEMO [cualquier descenso de la PAS que resulte en intervención (reducir Qb, UF, o administración de suero)].
Eventos cardiovasculares y mortalidadSe recogieron los eventos mortales y cardiovasculares no fatales con un seguimiento de 30 meses desde el inicio del estudio. Los eventos cardiovasculares se definieron como infarto agudo de miocardio (diagnosticado mediante la elevación de marcadores cardíacos y cambios en el ECG, y confirmado mediante cateterismo cardíaco), insuficiencia cardíaca [diagnosticada usando criterios clínicos (Framingham) o una fracción de eyección <45%], ictus (diagnosticado mediante tomografía computarizada), enfermedad vascular periférica (diagnosticada mediante la estenosis de una arteria principal de miembros inferiores confirmada mediante arteriografía, o la necesidad de amputación, o cualquier condición isquémica que abarque otros territorios como isquemia mesentérica, neuritis óptica).
Análisis estadístico de los datosLas variables continuas fueron analizadas usando el test de Kolmogorov-Smirnov para verificar la distribución normal. Están descritas como media±DE, o mediana y rango intercuartílico para las de distribución no normal. La comparación de variables cuantitativas de distribución normal y no normal se realizó mediante el test de correlación de Pearson o Spearman, respectivamente. La comparación de datos paramétricos se realizó mediante el test de Student o ANOVA. Las variables categóricas se expresaron como porcentaje, y se compararon empleando el test de Chi-cuadrado. Se empleó un análisis de supervivencia (Kaplan-Meier) para estimar la capacidad predictiva de mortalidad para cada definición de hipotensión intradiálisis. Finalmente, mediante un análisis de riesgos proporcionales de Cox se estimó la relación entre mortalidad y HAID. Se consideró estadísticamente significativo un valor de p<0,05 con un intervalo de confianza del 95%. El análisis se efectúo mediante el paquete informático SPSS versión 20.0 (SPSS, Inc.,Chicago, IL, EE.UU.).
ResultadosCaracterísticas basalesLas causas de ERC más prevalentes fueron la nefropatía diabética (22,1%) y la glomerular (22,1%), mientras que la menos frecuente fue la nefropatía vascular (5,9%). Alrededor del 60% de los pacientes recibían medicación antihipertensiva, con una media de número de fármacos de 0,6±0,4. Los betabloqueantes (35,3%), los bloqueantes del sistema renina-angiotensina (26,5%) y los diuréticos (11,8%) fueron los más utilizados. Las características basales se resumen en la tabla 1.
Características basales
| Hallazgos clínicos/analíticos | Media±DE n (%) |
|---|---|
| Edad (años) | 58,6±14,7 |
| Género (masculino/femenino), n (%) | 44 (64,7) / 24 (35,3) |
| Diabetes mellitus, n (%) | 16 (23,5) |
| FAV / Catéter, n (%) | 59 (86,8) / 9 (13,2) |
| Patología cardiovascular, n (%) | 34 (50) |
| Tiempo en HD (meses)a | 46,5 (24-104) |
| Función renal residual, n (%)b | 18 (26,5) |
| HDF-OL, n (%) | 50 (73,5) |
| Pacientes con fármacos anti-HTA, n (%) | 43 (63,2) |
| Hemoglobina (g/dl) | 11,3±1,3 |
| Calcio sérico (g/dl) | 8,6±0,6 |
| Fósforo sérico (mg/dl) | 3,9±1,5 |
| Proteína C reactiva [PCR] (mg/dl) | 0,8±1,4 |
| Albúmina sérica (g/dl) | 3,7±0,4 |
| Colesterol-HDL (mg/dl) | 46,2±15,8 |
| IMC (kg/m2) | 24,9±6,4 |
| Sobrehidratación (L) | 1,47±1,59 |
| Masa magra (kg) | 35,1±11,6 |
| Índice tejido magro (kg/m2) | 12,8±3,4 |
| Masa grasa (kg) | 28,3±15,2 |
| Índice tejido graso (kg/m2) | 12,3±6,1 |
Los datos de composición corporal se obtuvieron mediante BCM (FMC).
DE: desviación estándar; FAV: fístula arteriovenosa; HD: hemodiálisis; HDF-OL: hemodiafiltración online; HDL: lipoproteína de alta densidad; HTA: hipertensión arterial; IMC: índice de masa corporal; n: número de pacientes.
Las principales características de las 1.224 sesiones de diálisis, 18 por paciente, se resumen en las tablas 2 y 3.
Características de las sesiones de diálisis
| Parámetros relacionados con la HD | Media±DE |
|---|---|
| PAS prediálisis (mmHg) | 139,2±16,8 |
| PAS posdiálisis (mmHg) | 128,9±17,2 |
| Ganancia de peso interdiálisis (gramos) | 1.873±685 |
| Ultrafiltración (ml) | 1.866±717 |
| Ratio de ultrafiltración (ml/h/kg) | 7,4±2,9 |
| Número de sesiones con ratio de ultrafiltración >12ml/h/kg | 1,8±3,1 |
| Kt/V | 2,0±0,5 |
| Volumen convectivo, pacientes en HDF-OL (L) | 27,6±4,1 |
| Temperatura de baño de diálisis (̊C) | 35,6±0,4 |
| Conductividad baño de diálisis (mSm/cm) | 13,7±0,1 |
| Ratio de reducción de urea (%) | 81,9±6,7 |
| Ratio de reducción de β2-microglobulina (%) | 79,1±8,1 |
Kt/V: obtenido por dialisancia iónica mediante monitor 5008 FMC.
HD: hemodiálisis; HDF-OL: hemodiafiltración online; PAS: presión arterial sistólica.
Características de las sesiones de diálisis según modalidad de diálisis
| HDF-OL n=50 | HD alto flujo n=18 | p | |
|---|---|---|---|
| Qb (ml/min) | 463,3±49,1 | 410,2±67,9 | 0,006 |
| Temperatura de baño de diálisis (̊C) | 35,6±0,4 | 35,5±0,3 | ns |
| Kt/Vs | 2,0±0,4 | 1,8±0,5 | ns |
| Volumen convectivo, HDF-OL (L/sesión) | 27,6±4,1 | - | - |
| RR-β2-microglobulina (%) | 80,2±6,5 | 70,5±13,7 | 0,010 |
| RR-Urea (%) | 82,1±6,6 | 81,2±8,5 | ns |
| GPID (gramos) | 1.917,6±694,3 | 1.749,6±661,5 | ns |
| Ultrafiltración (ml) | 1.914,1±736,4 | 1.732,4±661,3 | ns |
| Ratio UF (ml/h/kg) | 7,5±3,2 | 7,1±1,9 | ns |
| PAS prediálisis (mmHg) | 139,2±18,3 | 139,2±12,4 | ns |
| PAS posdiálisis (mmHg) | 129,0±19,0 | 128,7±11,2 | ns |
Kt/V: obtenido por dialisancia iónica mediante monitor 5008 FMC.
GPID: ganancia de peso interdiálisis; HD: hemodiálisis; HDF-OL: hemodiafiltración online; ns: no significativo; PAS: presión arterial sistólica; Qb: flujo sanguíneo; RR: ratio de reducción; UF: ultrafiltración.
Las definiciones más frecuentes en el estudio fueron las «asintomáticas» (Fall20: 11,0±4,2 sesiones; Fall30: 7,9±4,8 sesiones; Nadir90: 3,1±3,8 sesiones; Nadir100: 6,1±5,7 sesiones) en comparación con las «sintomáticas» (KDOQI: 1,7±2,0 sesiones; HEMO: 2,3±2,5 sesiones) (tabla 4).
Prevalencia de definiciones de hipotensión arterial intradiálisis
| Definición de HAID | n/1.000 sesiones | Pacientes con evento positivo HAID (>25% sesiones) |
|---|---|---|
| Nadir90 | 172,3 | 27,9% |
| Nadir100 | 339,8 | 50% |
| Fall20 | 611,1 | 95,6% |
| Fall30 | 441,1 | 73,5% |
| Fall20Nadir90 | 145,4 | 23,5% |
| Fall30Nadir90 | 120,1 | 16,2% |
| KDOQI | 98,0 | 10,3% |
| HEMO | 129,9 | 20,6% |
Se definió como evento positivo de HAID si una definición ocurría en >25% de las sesiones analizadas.
HAID: hipotensión arterial intradiálisis.
No encontramos diferencias entre la tasa de HAID (todas las definiciones) y la presencia de FRR. Sin embargo, encontramos que los pacientes con FRR precisaban un significativo menor ratio de UF (5,2±2,5ml/h/kg) que los que no tenían FRR (8,2±2,6ml/h/kg) (p<0,001). Tampoco encontramos diferencias entre la HAID y los antecedentes de patología cardiovascular, ni con la modalidad de diálisis (HDF-OL y HD de alto flujo), ni con el tipo de acceso vascular empleado para la diálisis (FAV frente a catéter). Los factores relacionados con las distintas definiciones de HAID se resumen en la tabla 5.
Factores relacionados con la hipotensión arterial intradiálisis
| Nadir90 | Nadir100 | KDOQI | HEMO | |||||
|---|---|---|---|---|---|---|---|---|
| <25% sesiones | >25% sesiones | <25% sesiones | >25% sesiones | <25% sesiones | >25% sesiones | <25% sesiones | >25% sesiones | |
| Edad (años) | 57,6±13,7ns | 61,4±17,2ns | 54,5±13,6p=0,019 | 62,8±14,8p=0,019 | 58,5±15,4ns | 59,7±6,8ns | 58,8±14,6ns | 58,1±15,7ns |
| Diabetes mellitus (%) | 24,5ns | 21,1ns | 23,5ns | 23,5ns | 19,7p=0,048 | 57,1p=0,048 | 20,4ns | 35,7ns |
| Tiempo en HD (meses) | 66,7±70,1p=0,043 | 109,3±90,4p=0,043 | 65,6±63,7ns | 91,6±89,6ns | 79,9±81,0ns | 67,7±48ns | 83,5±83,8ns | 59,7±47,6ns |
| Pacientes con fármacos antihipertensivos (%) | 75,5p=0,002 | 31,6p=0,002 | 76,5p=0,024 | 50p=0,024 | 67,2ns | 28,6ns | 68,5ns | 42,9ns |
| PAS prediálisis (mmHg) | 143,8±14,9p<0,001 | 127,4±16,1p<0,001 | 147,6±14,1p<0,001 | 130,9±15,4p<0,001 | 138,8±17,2ns | 143,9±13,7ns | 139,6±17,0ns | 137,8±16,9ns |
| GPID (gramos) | 1809±690ns | 2038±685ns | 1812±783ns | 1934±575ns | 1844±678ns | 2123±740ns | 1823±701ns | 2063±604ns |
| Ratio de ultrafiltración (ml/h/kg) | 7,1±2,9ns | 8,2±2,7ns | 7,0±3,4ns | 7,8±2,3ns | 7,2±2,8ns | 9,4±3,2ns | 7,1±2,8ns | 8,4±3,1ns |
| β2-microglobulina sérica prediálisis (mg/L) | 20,9±5,3p<0,001 | 26,4±5,3p<0,001 | 20,3±5,8p=0,002 | 24,6±5,2p=0,002 | 22,2±5,6ns | 25,1±6,7ns | 22,2±5,8ns | 23,6±6,2ns |
| Caída del VS (%)a | 11,2±3,8ns | 12,1±2,8ns | 10,8±4,2ns | 12,1±2,8ns | 11,3±3,3ns | 13,1±4,3ns | 10,8±3,3p=0,03 | 13,5±3,1p=0,03 |
| Sobrehidratación (L) | 1,5±1,3ns | 1,3±2,1ns | 1,6±1,1ns | 1,2±1,9ns | 1,4±1,6ns | 1,7±1,0ns | 1,4±1,7ns | 1,5±1,1ns |
| Kt/V | 1,9±0,5ns | 2,0±0,3ns | 2,0±0,5ns | 1,9±0,4ns | 1,9±0,5ns | 2,1±0,5ns | 2,0±0,5ns | 1,9±0,4ns |
Se definió como evento positivo de HAID si una definición ocurría en >25% de las sesiones analizadas.
Kt/V determinado por dialisancia iónica.
GPID: ganancia de peso interdiálisis; HD: hemodiálisis; HAID: hipotensión arterial intradiálisis; ns: no significativo; PAS: presión arterial sistólica; VS: volumen sanguíneo.
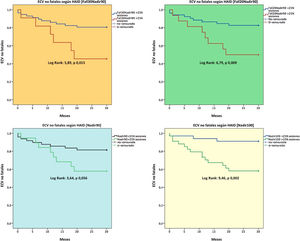
Se registraron 17 eventos cardiovasculares no mortales con la siguiente distribución: insuficiencia cardíaca (n=8), cardiopatía isquémica (n=5), ictus (n=2), enfermedad vascular periférica (n=2). Un mayor número de sesiones con HAID fue un factor predictor de estos eventos no mortales [Nadir100, Fall20Nadir90, Fall30Nadir90 (fig. 1)], y las definiciones Nadir100 y Fall30Nadir90 fueron factores predictores independientes de eventos cardiovasculares no fatales en los modelos ajustados (tabla 6).
Análisis multivariante para eventos cardiovasculares no mortales
| Modelo 1 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,00 | (0,96-1,04) | 0,6 |
| Sexo (masculino ref.) | 0,32 | (0,092-1,15) | 0,08 |
| Tiempo en HD | 1,00 | (0,99-1,00) | 0,3 |
| HAID [Nadir100] | 4,54 | (1,25-16,4) | 0,02 |
| APCV | 4,01 | (1,03-15,52) | 0,04 |
| Diabetes mellitus | 0,62 | (0,17-2,28) | 0,4 |
| Modelo 2 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,02 | (0,98-1,06) | 0,2 |
| Sexo (masculino ref.) | 0,34 | (0,09-1,21) | 0,09 |
| Tiempo en HD | 1,00 | (0,99-1,01) | 0,1 |
| HAID [Fall30Nadir90] | 3,08 | (1,07-8,87) | 0,03 |
| APCV | 2,97 | (0,73-12,08) | 0,1 |
| Diabetes mellitus | 0,66 | (0,18-2,46) | 0,6 |
| Modelo 3 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,01 | (0,97-1,06) | 0,4 |
| Tiempo en HD | 1,00 | (0,99 -1,01) | 0,07 |
| HAID [Nadir100] | 1,70 | (0,42-6,91) | 0,4 |
| RR-β2 microglobulina | 0,92 | (0,85-0,99) | 0,03 |
| Modelo 4 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,03 | (0,99-1,07) | 0,1 |
| Tiempo en HD | 1,00 | (1,00-1,015) | 0,04 |
| HAID [Fall30Nadir90] | 4,27 | (1,26-14,47) | 0,02 |
| RR-β2 microglobulina | 0,92 | (0,86-0,98) | 0,02 |
Se definió como evento positivo de HAID si una definición ocurría en >25% de las sesiones analizadas.
APCV: antecedentes de patología cardiovascular (origen aterosclerótico y no aterosclerótico); HAID: hipotensión arterial intradiálisis; HD: hemodiálisis (tiempo en hemodiálisis en meses); HR: hazard ratio; IC: intervalo de confianza; RR: ratio de reducción.
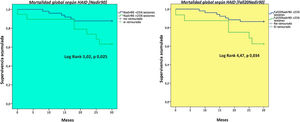
Con una media de seguimiento de 27,12±6,84 meses se registraron 13 eventos mortales. Las causas de mortalidad fueron de origen infeccioso (38,5%), secundarias a enfermedad cardiovascular (30,8%), ocasionadas por la muerte súbita (7,7%) y otras causas (23,1%, dentro de las cuales destaca la causa tumoral).
Un mayor número de sesiones con hipotensión intradiálisis (definiciones Nadir90, Fall20Nadir90) fueron predictores de mortalidad (fig. 2). La hipotensión arterial, según la definición Nadir90, fue un factor predictor independiente de mortalidad a 30 meses, mientras que otros factores como la edad avanzada o una PAS prediálisis baja también fueron predictores independientes de mortalidad. Además, encontramos que la HDF-OL se asoció a una menor tasa de mortalidad durante el seguimiento (tabla 7).
Análisis multivariante para mortalidad por todas las causas
| Modelo 1 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,04 | (0,99-1,09) | 0,1 |
| Sexo (masculino ref.) | 0,56 | (0,15-2,07) | 0,3 |
| Tiempo en HD | 0,99 | (0,99-1,01) | 0,7 |
| HAID [Nadir90] | 3,2 | (1,08-9,64) | 0,035 |
| APCV | 0,72 | (0,17-3,14) | 0,6 |
| Diabetes mellitus | 0,46 | (1,01-2,18) | 0,3 |
| Modelo 2 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,04 | (1,00-1,08) | 0,03 |
| Sexo (masculino ref.) | 0,58 | (0,15-2,2) | 0,4 |
| Tiempo en HD | 0,99 | (0,99-1,06) | 0,6 |
| HAID [Fall20Nadir90] | 1,9 | (0,53-7,06) | 0,3 |
| APCV | 1,3 | (0,39-4,8) | 0,6 |
| Diabetes mellitus | 0,47 | (0,09-2,2) | 0,3 |
| Modelo 3 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,02 | (0,99-1,07) | 0,2 |
| Modalidad HD (HDF-OL ref.) | 0,26 | (0,07-0,92) | 0,03 |
| HAID [Nadir90] | 1,41 | (0,37-5,3) | 0,6 |
| PAS prediálisis | 0,95 | (0,91-1,00) | 0,06 |
| Modelo 4 | Análisis multivariante | ||
|---|---|---|---|
| HR | (IC 95%) | p | |
| Edad | 1,02 | (0,98-1,07) | 0,2 |
| Modalidad HD (HDF-OL ref.) | 0,26 | (0,07-0,93) | 0,03 |
| HAID [Fall20Nadir90] | 1,2 | (0,34-4,3) | 0,7 |
| PAS prediálisis | 0,95 | (0,91-0,99) | 0,03 |
Se definió como evento positivo de HAID si una definición ocurría en >25% de las sesiones analizadas.
APCV: antecedentes de patología cardiovascular (origen aterosclerótico y no aterosclerótico); HAID: hipotensión arterial intradiálisis; HD: hemodiálisis (tiempo en hemodiálisis en meses); HDF-OL: hemodiafiltración online; HR: hazard ratio; IC: intervalo de confianza; PAS: presión arterial sistólica.
En una cohorte de pacientes prevalentes en HD, demostramos el poder predictivo de eventos cardiovasculares no fatales y de mortalidad global de la hipotensión intradiálisis, especialmente con las definiciones asintomáticas (nadir), lo que magnifica la importancia que tiene un episodio de hipotensión en diálisis independientemente que se acompañe o no de sintomatología asociada.
La evaluación adecuada del impacto de la hipotensión intradiálisis depende en gran medida del uso de una definición que incluya distintos escenarios clínicos, lo más cercano posible a la práctica habitual de una sesión de diálisis. Hay definiciones que se basan en la necesidad de implementar medidas correctivas tales como la reducción de la tasa de UF, o la administración de suero salino, entre otras, mientras que otras definiciones se basan en el descenso absoluto de la PAS a partir de la PAS prediálisis, o en las definiciones nadir sin presencia de síntomas1,2. No obstante, las guías clínicas utilizan una combinación de estos factores, es decir, un descenso de la PAS acompañado de un evento clínico más la necesidad de intervención1,2. Por ejemplo, las guías KDOQI y las guías europeas de buenas prácticas la definen como el descenso mayor o igual de 20mmHg en la PAS, o de 10mmHg en la presión arterial media, más la presencia de síntomas de hipotensión arterial (cefalea, calambres, dolor torácico, disminución de la agudeza visual o cualquier síntoma atribuible a una situación de hipoperfusión tisular), pudiendo precisar o no medidas de intervención para incrementar la presión arterial o mejorar los síntomas asociados3,4.
En este estudio se emplearon las 8 definiciones de HAID más recogidas en la literatura, incluidas las recomendadas por las guías clínicas europeas de buenas prácticas o las KDOQI1–5. Recientemente, Flythe et al. han demostrado el poder predictivo de mortalidad de la definición Nadir90 en pacientes con una PAS prediálisis en torno a los 130mmHg3, cifra similar de PAS prediálisis en nuestro estudio, y con el mismo resultado de una capacidad predictiva de mortalidad para la definición Nadir90. No obstante, con la definición Nadir100 no encontramos una relación con la mortalidad, aspecto que se puede explicar entre otros factores por la media de PAS prediálisis de nuestra serie. La capacidad predictiva de Nadir100 fue más consistente en pacientes con una PAS prediálisis superior a los 140mmHg3.
Cuando evaluamos la relación de la HAID con los eventos cardiovasculares no fatales, la combinación de Nadir90 y el descenso de 30mmHg de la PAS prediálisis (Fall30Nadir90) fue la definición de hipotensión que mantuvo una relación más consistente en términos predictivos en los modelos ajustados. Es de destacar que otras definiciones también mostraron en los análisis de supervivencia poder predictivo de eventos cardiovasculares fatales y no fatales, aunque en los modelos ajustados su relación no fue igual de consistente que para las definiciones Nadir90 y Fall30Nadir90, respectivamente. Resulta sorprendente la baja capacidad predictiva de la HAID sintomática en nuestro estudio, quizás condicionada por la baja prevalencia de la definición KDOQI y/o HEMO.
De acuerdo con nuestros datos se pone de manifiesto la alta variabilidad de la HAID interpacientes, similar a lo descrito en otros estudios de HAID6. Si consideramos la definición de HAID sintomática (KDOQI), el 39% de los pacientes del estudio no presentaron ninguna sesión con hipotensión sintomática. Al contrario, en el 60% de los pacientes por lo menos se registró un episodio de hipotensión sintomática. Un perfil similar ocurrió con las definiciones nadir, aunque el descenso de 20mmHg de la PAS (Fall20) fue un fenómeno constante, a tal punto que solo un paciente del estudio no experimentó ningún episodio de hipotensión bajo esta definición. Definimos como evento positivo de HAID si el número de sesiones en las que ocurría la definición de hipotensión era superior al 25% de las sesiones analizadas, un punto de corte similar al propuesto por otros autores3. Al utilizar este punto de corte, las definiciones de HAID sintomática y/o que requirieron algún tipo de intervención tuvieron una prevalencia del 10,3% y 20,6%, respectivamente. En contrapartida, la prevalencia de Nadir100 fue del 50% frente a un 27,9% de Nadir90. Estas diferencias en cuanto a la prevalencia de HAID observada en nuestros datos son similares a las reportadas en otros estudios con una oscilación de la prevalencia de HAID de un 5-30%, y dependen en gran medida de la definición empleada1,2.
La HAID está condicionada por factores propios del paciente (edad avanzada, diabetes, mayor tiempo en HD, baja PAS prediálisis, insuficiencia cardíaca, disfunción autonómica) pero también influyen aspectos propios de la HD8. Actualmente disponemos de la suficiente evidencia clínica para caracterizar la HD como un factor de riesgo desde el punto de vista hemodinámico, especialmente sobre un árbol vascular susceptible9,10. El efecto negativo y acumulativo del estrés hemodinámico condicionado por la HD es potencialmente perjudicial para la funcionalidad de un órgano9,10. El mejor ejemplo de este escenario clínico es la entidad conocida como miocardio aturdido11, condición común en HD12, lo que conlleva una pérdida de la función contráctil en el momento que más se requiere un mayor gasto cardíaco para compensar la reducción en la presión arterial9–12. A lo que se suma el compromiso habitual en la ERC de los mecanismos adaptativos a nivel de la microcirculación, lo que se agrava en el contexto de un mayor requerimiento de oxígeno como ocurre en la hipertrofia del ventrículo izquierdo8.
En nuestro estudio, la presencia de patología cardíaca solo se asoció con el descenso de 30mmHg de la PAS prediálisis (Fall30), aunque la edad avanzada y un mayor tiempo en HD fueron factores que se asociaron con una mayor frecuencia de episodios de hipotensión según las definiciones nadir. Y la presencia de diabetes mellitus aumentó la probabilidad de experimentar un episodio sintomático de hipotensión (KDOQI). El efecto negativo desde el punto de vista hemodinámico actúa como un fenómeno expansivo, a tal punto que todos los órganos de la economía pueden verse críticamente afectados. Destacan las recientes descripciones a nivel cerebral de Polinder-Bos et al. y Findlay et al., que demuestran un significativo descenso del flujo sanguíneo cerebral durante una sesión de HD13,14, una imagen especular de lo que sucede a nivel cardíaco, lo que los autores definen como «cerebro aturdido»14.
El descenso de la presión arterial en HD no se suele acompañar del efecto positivo en la mortalidad observado en población general7, y en el presente estudio objetivamos que una PAS prediálisis más baja aumentó la probabilidad de experimentar una hipotensión según las definiciones nadir. Además, encontramos que una PAS prediálisis más baja fue un factor predictor independiente de mortalidad, de forma similar a lo que han hallado otros autores15–20. Aunque no disponemos de la suficiente evidencia para determinar cuál es el rango óptimo de presión arterial en HD; cada vez hay más datos que sugieren que la relación entre la morbimortalidad y la presión arterial adopta una curva en «J» o en «U»15–20. Li et al., Klassen et al., Zager et al. y Bansal et al. han reproducido hallazgos similares a los presentados en este estudio con el denominador común de mayor riesgo de mortalidad en situación de «normotensión», o de hipotensión arterial en pacientes en HD con distintos rangos de PAS prediálisis predictora de mortalidad (pej., <120mmHg, <130mmHg, <110mmHg)16–19. Es probable que el efecto paradójico de esta relación se explique por una mayor susceptibilidad desde el punto de vista hemodinámico en pacientes con patología cardíaca20, y en nuestros datos una PAS prediálisis por encima de los 140mmHg se asoció con una menor tasa de mortalidad durante el seguimiento.
El esquema de diálisis de los pacientes participantes del estudio fue de 3 sesiones a la semana con una dosis de diálisis óptima en las 1.224 sesiones de diálisis analizadas, conforme a lo recomendado por las guías de adecuación de diálisis21. La ganancia de peso interdiálisis estuvo por debajo de los 2kg, media habitual en nuestro entorno22, lo que justifica el ratio de UF de 7,4±2,9ml/h/kg. Este ratio es considerablemente inferior a los puntos de corte de 10, 12, o 13ml/h/kg propuestos por otros autores como factores de riesgo de morbimortalidad cardiovascular23,24. Si bien estaría por encima de los 6ml/h/kg, que sería el punto de corte a partir del cual otros autores han identificado que empezaría la relación lineal entre mortalidad y ratio de UF25. Un aspecto interesante de nuestros datos es que no encontramos diferencias entre la tasa de UF y las distintas definiciones de hipotensión.
La falta de uniformidad de criterios respecto a cuál debería ser el rango ideal de presión arterial en HD es una de las tareas pendientes en el campo de la nefrología. Las guías KDOQI, con un grado de recomendación C, definen un objetivo de presión arterial prediálisis<140/90mmHg, y posdiálisis<130/80mmHg7. Con base en la información derivada de estudios observacionales, esta práctica podría exponer a los pacientes a una mayor tasa de hipotensión intradiálisis, con el consiguiente efecto negativo en la morbimortalidad15–20. Por ello, son necesarios ensayos clínicos que definan con mayor claridad los objetivos terapéuticos de presión arterial en pacientes en HD.
Un aspecto clave relacionado con la tolerabilidad hemodinámica en HD es la estimación del peso seco, concepto que ha ido evolucionando a medida que lo ha hecho la propia diálisis constituyendo un verdadero desafío para el nefrólogo dada la pobre precisión de la exploración física, y hasta la fecha sigue siendo motivo de controversia26,27. En su definición más clásica, el peso seco representa el estado de «normohidratación» o euvolemia después de la sesión de diálisis; así se identificaba que un paciente alcanzaba su peso seco cuando al bajar de ese nivel experimentaba un episodio de HAID22,26–28. La bioimpedanciometría espectroscópica es una herramienta que puede ayudar a estimar el peso seco27, si bien el cálculo del peso seco es más un arte y una cuestión de ensayo-error que una fórmula matemática, o el resultado de la aplicación de una técnica22. En esta línea argumental, otros autores proponen que un «estado permisivo de hipervolemia» garantizaría la perfusión de distintos órganos al mantener un estado de leve aumento del volumen extracelular, lo que definen como «peso seco funcional», y sería una opción razonable para evitar el daño producido por los estados de hipoperfusión en el contexto de la HAID27. De acuerdo con nuestros resultados, no encontramos diferencias significativas entre las distintas definiciones de hipotensión, siendo especialmente llamativo en las definiciones sintomáticas, pero también en las definiciones nadir. Varios factores pueden explicar estos datos (p.ej., un ratio de UF bajo), pero no se puede dejar de resaltar el papel del nefrólogo a la hora de estimar «correctamente» el peso seco en HD, bien sea para conseguir el objetivo de un estado de «normovolemia», o bien en los casos en que es preferible alcanzar ese «estado permisivo de hipervolemia» que otros autores justifican como mecanismo protector del daño tisular en diálisis.
El presente estudio no está exento de limitaciones; por ejemplo, el pequeño tamaño muestral, que nos condiciona una menor potencia estadística y limita la capacidad de generalizar nuestros resultados. Otros aspectos críticos podrían ser el análisis retrospectivo de las sesiones de diálisis —si bien incluimos un número razonable de sesiones, lo que da una idea global de la situación del paciente en diálisis— y el carácter observacional del estudio, que imposibilita demostrar una relación de causalidad entre la hipotensión y los eventos cardiovasculares.
En conclusión, la hipotensión intradiálisis, incluso asintomática, tiene poder predictivo de mortalidad y eventos cardiovasculares no fatales en pacientes prevalentes en HD, lo que enfatiza la necesidad de enfocar nuestros esfuerzos en la prevención del estrés hemodinámico con el objetivo de minimizar el daño tisular y el consiguiente efecto negativo en la morbimortalidad.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
AutoríaSC: diseño del estudio, recolección de datos, análisis estadístico, revisión bibliográfica, escritura del manuscrito. AV: análisis estadístico, revisión del manuscrito. NM: análisis estadístico, revisión del manuscrito. LS: recolección de datos, análisis estadístico. SA: análisis estadístico, revisión del manuscrito. JMLG: diseño del estudio, revisión del manuscrito. JL: revisión del manuscrito.
Conflicto de interesesLos autores declaran que no tienen conflictos de intereses.