Pese a sus ya casi cuarenta años de historia y la mejora de la supervivencia tanto de la técnica como de los pacientes, la modalidad de diálisis peritoneal (DP) sigue siendo la menos utilizada. Tras un repaso histórico y un análisis de los datos actuales, analizamos los factores no médicos («el círculo vicioso») que contribuyen a la infrautilización de la DP: la formación deficiente de los especialistas, la falta de infraestructuras, las pequeñas unidades de DP, la falta de información a los pacientes, la proliferación de unidades de hemodiálisis, la escasez de consultas de enfermedad renal crónica avanzada o la forma de financiación de la diálisis. Y proponemos estrategias de futuro para mejorar y promocionar el uso y desarrollo de la DP.
Despite the 40 years history, the comparable survival of Hemodialysis and Peritoneal Dialysis (PD), and the improved PD technique survival, the percentage of patients performing PD is low. After a short history review and data description, we analyze the many non-medical factors (“the vicious circle”) that contribute to the underutilization of PD: inadequate medical training, lack of infrastructures, small PD units, inadequate patient education for choice of dialysis modality, lack of multidisciplinary end-stage renal disease units, the proliferation of hemodialysis centers, or the trends in government reimbursement. Several of these factors are modifiable, and we propose future strategies to increase the use of PD.
A punto de cumplirse cuarenta años de la existencia de la diálisis peritoneal continua ambulatoria (DPCA), el desarrollo de esta técnica no ha seguido una evolución «natural», y lejos de ser ya una técnica «adulta» y reconocida, al menos en nuestro país sigue sin «independizarse», sin ser considerada, y en ocasiones da la impresión de estar quizás empezando a declinar en plena juventud.
Pero no es esta una problemática local, y en otros países se está apreciando el mismo problema. El contexto económico internacional y nacional está motivando cambios políticos, estructurales y funcionales que afectan a la sanidad, y por tanto también a la diálisis peritoneal (DP). Sin embargo, las diferentes incidencias y prevalencias de la técnica según los países que se analicen hacen pensar que la situación actual de la DP no define una «enfermedad» propia de la técnica, sino que debe de haber otros factores que justifiquen estas diferencias en su uso y desarrollo.
Si queremos que la «joven pero suficientemente preparada» técnica de DP tenga futuro y no se marchite, tendremos que ver y analizar qué ha pasado, qué pasa y qué no queremos que siga pasando. Aprender del pasado y del presente para romper las barreras que impiden su progreso, mediante la aplicación de estrategias de futuro.
EL PASADO
El primer uso clínico del peritoneo se remonta a 1743, cuando C. Warrick decidió tratar a una paciente con ascitis de repetición quemando los linfáticos abdominales, a los que atribuía el origen de la ascitis, con una solución de vino de Borgoña y agua de Bristol a partes iguales. Para ello, tras drenar la ascitis infundió dicha solución y, aunque clínicamente la paciente lo toleró mal, tras recuperarse la ascitis tardó más tiempo en reaparecer. Animado por este hecho, en el siguiente intento infundió el vino más concentrado. Y, cuando milagrosamente la mujer salió del trance, la ascitis no volvió a repetirse1.
En el siglo siguiente, y con el auge de la cirugía abdominal, se iniciaron los estudios funcionales del peritoneo, demostrándose que este se comportaba como una membrana semipermeable: F. von Recklingshausen publica una descripción muy detallada de la anatomía, histología y fisiología del peritoneo2, G. Wegner demuestra que añadiendo un agente osmótico se puede conseguir ultrafiltración3, E. H. Starling demuestra que el transporte de agua y solutos a través del peritoneo y la sangre es bidireccional4 y J. Putman tras repetidos experimentos en animales publica la «Eficacia del peritoneo como membrana dializante»5.
Ya en el siglo XX, Ganter, en 1923, realiza los primeros lavados peritoneales con intención dialítica reseñados en humanos, describiendo la técnica con profusión de instrucciones y recomendaciones6.
En 1927 H. Heusser y H. Werder son los primeros en tratar con DP de flujo continuo (usando dos catéteres) a tres pacientes con insuficiencia renal aguda (IRA) por intoxicación por mercurio7. Tuvieron éxito bioquímico, al demostrarse un descenso en los niveles de urea sanguíneos, pero no clínico, porque los pacientes fallecieron. En 1934 Rosenmark lo vuelve a intentar, utilizando por primera vez glucosa como agente osmótico. Tampoco él tuvo éxito clínico, pero nuevamente demostró un descenso de los niveles de urea8.
No fue hasta después de la Segunda Guerra Mundial cuando, en 1946, J. Fine, A. Seligman y H. Frank, en Boston, y R. Reid, en Inglaterra, reseñan los primeros casos de IRA tratada y resuelta con DP continua9,10.
Llegamos así a la década de 1950, con la DP utilizada como último recurso para el tratamiento de la IRA por sus muchas e importantes complicaciones y porque todavía no estaban definidos aspectos claves de la técnica, como el tipo de acceso, de dializado, de flujo, etc. No estaba claro si la técnica de lavados peritoneales debía ser de flujo continuo (con dos catéteres) o intermitente (el mismo catéter para infundir y drenar), aunque al final la menor tasa de fugas y de peritonitis inclinaron la balanza hacia la segunda opción, y a partir de los estudios de Arthur Grollman11 se empiezan a permitir tiempos de permanencia de la solución en la cavidad peritoneal.
Se intentaron distintos tipos de catéteres peritoneales, porque los problemas de acodamientos, obstrucciones y atrapamientos eran frecuentes. El diseño de M. Maxwell y su equipo de un catéter de nailon, flexible y no irritante, colocado mediante trocar a través de la línea alba facilitó el método. También es Maxwell quien, en 1959, introduce el sistema de botellas colgantes que, una vez infundido su contenido en la cavidad peritoneal, servían, al bajarlas al suelo, para recoger el drenado. Convence a Baxter para comercializar la solución de diálisis y se estandariza la técnica12.
A finales de diciembre de 1959, una mujer ingresa en San Francisco tras detectarse en su primera revisión posparto datos clínicos y analíticos de uremia. El Dr. R. F. Ruben le implanta un catéter peritoneal e inicia tratamiento con lavados peritoneales. Al cabo de pocos días la paciente se recuperó bastante, pero un estudio más detallado demostró que se trataba ya de un caso de insuficiencia renal crónica (IRC). Sin embargo, mantuvieron el catéter y volvieron a repetir la serie de lavados peritoneales cuando la clínica urémica volvió a aparecer… y la paciente y sus parámetros analíticos volvieron a mejorar. Y así una vez, y otra… se iniciaban los lavados peritoneales cuando se alcanzaba una cifra de creatinina de 20 mg/dl y se suspendían cuando dicho valor había descendido a 13 mg/dl. De esta forma, la paciente fue tratada durante más de seis meses13. Aunque este fue el primer caso de IRC tratado y mantenido con DP periódica, nunca fue publicado, porque los revisores entendieron que carecía de interés, al ser solo un caso y tener una supervivencia corta.
Comienza así la década de los sesenta, con varios centros incluyendo a pacientes con uremia crónica en DP periódica. Al principio, manteniendo cánulas plásticas en el punto de entrada del catéter peritoneal que se tapaban durante el descanso y servían de «puerta» para el catéter en cada sesión de DP14. Las frecuentes complicaciones infecciosas hicieron que el equipo de Tenckhoff, Shilipetar y Boen se decantase por implantar un catéter en cada sesión de diálisis. Ese mismo equipo logró tener un respetable programa de DP periódica domiciliaria (el médico iba al domicilio a implantar el catéter)15,16. Pero las limitaciones que suponían tanto las implantaciones repetidas del catéter como los grandes volúmenes de solución requeridos, así como la alta tasa de infecciones favorecidas por tantas conexiones y desconexiones, hacían que la técnica de DP periódica se utilizase como antesala a la hemodiálisis (HD), o en situaciones clínicas especiales, y que no se le augurase un futuro exitoso.
Varias innovaciones cambiaron este panorama:
- Por un lado, la sencilla modificación de West y Roberts17, que introducía un estilete en el catéter reduciendo la necesidad de suturas y la tasa de fugas del dializado y que simplificó la técnica de implantación.
- Por otro, el diseño de Tenckhoff en 1968 de un catéter recto de silicona con uno o dos dacron18 que permitían mantenerlo implantado durante largo tiempo (y que aún hoy es modelo de referencia).
- Por último, la aparición de las primeras máquinas cicladoras, que infundían y drenaban la solución automáticamente sin tener que hacer múltiples desconexiones19.
Distintos modelos de catéteres y de cicladoras fueron diseñados a partir de los originales, permitiendo aumentar el número de pacientes que se trataban con la denominada técnica de DP periódica: lavados peritoneales continuos durante 48-72 horas una o dos veces por semana. Pero se seguían necesitando grandes cantidades de solución de diálisis, contenidas en grandes garrafas de cristal, y cuya esterilidad era difícil de garantizar.
Hasta que, en 1975, J. Moncrief y R. Popovich postulan la idea de que se podía conseguir la misma eficacia de diálisis utilizando menos volumen pero permitiendo permanencias más largas y realizando el tratamiento todos los días. Aunque quisieron publicar su experiencia, nuevamente su trabajo no fue aceptado, aunque sí aparece en el libro de abstracts del congreso de la American Society for Artificial Internal Organs de 197620. La idea, bautizada con el nombre de «diálisis peritoneal continua ambulatoria», pronto entusiasmó en muchos países. Básicamente imitaba el sistema de las botellas colgantes, pero se realizaban muchos menos intercambios, al permitir permanencias diurnas de 4-6 horas y una nocturna de 8 horas.
En 1977 se realiza el primer estudio multicéntrico que, aunque con pocos pacientes, demuestra que la DPCA era más eficiente que la DP periódica21. En Canadá, D. Oreopoulus sustituye la botella de cristal por una bolsa plástica que, una vez infundido su contenido, se enrollaba y mantenía bajo la ropa para ser utilizada más tarde como bolsa receptora del drenado22.
Las peritonitis seguían siendo un importante problema hasta que, gracias a la adición de un conector de titanio entre el catéter y la línea de transferencia (Nolph, 1979) y el diseño de un sistema de doble bolsa que permite «purgar antes de infundir» (grupo de Buoncritiani, 1980), también este inconveniente parece estar en vías de resolución23,24.
Durante los años ochenta se diseñan nuevos tipos de catéter con el objetivo de reducir las complicaciones del acceso, aparecen la doble bolsa integrada y la conexión tipo luer-lock que reducen los riesgos de contaminación, y surgen también los primeros prototipos de cicladoras domésticas.
La técnica de DP progresa y se expande rápidamente a partir de los años noventa: mejora la conectología, aparecen nuevas soluciones de diálisis como el Nutrineal® (1995) o el Extraneal® (1996), se cambia el material de las bolsas contenedoras por otros más biocompatibles. Con el auge de la informática desde finales del siglo XX, aparecen las cicladoras que registran los tratamientos y que incluso permiten la telemedicina, y se consiguen soluciones más biocompatibles al sustituir el lactato por bicarbonato (2001-2003).
Con todos estos avances, la proporción de pacientes en DPCA aumenta vertiginosamente hasta que, en la primera década del siglo XXI alcanza un punto en el que esa tendencia se estanca o incluso se invierte.
EL PRESENTE
A. Los datos
Hemos dejado atrás una década en la que se confirma el descenso lento pero progresivo del número de pacientes incidentes en tratamiento renal sustitutivo (TRS), aunque se sigue manteniendo una diferencia significativa en el uso de las distintas modalidades de terapia. Los últimos datos recogidos por la Sociedad Española de Nefrología (S.E.N.) muestran una incidencia media nacional de 120 pmh, con curiosas discrepancias entre comunidades autónomas (CCAA). Así, las de mayor incidencia doblan el dato de las de menor incidencia. Por grupos de edades, la mayor tasa de incidencia se da en pacientes mayores de 75 años25.
Si analizamos nuestra posición dentro del conjunto europeo, vemos que estamos en un aceptable término medio26. No tan aceptable si desglosamos el uso de las distintas modalidades de terapia. Así, en España, el uso de DP no es de los más altos: nos superan la mayoría de los países desarrollados, e incluso alguno de los no considerados como tales. Volvemos a ver diferencias significativas entre las distintas CCAA, aunque en alguna de ellas como, por ejemplo, Cantabria, el menor uso de la DP es a costa de una mayor tasa de trasplante anticipado.
Pero también es importante saber cuántos pacientes permanecen en TRS. Los datos de prevalencia van en progresivo aumento, y ya hemos superado y nos mantenemos por encima de los 1000 pmh. Nuevamente hay diferencia entre los datos de las distintas modalidades de terapia, porque crece el apartado de trasplante. Las diferencias entre distintas CCAA persisten, pero no son tan llamativas. Y como consecuencia del fallecimiento de los pacientes más ancianos, el grupo de edad más numeroso es ahora el de 50-75 años. Comparados con el resto de los países del registro europeo, vemos que esta vez nuestros datos de prevalencia nos sitúan cerca de los mejores puestos; podríamos decir que no lo hacemos mal y que conseguimos buenas supervivencias. Las diferencias de prevalencia de las distintas modalidades de terapia dependen más del grupo de pacientes trasplantados, pero son bastante similares tanto entre las distintas CCAA como en comparación con Europa.
En conclusión, se confirma el descenso progresivo de pacientes incidentes en TRS y el aumento de la prevalencia. Pero la DP sigue siendo la modalidad de diálisis menos usada.
¿Y esto por qué? ¿Es acaso la DP una técnica inferior a la HD? Numerosos estudios han demostrado que los resultados clínicos de la DP son similares, si no mejores, a los de la HD. Y que la tasa de supervivencia en ambas técnicas es similar27-33. En España se constata que la mortalidad es superior en HD independientemente del grupo de edad25.
B. El contexto
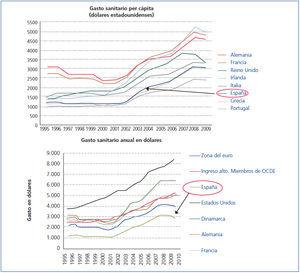
Es conocida y sufrida por todos, y recordada repetida y ampliamente en los medios de comunicación: la crisis económica. Y, ante la crisis, se han aplicado recortes. Uno de los apartados más mirado y más interesante para hacerlo es el gasto sanitario, que desde el inicio del siglo XXI ha ido en progresivo aumento y solo se ha contenido en los últimos años precisamente por la crisis, pero cuyo importe en España no es precisamente de los más elevados34,35 (figura 1).
La partida de gasto sanitario más elevada es precisamente la del Gasto de Atención Especializada36. Y ahí entramos nosotros, que somos especialistas. Los pacientes renales suponen una muy pequeña parte de la población enferma y, sin embargo, consumen una importante cantidad de los recursos sanitarios37. Por ello se ha hecho necesario estudiar cómo racionalizar dicho gasto. Y esto se ha hecho tanto a nivel nacional como internacional37-44.
Si hay un país donde para tener salud hay que tener dinero, ese es Estados Unidos. El sistema americano demostró que tratar a sus pacientes renales suponía un gasto muy importante; más si se trataban con HD que con DP. Y sin embargo la mayoría de sus pacientes se trataban con HD. A partir de estos datos hicieron una estimación de costes a cinco años según varios supuestos: lo que les costaría mantener la situación actual, y las modificaciones que tendrían que hacer en la proporción de uso de la DP para conseguir un ahorro de un billón de dólares. Encontraron que, en todos los supuestos en los que se aumentaba el uso de la DP, se conseguía dicho ahorro y que, cuando se reducía dicha proporción, no solo no se conseguía ahorro sino que incluso se superaba el gasto inicial calculado45,46.
Un estudio parecido se ha hecho en nuestro país37. Tras analizar los costes de cada una de las modalidades de diálisis, teniendo en cuenta la previsión de aumento de la población en la técnica y considerando que más de la mitad de los pacientes inician tratamiento de diálisis de forma no programada, se hizo una estimación de costes a 15 años según varios escenarios: el primero, manteniendo la situación actual; el segundo, aumentando la tasa de inicio programado de TRS; el tercero, incrementando la inclusión en DP; y el cuarto escenario, combinando el segundo y el tercero. La conclusión fue que cualquiera de los escenarios suponía un menor coste paciente/año que mantener la situación actual y que el ahorro conseguido era muy significativo en los escenarios en los que se aumentaba el uso de la DP. Y esto sin considerar para el cálculo los costes de gastos colaterales, como pruebas complementarias o costes indirectos por morbilidad47,48.
Pero, entonces, si ninguna de las técnicas de diálisis es clínicamente superior a la otra49 y si es posible una distribución de las técnicas de diálisis más barata50, ¿por qué la DP sigue siendo la modalidad menos usada?51-53, ¿qué otros factores influyen en esta situación?
Se han descrito numerosos factores, además de los directamente dependientes de la técnica, relacionados tanto con los pacientes como con los centros, las administraciones, los sistemas sanitarios o incluso los propios profesionales51,54-59. Y muchos de ellos repetidos tanto fuera de nuestras fronteras como en casa.
EL FUTURO
A. Identificando barreras
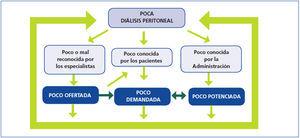
Y hacia ahí es a donde tenemos que ir: a romper ese círculo vicioso cuya consecuencia es el menor uso de la DP (figura 2). Un círculo mantenido por tres ejes principales.
1. La diálisis peritoneal es poco conocida y/o mal reconocida por los profesionales
Y, por tanto, poco ofrecida. Destacan varias razones para este desconocimiento o desprestigio de la DP.
1. El plan formativo de la especialidad: el programa nacional de formación de residentes de Nefrología obliga a las unidades docentes a disponer de unidad de HD, pero, sin embargo, considera opcional que también ofrezcan DP. Además, el tiempo de rotación estimado para la DP es marcadamente inferior60. Como consecuencia, los residentes no reciben una formación adecuada. Así, en una reciente encuesta realizada a residentes de la especialidad, más de la mitad reconocieron estar escasamente formados en DP61. Y no es este un problema español, sino que, en una encuesta similar realizada en los Estados Unidos los residentes americanos se quejaban de lo mismo58.
2. La falta de recursos (materiales y humanos): a pesar de que, como se indica en las guías nacionales de DP62 publicadas ya hace casi diez años, para disponer de una unidad de DP solo se precisan tres espacios pequeños y muy poco personal. Aunque las ratios iniciales de paciente/médico-enfermera se han ido ajustando por la complejidad de los pacientes, son pocos los centros que disponen de personal especializado y dedicado únicamente a la DP63,64. Esto, sumado a la falta de experiencia, hace que los pacientes de DP se consideren «una sobrecarga de trabajo»65. En el caso de los médicos, el combinar la atención de pacientes en HD (a los que se ve tres veces por semana) y en DP (de los que hay que «acordarse» por no estar tan presentes) hace que la atención de los pacientes «no tan visibles» no compute. En el caso de las enfermeras, la enfermería dedicada a la DP puede sentirse discriminada respecto a sus compañeras de HD por la mayor ratio de pacientes atendidos y la mayor dedicación personal y no «rutinaria» que estos suponen. Por otro lado, sus compañeras de HD, no habituadas a la técnica de DP, pueden sentirse agobiadas por el trabajo extra que suponen los pacientes de DP en los turnos de tarde o en las urgencias. Nuevamente, no se trata de un problema español, sino que también se ha descrito en otros países65,66.
3. El «efecto centro»: es otro de los factores implicados. Diversos estudios han demostrado que, a mayor tamaño de las unidades de DP y mayor número acumulado de pacientes tratados, mejores resultados se obtienen. El tamaño mínimo o «número clave» de pacientes tratados debe ser superior a 20-25 para que se puedan asegurar buenos resultados y menos problemas51,66-70. Y, sin embargo, en España casi la mitad de las unidades de DP no llega a esta cifra64.
4. La proliferación de unidades de HD: resulta difícil potenciar el uso de la DP cuando se siguen abriendo unidades de HD a un ritmo que supera el de la incidencia de pacientes y cuyo coste hay que amortizar. En un erróneo concepto de dicha amortización, se presiona para que todos los puestos estén ocupados, desviando a pacientes que podrían optar a la DP. Y, una vez saturadas las unidades de HD y dada la incidencia de nuevos pacientes, se justifica el seguir creando unidades de HD, que se dotan de personal y material incluso antes de ser inauguradas.
La no inclusión de pacientes en DP, precisamente para amortizar los puestos de HD, hace que los pocos pacientes que aún siguen en esta técnica sean proporcionalmente más caros, porque siguen precisando de personal que les atienda y ese personal podría ocuparse de un mayor número de pacientes50,63-65. Se ha visto, además, que los centros hospitalarios que disponen del apoyo de unidad de HD extrahospitalaria incluyen menos pacientes en DP50,64. Y esta situación se mantiene a pesar de que el precio de la DP es menor incluso que el de la HD en centros concertados37,50.
Algunos autores se han atrevido incluso a mencionar otros motivos ocultos en esta proliferación de unidades de HD, como la participación de los médicos en los beneficios de estas unidades o la mayor esponsorización o financiación por parte de empresas farmacéuticas, cuyos productos se consumen más en HD54,58,64,66.
5. La carga asistencial: y el último, pero no menos importante, factor que influye en la poca utilización de la DP es que los pacientes de DP dan más trabajo. Porque hay que resolver los problemas a distancia y/o en el momento, transmitiéndole al paciente la seguridad de que tiene supervisión continua71. Porque el manejo clínico del paciente de DP es distinto al de HD: en el control de la volemia, los esfuerzos para mantener la función renal residual, en la nutrición, etc. Porque, como dan más trabajo, los profesionales que no tratan habitualmente con ellos no suelen implicarse en su control y, en caso de ausencia del médico titular y ante la aparición de problemas, pueden preferir decantarse por la opción más «segura» de transferirlos a HD65.
Son muchos los factores que hay que controlar a distancia en un paciente al que no se ve tres veces por semana: el autocuidado que hay que mantener y potenciar para evitar el agotamiento psicológico del enfermo, la teleconsulta a la que obliga la frecuente lejanía del centro, la necesidad de una resolución rápida de problemas de la técnica que, no teniendo un rápido acceso alternativo, precisan de especialidades quirúrgicas o intervencionistas71. Por todo ello, en caso de cansancio, dificultad o aburrimiento, siempre queda la fácil alternativa de pasar al paciente a HD.
2. Poco conocida por los pacientes
Y, por tanto, poco demandada. Las razones de este hecho pueden resumirse en:
1. La información prediálisis: la información inicial que tienen los pacientes sobre la DP es siempre menor que sobre la HD, y mucho menor cuanto mayor es el paciente. Dedicamos poco tiempo a la información de los pacientes y mucho menos, precisamente, en los menos informados. En un reciente estudio se constató que dedicamos menos de una hora a informar a casi la mitad de los pacientes, que, lógicamente, al ser preguntados, se consideran mal informados72.
Varios estudios han demostrado que una mayor y mejor información al paciente sobre las técnicas de TRS aumenta el porcentaje de elección de DP73,74. En nuestro país, el Grupo de Apoyo para el Desarrollo de la Diálisis Peritoneal (GADDPE) ha confirmado que la utilización de herramientas educativas e informativas para la toma de decisión del paciente aumenta el índice de elección de DP frente a HD. De la conveniencia y necesidad de informar a los enfermos se ha hecho eco también el Consejo Asesor de las Mejores Prácticas Renales Europeas49.
Pero no solo debemos informar para mejorar la tasa de elección de DP, sino que en nuestro país la legislación nos obliga a ello. La Ley 41/2002 indica claramente que el paciente tiene el derecho de conocer todas las opciones terapéuticas de su proceso, que son los profesionales que le van a atender los que tienen que informarle y que dicha información debe ser refrendada por un consentimiento informado75.
2. Las consultas ERCA (enfermedad renal crónica avanzada): pero informar bien lleva su tiempo y, en nuestro país, cerca de la mitad de los pacientes inicia diálisis de forma no programada y, por tanto, en HD a través de un catéter vascular76. Consciente de este problema, la S.E.N. publicó las guías de la consulta ERCA77, entre cuyos cometidos están precisamente el informar regladamente a los pacientes y controlarlos estrechamente hasta su inclusión programada en diálisis. Sin embargo, aún no todos los centros disponen de consultas de este tipo y las personas con enfermedad renal avanzada se siguen viendo en la consulta general hasta su inmediata inclusión en diálisis. Los resultados obtenidos por las consultas ERCA son espectaculares, siempre que los pacientes no se deriven a ellas con una función renal tan reducida que estas consultas se conviertan en meros ejecutores del acceso de diálisis78-81.
3. Poco conocida por la Administración
Y, por tanto, poco potenciada. Pero a tenor de las declaraciones de los gobernantes, el desconocimiento de la DP no parece ser el problema82,83.
Son varios los aspectos en los que la Administración puede intervenir:
1. Nefrología preventiva: en cuestiones de salud, la Administración suele apreciar solo la parte visible del iceberg de la enfermedad, olvidando que es la no visible la más grande y peligrosa (figura 3).
Se centra más en el aspecto terapéutico sin darle a la prevención el importante papel que tiene. Son muchos los aspectos preventivos, tanto en nuestra especialidad como en la medicina en general, que han demostrado su eficacia clínica y su rentabilidad económica.
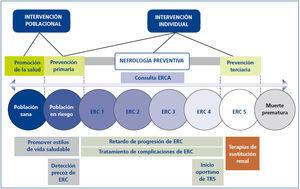
El esquema clásico de la medicina preventiva se puede aplicar perfectamente a la nefrología, aunque como especialistas lo que nos atañe más de cerca es la nefrología preventiva secundaria. En este apartado son muchos los factores de riesgo que se han de prevenir y controlar, actividades que, curiosamente, coinciden en gran medida con los cometidos de las consultas ERCA77,84,85 (figura 4).
Y por si la ganancia en salud no fuese argumento suficiente, diferentes estudios han demostrado que las actividades preventivas suponen una inversión económicamente rentable por el ahorro conseguido a medio y largo plazo86-89.
2. Tipo de financiación sanitaria: los países que poseen servicio de salud con provisión mayoritariamente pública tienen mayor disponibilidad de acceso a la DP y, por tanto, mayor prevalencia de pacientes en esta modalidad de diálisis, en comparación con los países que tienen una provisión mayoritariamente privada51,63.
En España, casi la mitad de los centros de HD son extrahospitalarios y la mayoría pertenecen a grandes compañías. El precio por sesión de HD es más caro en un centro hospitalario que en uno extrahospitalario, pero los centros extrahospitalarios solo ofrecen el servicio de HD crónica periódica; no atienden urgencias, ni las 24 horas del día, y los costes de medicación, transporte, pruebas complementarias, etc., repercuten en el centro hospitalario de referencia90.
La DP, a nivel nacional, está concertada con empresas privadas. El coste abonado por un día de terapia es relativamente bajo, pero es fijo independientemente de la cantidad de intercambios que realice el paciente, y nuevamente, no incluye la medicación, el transporte, etc.
Los diferentes estudios económicos sobre TSR realizados en nuestro país han demostrado de manera consistente que los costes reales no se relacionan con los que se reflejan oficialmente91,92.
El método de financiación de las técnicas de diálisis influye de manera determinante en su distribución. Un ejemplo de ello lo tenemos en Estados Unidos. Hasta 2011, cada una de las modalidades se pagaba de forma distinta, tanto en los costes de las partidas fijas (infraestructuras inmobiliarias, personal, energía, equipos, etc.) como en los de gastos en medicamentos, siendo menor el abono por ofrecer DP. Desde 2011, el sistema sanitario norteamericano abona a los centros la misma cantidad por paciente independientemente de la modalidad ofrecida. Puesto que los costes de las partidas son menores en DP, para obtener mayores beneficios los centros potenciarán el uso de DP. La modificación de la remuneración de la diálisis está favoreciendo el desarrollo de programas de DP93-95.
3. Incentivación de los profesionales: la falta de colaboración de los especialistas ha sido argumentada por gerentes de grandes hospitales como una de las causas por las que no se potencia la DP96. Y siendo conscientes de que en la nómina de los profesionales de los centros públicos no influye, al contrario que en los centros extrahospitalarios, el número de pacientes atendidos ni el tipo de técnica de diálisis ofrecido66, la mayoría de los gestores estaría de acuerdo en incentivar a los profesionales96.
En España tenemos un ejemplo de modelo de coordinación clínica público, extenso, con recursos y, por sus grandes logros, copiado fuera de nuestras fronteras: el Programa Nacional de Trasplantes, en donde la incentivación de los profesionales es una de las razones de su éxito. Este modelo ha demostrado ser beneficioso para el paciente, para los profesionales y para el sistema, y su esquema sería fácilmente aplicable a la DP.
B. Estrategias de futuro
Conociendo las barreras que impiden el crecimiento de la DP es fácil plantear estrategias de futuro97-100.
1. Para que la diálisis peritoneal esté mejor considerada
- Modificar el plan de formación de la especialidad, haciendo la rotación por DP obligatoria y de mayor duración. El objetivo debería ser que la formación de ambas técnicas de diálisis fuese independiente para cada una de las modalidades y de duración similar. Esto último no parece práctico o razonable en aquellos centros con unidades de DP pequeñas y con pocos pacientes, en las que generalmente un mismo facultativo es responsable de toda la diálisis.
- Evitar la proliferación de múltiples unidades pequeñas y en las zonas con varios hospitales valorar la creación de unidades de DP de referencia. De esta forma mejorarían tanto la experiencia acumulada, y por tanto los resultados clínicos, como la formación de los residentes.
- Reconsiderar la acreditación para la docencia MIR en aquellos hospitales que no ofrezcan DP o, en su defecto, hacer obligatoria para la formación de los residentes una rotación externa prolongada en un centro con experiencia en esta técnica.
- Independizar, facilitar y potenciar la dedicación a la DP dentro de los equipos nefrológicos y estimular la formación y reciclaje en DP del personal médico y de enfermería. Aun cuando una dedicación plena favorece el crecimiento y buenos resultados de las unidades de DP, no parece razonable personalizar o dejar en exclusiva la atención de estos pacientes en un solo facultativo y/o personal de enfermería. Un sistema de segunda persona «rotatoria» colaborando con el «personal titular» garantizaría la continuidad en la atención de los pacientes, y el reciclaje y formación del personal.
- Demandar una adecuada dotación de recursos humanos y materiales dedicados a la DP. De la misma forma que está establecida la ratio pacientes/enfermera en HD, dicha ratio debe considerarse y revisarse en DP. La complejidad creciente de los pacientes que inician diálisis y la mayor dedicación personal que las personas de DP exigen (durante la enseñanza de la técnica, para la resolución de dudas y problemas, para la vigilancia y control del catéter, los reciclajes, la realización de pruebas y técnicas añadidas, etc.) hace recomendable reducir el número de pacientes inicialmente estimado77. Quizás una ratio de 25 pacientes por enfermera sería un valor más realista y eficaz. E incluso esta ratio debería reducirse en el caso de que la misma enfermería compagine la asistencia de DP con la HD. En los casos en los que la atención de enfermería ordinaria para la DP solo se ofrezca de forma específica y exclusiva en turno de mañana, debería buscarse una compensación por la pérdida de los beneficios (económicos o de jornada laboral) que conlleva el sistema de trabajo a turnos, para que este puesto sea atractivo y, por tanto, no rechazado.
- Dejar de potenciar la creación de unidades de HD y acomodarlas al crecimiento real de pacientes en TRS.
- Crear vías rápidas para la cirugía o técnicas intervencionistas relacionadas con la DP. De la misma manera que los problemas de la fístula o el catéter vascular se consideran urgentes y suelen tener ya sus vías de atención rápida, los problemas del catéter peritoneal o de la cavidad abdominal deben considerarse también como prioritarios y articularse su resolución lo antes posible para evitar o retrasar en lo posible el paso por HD temporal.
- Potenciar aspectos como la telemedicina: una buena parte de los problemas o dudas de los pacientes pueden resolverse vía telefónica por el personal tanto facultativo como de enfermería. Estas consultas deberán ser consideradas y computadas como labor asistencial, al igual que la consulta presencial, facilitando esta vía incluso en turnos de tardes, noches o festivos, por ejemplo, mediante localización del personal. Aprovechar los avances informáticos que permiten la transmisión de datos o incluso la visualización a distancia facilitaría el control de los pacientes, ahorrándoles visitas al centro hospitalario.
2. Para que los pacientes la demanden
- Informar a todos los pacientes sobre las modalidades de TRS, independientemente de la forma de inicio de diálisis. Dicha información debe ser detallada, planificada en varias sesiones para su mejor asimilación, preferiblemente ofertada por distintas fuentes (personales o por medios visuales o audiovisuales) y comprensible para el paciente. Al final, esta información deberá ser refrendada por el paciente mediante consentimiento informado.
- Crear, fomentar y potenciar las consultas ERCA para conseguir que más personas inicien diálisis de manera informada y programada. Los criterios y requisitos de dichas unidades están ya definidos y los pacientes deben ser remitidos con tiempo para que estas unidades no sean únicamente la antesala del ingreso en diálisis.
- Promover y difundir el conocimiento de la DP. En nuestro país, la creación y las actuaciones del GADDPE son un ejemplo de la eficacia de este punto.
3. Para que la Administración la potencie
- Promover y fomentar la prevención y cuidados de la IRC colaborando con Atención Primaria y otras especialidades para desarrollar la nefrología preventiva. La programación de sesiones docentes o protocolos conjuntos y facilitar el contacto o consulta con el Servicio de Nefrología (consulta telemática, vías rápidas de derivación, etc.) reduciría el número de pacientes con ERCA no detectada.
- Seguir insistiendo en la creación y potenciación de las consultas ERCA.
- Plantear una financiación específica de los programas de diálisis que englobe todas las partidas, tanto de material como de medicación, ingresos hospitalarios, transporte, personal, etc. Esto puede ser positivo para la gestión del centro sanitario y estimulante para el apoyo y desarrollo de la DP.
- Involucrar a los profesionales en la promoción de la DP, por ejemplo, con un sistema de incentivación por objetivos similar al que se aplica en los programas de trasplante.
Todas las barreras que impiden el desarrollo de la DP son como capas de cebolla: cuando se quita una, aparece otra serie de dificultades. Romper cada una de ellas requiere entusiasmo, dedicación e innovación aplicando nuevas fórmulas que deberán ser actualizadas a medida que aumenta la edad y morbilidad de la población.
Conflictos de interés
La autora declara que no tiene conflictos de interés potenciales relacionados con los contenidos de este artículo.
CONCEPTOS CLAVE
Figura 1. Evolución del gasto sanitario
Figura 2. El círculo vicioso que mantiene la escasa utilización de la diálisis peritoneal
Figura 3. El iceberg de la enfermedad renal
Figura 4. Nefrología y medicina preventiva