Una de las funciones primordiales de la diálisis en el tratamiento de la enfermedad renal crónica (ERC) en estadio cinco es la eliminación de las toxinas urémicas (TU). El modelo a seguir es el riñón, capaz de depurar todo tipo de TU de forma continua sin desechar albúmina. Los elementos de esta función renal son el filtrado glomerular, las funciones tubulares y su eliminación urinaria al exterior. La diálisis está lejos de emular esas funciones, aunque su capacidad de depuración ha ido mejorando con los años.
El conocimiento de las TU ha avanzado en las últimas décadas1,2. Se han tipificado molecularmente, se ha medido qué concentraciones alcanzan en la ERC y se ha descrito su toxicidad individual1–3. La retención de las TU se relaciona con el riesgo cardiovascular3–5, principal causa de mortalidad de los pacientes en diálisis. Las TU se clasifican habitualmente por su peso molecular (PM) y su unión o no a las proteínas, fundamentalmente a la albúmina (tabla 1)1,2. Recientemente, algunos autores proponen la división de las TU medianas, en dos grupos: moléculas de PM medio y alto6, situando el límite de estos en 15.000 Da, según diferentes autores. Esta clasificación cobra especial interés, ya que, estas TU de alto PM se han relacionado con algunas de las principales comorbilidades derivadas de la ERC y la diálisis3, en concreto, con la inflamación y la enfermedad cardiovascular. Las nuevas técnicas y membranas de hemodiálisis (HD) permiten eliminar un mayor número de moléculas de mediano tamaño que la HD convencional.
Clasificación de las toxinas urémicas y depuración por las distintas técnicas
| Moléculas pequeñas hidrosolubles | Moléculas medias | Moléculas unidas a proteínas | ||
|---|---|---|---|---|
| Moléculas medias | Moléculas grandes | |||
| PM Daltons | < 500 | 500-15.000 | 15.000-60.000 | |
| UreaCreatininaFósforoOxalatoPurinas/ác. úricoGuanidina (ADMA) | Péptido natriurético atrialEndotelinaPTHβ2 microglobulinaCistatina C | LeptinaMioglobinaCadenas ligeras κInterleuquina 6HepcidinaCadenas ligeras λTNFα | P-cresol sulfatoA. indolacéticoIndoxilsulfatoPentosidinaNeuropéptido | |
| TDE/Mecanismo de depuración | HD-LF, HD-HF/difusiónHDF-OL, HDx/difusión y convección | HD-HF/difusiónHDF-OL, HDx/difusión y convección | HDF-OL, HDx/difusión y convección | Adsorción, HFR/Difusión, convección y adsorción |
HDF-OL: hemodiafiltración en línea; HD-HF: hemodiálisis de alto flujo; HD-LF: hemodiálisis de bajo flujo; HDx: hemodiálisis extendida; HFR: hemofiltración con reinfusión del ultrafiltrado; PM: peso molecular; TDE: técnica depuración extrarrenal.
Al inicio de la diálisis, los dializadores-membranas disponibles solo permitían eliminar las TU de bajo PM. Los dializadores de bajo flujo o low flux (LF) solo depuran de forma significativa las TU de bajo PM y tienen un coeficiente de permeabilidad hidráulica (Kf) menor de 20 mL/h/mmHg. Posteriormente, aparecieron los dializadores de alto flujo o high flux (HF) con un Kf mayor de 20 mL/h/mmHg, capaces de eliminar las denominadas moléculas medias, con un PM de hasta 20.000 Da, incluyendo la β2-microglobulina (β2-mG) y la leptina. Así, en función de la permeabilidad del dializador, se distinguen dos tipos de HD, de alto (HD-HF) y bajo flujo (HD-LF). Actualmente, contamos con numerosos dializadores con Kf mayor de 50 mL/h/mmHg, denominados de muy alta permeabilidad hidráulica. El estudio Membrane Permeability Outcome (MPO) es el mayor exponente de los mejores resultados en la clínica de la HD-HF respecto a la HD-LF7,8. Las técnicas con alto transporte convectivo y especialmente la hemodiafiltración en línea (HDF-OL) con dializadores HF, fueron el siguiente paso, logrando depurar algunas de las TU de gran PM, evitando eliminar cantidades importantes de albúmina. El estudio Online Hemodiafiltration Study (ESHOL) y otros ensayos randomizados han demostrado la superioridad en cuanto a la supervivencia de los pacientes de la HDF-OL respecto a la HD-HF y la HD-LF9,10. Podríamos concluir que eliminar las TU de PM más grande y en una cantidad mayor se relaciona con un mejor pronóstico de los pacientes en diálisis, independientemente de otros cofactores de morbimortalidad.
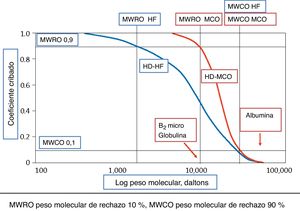
En los últimos cinco años, se ha desarrollado un nuevo tipo de membranas, con un punto de corte o cut-off (CO) mayor, llamadas de punto de corte medio (MCO), con capacidad para eliminar moléculas de alto PM, al igual que lo hacen las membranas de alto CO (HCO), utilizadas en el mieloma, pero capaces de retener la albúmina11,12. Estas nuevas membranas, tienen un punto de retención o «retention onset» alto, este concepto viene determinado por el PM a partir del cual se va a retener más del 10% de los solutos, es decir, el PM para el cual el coeficiente de cribado (Cc) será de 0,9. El tamaño de los poros de la membrana MCO es intermedio entre los de las membranas HF y las HCO (fig. 1). Además, y como explicaremos a continuación, estas membranas tienen un diseño de los dializadores que potencia el trasporte convectivo interno13. Por todo ello, con estos dispositivos se puede obtener una depuración de moléculas medias y grandes superior a la de los dializadores de HF, (tabla 2). La HD realizada con los dializadores MCO se ha denominado HD «extendida» (HDx) porque es capaz de aumentar el rango de PM de las TU eliminadas.
Eliminación de toxinas urémicas medida mediante RR y aclaramientos en la HDx en comparación con HD-HF y la HDF-OL
| Cita n.°/ 1er autor | Compara | Características | Diseño/ metodología | n.° pacientes | Duración | Resultado |
|---|---|---|---|---|---|---|
| 23/ Belmouaz M. et al. | HDF-OL Pol210HTher500 | Qb 300 mL/min | Pacientes en HDF-OL pasan a Ther | 10 | 1 año en Ther | RR de mol medias semejanteAlbúmina y prealbúmina séricas sin cambios |
| 24/ Boschetti-de-Fierro A. et al. | HD-HF: Elisio17H™, FX CorDiax80 y 100™Ther400 y 500 | Qb 300 mL/minQd 700 mL/min | Aclaramiento: β2MG, mioglobina, CL κ y λ, IL-6 | Plasma in vitro | Aclaramiento superior de Ther en moléculas medias y grandes | |
| 24/ Boschetti-de-Fierro A. et al. | HD-HF: Elisio21H y 25H™, FX CorDiax 120 y 1000™Ther500 | Qb 400 mL/minQd 700 mL/min | Aclaramiento: β2MG, mioglobina, CL κ y λ, IL-6 | Plasma in vitro | Aclaramiento Ther500 superior a partir de mioglobina | |
| 24/ Boschetti-de-Fierro A. et al. | HDF (UF): Elisio17H™, FX CorDiax800™Ther500 sin Quf | Qb 300 mL/minQd 700 mL/minQuf 100 mL/min | Aclaramiento: β2MG, mioglobina, CL κ y λ, IL-6 | Plasma in vitro | Aclaramientos semejantes | |
| 24/ Boschetti-de-Fierro A. et al. | HDF (UF): Elisio21H y 25H™, FX CorDiax800™Ther500 sin Quf | Qb 300 mL/minQd 700 mL/minQuf 100 mL/min | Aclaramiento: β2MG, mioglobina, CL κ y λ, IL-6 | Plasma in vitro | Aclaramiento superior en HDF para β2MG y en Ther500 para IL-6. | |
| 25,26/ Kirsh. et al. | HD FX CorDiax 80™HD Ther400 | Qb 300 mL/minQd 500 mL/min | RR & Cl: MM: β2MG, Factor D, mioglobina, CL κ y λ, α1-mG, YKL-40 y MBPM. | 39 | Cuatro sesiones de HD de 4 h | RR & Cl superior con Ther en todas las moléculas medidas, mayor en las de mayor PM.Cl de P y urea superior en Ther |
| 25, 26/ Kirsch et al. | HD Ther400HD HF FX CorDiax 80™HDF-OL FX CorDiax 800™ | Qb 400 mL/minQd 700/600 mL/minQuf total 21,4 L | RR & Cl: β2MG, Factor D, mioglobina, CL κ y λ, α1-mG, YKL-40 | 39 | Sesiones 4-5 h | Cl y RR con Ther superior en CL que HDF-OL y HD-HF |
| 27/ Latosinska A. et al. | HD-HF Revaclear400™HD Ther400 | LD 30 L x 16 ensayos en CETs; LC-MS/MS; Moléculas disueltas | 8 | LD recogido durante la 1ª hora de la sesión de HD | Mayor concentración de proteínas, albúmina, B2MG, LPS, moléculas proapotóticas y proinflamatorias en LD con Ther. El LD con Ther produce peor viabilidad y cambios morfológicos en CTs | |
| 28/ Cordeiro I.S.F. et al. | HD-HF polisulfonaHF Diacap™ 2m2HDF-OL polisulfona HF Diacap™ 2Ther400 | Qb 350 mL/minQd 800 mL/minQinf 90-100 mL/min | Prospectivo-cruzadoRR, Cl y extracción total: urea, P, B2MG, albúmina | 16 | 4+ 4 + 4 semanas | Cl mayor de B2MG en HDF-OL y Ther; extracción total semejante con las tres técnicas. |
| 29/ García-Prieto A.M. et al. | HD-HF FX CorDiax 80™HDF-OL FX CorDiax1000™Ther500 | Qb 450 mL/minHDF-OL: Quf total 28 L | RR: urea, Cr, P, β2MG, mioglobina, prolactina, cistatina, α1-glicoproteinaAlbúmina en LD | 18 | 1 sesión con cada técnica | No diferencias en urea, Cr ni P. Ther y HDF-OL superior a HD-HF en todas las moléculas, sin diferencias entre ellas. Albúmina 0,03 g/sesión con Ther y 3,1 g en HDF-OL |
| 30/ Maduell F. et al. | HD-HF FX CorDiax 80™HDF-OL FX CorDiax 80™HD-HF: PMMAHD-HF: PolyphenyleneTher400 | Qb 434 mL/minQd 400 mL/minHDF-OL Quf 31 L | RR: urea, Cr, β2MG, mioglobina, prolactina, α1-MG, α1-GP yalbúmina.Albúmina en LD | 21 | Una sesión con cada técnica | RR de urea y Cr mayor con HDF-OL y Ther que con los otros HD-HF; HDF-OL superior a las HD-HF y Ther. En general, Ther intermedia entre HDF-OL y HD-HF. Pérdida de albúmina entre 0,54 g HD-HF FX CorDiax 80™ y 3,3 g Polyphenylene |
| 31/ Cho L-F. et al. | HD-HF FX CorDiax 80™Ther400 | Qb 289 -294 mL/min | RR: urea, β2MG, Vit.B12, CL κ y λ y Hb libre | 1938 | Una sesión con cada técnica | Mayor RR con Ther400 que con HD-HF en todas las moléculas medidas |
| 32/ Kim T.H. et al. | HD-HF Rexeed-21A™HDF-OLpre Rexeed-21A™Ther 400 | 250 mL/min | RR: urea, Cr, P, Ac. úrico, β2MG, mioglobina, CL κ y λ, FGF-23. Cl: CL λ | 6 | Una sesión con cada técnica | RR semejante en las 3 técnicas para moléculas pequeñas; RR superior en HDF-OLpre para B2-mG y en Ther para mioglobina y CL λ. |
| 33/ Lim J-H et al. | HD-HF FX CorDiax 80-60™Ther400 | Qb 235 mL/minQb 245 mL/minQd 500 mL/min | Prospectivo randomizado. RR: β2MG, CL κ y λ, | 49 | 12 semanas | RR mayor con Ther CL κ y λ, sin diferencias en B2MG |
| 34/ Willy K et al. | HD-HF: Revaclear™HCO1100MCO400 | Modelo de diálisis in vitro del plasma | IL-6 en plasma y LD; Cultivo VSMC, MGP y OPN | Plasma enriquecido con LPS in vitro x 2 | IL-6 disminuye en plasma y aumenta en LD con MCO y HCO; la inducción de la calcificación vascular se reduce con plasma dializado con MCO y HCO |
α1-GP: α1-glicoproteina ácida; CETs: células epiteliales tubulares; Cl: aclaramiento; CL: cadenas ligeras κ o λ libres; Cr: creatinina; Hb: hemoglobina; HCO: dializador de alto punto de corte; HD: hemodiálisis; HDF: hemodiafiltración; HDF-OL: HDF en línea postdilucional; HDF-OLpre: HDF en línea predilucional; LC-MS/MS: cromatografía líquida/espectrometría en masa; LD: líquido de diálisis; LPS: lipopolisacaridos; MBPM: moléculas de bajo peso molecular; MCO: dializador de punto de corte medio; MGP: Gla proteína; MM: moléculas de PM medio y alto; OPN: osteopontina; P: fosfatos; Pol 210H: Polyflux 210 H™; Qb: flujo sanguíneo; Qd: Flujo líquido de diálisis; Quf: Flujo ultrafiltración; Ther: theranova™; RR: porcentaje de reducción; VSMC: Vascular Smooth Muscle Cells.
La discrepancia en cuanto a la eliminación de toxinas urémicas se explica por la diferente metodología de los estudios.
El objetivo de esta revisión es describir las características de los dializadores con membrana de MCO, sus prestaciones en cuanto a la eliminación de TU, resultados clínicos preliminares y posicionar a la HDx entre las técnicas de HD en la actualidad.
Desarrollo técnico de los dializadores y la diálisisLa evolución de los dializadores ha sido una pieza clave en el desarrollo de la HD. En esa evolución han destacado una serie de marcadores de su eficacia en la eliminación de TU. Clásicamente, para valorar la eliminación de las TU de bajo PM se utiliza el Kt/V o mejor el Kt corregido por la superficie corporal (Ktsc)14. El paso de la HD-LF a la HD-HF vino marcado por la valoración del Kf de los dializadores, mayor de 20 mL/h/mmHg en los de HF.
El transporte convectivo se valora por el volumen total ultrafiltrado (VTU) y el coeficiente Cc para las distintas moléculas15, siendo el Cc de la β2-mG el más utilizado. En este sentido, el grupo EUDIAL16 marcaba entre los requisitos para definir una HDF-OL eficaz, emplear un dializador con un Cc para la β2-mG mayor de 0,6 y un VTU por sesión mayor de 23 L. La importancia de la cantidad de volumen convectivo administrado se debe a que este se ha relacionado de forma directa con la depuración de moléculas medias17, y como se ha comentado previamente, con la mortalidad de los pacientes en HD.
Para tipificar los dializadores con membranas MCO, se ha recurrido a dos marcadores11, el punto de retención o «retention onset» (MWRO) y el punto de corte (MWCO): el primero viene determinado por el PM de la molécula cuyo Cc es de 0,9 o expresado de otra forma, el PM de las moléculas que empiezan a retenerse en un 10%, y el segundo, el PM que corresponde a un Cc del 0,1, cercano al CO de la membrana evaluada (fig. 2). Se ha recurrido a estos dos marcadores en la curva del Cc para una membrana/dializador, porque determinar el PM con el que empieza a retenerse una molécula y el PM del CO es muy difícil. Los dializadores MCO tendrían un Cc para la β2-mG cercano a 1 y de 0,9 para la mioglobulina.
Los Cc en los dializadores dependen de las condiciones en las que se han medido. El tipo de plasma, el flujo sanguíneo (Qb), flujo de ultrafiltración (Quf) y el tiempo de obtención de la muestra son algunos de los factores que condicionan el resultado15. La comparación de dializadores, utilizándo sus Cc solo es fiable si las condiciones de medida son semejantes. En la ficha técnica de los dispositivos, debe especificarse en qué condiciones se ha medido el Cc.
La membrana MCO se ha empleado en los dializadores Theranova® (Ther), disponibles en España desde hace tres años. El diseño de estos favorece la filtración/retrofiltración interna, como forma de depuración por transporte convectivo18, lo que se ha denominado hemodiafiltración interna (HDFi)19. Una de las formas de aumentar la HDFi es disminuir el diámetro interno de los capilares, hasta 180 μ de diámetro en estos dializadores, para aumentar las resistencias internas y lograr una mayor filtración/retrofiltración. El radio interno del capilar figura a la cuarta potencia en la ecuación de Hagen-Poiseuille que calcula la resistencia de la sangre al paso por los capilares. Un dializador largo, estrecho y con un diámetro de los capilares de 180 μ va a provocar una caída de presión dentro del capilar muy grande, de alrededor de 170 mmHg para 400 mL/min de Qb. Otra forma de aumentar la filtración interna es incrementar la resistencia hidráulica en el compartimento del líquido de diálisis (LD), aumentando la densidad de los capilares dentro del dializador, entre un 55 y 60%20, creando una caída de presión de 30 mmHg para 500 mL/min de flujo del LD (Qd). En la filtración interna, influyen de forma directa el Qb y Qd.
Aunque, en los nuevos dializadores MCO se ha potenciado el transporte convectivo interno, estudios recientes sugieren que el transporte difusivo es el mecanismo principal de eliminación de moléculas medias en la HDx21. Siempre hay que recordar la interferencia de estos dos tipos de trasporte en una misma membrana.
Un requisito en el desarrollo de los dializadores con membranas MCO fue que no perdieran una cantidad significativa de albúmina. La alta permeabilidad debe ser compatible con una mínima eliminación de esta proteína, con un Cc menor de 0,01. La pérdida de albúmina es dependiente del tamaño de los poros, de su interacción con el plasma y de la presión transmembrana (PTM). En la HDF-OL la presión prefiltro puede llegar a 700 mmHg, siendo el principal determinante de la pérdida de albúmina. Los dializadores con membranas MCO no se deben utilizar a esas presiones, por lo que su uso está contraindicado en HDF-OL y en la ultrafiltración aislada. Con la técnica de HDF, las membranas MCO pueden producir importantes pérdidas de albúmina. En cualquier técnica de hemodiálisis la pérdida de esta debería ser menor de 4 g por sesión6.
Para valorar la eficacia de los dializadores MCO, debemos seguir utilizando el Kt/V o Ktsc. En la clínica no podemos medir la HDFi, aunque se ha estimado que para un dializador MCO, Ther400, con un Qb de 400 mL/min sería de 41,6 mL/min y de 53,1 mL/min con el Ther5006,22, lo que supondría en una sesión de HD de cuatro horas de duración con una filtración interna de 9.984 mL y 12.744 mL, respectivamente, a lo que habría que sumar la ultrafiltración programada. Teniendo en cuenta que el Cc de este dializador para la β2-mG es > 0,9, se puede calcular un aclaramiento de β2-mG semejante al de la HDF-OL. El Qb, por tanto, también sería un determinante importante de la eficacia depurativa con estos dializadores. La concentración preHD de β2-mG podría ser útil, debiendo mantenerse entre 20 y 30 mg/L, salvo en las situaciones de hiperproducción de β2-mG. Con los dializadores MCO, el Kf ya no tiene la importancia que en los de HF; la relación Kf y Cc no es buena.
La utilización de la HD-HF y de la HDF-OL ha necesitado de otros avances en la diálisis. Entre ellos, destacan las máquinas con un control de ultrafiltración (UF) preciso, los LD con bicarbonato y de calidad ultrapura. La HDx también requiere un monitor de diálisis con estos avances, aunque, al contrario de la HDF-OL, no necesita un sistema de infusión del LD ligado al control de UF. La HDx se puede realizar con cualquier máquina de HD moderna con filtros de endotoxinas.
Depuración de toxinas urémicas y evidencias clínicas de la HDxLos dos dializadores disponibles en España con membrana MCO, compuesta por poliariletersulfona y polivinilpirrolidona, libre de bisfenol A (BPA), son el Ther400 y el Ther500. Los dos tienen un diámetro interno de los capilares de 180 μm y 35 μm de grosor de la pared del capilar. El Ther400 tiene una superficie de 1,7 m2 y un Kf, de 48 mL/h/mmHg y el Ther500 2,0 m2 y un Kf de 59 mL/h/mmHg (in vitro con sangre bovina, Hto. 32%, Pt 6 g/dL y 37°C). El Cc es de 1 para la β2-mG, 0,9 para la mioglobina y 0,008 para la albúmina (medido con plasma humano y Qb 300 mL/min y UF 60 mL/min).
La depuración de TU con estos dializadores se ha comparado con la de los dializadores-HF y con la HDF-OL (tabla 2)23–34. La HD-HF tiene unos resultados semejantes o discretamente inferiores respecto a la eliminación de moléculas de bajo PM en contraste con la HDF-OL y la HDx, medida por la proporción del descenso de la concentración de las moléculas pre y postHD (RR) o mediante su aclaramiento. Respecto a las moléculas medias la HDF-OL postdilucional y la HDx son superiores a la HD-HF y si la HDF-OL se realiza con transporte convectivo elevado, la HDF-OL es superior a la HDx. Respecto a las moléculas grandes, según aumenta el PM la HDx llega a superar a la HDF-OL, como por ejemplo con las cadenas ligeras λ.
Se han valorado qué características de la diálisis hacen superior a la HDF-OL respecto a la HDx34. Con un Qb de 350 mL/min, la HDF-OL supera a la HDx en cuanto al porcentaje de reducción (RR) de las moléculas, evaluadas mediante un «Global Removal Score» (GRS), a partir de 80,6 mL/min de Quf, con un Qb de 400 mL/min sería a partir de 74,1 mL/min. El principal problema de esta comparación está en la composición del GRS, que incluye, entre otras moléculas, a la urea. Si se analiza el RR de moléculas grandes, como las cadenas ligeras λ e interleucina-6 (IL-6), la HDx sería superior a la HDF-OL24–26. La influencia de las distintas TU grandes en la morbimortalidad se está por ponderar.
Con los dializadores MCO la pérdida de albúmina en el LD suele ser mayor que en la HD-HF y en la HDF-OL, en todo caso menor de 3,5 g/sesión, entre 0,03 y 3,15 g/sesión25,29,30,32,35,36. La pérdida de albúmina es dependiente del tipo de membrana y de las presiones transmembrana utilizadas, pudiendo superar en HDF-OL los 10 g/4 h con algunos dializadores37. En los pacientes en HDx, la albúmina sérica se mantiene después de una caída inicial24,38. A las 12 semanas y a los 12 meses con membranas MCO no se han detectado cambios significativos en la albuminemia31,33. En el trabajo de Bunch et al.39 realizado en 638 pacientes, después de un año, encontraron una disminución de un 3,5%.
Una pregunta que surge con las membranas MCO es si al mismo tiempo que depuran más TU de PM medio y alto que la HD-HF, eliminan más factores de la coagulación, nutrientes, fármacos y otras moléculas beneficiosas para el organismo. Un estudio in vitro sugiere que el cambio de HD-HF a Ther500 no requiere variaciones en la anticoagulación ni en el ajuste de algún fármaco como la vancomicina40. Los cambios de las concentraciones de insulina y eritropoyetina serían semejantes con Ther500, HD-HF con Polyflux210H™ y HDF con Fx CorDiax 800™40.
Aunque se ha referido la capacidad de los dializadores MCO en la retención de endotoxinas y otras sustancias pirogénicas41,42, dada la importante retrofiltración de estos dializadores, es razonable utilizar LD ultrapuro.
Resultados clínicos con la HDxHay pocas evidencias clínicas a medio y largo plazo con HDx (tabla 3)23,28,31,33,38,43–45. El estudio que incluye más pacientes es el Registro COREXH colombiano39, ahí reclutan a 992 pacientes dializados con HDx y 638 completan un año de seguimiento (tabla 3). Tienen una mortalidad de 8,54 por 100 pacientes-año, baja en comparación con otros estudios similares con otras técnicas de HD46,47. La tasa de ingresos sería de 0,79/paciente-año y 6,91 días/paciente-año39. No se describen efectos adversos con la HDx25,39,43, ni reacciones de hipersensibilidad a las membranas sintéticas/polisulfonas48. No obstante, por tratarse de una membrana sintética, es posible que se produzcan estas reacciones de hipersensibilidad.
Aspectos clínicos con HDx
| Cita n.°/ 1er autor | compara | Características | Diseño | n.° pacientes | Duración | Resultado |
|---|---|---|---|---|---|---|
| 23/ Belmouaz M. et al. | HDF-OL Pol210HTher500 | Qb 300 mL/min | Pacientes en HDF-OL pasan a Ther | 10 | 1 año en Ther | RR de mol medias semejanteAlbúmina y prealb sin cambios |
| 43/ Cozzolino et al. | HD-HF: (Fx80, Fx100)Ther400 | Prospectivo y cruzado | 20 | 3 + 3 meses | Menor n.° de infecciones, IL-1β y IL-6 en Ther 400, con mayor caída de albúmina | |
| 38/ Zickler D. et al. | HD-HF: Revaclear400≈ Ther400 | Prospectivo randomizado | 48 terminan(23 + 24) | 4 + 8 semanas | Ther400 modula la inflamación mejor que HD-HF: TNFα y IL6mRNA-RQ en PBMCs. < CQ proinflamatorias | |
| 44/ Belmouaz M. et al. | HD-HF: Elisio 21H™Ther | Qb 317 mL/minQd 500 mL/min | Prospectivo, randomizado, cruzado | 40 | 3 + 3 meses | Menores concentraciones preHD de β2-mG, LDL oxidada, κ y λ CL y albúmina con Ther |
| 28/ Cordeiro I.S.F. et al. | HD-HFHDF-OLTher | RR, Cl y extracción total: urea, P, B2MG, albúmina | 16 | 4 + 4 + 4 semanas | Concentraciones séricas preHD de urea, P, β2-mG y albúmina semejantes con las tres técnicas | |
| 31/ Cho L-F. et al. | HD-HF FX CorDiax 80™Ther400 | Qb 289 -294 mL/min | Concentración preHD: urea, β2MG, Vit.B12, CL κ y λ, albúmina y Hb libre | 1938 | 12 meses | Disminuye significativamente en el grupo Ther el Na, K y ferritina. No cambios en el resto de moléculas. No control de FRR. |
| 53/ Florens N. et al. | Ther | Experiencia observacional | 5.191 sesiones | 4 meses | Cebado automático + manualNo efectos adversos. Mejoría clínica especifica. | |
| 33/ Lim J-H. et al. | HD-HF FX CorDiax 80-60™Ther400 | Qb 235 mL/minQb 245 mL/minQd 500 mL/min | Prospectivo randomizado: QoL short form 36.Cuestionario prurito | 49 | 12 semanas | Mejor QoL con Ther, principalmente en componentes físicos. Menor prurito y trastornos del sueño con Ther |
| 39/ Bunch A. et al. | Ther | Qb 350 mL/minQd 500 mL/min | Prospectivo morbi-mortalidad. Evolución parámetros clínicos y bioquímicos | 992 incluidos, 638 concluyen el seguimiento | 1 año | Mortalidad: 8,54 p/100 p-añoIngresos: 0,79 eventos/p-año; 6,91 días/p-año. La albúmina sérica disminuye 3,5%. No E.A. |
β2-microglobulina: β2-mG; CL: cadenas ligeras libres; CQ: citoquinas; E.A.: efectos adversos; FRR: función renal residual; Hb: hemoglobina; HDx: hemodiálisis extendida; IL6mRNA-RQ: IL-1β; IL-6: interleucina; 6LDL oxidada: lipoproteína de baja densidad oxidada; P: pacientes; PBMCs: células mononucleares en sangre periférica; Pol 210H: Polyflux 210 H™; Qb: flujo sanguíneo; Qd: flujo líquido de diálisis; QoL: calidad de vida cuestionario corto 36 ítems; Quf: flujo ultrafiltración; RR: porcentaje de reducción; Ther: Theranova; TNF-α: Tumor-necrosis factor alpha; β2-mG: β-2-microglobulin; IL-6: interleukin-6; mRNA: RNA mensajero; PBMC: peripheral blood mononuclear cells.
La calidad de vida percibida ha sido valorada en un estudio prospectivo33 en el que se randomizaron 49 pacientes, 24 fueron dializados con Ther400 y 25 con HD-HF con el dializador FX CorDiax 80-60™. Basalmente y a las 12 semanas, se realizó el test Kidney Disease Quality of Life Short Form-36 (KQDOL-36) con 36 ítems. Los pacientes con Ther400 expresaron una mejor calidad de vida, principalmente en los componentes/dominios físicos, así como menos prurito y trastornos del sueño.
Cho et al.31 no encontraron diferencias significativas en la concentración preHD de las TU entre los pacientes dializados con Ther400 y aquellos con FX CorDiax 80 al cabo de 12 meses. Llama la atención las bajas concentraciones séricas de β2-mG, 25,6 mg/L, que suben a 28,4 mg/L al año; estas concentraciones son habituales en HDF-OL o cuando hay una función renal residual (FRR) significativa. El trabajo no aporta este último dato, que podría enmascarar el efecto del Ther400 a través de su disminución con el tiempo.
Con la HDx se ha referido una mejoría en los parámetros proinflamatorios38. Uno de los factores que explican la pérdida de la FRR en la diálisis es la inflamación49. Algunas TU de PM alto serian lesivas para los túbulos renales y para la FRR2,3,27, su mayor depuración por los dializadores MCO27 podría preservar mejor la FRR, lo que habrá que investigar.
La inducción de la calcificación vascular se reduce con plasma dializado con MCO y HCO34, por lo que habrá que estudiar un posible papel beneficioso de la HDx para evitar las calcificaciones vasculares.
Al cierre de esta revisión, existen 16 estudios sobre la HDx en curso, registrados en el ClinicalTrials50. Seis de estos están completos y ocho en reclutamiento. En seis se compara la HDx con la HD-HF, en cuatro con la HDF y en uno con las dos técnicas. Algunos se centran en aspectos concretos como: la anticoagulación, la preservación de la FRR, las calcificaciones y el metabolismo mineral o los síntomas. Entre ellos, está el estudio MoTHER, multicéntrico español, abierto, prospectivo, aleatorizado para explorar la morbimortalidad en pacientes dializados con HDx en comparación con la HDF-OL.
Características clave de la HDx¿Qué diferencia la HDx de las otras formas de HD? Su capacidad de eliminar grandes moléculas, TU de alto PM (tabla 1). Se puede definir a la HDx como una HD con alto Cc, afinando más, con un MWRO en el rango de las TU de alto PM. Por ello, para conceptualizarla y diferenciarla de la HD convencional-HF, se debería utilizar el Cc de la mioglobina, ≥ 0,9. La HDx es, por tanto, una HD de alto cribado. La mioglobina es una molécula de 17.000 Da, fácil de medir y que pertenece al rango bajo de las moléculas de alto PM.
Dónde posicionar la HDx como técnica de diálisisExisten pocas evidencias clínicas para determinar qué tipo de pacientes se pueden beneficiar más de la HDx. Basándonos en la experiencia previa con otras técnicas de alto nivel de depuración de TU, como la HDF-OL, podríamos proponer algunos aspectos a comprobar en futuros estudios. 1. Pacientes sin una FRR significativa; 2. Pacientes con perspectivas de mantenerse años en hemodiálisis, por ejemplo, no candidatos a trasplante renal; 3. Pacientes con una ingesta suficiente de nutrientes; 4. Pacientes con mucha comorbilidad; 5. Como alternativa a la HDF-OL en casos en los que no pueda garantizarse un alto transporte convectivo (Hb elevada, Qb subóptimos)51. Los casos con mayor comorbilidad que se podrían beneficiar de la HDx serían los que guardan una clara relación con la retención de TU de alto PM: inflamación crónica; resistencia a AEE; síndrome de piernas inquietas, inmunodeficiencia secundaria y enfermedad cardiovascular52.
Respecto a la competencia con la HDF-OL, la HDx sería útil en pacientes en los que no es posible alcanzar un adecuado volumen convectivo por sesión (23 L) o cuando se suspende la HDF-OL por razones de seguridad.
Se han referido buenos resultados en personas con ciertas patologías43,53: prurito33, astenia postHD, anorexia, síndrome de piernas inquietas, mieloma por cadenas ligeras54, rabdomiólisis, inflamación severa. Algunas de estas indicaciones coinciden con nuestra propia experiencia.
La superioridad de la HDx sobre la HD-HF a la hora de eliminar TU de alto PM, su fácil implementación y su seguridad sugieren crear un nuevo apartado en la clasificación de las técnicas de HD. La HDx no es una HD «convencional» en el sentido de estar dentro de los estándares establecidos. Con los datos existentes, la HDx debe estar en una nueva categoría de HD. Hacen falta estudios clínicos de morbimortalidad para demostrar la no inferioridad de la HDx sobre la HDF-OL50.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.