La hiperpotasemia (HK) es una alteración electrolítica en la concentración de iones potasio (K+), cuyo riesgo aumenta en pacientes con enfermedad renal crónica (ERC) o insuficiencia cardiaca (IC) y/o en pacientes en tratamiento con inhibidores del sistema renina-angiotensina-aldosterona (iSRAA). Los nuevos quelantes orales de K+ ofrecen un tratamiento seguro y eficaz para mantener la normopotasemia en estos pacientes. El objetivo del análisis es estimar el coste-efectividad del ciclosilicato de sodio y zirconio (CSZ) para el tratamiento de la HK crónica en pacientes con ERC o IC vs. tratamiento estándar (poliestireno sulfonato cálcico y modificaciones del estilo de vida) desde la perspectiva del Sistema Nacional de Salud (SNS) español.
Materiales y métodosSe utilizaron dos modelos de microsimulación que reflejan la historia natural de la ERC y de la IC. En ambos modelos se realizó una simulación de forma individual de los niveles de K+. Con base en la eficacia (reducción de los niveles de K+), la calidad de vida de los pacientes (utilidades según estado de salud, y disutilidades de los eventos derivados de cada patología y los eventos adversos [EA] del tratamiento) y a los costes contemplados (coste del tratamiento para la HK, del tratamiento con iSRAA y su modificación, de los estados de salud, del manejo de los eventos derivados de cada patología, de los episodios de HK, y de los EA del tratamiento) (€, 2022), se obtuvieron resultados de beneficio clínico (años de vida ajustados por calidad [AVAC]) y costes. Se empleó un horizonte temporal de toda la vida del paciente y se aplicó una tasa de descuento del 3% para costes y resultados.
ResultadosEl CSZ resulta una opción más efectiva en ambas patologías, con una diferencia de AVAC de 0,476 en ERC, y de 0,978 en IC vs. tratamiento estándar, y supone un coste incremental de 3.616 € y 14.749 €, respectivamente, obteniéndose un ratio coste-utilidad incremental (RCUI) de 7.605 €/AVAC en ERC y 15.078 €/AVAC en IC.
ConclusionesEl CSZ es una alternativa con una buena relación coste-efectividad para el tratamiento de la HK en pacientes con ERC o IC, teniendo en cuenta los valores de eficiencia de referencia empleados habitualmente en España.
Hyperkalemia (HK) is an electrolyte disturbance in the concentration of potassium ions (K+), whose risk increases in patients with chronic kidney disease (CKD) or heart failure (HF) and/or in patients being treated with renin-angiotensin-aldosterone system inhibitors (RAASi). The new oral K+ chelators offer a safe and effective treatment to maintain normokalemia in these patients. The objective of the analysis is to estimate the cost-effectiveness of sodium zirconium cyclosilicate (SZC) for the treatment of chronic HK in patients with CKD or HF versus standard treatment (calcium polystyrene sulfonate and lifestyle modifications) from the perspective of the Spanish National Health System.
Materials and methodsTwo microsimulation models reflecting the natural history of CKD and HF were used. In both models, K+ levels were simulated individually. Based on efficacy (reduction of K+ levels), quality of life of patients (utilities according to health states, and disutilities of events derived from each pathology and adverse events [AEs] of treatment) and costs considered (cost of treatment for HK, of RAASi treatment and its modification, health states, management of events derived from each pathology, HK episodes, and AEs treatment) (€, 2022), clinical benefit (quality-adjusted life years [QALYs]) and cost results were obtained. A time horizon of the patient's lifetime was used and a discount rate of 3% was applied for costs and outcomes.
ResultsSZC is a more effective option in both pathologies, with a difference in QALYs of 0.476 in CKD and 0.978 in HF compared to standard treatment, and it represents an incremental cost of € 3,616 and € 14,749, respectively, obtaining an incremental cost-utility ratio of € 7,605 /QALY in CKD and € 15,078 /QALY in HF.
ConclusionsSZC is a cost-effective alternative for the treatment of HK in patients with CKD or HF, taking into account the reference efficiency values commonly used in Spain.
La hiperpotasemia (HK) es una alteración electrolítica definida como una concentración de iones potasio (K+) en suero> 5,0 mEq/L o> 5,5 mEq/L1. El riesgo de desarrollar HK aumenta en personas con enfermedad renal crónica (ERC) o insuficiencia cardiaca (IC)2,3, ya que el riñón es el principal órgano regulador de la homeostasis de K+. Asimismo, los inhibidores del sistema renina-angiotensina-aldosterona (iSRAA), fármacos beneficiosos en estas dos patologías, disminuyen la excreción renal de K+3,4. Es por ello que, en ambas patologías, resulta especialmente relevante mantener unos niveles adecuados de K+, manteniendo un tratamiento óptimo con iSRAA4,5. Según las guías Kidney Disease: Improving Global Outcomes (KDIGO), la HK se puede clasificar como leve (5,0-5,9 mEq/L) o moderada-grave (≥ 6,0 mEq/L) en función de la concentración de K+ en suero6. La HK leve suele ser asintomática. Sin embargo, en los casos más graves, la HK se asocia con una elevada morbilidad y mortalidad debido, entre otros, al riesgo de desencadenar arritmias cardiacas graves que pueden llevar a la muerte2,3,7.
El tratamiento de la HK tiene como objetivo la reducción de los niveles séricos de K+8. Hasta la fecha, el manejo se ha basado en recomendaciones dietéticas, la disminución o interrupción de fármacos como los iSRAA o mediante el uso de resinas de intercambio catiónico como el poliestireno sulfonato cálcico o sódico8–10. Sin embargo, el uso de estas resinas se asocia a efectos adversos gastrointestinales ocasionalmente graves y mala tolerabilidad, lo que puede resultar en una baja adherencia al tratamiento9,11.
El desarrollo y aprobación del ciclosilicato de sodio y zirconio (CSZ), un compuesto inorgánico que se une al K+ en el tracto gastrointestinal, supone una alternativa a las terapias clásicas12. Los ensayos clínicos han mostrado que el CSZ es eficaz reduciendo los niveles de K+ hasta niveles normales en 48 horas13,14, incluso en pacientes con ERC o enfermedad cardiovascular que reciben iSRAA, sin necesidad de disminuir la dosis del inhibidor o interrumpir temporalmente este tratamiento14, y sus efectos se mantienen a largo plazo15,16. Además, el CSZ ha mostrado un perfil de seguridad favorable, con eventos adversos (EA) leves o moderados que se pueden controlar y que no conllevan la interrupción del tratamiento16.
En este contexto, el objetivo de este estudio fue realizar un análisis de coste-efectividad del CSZ vs. tratamiento estándar (poliestireno sulfonato cálcico y modificaciones del estilo de vida) para la HK crónica en pacientes que presenten ERC o IC de manera independiente, desde la perspectiva del Sistema Nacional de Salud (SNS) español.
MétodosSe utilizaron dos modelos de simulación a nivel de paciente, que reflejan la historia natural de la evolución de un paciente tipo que padece ERC o IC, respectivamente, en función de los niveles séricos de K+ y el cumplimiento del tratamiento con iSRAA. En ambas patologías se estimaron las consecuencias clínicas (años de vida ganados [AVG] y años de vida ajustados por calidad [AVAC]) y económicas (costes del tratamiento [HK e iSRAA], de los eventos asociados a cada patología y del manejo de EA del tratamiento de la HK) del tratamiento con CSZ en comparación con el tratamiento estándar en España (poliestireno sulfonato cálcico y modificaciones del estilo de vida) desde la perspectiva del SNS. A partir de la información generada, se calcularon los ratios coste-efectividad incremental (RCEI) y ratio coste-utilidad incremental (RCUI) en cada uno de los casos simulados. La estructura de los modelos, así como sus parámetros y asunciones principales, fueron consensuados y validados por los autores de este artículo (dos especialistas en nefrología, dos especialistas en cardiología y un especialista en economía de la salud).
En ambos casos, se empleó un horizonte temporal de toda la vida del paciente y una duración del ciclo de cuatro semanas (periodo tras el cual se evalúan los costes y efectos en salud), a excepción del primer periodo donde se consideraron ciclos más cortos atendiendo al diseño de los ensayos de referencia de CZS13,15,16, con el fin de reflejar los cambios en los niveles de K+ durante el evento de HK (fase aguda). Tal y como recomienda la guía de referencia española, se aplicó una tasa de descuento del 3% para costes y resultados17.
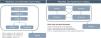
En el caso del modelo de ERC, los pacientes con ERC en estadio 3b con un evento de HK entran en el modelo recibiendo CSZ o tratamiento estándar. Su enfermedad puede progresar a estadios más avanzados en función de un descenso anual del filtrado glomerular estimado (FGe) dependiente de iSRAA (3b-5), tras los cuales recibirán terapia de reemplazo renal (TRR: diálisis o trasplante) (fig. 1).
En el modelo de IC, los pacientes con IC que presentan un evento de HK entran en el modelo recibiendo CSZ o tratamiento estándar, y se pueden encontrar en cualquiera de las cuatro etapas de la clasificación funcional de la New York Heart Association (NYHA I-IV), a través de las cuales transitan (fig. 1).
A su vez, se realizó una simulación de forma individual de los niveles de K+ con base en la eficacia del tratamiento recibido (cada paciente presentará una trayectoria única de los niveles de K+). Asimismo, tras un evento de HK, se tuvo en cuenta la posible reducción del tratamiento con iSRAA (pasando de recibir una dosis óptima, a una subóptima) o su interrupción. Un porcentaje de estos pacientes volverá a recibir una dosis óptima tras el evento de HK, pero si tras retomarla sufre un nuevo evento de HK que conlleva la reducción de la dosis o interrupción del tratamiento con iSRAA, continuará en este estado hasta el final de la simulación (tablas S1 y S2).
Adicionalmente, los pacientes podían presentar eventos cardiovasculares mayores (MACE) y hospitalizaciones en función del estado de salud en el que se encontraran y de sus niveles de K+. En ambos modelos se consideró que los pacientes podían pasar al estado «muerte» en cualquier momento y desde cualquier estado de salud.
Este estudio se adhiere a los estándares recomendados en las Normas Consolidadas para la presentación de Informes de Evaluación Económica Sanitaria CHEERS18.
PoblaciónEn el caso base se simuló con una cohorte de 30.000 pacientes con ERC y otra de 30.000 pacientes con IC, que habían presentado un evento de HK (niveles séricos de K+ ≥ 5,5 mEq/L). Las características de los pacientes para las dos cohortes se extrajeron tanto del estudio HARMONIZE (ZS-004; NCT02088073)13, como de la base de datos Clinical Practice Research Datalink (CPRD)19 (tablas S1 y S3).
EficaciaEn pacientes con ERC, se consideró un FGe basal de 35mL/min/1,73 m2, la cual disminuía anualmente en función del tratamiento con iSRAA. Cuando alcanzaba un valor de 9,00mL/min/1,73m2 los pacientes pasaban a recibir diálisis o trasplante en base a la probabilidad anual de trasplante. En pacientes con IC, la transición entre las etapas de la clasificación NYHA se modelizó con base en la probabilidad mensual de pasar de una etapa a otra20 (tabla 1).
Parámetros clínicos del modelo
| Características | Valor |
|---|---|
| ERC | |
| Edad (años)13 | 63,3 |
| Porcentaje de mujeres (%)13 | 37 |
| FGe (mL/min/1,73m2)13 | 35 |
| Disminución anual del FGe (mL/min/1,73m2)21 | |
| En pacientes en tratamiento con iSRAA | 2,3 |
| En pacientes sin tratamiento iSRAA | 3,5 |
| FGe media con el que los pacientes pasan a recibir terapia de remplazo renal (mL/min/1,73m2)* | 9 |
| Probabilidad anual de recibir trasplante*(%) | 27 |
| IC | |
| Edad (años)13 | 65,2 |
| Porcentaje de mujeres (%)13 | 35 |
| Porcentaje de pacientes NYHA I (%)13 | 40 |
| Porcentaje de pacientes NYHA II (%)13 | 30 |
| Porcentaje de pacientes NYHA III (%)13 | 20 |
| Porcentaje de pacientes NYHA IV (%)13 | 10 |
ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; NYHA: New York Heart Association.
La simulación de los niveles séricos de K+ de manera individual se basó en los datos del estudio HARMONIZE13 para los primeros 28 días y del estudio realizado por Spinowitz et al. (ZS-005)16 para el resto de la simulación. Tras el episodio inicial de HK, los pacientes podían sufrir nuevos episodios de HK en cada ciclo (niveles de K+ ≥ 5,5 mEq/L).
En pacientes con ERC, la probabilidad anual de sufrir un MACE u hospitalización se calculó a partir de su tasa anual en función del estado de salud (la cual se extrajo del estudio realizado por Go et al., basado en el registro Kaiser permanente de California donde se estudiaron 1.120.295 pacientes con ERC en diferentes estadios)22, y se ajustó según los niveles de K+ del paciente23, su FGe (solo en el caso de las hospitalizaciones)23, si recibía tratamiento con iSRAA24, así como si su dosis era óptima (asumiéndose que la eficacia de los iSRAA disminuye al 50% con dosis subóptimas). En pacientes con IC, la probabilidad anual de MACE se estimó utilizando una ecuación de riesgo basada en datos del CPRD20 (tabla S4), que se ajustó según los niveles de K+ del paciente, asumiendo los mismos datos que en aquellos con ERC al no disponer de datos específicos23. La probabilidad mensual de hospitalización se calculó a partir de la incidencia extraída del CPRD19 en función del uso de iSRAA y los niveles de K+ (tabla S5).
En ambas patologías se asumió una duración del tratamiento para la HK indefinida cuando los pacientes recibían CSZ, excepto en los pacientes con ERC que progresaban a una fase terminal de la enfermedad y empezaban a recibir TRR. No obstante, tanto en ERC como en IC, se consideró una probabilidad anual de discontinuación del tratamiento con CSZ del 26,4%16,25. En el caso del tratamiento estándar, dado que se basa en modificaciones del estilo de vida y tratamiento con poliestireno sulfonato cálcico durante la fase aguda (tres días), se asumió que ningún paciente discontinuaba el tratamiento.
MortalidadEn el caso de pacientes con ERC, partimos del riesgo de muerte en función del estado de salud del paciente, extraída del estudio realizado por Go et al., mencionado anteriormente22, que se ajustó según sus niveles de K+23 y el uso de iSRAA24 (asumiendo una reducción del 50% de la eficacia de los iSRAA con dosis subóptimas). En el caso de IC, el riesgo de muerte se calculó utilizando un modelo de predicción (The Seattle Heart Failure) basado en la publicación de Levy et al.26 (tabla S6), que se ajustó en función de los niveles de K+27. En ambos casos, si el riesgo resultante era menor que el riesgo de mortalidad de la población general española, se utilizó este último28.
Valores de utilidadPara incorporar el impacto en el estado de salud y la calidad de vida de la ERC, la IC, los episodios de HK y los EA derivados de su tratamiento, se tuvieron en cuenta los valores de utilidad asociados a cada estado de salud, así como los valores de disutilidad asociados a los episodios de HK, MACE, hospitalizaciones, complicaciones de la diálisis, y a los EA derivados de los tratamientos (tabla 2).
Valores de utilidad y disutilidad consideradas en el modelo
| Estado de salud | Valor de utilidad/disutilidad | Fuente |
|---|---|---|
| Estado de salud | ||
| Pacientes con ERC | ||
| Estadio 3b | 0,870 | Gorodetskaya et al.29 |
| Estadio 4 | 0,850 | Gorodetskaya et al.29 |
| Estadio 5 | 0,570 | Lee et al.30 |
| Diálisis* | 0,455 | Lee et al.30 |
| Trasplante | 0,710 | Lee et al.30 |
| Pacientes con IC | ||
| NYHA I | 0,855 | |
| NYHA II | 0,771 | Göhler et al.31 |
| NHYA III | 0,673 | |
| NYHA IV | 0,532 | |
| Eventos | ||
| Episodios de HK | 0,000 | Asunción |
| MACE–año 1 | -0,050 | Kent et al.32 |
| MACE–año 2+ | 0,000 | Kent et al.32 |
| Hospitalización | -0,024 | Göhler et al.31 |
| Complicaciones de la diálisisa | -0,060 | Sennfält et al.33 |
| EA del tratamientob | ||
| Hipertensión | -0,0375 | Sullivan et al.34 |
| Edema (generalizado y periférico) | -0,0375 | Se asume igual a la hipertensión |
| Estreñimiento | -0,0727 | Sullivan et al.34 |
| Nausea | -0,0727 | Se asume igual al estreñimiento |
| Anorexia | -0,0368 | Sullivan et al.34 |
| Anemia | -0,0200 | Sullivan et al.34 |
| Infección de las vías urinarias | -0,0054 | Sullivan et al.34 |
EA: eventos adversos; ERC: enfermedad renal crónica; HK: hiperpotasemia; IC: insuficiencia cardiaca; MACE: eventos cardiovasculares mayores; NYHA: New York Heart Association.
Cálculo: utilidad de hemodiálisis (0,440) y diálisis peritoneal (0,530) ponderadas por la proporción de uso (83,3% y 16,7%, respectivamente) extraído del registro español de enfermos renales35.
Para los pacientes que inician TRR únicamente se tienen en cuenta las utilidades específicas y la disutilidad de la diálisis (no se tienen en cuenta los eventos anteriores a la TRR).
El modelo tiene en cuenta los eventos que ocurren con una incidencia ≥ 5% para las alternativas comparadas, extraídas del estudio ZS-00536 para CSZ y de Nasir et al.37 para el tratamiento estándar (se toman los datos para los pacientes que reciben tratamiento con poliestireno sulfonato cálcico en la fase aguda de HK). No se tiene en cuenta la infección de las vías urinarias, por asunción de los expertos.
Se tuvieron en cuenta los costes directos asociados a los tratamientos farmacológicos, las modificaciones en el tratamiento con iSRAA, los costes derivados del manejo de la enfermedad y sus eventos, así como los derivados de los episodios de HK (en función de su gravedad, definida como baja: 5,5 ≤ K+ ≤ 6,0 mEq/L, o media-alta: K+> 6,0 mEq/L), y los EA derivados de su tratamiento. En cuanto al coste farmacológico, se tuvieron en cuenta los costes del tratamiento de la HK, CSZ y poliestireno de sulfonato cálcico, y del tratamiento con iSRAA (cuyo coste dependía de si su dosis era óptima o subóptima, y cuyas consideraciones tomadas para el cálculo de su coste anual se presentan en la tabla S7). Para el cálculo del coste de CSZ, se calculó el coste/día en la fase de corrección del K+, donde, según la estimación de los autores, el día uno 10,0% de los pacientes utiliza 5g/día, un 25,0% 10g/día y un 65,0% 10g/3 veces al día; el día dos 10,0% utiliza 5g/día, un 73,3% 10g/día y un 16,7% 10g/3 veces al día; y el día tres 20,0% utiliza 5g/día, un 76,7% 10g/día y un 3,3% 10g/3 veces al día. Asimismo, se calculó el coste/día de la fase posterior, tomando como referencia el porcentaje de uso de cada dosis en el estudio de extensión de CZS36 (donde un 0,9% utiliza 5g/2 días, 61,7% 5g/día y 37,4% 10g/día). Para el cálculo del coste de la dosis del poliestireno de sulfonato cálcico, se tuvo en cuenta el coste farmacológico de la fase de corrección de K+ (días 1-3), asumiéndose una dosis diaria definida de 45g/día38. En relación con los costes derivados de las modificaciones en el tratamiento con iSRAA, se tuvo en cuenta los costes que conllevaban la discontinuación del tratamiento, la reducción de la dosis y el aumento a la dosis inicial. Con respecto a los costes derivados del manejo de la enfermedad, se tuvieron en cuenta los costes asociados a los estados de salud de cada una de las enfermedades que, en el caso de la IC, de manera conservadora, se asumió que viene dado por los eventos, por lo que no se le asoció un coste directo a cada estado de salud NYHA. También los costes del manejo de los eventos derivados de la ERC e IC (MACE y hospitalizaciones) y de los episodios de HK (cuyo coste dependía de su gravedad). Por último, se tuvo en cuenta el coste derivado de los EA del tratamiento de la HK (CSZ y poliestireno de sulfonato cálcico).
Los costes farmacológicos (precio de venta del laboratorio [PVL] sin IVA) se extrajeron de la base de datos BotPLusWeb39. Los costes unitarios se obtuvieron de bases de datos nacionales40,41. El año base o de referencia para la valoración de los costes fue el 2022 (tabla 3).
Costes considerados en el modelo
| Parámetro | ERC | IC | |
|---|---|---|---|
| Coste (€, 2022) | Coste (€, 2022) | Fuente | |
| CSZ | |||
| Fase de corrección (días 1-3) | 37,21 € | 37,21 € | BotPLusWeb39 |
| Fase posterior (coste/ciclo de 28 días) | 188,57 € | 188,57 € | BotPLusWeb39 |
| Tratamiento estándar (poliestireno sulfonato cálcico) | 6,42 € | 6,42 € | BotPLusWeb39 |
| Coste anual de los iSRAAa | |||
| Dosis óptima | 99,56 € | 552,28 € | BotPLusWeb39 |
| Dosis subóptima | 53,11 € | 281,98 € | BotPLusWeb39 |
| Modificaciones en el tratamiento iSRAA | |||
| Discontinuación | 102,12 € | 102,12 € | eSalud40 |
| Reducción de la dosis | 95,25 € | 95,25 € | eSalud40 |
| Aumento a la dosis inicial | 219,03 € | 219,03 € | eSalud40 |
| Coste anual asociado a los estados de salud | |||
| ERC estadio 3b | 5. 452,11 € | - | Darbà et al.42 |
| ERC estadio 4 | 6.728,84 € | - | Darbà et al.42 |
| ERC estadio 5 | 10.737,34 € | - | Darbà et al.42 |
| ERC Diálisis | 43.556,67 € | - | eSalud40,c |
| ERC Acceso a diálisis (coste único) | 843,22 € | - | Coste de inserción del catéter; eSalud40 |
| ERC Complicaciones de la diálisis | 932,27 | - | eSalud40,d |
| ERC Trasplante-procedimiento (coste único) | 37.928,18 € | - | eSalud40 |
| ERC Trasplante-mantenimiento | 11.556,40 € | - | Sánchez et al.43 |
| Costes asociados a los eventos derivados de la enfermedad | |||
| MACE | 3.361,96 € | 3.361,96 € | CMBD41,e |
| MACE mantenimiento (año) | 6.169,72 € | 6.169,72 € | Coste anual por insuficiencia cardiaca44 |
| Hospitalización | 10.033,47 € | 4.140,74 € | CMBD41 |
| Costes asociados a los episodios de HK | |||
| Pacientes con K+ ≤ 6 mmol/L | 236,26 € | 236,26 € | eSalud40,f |
| Pacientes con K+> 6 mmol/L | 502,86 € | 502,86 € | eSalud40,g |
| CSZ: pacientes en los que se repite el evento | 4.841,88 € | 4.841,88 € | eSalud40,h |
| Tratamiento estándar: pacientes en los que se repite el evento | 5.565,36 € | 5.565,36 € | eSalud40,h |
| Costes asociados al manejo de los EAi | |||
| Edema | 129,54 € | 129,54 € | eSalud40* |
| Hipertensión | 129,54 € | 129,54 € | eSalud40 |
| Estreñimiento | 64,77 € | 64,77 € | eSalud40* |
| Nauseas | 64,77 € | 64,77 € | eSalud40* |
| Anorexia | 107,35 € | 107,35 € | eSalud40* |
| Anemia | 205,38 € | 205,38 € | eSalud40* |
CSZ: ciclosilicato de sodio y zirconio; EA: eventos adversos; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; MACE: eventos cardiovasculares mayores; PVL: precio venta laboratorio (para CSZ se utiliza el precio notificado y para el poliestireno sulfonato cálcico el precio de referencia).
Las consideraciones tomadas para el cálculo del coste anual del tratamiento con iSRAA, se presentan en la tabla S7.
b Discontinuación y reducción de dosis: analítica (bioquímica, 100%), una visita Atención Primaria (53,3%) y una visita médico especialista (46,7%). Manejo de efectos secundarios derivados de la discontinuación de la dosis: una visita adicional a Atención Primaria y analítica adicional (20%). Manejo de los posibles efectos secundarios derivados de la reducción de la dosis: una visita adicional a Atención Primaria y analítica adicional (10%); Aumento a la dosis inicial: dos analíticas (bioquímica, 100%), dos visitas Atención Primaria (26,7%), y dos visitas médico especialista (un 73,3%). Manejo de los posibles efectos secundarios derivados del aumento de dosis: una visita adicional a Atención Primaria y una analítica adicional (20%), y visita a Urgencias (3%).
Coste ponderado de hemodiálisis y diálisis peritoneal35: hemodiálisis (83,3%), diálisis peritoneal (16,7%). Coste hemodiálisis 45.084,00 €: 289,0 €/sesión (eSalud40) en tres sesiones semanales (Arieta45). Coste diálisis peritoneal 36.406,00 €: entrenamiento 144,0 €/sesión y 97,0 €/sesión continuada (eSalud40) en siete sesiones de entrenamiento durante dos semanas y una sesión al día a partir del entrenamiento (Arieta45).
Un electrocardiograma (80%); 1,7 test de urea y electrolitos (97%); 1,7 visitas Atención Primaria (73%); dos visitas ambulatorias (27%).
El 26,7% son hospitalizados (hospitalización que dura 4,5 días [25%], dos electrocardiogramas y cuatro test de urea y electrolitos [100%]); y el 73,3% reciben visita ambulatoria (2,3 visitas ambulatorias [47%]), un electrocardiograma (60%); 2,3 test de urea y electrolitos (73%); un transporte de ambulancia (10%); una visita Urgencias (15%); una visita nefrología (35%).
Dos electrocardiogramas, cinco test de urea y electrolitos y cinco test de glucosa (100%); tratamiento CSZ: hospitalización seis días; tratamiento estándar: hospitalización siete días.
El modelo tiene en cuenta los eventos que ocurren con una incidencia ≥ 5% para las alternativas comparadas, extraídas del estudio ZS-00536 para CSZ y de Nasir et al.37 para el tratamiento estándar (se toman los datos para los pacientes que reciben tratamiento con poliestireno sulfonato cálcico en la fase aguda de HK). No se tiene en cuenta la infección de las vías urinarias, por asunción de los expertos.
Con el fin de evaluar la robustez de los modelos y determinar el impacto de la incertidumbre de los parámetros en el RCUI, se realizó un análisis de sensibilidad determinístico (ASD) univariado, y un análisis de sensibilidad probabilístico (ASP). A través del ASD se variaron los parámetros principales del modelo de manera individual (hasta el límite superior e inferior de su intervalo de confianza (IC 95%), o un±10% con respecto al valor basal). Los resultados se representaron en un diagrama de tornado. El ASP se llevó a cabo a través de una simulación de Monte-Carlo de 1.000 simulaciones, mediante el cual se asignaron variaciones aleatoriamente a cada uno de los parámetros según su distribución de probabilidad. Los resultados se representaron en un diagrama de dispersión del plano coste-efectividad. Teniendo en cuenta la literatura española existente, se asumió como referencia de partida un umbral de disponibilidad a pagar de 25.000 € por AVAC ganado46.
ResultadosCaso baseEn pacientes con ERC, los resultados mostraron un coste a lo largo de su ciclo vital de 175.340 € para CSZ y de 171.724 € para el tratamiento estándar (poliestireno sulfonato cálcico). Los AVG y AVAC con CSZ fueron de 7,753 y 5,233, respectivamente, mientras que con el tratamiento estándar fueron de 7,082 y 4,757, respectivamente, estimándose un RCEI de 5.387 €, y un RCUI de 7.605 €.
En pacientes con IC, los resultados mostraron un coste de 50.144 € para CSZ y de 35.395 € para el tratamiento estándar. Los AVG y AVAC con CSZ fueron de 4,693 y 3,060 respectivamente, mientras que con el tratamiento estándar fueron de 3,167 y 2,082 respectivamente, estimándose un RCEI de 9.666 € y un RCUI de 15.078 € (tabla 4).
Resultados del caso base
| ERC | IC | |||||
|---|---|---|---|---|---|---|
| CSZ | Tratamiento estándar | Diferencia | CSZ | Tratamiento estándar | Diferencia | |
| Costes totales | 175.340 € | 171.724 € | 3.616 € | 50.144 € | 35.395 € | 14.749 € |
| Tratamiento | 11.722 € | 113 € | 11.608 € | 9.801 € | 64 € | 9.737 € |
| EA | 236 € | 6 € | 230 € | 197 € | 3 € | 194 € |
| Evento de HK | 4.074 € | 21.761 € | -17.688 € | 2.887 € | 10.410 € | -7.523 € |
| ERC | 37.456 € | 33.289 € | 4.167 € | - | - | - |
| TRR | 59.441 € | 57.899 € | 1.543 € | - | - | - |
| MACE | 16.694 € | 14.706 € | 1.989 € | 16.018 € | 9.590 € | 6.429 € |
| Hospitalizaciones | 45.132 € | 43.433 € | 1.698 € | 19.550 € | 14.427 € | 5.123 € |
| Cambio en iSRAA | 586 € | 516 € | 69 € | 1.690 € | 901 € | 789 € |
| AVG totales | 7,753 | 7,082 | 0,671 | 4,693 | 3,167 | 1,526 |
| AVAC totales | 5,233 | 4,757 | 0,476 | 3,060 | 2,082 | 0,978 |
| Coste/AVG | 5.387 € | 9.666 € | ||||
| Coste/AVAC | 7.605 € | 15.078 € | ||||
AVG: años de vida ganados; AVAC: años de vida ajustados por calidad; CSZ: ciclosilicato de sodio y zirconio; EA: eventos adversos; ERC: enfermedad renal crónica; HK: hiperpotasemia; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; MACE: eventos cardiovasculares mayores; TRR: terapia de reemplazo renal.
Tanto en ERC como en IC, el parámetro con mayor influencia en el RCUI fue el horizonte temporal considerado. En el caso de la ERC, considerar un horizonte temporal de cinco años haría que CSZ resultara una opción dominante, y un horizonte temporal de 50 años supondría un aumento del RCUI de 5 €. El segundo parámetro con mayor influencia fue el descuento aplicado en los costes. No obstante, en todos los casos CSZ resulta una opción coste-efectiva teniendo en cuenta un umbral de coste-efectividad de 25.000 €/AVAC (fig. 2).
ASD.
A: ASD para ERC. Los resultados de la variación del horizonte temporal a su umbral inferior no se muestran, al resultar en este caso CSZ una opción dominante (menos costoso y más efectivo); al variarlo a su umbral superior, el RCUI es 7.610 €, por lo que no se aprecia la línea al solo diferir del caso base en 5 €; B: ASD para IC.
ASD: análisis de sensibilidad determinístico; CSZ: ciclosilicato de sodio y zirconio; ERC: enfermedad renal crónica; FGe: filtrado glomerular estimado; HK: hiperpotasemia; IC: insuficiencia cardiaca; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; NYHA: New York Heart Association; RCUI: ratio coste-utilidad incremental; TRR: terapia de reemplazo renal.
Con respecto al análisis probabilístico, en el caso de la ERC, en el 90,4% de las simulaciones, CSZ resultó una opción coste-efectiva, y en el 9,6% restante, una opción dominante (alternativa más eficaz y menos costosa) vs. tratamiento estándar. En el caso de la IC, en el 100% de las simulaciones CSZ resultó una alternativa coste-efectiva (fig. 3).
ASP: plano coste-efectividad.
A: ASP para ERC; B: ASP para IC.
Umbral de disposición a pagar: cantidad máxima que se considera apropiada invertir por unidad de eficacia en salud en el sistema sanitario.
ASP: análisis de sensibilidad probabilístico; AVAC: año de vida ajustado por calidad; CE: coste-efectivo; ERC: enfermedad renal crónica; IC: insuficiencia cardiaca.
En este estudio hemos evaluado el coste-efectividad del CSZ vs. tratamiento estándar para la HK crónica en pacientes con ERC y en pacientes con IC, mostrando que el CSZ es coste-efectivo desde la perspectiva del SNS español. En nuestro conocimiento, se trata del primer estudio europeo que analiza el coste-efectividad del CSZ para pacientes con IC, y el primero llevado a cabo en España que analiza el coste-efectividad del CSZ, por lo que nuestros resultados pueden resultar de gran utilidad para la toma de decisiones. Aunque las evaluaciones económicas relacionadas con el uso del CSZ son escasas en la literatura, los resultados alcanzados en nuestro estudio están en la línea de los obtenidos en una evaluación previa realizada con una cohorte de pacientes en el ámbito de Noruega y Suecia, si bien en ese estudio solo se analizó el tratamiento en pacientes con ERC47.
En nuestro análisis se estimó un RCEI de 5.387 €/AVG y de 9.666 €/AVG y un RCUI de 7.605 €/AVAC y de 15.078 €/AVAC en pacientes con ERC e IC, respectivamente. En ambos modelos, aunque el coste asociado al tratamiento farmacológico con CSZ fue mayor, debido principalmente al mayor coste de adquisición de CSZ (diferencia en coste farmacológico CSZ vs. tratamiento estándar: ERC: 11.608 €; IC: 9.737 €), se observó un menor coste asociado a los episodios de HK, debido a la menor frecuencia de estos episodios en pacientes tratados con CSZ (diferencia en coste tratamiento episodio de HK CSZ vs. tratamiento estándar: ERC: -17.688 €; IC: -7.523 €), ya que los episodios de HK se asocian con un mayor uso de recursos3.
Los resultados también mostraron un aumento tanto de los AVG como de los AVAC con el tratamiento con CSZ, en concreto una ganancia de 0,671 y 1,526 AVG, y de 0,476 y 0,978 AVAC en pacientes con ERC e IC, respectivamente. Esta mejoría de la efectividad en ambos casos se debió principalmente a que el tratamiento con CSZ mejora el pronóstico de ambas enfermedades, manteniendo a los pacientes durante más tiempo en los estados de salud menos graves. Asimismo, debemos de tener en cuenta que este hecho conlleva una menor mortalidad en pacientes que reciben CSZ, la cual se ve favorecida también por la menor frecuencia de episodios de HK, los cuales aumentan su riesgo3. Todo ello implica que los pacientes tratados con CSZ utilicen recursos durante un mayor tiempo. Este dato explicaría que, en pacientes en tratamiento con CSZ, no se observen ahorros en los costes asociados a los eventos derivados de la enfermedad, MACE y hospitalizaciones, o en los costes generados de los cambios en el tratamiento iSRAA. En este contexto, se ha publicado recientemente un estudio retrospectivo en vida real sobre el uso de recursos asociados al tratamiento con el CSZ, en Estados Unidos, donde se analizaron los datos de más de 1.100 pacientes con HK y se reportó una menor proporción de hospitalizaciones en pacientes tratados con el CSZ a largo plazo (> 90 días) vs. aquellos tratados a corto plazo (≤ 90 días)48. Este resultado podría estar asociado con un menor coste, aunque los autores no proporcionan datos al respecto48. Así pues, los resultados indican que la terapia con CSZ a largo plazo podría traducirse en una reducción de uso de recursos y, por tanto, del coste total asociado vs. la terapia estándar. Además, según los autores, una terapia a largo plazo podría ayudar a optimizar el tratamiento con los iSRAA, tal y como sugieren las guías internacionales49,50. Asimismo, un estudio llevado a cabo en España en pacientes con HK crónica y ERC, IC o diabetes, reportó que la mayoría de los pacientes (70,4%) recibían tratamiento con iSRAA, el cual era frecuentemente interrumpido (mayor tasa de interrupción a mayor gravedad de la HK). La interrupción del tratamiento con iSRAA se asocia a un mayor riesgo de EA, y de progresión de la enfermedad51–53. En dicho estudio los pacientes con HK grave presentaban un mayor riesgo de hospitalización, e incurrían en mayores costes anuales vs. los pacientes con HK leve (12.705 € vs. 4.468 €)11.
El uso del CSZ en los pacientes con HK permitiría mejorar el control del potasio plasmático, reduciendo los elevados costes asociados, así como podría asegurar el mantenimiento del tratamiento de los iSRAA, lo que lo convierte en una alternativa terapéutica vs. las resinas, cuya efectividad y seguridad a largo plazo no ha sido demostrada. Asimismo, los resultados del estudio muestran la mejora en la calidad de vida de los pacientes tratados con CZS.
Las principales limitaciones de nuestro estudio están relacionadas con el diseño del análisis que, al tratarse de una modelización, se basa en los datos disponibles y requiere de la realización de asunciones. Por una parte, como es habitual en nuestro entorno, la mayoría de los datos considerados, procedían de fuentes internacionales debido a la falta de estudios españoles, a excepción de los costes. En concreto, las características basales de la población, entre ellas la edad de los pacientes o el porcentaje de mujeres, se obtuvieron del ensayo HARMONIZE13 (llevado a cabo en pacientes con ERC, IC y diabetes), siendo ambas menores a las reportadas en la literatura en vida real en España11. Sin embargo, el análisis de sensibilidad realizado en ambos modelos muestra que, con las variaciones realizadas, los resultados se mantienen estables y las conclusiones alcanzadas son robustas. Por otra parte, dado que no se han realizado ensayos que comparen de manera directa la eficacia de CSZ y el tratamiento estándar considerado (poliestireno sulfonato cálcico y modificaciones del estilo de vida), se asumieron los resultados del brazo placebo del ensayo HARMONIZE13 durante la fase de mantenimiento (tras el tratamiento del episodio de HK). Sin embargo, el ensayo HARMONIZE13 no consideraba modificaciones del estilo de vida (como podría ser una dieta baja en K+) en el grupo placebo. En cualquier caso, creemos que la asunción refleja la práctica clínica real dada la escasa evidencia que apoya la eficacia de este tipo de dietas y su difícil cumplimiento. En referencia a los episodios de HK, y a pesar de conocer que estos están asociados a EA2,54, se ha considerado que no presentan un valor de disutilidad. No obstante, esta asunción se podría considerar conservadora, debido al mayor número de episodios de HK que sufren los pacientes que reciben el tratamiento estándar. Asimismo, se ha considerado que el evento de HK ocurre cuando los niveles de K+ son ≥ 5,5 mEq/L, en línea con la indicación con financiación en España55. Finalmente, no se han considerado los costes indirectos, dado que el análisis adoptó la perspectiva del SNS, sin embargo, dada la edad media de la población considerada (> 60 años), las pérdidas potenciales de productividad se podrían considerar menores. Por otro lado, trabajos españoles han destacado que los costes no sanitarios asociados a estadios avanzados de la IC pueden ser tan o más elevados que los propios costes sanitarios45. Asimismo, en un estudio llevado a cabo en los países nórdicos, se observa que la progresión de la ERC incrementa la necesidad de cuidados informales para los pacientes56. Un mejor control de la evolución de los pacientes con IC o ERC puede mantener o mejorar su progresión, lo cual podría redundar también en sus necesidades de cuidados no sanitarios. Futuros estudios deberían abordar la comparación de resultados en salud y costes, contemplando la doble perspectiva del financiador sanitario y la social.
A pesar de las limitaciones, se considera que el análisis se puede generalizar a la población española y la práctica clínica en nuestro país, ya que las asunciones fueron conservadoras, un grupo de expertos ha validado los datos utilizados y los resultados del análisis se han mantenido estables en todos los análisis de sensibilidad realizados, representando una opción coste-efectiva vs. estándar de tratamiento. Adicionalmente, como fortalezas se debe destacar que no ha sido necesaria la extrapolación de los datos de eficacia del ensayo clínico, dado que se disponía de los datos del ensayo abierto de fase III a largo plazo de CSZ16, en el cual se asoció el uso diario de CSZ con el mantenimiento de la normopotasemia, sin cambios sustanciales en el tratamiento iSRAA hasta 12 meses. Además, otra fortaleza de nuestro estudio residiría en el propio diseño de los modelos, ya que al tratarse modelos de simulación a nivel de paciente y no simular una cohorte en su conjunto, permite una simulación más aproximada a la realidad.
ConclusionesEl tratamiento con CSZ, al evitar episodios de HK en pacientes con ERC o IC, reduce el uso de recursos sanitarios y costes asociados a ellos, mejorando la calidad de vida de los pacientes. El análisis realizado muestra que CSZ es una alternativa con una buena relación coste-efectividad para el tratamiento de la HK en pacientes con ERC o IC, teniendo en cuenta los valores de eficiencia de referencia empleados habitualmente en España.
FinanciaciónEl presente trabajo ha sido financiado por AstraZeneca.
Contribución de los autoresTodos los autores del manuscrito (RAA, MCL, JB, JO, MSM, SG, ALM, BLC, NVV, SA, MC) han contribuido a la concepción y diseño del proyecto y a la interpretación de los datos; han participado en la revisión crítica del contenido intelectual del manuscrito y han aprobado la versión definitiva que se presenta.
Conflicto de interesesRAA declara haber recibido remuneración por el presente manuscrito de AstraZeneca; honorarios por consultoría de AstraZeneca, Bayer y Boehringer Ingelheim; pagos u honorarios por charlas, presentaciones, conferencias, redacción de manuscritos o actos educativos de CSL Vifor, Boehringer Ingelheim, y AstraZeneca; ayudas para asistir a reuniones y/o viajar de CSL Vifor, Fresenius, y AstraZeneca; y que tiene un cargo directivo o fiduciario remunerado o no en la sociedad madrileña de nefrología (Somane).
MCL declara haber recibido remuneración por el presente manuscrito de AstraZeneca; pagos u honorarios por charlas, presentaciones, conferencias, redacción de manuscritos o actos educativos de AstraZeneca, CSL Vifor y Boehringer Ingelheim; y ayudas para asistir a reuniones y/o viajar de Pfizer.
JB declara haber recibido honorarios por asesoramiento y/o conferencias y/o apoyo para viajes de reuniones de Amgen, Abbvie, Sanofi, CSL Vifor, AstraZeneca, Rubió y GSK; y apoyo financiero de AstraZeneca para actividades educativas.
JO declara haber recibido remuneración por el presente manuscrito de AstraZeneca; pagos u honorarios por charlas, presentaciones, conferencias, redacción de manuscritos o actos educativos, así como ayudas para asistir a reuniones y/o viajar de AstraZeneca.
MSM, SG, ALM, BLC son empleados de AstraZeneca NVV y SA trabajan para una entidad de investigación independiente y han recibido honorarios por su contribución al desarrollo de este estudio.
MC declara haber recibido pagos u honorarios por charlas, presentaciones, conferencias, redacción de manuscritos o actos educativos de AstraZeneca, Vifor Pharma, Novartis, Boehringher Ingelheim, Bayer y Novonordisk.