El paciente con enfermedad renal tiene incrementado el riesgo de fracturas, y a los factores habituales de la población general se suman otros propios de la uremia. Los mecanismos que favorecen las fracturas en la uremia no son suficientemente conocidos, aunque es ampliamente aceptado que la disminución del contenido mineral óseo y la alteración en la arquitectura ósea son responsables de un aumento en la fragilidad ósea. Con la progresión de la enfermedad renal crónica (ERC), el riesgo de fractura aumenta, siendo especialmente evidente cuando el paciente requiere diálisis. Dentro de las numerosas causas implicadas en el aumento de fracturas óseas se encuentran la edad avanzada, la amenorrea, la exposición a esteroides, el descenso de la vitamina D, el aumento de la hormona paratiroidea (PTH) y también la desnutrición y la inflamación crónica. La concentración de fósforo sérico ya sea alto o muy bajo también se ha correlacionado con el riesgo de fractura. El aumento del fosfato sérico puede afectar el metabolismo óseo directamente e indirectamente a través del desarrollo de mecanismos hormonales adaptativos que tratan de prevenir la hiperfosfatemia, como el aumento de PTH y el factor de crecimiento de fibroblastos 23 (FGF23), y la disminución del calcitriol. Estos mecanismos de adaptación son de menor intensidad si la absorción intestinal de fosforo se disminuye con el uso de captores de fósforo; los cuales parecen tener un impacto positivo en la reducción del riesgo de fracturas. En este documento se describirán los posibles mecanismos que relacionan el riesgo de fracturas con: los niveles de fósforo sérico, los mecanismos adaptativos propios de la enfermedad renal y el uso de fármacos para controlar la hiperfosfatemia. No existen estudios que proporcionen evidencia sobre la influencia de diversos tratamientos en el riesgo de fracturas en pacientes con enfermedad renal crónica. Sugerimos que el control del fósforo debería ser un objetivo a tener en cuenta.
Patients with chronic kidney disease have a higher risk of fractures than the general population due to the added factor of uraemia. Although the mechanisms behind uraemia-associated fractures are not fully understood, it is widely accepted that the decrease in bone mineral content and alteration in bone architecture both increase bone fragility. As chronic kidney disease progresses, the risk of fracture increases, especially once the patient requires dialysis. Among the many causes of the increased risk are advanced age, amenorrhoea, steroid exposure, decreased vitamin D, increased parathyroid hormone (PTH), malnutrition and chronic inflammation. Serum phosphorus, whether high or very low, seems to correlate with the risk of fracture. Moreover, increased serum phosphate is known to directly and indirectly affect bone metabolism through the development of adaptive hormonal mechanisms aimed at preventing hyperphosphataemia, such as the increase in PTH and fibroblast growth factor 23 (FGF23) and the reduction in calcitriol. These adaptive mechanisms are less intense if the intestinal absorption of phosphorus is reduced with the use of phosphorus captors, which seem to have a positive impact in reducing the risk of fractures. We describe here the possible mechanisms associating serum phosphorus levels, the adaptive mechanisms typical in kidney disease and the use of drugs to control hyperphosphataemia with the risk of fractures. We found no studies in the literature providing evidence on the influence of different treatments on the risk of fractures in patients with chronic kidney disease. We suggest that control of phosphorus should be an objective to consider.
La relación entre enfermedad renal crónica (ERC) y hueso es bien conocida1. El paciente renal tiene un hueso frágil que se puede explicar por dos aspectos fundamentales: disminución del contenido mineral óseo (CMO) y una arquitectura ósea anómala. El CMO bajo es característico de la osteoporosis (OP) de la población general (senil o postmenopáusica) definida por la Organización Mundial de la Salud (OMS) como un T-score inferior a -2,5 desviaciones estándar medida por «dual-energy X-ray absortiometry» (DEXA). Pero no menos importantes son las alteraciones de la estructura ósea caracterizadas por anormalidades en la tasa de recambio, mineralización y volumen óseo, lo que se conoce como osteodistrofia renal2.
El paciente con ERC presenta un alto riesgo de fractura, más elevado que la población general, ya que se asocian los factores urémicos intrínsecos específicos de la ERC, como los factores clásicos favorecedores de OP. La OP urémica es una entidad más compleja que la OP clásica que ocurre en pacientes con ERC y aumenta el riesgo de fractura3. La coexistencia de OP urémica y las alteraciones óseas clásicas de la ERC (la llamada osteodistrofia renal) complican el diagnóstico, y por supuesto, el tratamiento. El diagnóstico de OP no es usual en la ERC y sin embargo es un patología muy frecuente. La cuantificación del riesgo de fractura en la población general se puede realizar valorando distintos factores de riesgo clínicos (mayores y menores)4 y/o utilizando distintas escalas, siendo la más conocida el Fracture Risk Assessment Tool (FRAX®)5. El algoritmo de FRAX calcula la probabilidad de fractura mayor osteoporótica (vertebral, antebrazo, cadera o húmero) y/o de cadera a los 10 años (en pacientes sin tratamiento actual o previo). FRAX calcula el riesgo de fracturas a partir de datos demográficos y clínicos básicos, y permite recalcular el riesgo del paciente si se introduce el valor del cuello femoral calculado por DEXA. Se ha descrito que FRAX ha sido capaz de predecir fracturas mayores osteoporóticas en algunas poblaciones de pacientes con ERC e incluso mortalidad en pacientes en diálisis6.
Fracturas en ERCExiste cierta evidencia de que el paciente con ERC tiene una mayor incidencia de OP y un aumento de fracturas, especialmente en etapas más avanzadas de la ERC7. El paciente renal es más propenso a fracturas que ocasionan inmovilización, con las complicaciones que ello conlleva, como infecciones, úlceras y complicaciones vasculares8-9. La OP es una causa frecuente de fracturas en la población general, sin embargo, en los pacientes con ERC las alteraciones en el metabolismo mineral aumentan aún más el riesgo de fracturas1. En un estudio reciente, un grupo de Corea con casi 90 mil pacientes seguidos durante cuatro años ha encontrado que el riesgo de fractura de cadera del paciente en diálisis es un 66% mayor que el de los pacientes con ERC en prediálisis (OR 1,66; IC 95% 1,54-1,82; p < 0,001), después de ajustar por otros factores de riesgo10.
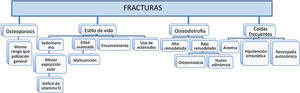
Causa de las fracturasLa mayoría de los estudios encuentran un mayor riesgo de fracturas en los pacientes con ERC que en la población general11. Los huesos del paciente renal son frágiles por varias razones (fig. 1). Suelen ser pacientes con una edad avanzada, las mujeres suelen ser postmenopáusicas o amenorreicas (especialmente si están en diálisis), no es infrecuente la exposición a esteroides y, tanto el descenso de la vitamina D (niveles inadecuados de calcidiol debido a dieta pobre en vitamina D o insuficiente exposición solar, y/ o niveles bajos de calcitriol por disminución de la hidroxilación renal de 1-α D3) como el aumento de la hormona paratiroidea (PTH) son factores que alteran la calidad del hueso.
No existen estudios que se hayan diseñado con la intención de conocer en qué grado las alteraciones del metabolismo mineral del paciente urémico están involucrados en la patogénesis de las fracturas12. De hecho, sólo hay evidencias indirectas de que los tratamientos destinados al control de éste reducen realmente la incidencia de fracturas13. Además, el papel de la PTH es controvertido y las evidencias sobre la relación entre los niveles plasmáticos de calcio y fósforo (P) con el riesgo de fractura son pobres14. Por ello, en las fracturas del paciente con ERC se deben tener en cuenta otros factores comunes con la población general y no solo las alteraciones del metabolismo mineral15. Otros elementos como la anemia, la hipotensión ortostática postdiálisis o la neuropatía autonómica son frecuentes en la ERC y favorecen los mareos, las caídas y por lo tanto, el riesgo de fracturas16. La importancia de las fracturas radica fundamentalmente en el aumento de la mortalidad. Las fracturas de cadera en el paciente con ERC aumentan 2,7 veces la mortalidad comparado con la población sin fractura17.
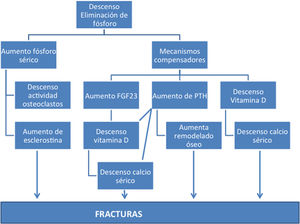
Fósforo y huesoCuando el filtrado glomerular (FG) estimado es inferior a 75 mL/min/1,73m2 desciende la eliminación urinaria de P y se origina el desarrollo de mecanismos adaptativos para evitar que el fosforo se acumule. Solo cuando el filtrado glomerular disminuye por debajo de 15 mL/min/1,73m2 se eleva el P sérico y aparece hipocalcemia. La sobrecarga de P que se produce en estadios tempranos de la ERC pone en marcha mecanismos fosfatúricos compensadores como son el aumento del factor de crecimiento de fibroblastos 23 (FGF23) y la PTH. El FGF23 reduce la vitamina D en cualquiera de sus formas porque disminuye la actividad de la 1α-hidroxilasa (CYP27B1) y aumenta la de la 24-hidroxilasa (CYP24A1)18. Este descenso de la vitamina D produce una disminución del calcio sérico. El descenso del calcio, la dificultad para eliminar el P y la resistencia a la acción de la PTH19 estimulan la producción de PTH incluso cuando el FG es de 60 mL/min/1,73m220.
El fósforo junto con el calcio son los principales iones que forman hueso, donde se encuentra en forma de hidroxiapatita21. La biodisponibilidad del P es crucial para una mineralización apropiada22. Los procesos causantes de osteomalacia y raquitismo se pueden dividir en aquellos que cursan con alteraciones de la vitamina D y las hipofosfatemias de otro origen (no relacionadas con la vitamina D), hereditarias o adquiridas. La clasificación de las diversas formas de raquitismo hipofosfatémico se ha racionalizado mediante el descubrimiento del papel central que desempeña el factor de crecimiento de fibroblastos 23 (FGF23) en la patogénesis de una serie de formas genéticas y adquiridas de la enfermedad23. La calcinosis tumoral es una rara enfermedad caracterizada por hiperfosfatemia debido a hipofosfaturia y calcificaciones ectópicas. La calcinosis tumoral primaria puede ser de variedad hiperfosfatémica o normofosfatémica. La variedad primaria hiperfosfatémica es un trastorno autosómico recesivo24. La calcinosis tumoral secundaria se encuentra asociada a condiciones como hiperparatiroidismo, enfermedad renal crónica, toxicidad por vitamina D, síndrome de leche y alcalinos (milk-alkali) y osteólisis.
El hueso es un órgano que a través de la producción de hormonas25 puede regular tanto las reservas de P como su propia mineralización. El hueso produce FGF2326, que estimula renalmente P y disminuye la producción de vitamina D lo cual reduce la absorción intestinal de P y también, por otros mecanismos, disminuye la reabsorción ósea, todo ello evita que aumente el P sérico27. En la población general la influencia del P en el contenido mineral óseo no ha sido suficientemente estudiado; sin embargo existe más información en el paciente renal28.
El fósforo como causa de fractura. Mecanismos de acción directos e indirectos por modificación de otros factoresNo existen evidencias que relacionen directamente los niveles de P con la pérdida de masa ósea y la incidencia de fracturas; pero algunos estudios arrojan indicios de esta asociación, y los mecanismos están reflejados en la figura 2. Hay que diferenciar entre tener niveles altos de P en suero, que pueden actuar directamente sobre la actividad osteoclástica, y la ingesta de altas cantidades de P que induce cambios hormonales18 que afectan el metabolismo óseo29.
Ingesta de fósforo y fracturasUna ingesta elevada de P se ha relacionado con pérdida de contenido óseo en población sana30, pero no existen evidencias en la ERC. En animales de experimentación se ha visto que una alta ingesta de P aumenta la síntesis ósea de esclerostina, molécula relacionada con anomalías en el remodelado óseo31, que inhibe la formación de hueso. La proteína de matriz ósea osteopontina (OPN) ha sido identificada como otro factor que media la respuesta de resorción ósea aumentada, secundaria a una dieta alta en fósforo. El impacto de una dieta alta en fósforo parece estar mediado en parte por OPN y por la PTH para aumentar la resorción ósea32. Las dietas altas en alimentos que contienen aditivos de fosfato inorgánico pueden alterar negativamente el metabolismo óseo y mineral y sus efectos sobe el hueso son más pronunciados en el envejecimiento.
Niveles de fósforo sérico y fracturasLos niveles extremos de fosfato (P), tanto elevados como bajos, se han asociado con defectos de mineralización y un mayor riesgo de fractura.
Los mecanismos que pueden relacionar el P y las fracturas óseas son varios:
- •
Efecto directo del P sobre el metabolismo óseo33,34, afectando a la maduración de la placa de crecimiento, diferenciación, proliferación y apoptosis de osteoblastos, inductor de resorción ósea o mineralización, y de este modo, ser responsable directo de la pérdida de CMO35. Se ha demostrado que el P sérico se asocia inversamente con la densidad mineal ósea (DMO) de columna lumbar en hombres36.
- •
Efecto indirecto a través de otras moléculas como la PTH, FGF23 y descenso de vitamina D secundario, todas ellas con efectos directos sobre el metabolismo óseo, incluyendo la osteoprotegerina33.
- •
Que el P sea solo un marcador de recambio óseo.
En estudios experimentales se ha demostrado que la alta concentración de fosfato inorgánico en los medios de cultivo inhibe directamente la generación de nuevos osteoclastos y también inhibe la reabsorción ósea por osteoclastos maduros, y esto lo hace por varios mecanismos: sobreestimulando la expresión del RNAm de la osteoprogesterina, sin afectar al RNAm del ligando del receptor para la activación del factor nuclear kappa B (RANKL), por acción directa sobre las células precursoras de los osteoclastos y por la inducción directa de la apoptosis de estos33. La implicación directa del P sobre la salud ósea se ha demostrado en animales de experimentación, no así en humanos, mostrando su implicación en la pérdida de hueso y en la calcificación vascular de una manera simultánea34.
Un estudio holandés en población normal36 muestra que un incremento de los niveles de P sérico, incluso en el rango normal, se asocia directamente con el riesgo de fractura en ambos sexos (HR 1,47; IC 95% 1,31-1,65 por cada mg/dL de P), independientemente de la DMO y de la ingesta de fosfato después de los ajustes por posibles factores de confusión (PTH y FGF23). El P se relacionó inversamente con la densidad mineral ósea en columna lumbar (hueso predominantemente trabecular) en hombres, pero no con la DMO de cuello femoral (hueso predominantemente cortical) en ningún sexo. Especialmente interesante en este estudio, al igual que estudios previos37 es que este riesgo de fractura asociado al P sérico era independiente de los ajustes por FGF-23, por lo que el P per se (y no las alteraciones hormonales secundarias) podría ser responsable del aumento de riesgo en esta cohorte.
En pacientes con ERC también se ha observado que por cada 1 mg/dL de aumento de P se incrementa un 12% el riesgo de hospitalización por fractura38.
FGF23 y fracturasLa dificultad en eliminar el P por el riñón con ERC produce un aumento del FGF2318. La correlación entre FGF23 y los hallazgos de la DMO es baja y desaparece cuando se ajusta por otras causas de osteopenia39. Tampoco existen datos consistentes en cuanto a la relación entre niveles elevados de FGF23 y riesgo de fracturas; mostrando datos discordantes, unos a favor40 y otras en contra41.
Rupp et al. han demostrado que en pacientes con osteoporosis, los niveles más altos de FGF23 se asocian con una microarquitectura ósea trabecular deficiente42, pero no han podido probar que la concentración de FGF23 en suero sea un marcador de fractura en estos pacientes.
La activación de la vía Wnt es esencial para la mineralización ósea normal43. El aumento de P sérico, PTH y FGF23 se asocia a elevaciones de esclerostina y Dickkopf 1 (Dkk1)44, dos inhibidores potentes de la vía Wnt/β-catenina, que serían responsables de un déficit de mineralización. Estudios experimentales realizados en ratas urémicas, demostraron que un elevado contenido en fósforo producía defectos de mineralización secundarios a la inhibición de Wnt. En este estudio FGF23 inhibió directamente la vía osteoblástica de Wnt a través de un proceso mediado por Klotho/MAPK soluble que requirió la inducción de Dkk1, demostrando que la inducción de Dkk1 por FGF23/Klotho soluble en osteoblastos inactiva la señalización de Wnt/β-catenina y puede tener un importante impacto en el desarrollo de pérdida del contenido mineral del hueso en el paciente renal45.
En conclusión, el efecto directo del FGF23 sobre el contenido mineral óseo y el riesgo de fracturas arroja datos contradictorios en los diferentes estudios clínicos analizados, sin embargo, en estudios experimentales se ha demostrado el papel directo de FGF23 en la inhibición de la vía osteoblástica de Wnt lo que condicionaría una perdida de mineralización ósea, a través del cual FGF23 podría ser partícipe del incremento de fracturas observado en los pacientes renales. Se necesitan más estudios que avalen este hecho.
PTH y fracturasComo hemos visto, la dificultad para eliminar el P por el riñón con ERC produce un aumento del FGF23, y este a su vez, reduce la vitamina D y aumenta la PTH18. Estas alteraciones ocurren de forma muy precoz, con filtrados de 60 mL/min/1,73m246. La PTH (junto a la fosfatasa alcalina) es la molécula que representa de una mejor manera la histomorfometría ósea. Tanto valores bajos como altos de PTH alteran el recambio óseo y aumentan el riesgo de fractura47-49. Los valores altos de PTH se correlacionan con pérdida de hueso cortical incrementando el riesgo de fractura, especialmente en pacientes en hemodiálisis (HD) del sexo femenino50.
La PTH alta, en presencia de P sérico alto o normal, tiene un efecto catabólico en el hueso51, se asocia con una pérdida de hueso cortical en lugar del trabecular y produce una microarquitectura ósea alterada. Además, contribuye al inicio y la progresión de la calcificación vascular en ratas urémicas34,52. Sin embargo, en presencia de una ingesta elevada de P, una PTH baja, atenua el deterioro del hueso cortical53.
Vitamina D y fracturasLa vitamina D es una hormona con un papel decisivo en la formación del hueso y en mantener el CMO. La 25-OH vitamina D o calcidiol sérico es la molécula que informa sobre los depósitos de la vitamina D, aunque solo es una de las diferentes moléculas que forman la cadena de activación de esa hormona. No es bien conocido cuáles deben de ser los valores de calcidiol sérico necesarios para reducir las fracturas54. Existen evidencias del CMO del paciente con ERC según los niveles de vitamina D. El nivel óptimo de 25-OHD sobre el turnover óseo parece estar entre 20 a 40 ng/mL. Los niveles del metabolito D por debajo de 20 ng/mL produce un defecto de mineralización y formación de hueso y niveles superiores a 40 ng/mL desencadenan una reducción del recambio óseo55 aunque no estudiaron su implicación en las fracturas. En realidad, pocos estudios han analizado la relación entre niveles bajos de calcidiol y fracturas, y los que lo han hecho encuentran que los niveles bajos incrementan este riesgo56. En un metaanálisis no se encuentra beneficio en suplementar con vitamina D para reducir las fracturas en pacientes con ERC57, aunque este también es un tema muy debatido para la población general.
Un estudio reciente muestra un incremento de fracturas por estrés asociado a bajas concentraciones de vitamina D en suero en población normal58.
Captores del fósforo y reducción de fracturasDesde hace años se conoce que los captores del P sin calcio mejoran el remodelado óseo en modelos animales, estimulando su formación59. El carbonato de lantano y el sevelámer mejoran el contenido mineral óseo en pacientes en diálisis con hueso adinámico, probablemente por la disminución de aporte de calcio y el consiguiente aumento de los niveles de PTH. Es probable que otros quelantes (p. ej. basados en hierro) puedan tener el mismo efecto, siempre y cuando no se produzca un acúmulo sistémico indeseado de hierro. Los pacientes con ERC moderada tratados con cualquier captor mejoran el contenido mineral óseo comparado con los no tratados60. Sin embargo, sigue existiendo incertidumbre respecto la repercusión real de los captores del fósforo en relación con las fracturas debido a la escasez de estudios controlados de captores del fósforo con placebo que incluyan este ítem puesto que el objetivo de las investigaciones se ha centrado fundamentalmente en demostrar la reducción de la calcificación vascular y la mortalidad cardiovascular61-63. Sin embargo, estudios recientes han demostrado que el riesgo de fractura en los pacientes con ERC y en diálisis que no estaban tomando captores del fósforo era 20% mayor en comparación con los pacientes que los tomaban64.
ConclusionesEl paciente con enfermedad renal tiene incrementado el riesgo de fracturas. Los mecanismos responsables son los habituales en la población general más los asociados a la uremia, aunque el diagnóstico de lesiones óseas responsables de las mismas continúa siendo un tema pendiente. El fósforo sérico parece correlacionarse con el riesgo de fractura y es conocido cómo los mecanismos adaptativos a la hiperfosfatemia y el incremento de la absorción de P tienen una estrecha relación con las fracturas. El aumento del FGF23 y PTH y el descenso de la vitamina D son responsables de ocasionar fragilidad ósea y aumentar las fracturas, al igual que la esclerostina secretada por el hueso. En ausencia de estudios que analicen adecuadamente la influencia de diversos tratamientos sobre el aumento del riesgo de fracturas en pacientes con ERC, sugerimos que el control del fósforo debería ser un objetivo a tener en cuenta.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses en el presente artículo.