Diversos estudios han estimado que entre el 30% y el 40% de los pacientes no reciben una asistencia sanitaria acorde con la mejor evidencia científica actual, mientras que, por otra parte, alrededor del 20% de la atención sanitaria prestada es innecesaria e, incluso, potencialmente peligrosa1. Esta discordancia entre la mejor evidencia científica de la que se dispone y la asistencia efectivamente dispensada constituye uno de las observaciones más consistentes y repetidas de los sistemas sanitarios, y también se ha detectado en el ámbito de la nefrología2. Las guías clínicas se convierten a partir de la década de 1990 en un instrumento útil para acercar entre sí, en lo posible, la evidencia científica de la que se dispone y la atención sanitaria efectivamente administrada. Su objetivo era sintetizar el conocimiento científico y facilitar su difusión entre los profesionales sanitarios. Esta revisión pretende analizar la contribución de las guías clínicas a la mejora de los resultados asistenciales, así como comentar sus principales limitaciones.
CONSIDERACIONES SOBRE LAS GUÍAS CLÍNICAS
No es el objetivo de esta revisión realizar un análisis exhaustivo sobre el proceso de elaboración de las guías clínicas. Sin embargo, ciertas consideraciones pueden contribuir a situarlas en su contexto y a explicar sus limitaciones. Las primeras guías clínicas en nefrología nacen de la mano de la National Kidney Foundation (NKF) mediante la publicación en 1997 de la Dialysis Outcomes Quality Initiative (DOQI). Sin duda, su aparición tuvo una importantísima repercusión en la comunidad nefrológica y sentó las bases de una nueva forma de entender la actividad nefrológica mediante la definición de medidas de resultado clínico (clinical performance measures). No obstante, pronto se hizo evidente que el cuidado de los enfermos renales debía comenzar mucho antes del inicio del tratamiento sustitutivo, y ello condujo a la aparición de unas nuevas guías, Kidney Disease Outcomes Quality Initiative (K/DOQI), publicadas en 2002, que definían y abordaban medidas de resultado clínico en los distintos estadios de la enfermedad renal. Posteriormente, se desarrollaron múltiples guías vinculadas a Sociedades nefrológicas nacionales (Reino Unido, Canadá, España y otros países) y continentales, como las guías europeas (ERA-EDTA), que contribuyeron a una cierta redundancia de recomendaciones, no necesariamente coincidentes. Finalmente, surgió la necesidad de realizar un enfoque más racional, uniforme y global que aunase los esfuerzos intelectuales y económicos de las múltiples Sociedades y que permitiera la universalización de las guías, lo que desembocó en una nueva iniciativa, Kidney Disease: Improving Global Outcomes (KDIGO)3. Desde la formulación de las preguntas que las guías pretenden responder hasta su publicación, éstas deben superar numerosos obstáculos. Su proceso de elaboración es complejo y costoso, debe implicar a un amplio equipo multidisciplinario, sintetizar la evidencia científica, pronunciarse sobre cuestiones con elevada incertidumbre y variabilidad de la práctica clínica, lidiar con diversos conflictos de intereses y considerar las repercusiones económicas y organizativas de sus recomendaciones. Finalmente, deben resultar científicamente acertadas y creíbles para la comunidad nefrológica4. Con el objetivo de homogeneizar este proceso se ha desarrollado un instrumento de validación internacional de guías clínicas óptimas (The AGREE Project)5. Sin embargo, a pesar de todo, ¿cuál es la evidencia disponible de que las guías clínicas actúan como un instrumento modificador efectivo de la práctica clínica de los profesionales?
EVIDENCIA SOBRE LA CONTRIBUCIÓN DE LAS GUÍAS A LA MEJORA DE LOS RESULTADOS
El estudio de Gleicher, proveniente del ámbito de la obstetricia y publicado en 1984, inició una nueva época en la investigación de la difusión del conocimiento científico. Constató por primera vez que, tras las recomendaciones en 1980 para la realización de cesáreas, su número continuó creciendo de manera ininterrumpida durante los años siguientes, a pesar de que dicha recomendación advertía de una utilización excesiva de dicho procedimiento6. Ese mismo año el Joint National Committee III Report (JNC III) publicó las guías para la detección, evaluación y tratamiento de la hipertensión arterial. La publicación se acompañó de un análisis sobre la modificación de la actitud de ciertas especialidades médicas (atención primaria, medicina interna, cardiología y nefrología) ante el paciente hipertenso, realizado previamente y un año después de la difusión de las recomendaciones. Según dicho análisis, el 62% de los médicos encuestados era consciente de la existencia de las recomendaciones; de los que las conocían, el 35% nunca las utilizaba y el 21% sólo lo hacía rara vez. La conclusión fue que el JNC III no parecía modificar de forma significativa el comportamiento de los médicos encuestados7. Una década después, el estudio de la difusión del conocimiento médico se había consolidado como una nueva disciplina. Una extensa revisión con el expresivo título de «¿Por qué los médicos no siguen las guías de práctica clínica?» recopiló y analizó los estudios más significativos realizados hasta aquel momento. Sus resultados detectaron la existencia de una falta de conciencia sobre las recomendaciones de las principales Sociedades y organismos competentes en el 54,5% de los médicos. En los estudios en los que se investigaba la ausencia de familiaridad con la guía, ésta apareció en el 56,5% de los encuestados. Además, en 41 de las 43 guías estudiadas (95%) al menos el 10% de los encuestados estuvo en desacuerdo con las recomendaciones establecidas, bien por considerarlas excesivamente simplistas, por reducir la autonomía del médico o el paciente, por carecer de aplicabilidad, por presentar una escasa flexibilidad, por manifestar ausencia de credibilidad en los autores o bien por considerar que deterioraban la relación médico-paciente8. El NICE (National Institute of Clinical Excellence) realiza, en el Reino Unido, continuas recomendaciones remitidas por vía postal sobre la utilización de ciertos fármacos y tecnologías sanitarias. Mediante un estudio descriptivo evaluó el cumplimiento de sus recomendaciones sobre la utilización de ciertos medicamentos (inhibidores de la bomba de protones, rosiglitazona, orlistat, zanamivir e inhibidores de la COX-2). El estudio incluyó a 98 médicos de atención primaria, 6 meses antes de difundir la recomendación en 2001 y entre 6 y 12 meses después de ésta. La conclusión fue que la modificación del patrón de prescripción tras las recomendaciones del NICE fue, en general, pequeña. Es más, la recomendación concreta sobre el uso de zanamivir no sólo fue universalmente rechazada, sino que también se consideró que pudo causar una pérdida de credibilidad para el conjunto del Instituto9. Podría argumentarse que, durante la última década, las tecnologías de la información han modificado y mejorado (y sin duda lo han hecho) tanto el soporte como la velocidad de la difusión del conocimiento científico. Sin embargo, revisiones posteriores realizadas en el mismo entorno obtienen similares resultados y parecen indicar que la evidencia médica no es sistemáticamente implementada en la atención primaria británica10. En un reciente estudio realizado entre 30 médicos holandeses de atención primaria se observó que desconocían el contenido específico de 26 de 56 (46%) recomendaciones clave de diversas guías clínicas publicadas desde 2003. En el caso de alguna guía concreta, como la del infarto agudo de miocardio, dicho porcentaje de desconocimiento superaba el 75%. No obstante, la barrera más importante para la aplicación de las guías no era su desconocimiento, sino el desacuerdo con las recomendaciones clave, esgrimida por un porcentaje superior al 50% de los médicos11. Grol y Grimshaw realizaron una exhaustiva revisión y análisis sobre la influencia que ejercían diversas estrategias en la mejora de la práctica clínica. Para el conjunto de los estudios clínicos aleatorizados revisados, se estimó que sólo el 8% de la mejora observada en los resultados clínicos era atribuible a la utilización de las guías clínicas1. En el ámbito específico de la nefrología son escasos los estudios realizados para evaluar la utilización de las guías clínicas. El primero de ellos fue realizado por Ramsay et al. en 2000. El estudio analizó, en seis centros de nefrología pertenecientes a diversos países europeos, el cumplimiento (si se hacía efectivamente lo que la guía recomendaba) tras la introducción de una guía específica para el tratamiento de la anemia y la enfermedad ósea en diálisis y del citomegalovirus en el trasplante renal. Aleatoriamente, la guía se aplicó en cuatro centros y los dos restantes se emplearon como controles. Se recogieron variables de resultado clínico cada trimestre, desde el año previo a la implantación de la guía hasta 9 meses después de ésta. En los resultados se observó un incremento del 11% en la frecuencia de la monitorización en el grupo de centros con guía clínica y un descenso del 5% en los centros sin guía (controles). Sin embargo, no hubo diferencias en relación con el cumplimiento de la guía entre centros controles y centros con guía (–4%; IC 95%, de –9 a +1%). Tampoco se detectaron diferencias en cuanto a los resultados clínicos considerados (–7%; IC 95%, de –14 a +1%). Es decir, una mejor monitorización de las variables no implicaba un mayor cumplimiento de las guías ni tampoco unos mejores resultados12. En uno de los pocos estudios diseñados para abordar específicamente la evaluación de la utilización de las guías clínicas, Irving estudió el cumplimiento de las Caring for Australasians with Renal Impairment (CARI) Guidelines de 2000. Se consideraron diversas variables clínicas en relación con la anemia y el manejo del hierro. Se escogieron estos aspectos por su relevancia en las unidades de hemodiálisis, por estar sustentados por un alto grado de evidencia y por analizar medidas fácilmente accesibles de resultado clínico (hemoglobina y ferritina). Se incluyeron seis unidades de hemodiálisis que sumaban un total de 1.763 pacientes evaluadas en 2004. En relación con la hemoglobina, a pesar de la existencia, difusión y fácil accesibilidad de las guías clínicas, se observaron diferencias significativas entre las distintas unidades de diálisis, pero no entre el conjunto de éstas y el resto de la población de diálisis australiana. En cuanto a la ferritina, se detectaron diferencias entre las distintas unidades de diálisis, y también entre el conjunto de éstas y el resto de la población de diálisis australiana. El porcentaje de pacientes con ferritina en el rango óptimo osciló entre el 60% en una unidad y el 26% en otra. La difusión de las guías fue considerada un paso insuficiente para lograr unos resultados homogéneos entre los distintos centros de diálisis. También se analizaron las causas por las que los nefrólogos no siguieron las guías clínicas, y se detectaron ciertas barreras para su implantación efectiva: falta de conciencia sobre la guía, escaso conocimiento de ésta, ausencia de credibilidad e insuficiente habilidad de los médicos para su puesta en marcha13. Otros trabajos enfocan el problema de una forma más indirecta al estudiar la variabilidad de los resultados entre diversos centros que supuestamente utilizan guías clínicas iguales o similares, o bien la modificación de los resultados tras la introducción de una guía. En algunos trabajos los datos se obtienen específicamente para el estudio14-18 y en otros la fuente de datos está constituida por diversos registros19. El denominador común de estos estudios es la importante variabilidad que se detecta en los resultados entre distintos centros, dentro de un mismo país y entre centros pertenecientes a países diferentes, así como el limitado impacto de las guías sobre las medidas de resultado clínico.
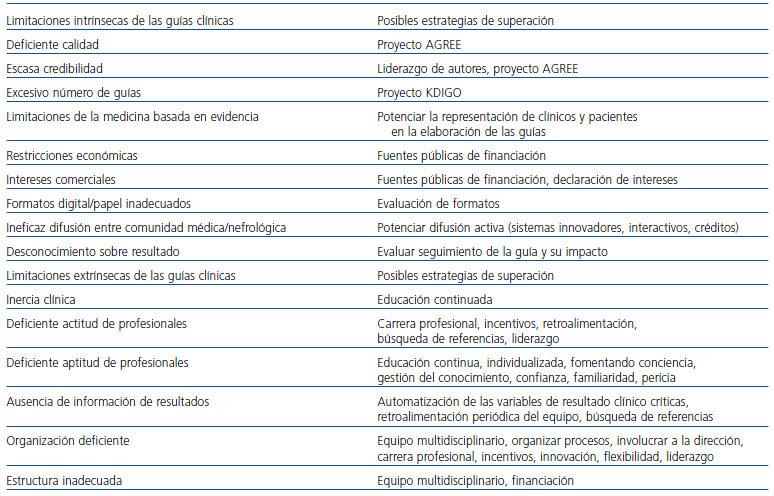
LIMITACIONES INTRÍNSECAS DE LAS GUÍAS CLÍNICAS
Ciertamente, sería ingenuo pensar que la simple elaboración y difusión de una guía clínica constituye un instrumento suficiente como para inducir una mejora sustancial en los resultados y anular la variabilidad existente entre centros. Las guías clínicas presentan importantes limitaciones atribuibles, en primer lugar, a la propia guía clínica (limitaciones intrínsecas) y, en segundo lugar, a la dificultad que conlleva su puesta en funcionamiento e incorporación a la rutina de trabajo de un centro concreto (limitaciones extrínsecas) (tabla 1). Entre las limitaciones intrínsecas que se han esgrimido en alguna ocasión y que pueden reducir la eficacia o desincentivar la utilización de la guía clínica se encuentran las siguientes: deficiente calidad, formatos inadecuados, insuficiente credibilidad, excesivo número de guías y otras razones diversas. Los equipos responsables de la elaboración de las guías clínicas, con independencia de consideraciones humanas, pueden carecer del tiempo, de los recursos y de las habilidades necesarias para establecer con nitidez la difícil frontera entre la evidencia científica y la incertidumbre. Incluso, aunque la evidencia quede bien definida, su traducción a una recomendación siempre es tará sujeta a valoraciones subjetivas20,21. Por otra parte, lo que es correcto en el ámbito poblacional puede no serlo en el ámbito individual. La existencia de múltiples guías que abordan una misma cuestión, si entran en contradicción o incluso si presentan pequeñas discrepancias, puede generar confusión y falta de credibilidad20. La iniciativa enfocada a unificar las múltiples recomendaciones de manera global, Kidney Disease: Improving Global Outcomes (KDIGO), puede constituir una solución al presente, y creciente, problema3. Las características del formato elegido para difusión de la guía no constituyen un aspecto irrelevante de ésta. Las guías deben ser cuidadosamente diseñadas para estimular su uso efectivo en el día a día. Existe un cierto consenso en el sentido de que deben promover un enfoque dirigido a «médicos clínicos» y evitar una perspectiva enfocada a «científicos» que no interactúan de forma directa con el paciente, es decir, deben ser orientadas claramente hacia el usuario final. Para lograr este objetivo, puede resultar de utilidad que incorporen sencillos algoritmos y otros recursos de ayuda para el clínico, preferiblemente en un formato accesible y manejable, pero a menudo sucede que estos elementos facilitadores no han sido probados en la práctica y su eficacia real no deja de ser una hipótesis que debería ser sometida al escrutinio del análisis científico22. Por otra parte, los valores y las preferencias de los pacientes no siempre están lo suficientemente representados por el equipo responsable de la elaboración de las guías. Así, aunque la medicina basada en la evidencia apela de manera continua a la mejora de los cuidados del paciente como objetivo principal, los métodos que emplea para definir y medir estos resultados clínicos provienen y continúan estando básicamente en manos de los especialistas. Pacientes y médicos poseen sus propias creencias y expectativas, y éstas no siempre se adaptan fácilmente al modelo de racionalidad asumido por la medicina basada en la evidencia23. Por ejemplo, pensando como pacientes y no como nefrólogos, ante una estenosis significativa de la arteria renal completamente asintomática, ¿cuántos (insistimos, como pacientes y no como nefrólogos) estimaríamos el tratamiento percutáneo de revascularización de la arteria renal, como considera la American Heart Association en sus recomendaciones de 2005?24. La prevalencia de un enfoque de arriba-abajo (científico-clínico- paciente), en lugar de un enfoque complementario e integrador, que promueva una toma de decisiones compartida, ha sido una de las limitaciones clásicamente reconocidas de la medicina basada en la evidencia25. Episodios como el acontecido con la publicación de las guías de la Kidney Disease Outcomes Quality Initiative (K/DOQI) de la National Kidney Foundation de mayo de 200626 claramente relatados en la revista NEFROLOGIA, sin duda merman en cierto grado la necesaria credibilidad de las guías. En efecto, éstas recomendaron como objetivo de hemoglobina el intervalo entre 11 y 13 g/dl, en contra de la versión previa del mismo organismo y de la recomendación vigente de la Food and Drug Administration, que se encontraba entre 11 y 12 g/dl, y ello a pesar de disponer en ese momento de la información que hacía aconsejable no modificar el rango, lo que permitía sospechar que la recomendación estaba presuntamente motivada por un interés comercial27. La ausencia de credibilidad de las guías ha sido identificada como una barrera para su aplicación en numerosos estudios. Una financiación de las guías clínicas independiente de la industria médica sin duda serviría para robustecer su credibilidad. La elaboración de una guía clínica debe prestar también especial atención a su acogida e implantación y al análisis del impacto que tiene sobre el comportamiento médico presente y sobre los resultados; una elaboración al margen de este enfoque puede constituir un ejercicio ciertamente estéril. También, las guías deben mantenerse siempre actualizadas, y ello conlleva un importante esfuerzo humano, institucional y económico que no siempre es fácil de satisfacer28. Un reciente estudio ha evaluado la opinión entre nefrólogos australianos y neozelandeses y su evolución en el tiempo sobre las Caring for Australasians with Renal Impairment (CARI) Guidelines. En 2002 y 2006 se realizaron sendas encuestas en las cuales el 40 y el 60%, respectivamente, se manifestaron de acuerdo con la afirmación de que las guías habían influido de forma significativa en su práctica. También el 14 y el 38%, respectivamente, afirmaron que las guías habían mejorado los resultados de los pacientes con enfermedad renal. Por tanto, parece observarse una actitud progresivamente más favorable hacia las guías con el transcurso del tiempo. No obstante, el tránsito desde la difusión del conocimiento médico hasta su implementación efectiva es lento y complejo, y todavía insuficientemente comprendido29. Algunas de estas limitaciones pueden ser soslayadas, al menos parcialmente, cuando la elaboración de la guía se somete a un riguroso procedimiento metodológico5.
LIMITACIONES DE LAS GUÍAS CLÍNICAS: MÁS ALLÁ DE ÉSTAS
Las limitaciones intrínsecas de las guías clínicas no son menores que las que se presentan en el entorno en el que deben aplicarse. En este ámbito aparecen diversas restricciones que dependen de la propia recomendación (como la inercia clínica), de las restricciones individuales del clínico (actitud y aptitud), de la organización (coordinación) y de las limitaciones materiales (recursos estructurales) que influyen de forma importante en el cumplimiento de las guías y en la consecución de los resultados. En primer lugar, la inercia clínica se ha invocado con frecuencia como una de las causas habituales de falta de seguimiento de las guías clínicas8. La inercia tiene que ver, sobre todo, con la existencia de prácticas clínicas, que a pesar de haberse comprobado que son eficaces, no se emplean, o a la inversa, prácticas que no siendo eficaces resultan difíciles de erradicar. La extendida utilización, todavía hoy día, de dosis bajas de dopamina en la insuficiencia renal aguda, a pesar de la ausencia de evidencia sobre su eficacia, constituye un buen ejemplo de la importancia que la inercia posee en la práctica clínica30. La guía clínica constituye frecuentemente una simple recomendación general, por ejemplo, «en la enfermedad renal crónica el objetivo de hemoglobina debería encontrarse generalmente en el rango entre 11 y 12 g/dl». La recomendación debe traducirse en un protocolo específico del centro que defina con detalle el comportamiento del clínico ante un problema concreto, siguiendo el ejemplo anterior: definir exactamente cuándo introducir, modificar (en qué dirección y cuantía) o suprimir los agentes estimulantes de la eritropoyesis. En este proceso intervienen múltiples elementos que pueden limitar potencialmente aún más la eficacia de la guía: la presunción de la entera racionalidad de los profesionales clínicos, la utilización de protocolos reactivos frente a los proactivos, el concepto de objetivo frente al de meta, el error humano y otros. Todos son elementos que distorsionan de forma potencial la trascendencia de la guía. La presunción equivocada de la entera racionalidad del ser humano y de su capacidad para decidir y diseñar procesos complejos ha sido invocada como fuente de aleatoriedad en numerosas áreas del conocimiento21,31. La nefrología no permanece al margen de esta circunstancia. No conocemos estudios enfocados a intentar calcular el impacto que este tipo de limitaciones podrían tener y que no deberíamos subestimar, porque pueden estar afectando a aspectos clave de los resultados, como es el modelo de formación continuada que individual y racionalmente escogemos de acuerdo con nuestras necesidades y posibilidades. La «reactividad» del protocolo empleado puede resultar importante a la hora de determinar sus resultados. Irving, en el estudio realizado en Australia, mencionado anteriormente, sobre la implantación de las guías CARI en seis centros de diálisis, analizó los protocolos para la administración del hierro i.v. e identificó como «protocolos reactivos» los utilizados en tres de esos centros, en lugar de los «proactivos » usados por los tres restantes. Parece que ser un protocolo proactivo es superior para mantener los depósitos de hierro en el rango óptimo de forma mantenida y estable, en lugar del protocolo reactivo, que intensifica de forma exagerada la administración de hierro cuando éste se encuentra fuera del rango definido o excesivamente cerca de éste13. Los conceptos de protocolo proactivo frente al reactivo están íntimamente relacionados con los de objetivo frente a meta («target vs goal»). En el primer caso, el objetivo, que vendría a significar el valor o rango que se pretende, se comportaría como una variable dicotómica (objetivo cumplido o no cumplido). En el segundo caso, la meta tendría que ver más con el sentido de la dirección, la velocidad de movimiento del resultado y su proximidad a los límites (no preocupa tanto el objetivo deseado, sino su evolución, favorable o no favorable, y su cercanía al límite). Ambos definirían cuándo es necesario realizar una intervención (p. ej., aumentar o disminuir la dosis de hierro intravenoso) o no hacerla, y la identificación de unos límites estandarizados, escalonados, que cuantifiquen la magnitud de la intervención, incluso dentro del rango de la misma meta, que sirva de ayuda a la decisión terapéutica para conseguir, en primer lugar, y mantener, después, el objetivo deseado. Estos conceptos con frecuencia no están contenidos en la guía clínica, pero sí lo están, implícita o explícitamente, en el protocolo de actuación22. Otra interesante cuestión, poco estudiada, es el comportamiento incierto, difícilmente predecible, que tienen los clínicos bajo ciertas condiciones, como por ejemplo cuando se mueven muy cerca del objetivo deseado o en función de los valores de partida que presentaba el paciente. Así, el 34% de los médicos de atención primaria suizos estudiados en el RIAT (Reasons for not Intensiying Antihypertensive Treatment) decidieron no intensificar el tratamiento antihipertensivo, aun cuando los resultados estaban por encima del objetivo, si éste ya «casi» se había alcanzado o si se había producido lo que denominaron una «clara» mejoría respecto a la situación de partida32. Esta actitud parece traducir la existencia de un cierto conformismo o conservadurismo cuando ya se ha alcanzado una reducción «suficiente» del riesgo. Las limitaciones de las guías clínicas también pueden depender de la población hacia la que van dirigidas. Los usuarios de la guías en general se enfrentan con poblaciones que son más heterogéneas y complejas que las que se incluyeron en los artículos originales y que permitieron la elaboración de las propias guías. Los pacientes pueden presentar numerosas características particulares que no se encuentran contempladas en las guías21. Otra limitación bien reconocida para mantener el cumplimiento de las guías es la aptitud de los profesionales. La obtención de unos resultados clínicos satisfactorios en un área clínica concreta supone, desde la perspectiva de la aptitud, la superación de ciertas barreras por parte del clínico: conciencia sobre la importancia del problema, conocimiento sobre su manejo, confianza en su propia capacidad y en la de su equipo, familiaridad con las herramientas a su alcance, pericia para hacer, y un adecuado y sistemático análisis de los resultados clínicos obtenidos. Frecuentemente se aduce sensación de incapacidad por parte de los profesionales para mantenerse actualizado en las diferentes materias que les competen, bien por escasez de tiempo o bien por falta de preparación u otros motivos33. No puede pasarse por alto el hecho de que la motivación del nefrólogo y del equipo profesional en el que está integrado es otro aspecto muy relevante para explicar el seguimiento de las guías clínicas y también los resultados obtenidos por la unidad. Por desgracia, son pocos los estudios que han abordado este aspecto, y menos los que lo han hecho específicamente en nuestro medio. En un análisis del síndrome de desgaste profesional entre médicos españoles (internistas, intensivistas, traumatólogos, oncólogos y radiólogos) se encontró que el 16% presentaban un alto cansancio emocional (pérdida de recursos emocionales para enfrentarse al trabajo), el 50% reconocía un alto de grado de despersonalización (presencia de actitudes negativas y cinismo hacia los pacientes) y el 41% manifestaba un bajo logro personal (tendencia a evaluar negativamente su propio trabajo con apreciación de escasa autoestima profesional)34. No podemos extrapolar estos resultados al ámbito de la nefrología, pero tampoco parecería razonable suponer que los nefrólogos somos en esto diferentes. El impacto negativo que podrían tener los datos mencionados sobre la motivación de los médicos y sobre sus resultados clínicos, hasta donde sabemos, no ha sido estudiado. El seguimiento de las guías clínicas también puede verse mermado cuando su implantación exija la puesta en marcha de cambios organizativos. En general, inducir un cambio en el comportamiento del clínico parece tanto más difícil cuanto mayor sea la innovación que se pretenda acometer, sobre todo si ésta conlleva complejos cambios técnicos y muy especialmente si precisa de una mejor colaboración entre distintas disciplinas1. Los nefrólogos tenemos presente este problema al pensar en la dificultad que supone mantener los estándares de las guías en relación con diversos aspectos de nuestra especialidad como, por ejemplo, alcanzar en nuestro centro de diálisis el porcentaje de fístulas autólogas que presentan los centros con mejores resultados35. Finalmente, a pesar de la existencia de las guías y de su conocimiento, la posibilidad del error siempre está presente en toda decisión y acto humano. Sus consecuencias sobre los pacientes han sido descritas y constituyen en la actualidad motivo de preocupación y estudio36,37.
ESTRATEGIAS DE MEJORA
La diseminación del conocimiento médico ha descansado mayoritariamente en la publicación de revistas científicas y en programas de educación médica continuada. Sin embargo, la eficacia y los resultados obtenidos por estas actuaciones han sido muy cuestionados38,39. Además, por desgracia, también la mayoría del conocimiento del que se dispone sobre la eficacia de las diversas estrategias para lograr mejores resultados modificando el comportamiento y las habilidades de los clínicos no provienen de estudios prospectivos, sino fundamentalmente de estudios observacionales y de la reflexión teórica. Sin embargo, parece que la utilización de ciertas estrategias de mejora es capaz de inducir una modificación positiva de los resultados clínicos. En una revisión realizada por Grimshaw se observó que en el 85% de los estudios analizados se obtuvo una mejoría de los indicadores clínicos contemplados, que fue cuantificada aproximadamente en el 10% del valor absoluto del indicador40. Aunque estos hallazgos son modestos, cuando se consideran desde una perspectiva poblacional pueden resultar clínicamente relevantes. Por otra parte, estos resultados podrían verse afectados por un potencial sesgo de publicación. Las estrategias existentes para trasladar la evidencia clínica disponible a los resultados clínicos son muy diversas, y entre ellas, la disponibilidad de guías clínicas apropiadas supone un paso necesario, pero insuficiente. Desde una perspectiva teleológica, la identificación de potenciales barreras que impiden la obtención de resultados óptimos en un entorno concreto debería constituir la primera aproximación al problema. Para ello, podría ser de ayuda la utilización de ciertos instrumentos definidos que complementen la información obtenida mediante la observación informal: estudio de casos, tormentas de ideas, grupos de enfoque, técnicas de grupo nominal, técnicas Delphi y otras41. Desgraciadamente, la influencia que el conocimiento y la aplicación que estas herramientas de mejora tiene sobre los resultados clínicos no ha sido suficientemente evaluada, por lo que no puede afirmarse con rigor científico que sean capaces de inducir un efecto beneficioso42. La elaboración de un plan de actuación multifacético que incida sobre cada una de las barreras identificadas sería el siguiente paso a transitar. La retroalimentación o «feedback » (conocer los resultados obtenidos por nuestro centro) y la búsqueda de referencias o «benchmarking» (valorar los resultados propios en relación con los logrados por otros centros similares) constituyen elementos básicos sobre los que descansa la mayor parte de los procesos de mejora. Las herramientas mencionadas han demostrado en general ser eficaces y pueden constituir un potente instrumento de información y motivación cuando se utilizan en los procesos adecuados. Sin embargo, la eficiencia de la retroalimentación y la búsqueda de referencias, es decir, los resultados que obtienen en relación con los costes que conllevan, parece menos clara43,44. Las limitaciones de estas herramientas son diversas, pero resaltaremos fundamentalmente dos. En primer lugar, no todas las actividades pueden incluirse en un programa de estas características; por ejemplo, en el ámbito de la nefrología pueden implantarse en hemodiálisis, diálisis peritoneal, trasplante renal y posiblemente hipertensión arterial. Su utilización generalizada en el ámbito de la nefrología clínica no será fácil, debido a la heterogeneidad de la patología que abarca. En segundo lugar, existe un problema de índole pragmática y tecnológica: debería resolverse cómo incorporar la recogida de resultados clínicos de forma automatizada (historia clínica electrónica), sin que ello suponga un incremento más de la carga de trabajo del médico. La clave para su implantación y difusión podría residir en su utilización en determinados procesos muy seleccionados y con sistemas automatizados de recogida de indicadores que no incrementen los costes de transacción del sistema. Resulta sorprendente la atomización actual de los sistemas de información de resultados clínicos y también la ausencia de una tecnología compartida que permita un uso eficiente de las economías de escala45. Afortunadamente ha surgido una iniciativa con el respaldo de la Comisión Europea y la European Renal Association-European Dialysis and Transplant Association (ERA-EDTA), con el objetivo de remediar este problema que pensamos que merece todo apoyo y a la que deseamos un exitoso futuro46. Otro de los aspectos que parece confirmarse mediante estudios observacionales es que los planes de mejora disponen de más posibilidades de conseguir el objetivo deseado cuando presentan un enfoque multifacético, es decir, cuando inciden simultáneamente sobre diversas barreras, por ejemplo, ausencia de protocolos específicos, de recogida sistemática de indicadores, de análisis de los resultados clínicos propios, de análisis comparativo con otros centros, de objetivos concretos y otras1,21,47,48. Sin duda son muchas las estrategias de mejora que se están evaluando en la actualidad, y no es objeto de esta revisión el análisis de sus características ni de su eficacia, sino simplemente perfilar una visión global que nos permita entender cuál es el papel de las guías clínicas en el complejo contexto para el que han sido diseñadas y en el que deben operar. En conclusión, las guías clínicas constituyen un elemento que puede resultar eficaz para inducir una mejora de los resultados clínicos. Sin embargo, también parece que su mera existencia e incluso su cumplimiento incondicional no es suficiente para producir el efecto deseado, ya que se necesitan, además, una cuidadosa implantación local, un estrecho seguimiento y una evaluación periódica de los resultados, así como, quizá, complementar su utilización con el uso de otras estrategias de mejora. En definitiva, el objetivo de lograr resultados óptimos excede con creces, por su propia complejidad, la capacidad de las guías clínicas para generarlos.
Tabla 1. Limitaciones de las guías clínicas y sus posibles estrategias de superación