Las tubulopatías primarias son enfermedades raras. La mayoría de ellas tienen una herencia autosómica recesiva. La posibilidad de disponer, en la actualidad, de las técnicas de biología molecular ha permitido conocer la causa íntima genética de estas enfermedades y descubrir que esos trastornos son más frecuentes en los territorios en los que en el pasado existió un mayor o menor grado de consanguinidad. Por otra parte, los desplazamientos poblacionales que son tan antiguos como la humanidad, son la causa de la difusión de algunas enfermedades de origen genético. Su conocimiento, permite a los investigadores perseguir los pasos que han seguido determinadas mutaciones cromosómicas desde el lugar de origen del “ancestro fundador” hasta otros lugares radicados, muchas veces, en lugares del planeta muy distantes.
En el presente artículo, revisamos a partir de resultados propios y ajenos, algunos hallazgos disponibles sobre las bases moleculares de ciertas tubulopatias y de dos trastornos renales causantes de cálculos renales, en relación con la endogamia y los desplazamientos poblacionales.
La consanguinidadLas consecuencias de la endogamia son un componente esencial para la ciencia. Desde los guisantes de Mendel, numerosos hallazgos genéticos se han visto favorecidos por esta circunstancia. En el ámbito renal, los nefrólogos estamos familiarizados con el síndrome nefrótico congénito tipo finlandés causado por mutaciones en el gen que codifica la nefrina1. Fue descrito en los años 70 por nefrólogos de Finlandia2, país que cuenta con una de las mayores tasas de consanguinidad en el mundo3. Es importante conocer si se ha exagerado acerca del impacto de la endogamia en la salud humana. Es cierto que en un matrimonio entre primos hermanos se duplica el riesgo de una enfermedad recesiva (en torno al 5%) en comparación con padres no consanguíneos (2-3%)3. En la década de 1960, unos estudios realizados en poblaciones insulares de Japón no mostraron ninguna relación clara entre la endogamia y la salud en general3. Años después, se demostró que el retraso mental y puntuaciones más bajas en pruebas que miden el cociente intelectual4, eran más probables en matrimonios consanguíneos. Como describiremos a continuación, en la isla canaria de la Gomera se ha descrito una mayor frecuencia de dos causas de cálculos que debe estar en relación con la alta tasa de endogamia que existió en la isla, al menos, hasta el siglo XX. Así, la frecuencia de matrimonios entre primos hermanos pudo alcanzar hasta el 25,8%5.
La Gomera, la «isla de las piedras»Los hallazgos realizados en los últimos años en los habitantes actuales de la isla de La Gomera se han convertido en un paradigma de las vicisitudes médicas que pueden estar relacionadas con la consanguinidad aunque no todas ellas sean, probablemente, negativas. Se ha descrito, por un lado, una mayor frecuencia de una causa grave de litiasis y enfermedad renal crónica, la hiperoxaluria tipo 1 y, por otro, de una anomalía metabólica, la hipercalciuria idiopática que puede originar cálculos renales y pérdida de masa ósea en algunos casos.
La Gomera es una de las islas occidentales canarias y una de las más pequeñas. Su población actual supera levemente los 20.000 habitantes. La morfología insular es abrupta, con escarpadas montañas volcánicas, surcada radialmente por barrancos que surgen desde el centro de la isla, con lo que es difícil la comunicación entre las distintas zonas. Esa geografía especial motivó el desarrollo de una forma especial de lenguaje sonoro denominado «silbo gomero», de tal trascendencia que fue designado Patrimonio de la Humanidad en 2009.
Desde la última década del siglo pasado se había observado una mayor frecuencia de hiperoxaluria primaria tipo 1 en la población adulta de la isla de Tenerife6. Lo mismo se describió más tarde en la población pediátrica de la isla7. En 2003, miembros del Servicio de Nefrología del Hospital Universitario de Canarias identificaron la mutación c.853T>C (p.I244T) en la mayoría de los alelos del gen AGXT de pacientes con hiperoxaluria primaria tipo 1, muchos de los cuales tenían ancestros en la isla de La Gomera. Aunque la mutación p.I244T no afectaba la actividad de AGXT o su localización subcelular, cuando estaba presente el polimorfismo c.32C>T (p.P11L) en la misma molécula de la proteína, daba lugar a la pérdida de su actividad enzimática en extractos de células solubles8. Los resultados eran compatibles con un efecto fundador, es decir, originado en un antepasado común. La herencia de esta enfermedad es autosómica recesiva.
El caso de la hipercalciuria idiopática (HI) es diferente. No se considera una enfermedad sino una «anomalía metabólica» o, mejor, una característica constitutiva con la que los pacientes heredarían la disponibilidad de tener en sus células un mayor número de receptores de la vitamina D (VDR) que aquellas personas con calciurias normales. La fisiopatología de la HI ha sido resumida en un artículo reciente9.
En la década de los 90 del pasado siglo comprobamos que en la población pediátrica de la isla de La Gomera existía una frecuencia muy elevada de HI, una de las más altas del mundo (16% frente a 3,8% en el grupo control). La prevalencia en distintas poblaciones de la isla era distinta, pero más elevada en las más aisladas y peor comunicadas, lo que podría tener relación con una mayor frecuencia de endogamia que en las poblaciones mejor comunicadas10. La hipótesis que hemos formulado es que los niños de La Gomera con HI serían descendientes de los sujetos más capaces desde el punto de vista inmunológico11, es decir aquellos con más densidad de VDR, es decir, una forma de «selección natural». Por consiguiente, la insularidad y la alta tasa de consanguinidad asociada, no serían la causa sino la forma de perpetuar esas condiciones inmunológicas favorecedoras de los sujetos que sobrevivían. Más detalles al respecto se citan en artículo antes mencionado9.
Características de los pacientes afectos de algunas tubulopatías diagnosticadas en la isla de Tenerife (cistinosis, síndrome de Bartter tipo IV, hipomagnesemia familiar con hipercalciuria y nefrocalcinosis)La mayoría de los niños con tubulopatías diagnosticadas en los hospitales de Tenerife proceden de la isla de La Palma y de un área concreta del noroeste (NO) de la isla, lo que sugiere una elevada consanguinidad en esas zonas.
Hasta 2009 no se había diagnosticado ningún caso de cistinosis en Tenerife. La única paciente estudiada procede de la población de Icod de los Vinos radicada en la zona geográfica antes mencionada12.
En 1995, Landau et al. describieron cinco niños pertenecientes a una extensa familia beduina consanguínea que estaban afectos de síndrome de Bartter y sordera neurosensorial. Esta asociación se denominó síndrome de Bartter tipo IV13. El gen BSND codifica una proteína denominada «barttina» que se colocaliza con los canales de cloro-Ka (ClC-Ka) y canales de cloro-Kb (ClC-Kb) de las membranas basolaterales de la rama ascendente gruesa del asa de Henle y en las células de la stria vascularis del oído interno14.
En 2006, estudiamos en nuestro hospital dos familias de las que tres y dos miembros, respectivamente, fueron diagnosticados de síndrome de Bartter tipo IV. Ambas familias procedían de la misma zona geográfica del NO de la isla (Icod de los Vinos). En una de las dos familias, la abuela paterna de la madre de dos pacientes y la abuela paterna de la madre de un tercer paciente eran hermanas. Los miembros de ambas familias negaban que estuvieran relacionadas entre sí. El análisis de la secuencia del gen BSND mostró que todos los miembros afectos eran homocigotos para una transición C a T en el exón 1, mientras que sus padres eran heterocigotos. Esta alteración da como resultado una mutación de cambio desentido, c.139G>A (p.G47R), de la que previamente se había demostrado que elimina su efecto favorecedor sobre la subunidad barttina del canal ClC-Kb15.
La hipomagnesemia familiar con hipercalciuria y nefrocalcinosis (HFHN) es la única tubulopatía conocida en la que las proteínas anómalas funcionan en el espacio paracelular. En 1999, Simon et al. describieron la existencia de una proteína, la paracelina-1, que es necesaria para la reabsorción tubular paracelular de magnesio. Esta proteína está localizada en las zonas de unión estrechas (tight junction), es decir, las estructuras intercelulares que permiten un contacto íntimo entre las células epiteliales adyacentes. Esos autores establecieron que mutaciones en el gen PCLN-1 que codifica la paracelina-1, eran las causantes de la HFHN16. La nueva proteína pasó a denominarse, más tarde, claudina-16 (gen CLDN16). Más tarde, se observó que existían pacientes con HFHN que no tenían mutaciones en el gen CLDN16. Por otro lado, se había constatado que esta tubulopatía era muy frecuente en España. De hecho su nombre definitivo procede de una publicación realizada por Manuel Praga et al. en 199517. Cesar Loris, nefrólogo pediátrico del Hospital Infantil Universitario Miguel Servet de Zaragoza comprobó, junto con sus colaboradores, que en los pacientes españoles, la frecuencia de alteraciones oculares era inusitadamente elevada (81% frente a 24% en pacientes procedentes de otros países)18. En este sentido, fue llamativo el hecho de que los pacientes españoles con HFHN, excepto muy pocos, no tuvieran mutaciones en dicho gen19. En 2006, se resolvió la cuestión puesto que se identificaron otros pacientes con HFHN que eran portadores de mutaciones en el gen CLDN19, otro miembro de la familia multigénica de las claudinas. Esos niños padecían hipomagnesemia, enfermedad renal crónica (en muchos casos, precoz) y anomalías oculares graves20. Dos años después, Hou et al. demostraron que ambas claudinas actúan de forma sinérgica a través de una interacción heteromérica que establece el medio ambiente electrofisiológico necesario en las zonas de unión estrechas para obtener un mecanismo selectivo de la reabsorción de cationes en la rama gruesa ascendente del asa de Henle21. Como se verá más adelante, la mayoría de los pacientes españoles con HFHN son portadores de la misma mutación en el gen CLDN19. En cambio, solo conocemos la existencia de tres pacientes españoles con una mutación en el gen CLDN16. Uno de ellos, procede de otra población del NO de Tenerife (San José de los Llanos)22.
La acidosis tubular renal distal, el rey Carlos II y la ATRd tropicalDe Carlos II, último rey español de la dinastía española de los Habsburgo (1516-1700), se ha publicado que podría padecer enfermedades tan dispares como panhipopituitarismo y progeria, síndrome de Klinefelter, acromegalia o síndrome X frágil. Más seguro es que tuviera convulsiones y que contrajera paludismo. Contaba con una escasa musculatura y, hasta los seis años, no pudo andar ni tenerse prácticamente en pie. Tenía una gran cabeza, que se ha achacado a que padecía hidrocefalia. Sufrió crisis epilépticas que se exacerbaron hacia el final de su vida. Sobre su actividad en sus últimos años se escribió que «es tan grande su debilidad que no puede permanecer más de una o dos horas fuera de la cama. Cuando sube o baja de la carroza siempre hay que ayudarle»23. En 2009, Gonzalo Álvarez et al., de la Universidad de Santiago de Compostela, interesaron a la comunidad científica con sus conclusiones sobre las enfermedades que podría haber padecido el desdichado monarca. Esos autores calcularon que el coeficiente de endogamia (F) del rey era 0,254, es decir un nivel de endogamia mayor que lo que ocurriría al hijo de dos hermanos (F=0,25), lo que implica que más de la cuarta parte del ADN era idéntico en ambos alelos24. Por supuesto, ello era debido a la nefasta política de matrimonios consanguíneos propia de la dinastía reinante en España durante los siglos XVI y XVII. Álvarez y sus colaboradores comunicaron que Carlos II podría ser portador simultáneamente de dos trastornos genéticos determinados por alelos recesivos, a saber, una deficiencia combinada de hormona hipofisaria y una acidosis tubular renal distal (ATRd). Según esos autores, en Carlos II «su debilidad muscular a una edad temprana, el raquitismo, la hematuria y su cabeza grande en relación con el tamaño de su cuerpo» podrían atribuirse a este trastorno genético, la ATRd24. En la necropsia real se observó que «no tenía el cadáver ni una gota de sangre, el corazón aparece del tamaño de un grano de pimienta; los pulmones corroídos; los intestinos putrefactos y gangrenados; en el riñón tres grandes cálculos, un solo testículo, negro como el carbón, y la cabeza llena de agua». Por supuesto, que es muy difícil saber con certeza las dolencias reales, pero no parece probable que padeciera una ATRd. Es conocido que la hipopotasemia propia de esta enfermedad puede causar una tetraparesia, pero una hipotonía muscular crónica puede tener otras muchas causas como la distrofia muscular tipo Becker, por ejemplo. Es verdad que el rey era de talla baja23 pero en su historia clínica de la que se conserva muchos datos, no consta que tuviera una sintomatología característica de la ATRd que no habría pasado desapercibida a sus coetáneos, especialmente, los embajadores europeos que informaban cumplidamente de las dolencias reales a sus respectivos países. Nos referimos a la poliuria y polidipsia. Es verdad que tenía tres cálculos en la vejiga al fallecer (uno, en otra versión) pero, también, reveló lo mismo la necropsia realizada a su padre Felipe IV23. Por ello, es más probable que ambos tuvieran una hipercalciuria idiopática asociada o no a hipocitraturia que, como hemos recordado antes, está también relacionada con la consanguinidad. Se podría argüir que ambos, padre e hijo, podrían haber padecido la forma autosómica dominante de ATRd pero es muy improbable porque Felipe IV tenía una talla normal23, algo que es incompatible con una situación de acidosis metabólica crónica.
Pasando a otra cuestión, la ATRd causada por mutaciones en el gen SLC4A1 que codifica las isoformas propias de eritrocitos y riñón del intercambiador de aniones 1 (anion exchanger 1, AE1 o banda 3) tiene una alta prevalencia en algunos países tropicales, en particular Tailandia, Malasia, Filipinas y Papua Nueva Guinea. En este caso, la enfermedad es casi siempre recesiva y puede ser el resultado de mutaciones homocigotas o heterocigotas compuestas en el gen SLC4A1. Estas mutaciones pueden causar cambios morfológicos en los glóbulos rojos, a menudo con un exceso de hemólisis. En cambio, la ATRd «clásica» causada por mutaciones en el gen SLC4A1 es mucho más rara, casi siempre de herencia autosómica dominante25 y producida por mutaciones que son bastante diferentes de las encontradas en los trópicos.
Oliver M. Wrong (1925-2012) fue un gran nefrólogo inglés que dedicó gran parte de su vida al estudio del equilibrio ácido-base y sus trastornos26–28. En los últimos años de su vida se dedicó a intentar dilucidar la razón de la alta frecuencia de ATRd en el Sudeste asiático. Fruto de ello fue una publicación en la que se sugería la hipótesis de que los cambios en los hematíes causados por estas mutaciones podían proteger contra la malaria29. En efecto, desde mediados los años 70 del pasado siglo, la relación entre las variantes de eritrocitos humanos y la susceptibilidad a la infección por malaria ha sido objeto de un estudio clínico y epidemiológico intensivo que se ha prolongado durante varias décadas30. En 1981, se demostró que los hematíes ovalocitos de los melanesios que habitan en Papua Nueva Guinea son resistentes a la infección por parásitos de la malaria (Plasmodium falciparum). El análisis del comportamiento ante la deformación térmica demostró que los ovalocitos son más termoestables que los normocitos, lo que sugería que existe una diferencia importante en la estructura del citoesqueleto31.
El pueblo romaní y la enfermedad de GitelmanLos estudios de genética molecular han permitido distinguir claramente el síndrome de Bartter de una enfermedad con características similares, descrita en 1966 por Gitelman, Graham y Welt32. Estos autores publicaron los datos clínicos de tres pacientes adultos, dos de ellos hermanos, afectos de hipopotasemia, hipomagnesemia y alcalosis metabólica. Durante muchos años, los pacientes con estas características fueron diagnosticados erróneamente de síndrome de Bartter del adulto. La presencia de hiperreninemia e hiperaldosteronismo, contribuyó a la confusión con el síndrome de Bartter clásico. En 1996, se estableció que la enfermedad de Gitelman es producida por una alteración en el transporte de NaCl en el túbulo contorneado distal debido a la existencia de mutaciones en el gen SLC12A3 que codifica el cotransportador de NaCl sensible a tiazidas (thiazide-sensitive Na+-Cl−cotransporter, NCC), que se localiza en el lado luminal de las células del túbulo contorneado distal inicial33.
El pueblo romaní es una comunidad itinerante con una genética particular. Se cree que procede de la India y que alrededor del año 500 EC se establecieron en los Balcanes y se dispersaron por Bulgaria y otros países europeos. Aunque es difícil estimar el grado de endogamia de las comunidades romaníes se han descubierto más de nueve mutaciones que parecen ser específicas de sus miembros3. Es lo que ocurre con la enfermedad de Gitelman. La mutación c.1180+1G>T que consiste en la sustitución de guanina por timina en la posición 1 del intrón 9 del gen SLC12A3, es una mutación única y exclusiva de la etnia romaní. Ha sido estudiada por el Grupo de Nefrología Pediátrica y el Laboratorio de Biología Molecular del Hospital Universitario Central de Asturias (Dres. Coto y Santos). Se ha sugerido que constituiría una mutación de origen antiguo extendida por toda Europa en este grupo étnico34. Recientemente, este mismo grupo ha identificado una segunda mutación fundadora del gen SLC12A3, c.1939G>A, en pacientes gitanos que no presentan la variante c.1180+1G>T35. Esta nueva mutación supone el cambio de valina por metionina en el residuo 647 de la proteína NCC.
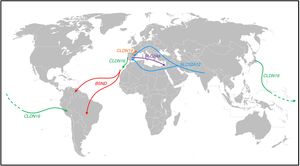
Los movimientos poblacionales y algunos de los hallazgos observados en pacientes con varias tubulopatías (fig. 1)Síndrome de Bartter con sorderaLa creación del Grupo RenalTube, con el objetivo de mejorar el conocimiento de las tubulopatías primarias, ha permitido estudiar el ADN de pacientes con tubulopatías que proceden de fuera de España36 (ver portal http://www.renaltube.com/es/). Ello ha permitido demostrar, por ejemplo, que la mutación G47R observada en los pacientes de Tenerife con síndrome de Bartter con sordera15 es la misma que estaba presente en dos pacientes de Venezuela37 y en uno de Brasil. Es conocida la alta tasa de emigración de jóvenes canarios a Venezuela («la octava isla») durante la primera mitad del siglo XX, especialmente, en los años difíciles que sucedieron a la Guerra Civil española.
Desplazamientos poblacionales y pasos que han seguido los sujetos portadores de ciertas mutaciones causantes de algunas tubulopatías descritas en el texto. La mutación G47R que causa el síndrome de Bartter se ha descrito en el NO de la isla de Tenerife, así como en Venezuela y Brasil (flechas de color rojo). La mutación p.R149Q descrita en el gen CLDN16 que codifica la claudina 16 se ha descrito tanto en Japón como en Perú; en el mismo gen, la mutación p.G162V se ha descrito tanto en Portugal como en la isla de Lanzarote (flecha de color verde). En el gen CLDN19 se ha descrito la mutación p.G20D que está presente en la mayoría de los pacientes españoles con hipomagnesemia familiar con hipercalciuria y nefrocalcinosis y en pacientes franceses del suroeste de Francia de origen español (flecha de color naranja). En la población de origen romaní se ha descrito la mutación c.1180+1G>T exclusiva de este grupo étnico, que origina la enfermedad de Gitelman (flechas de color azul claro). La mutación p.T125M observada en el gen SLC2A9 se ha identificado en pacientes españoles con hipouricemia tubular renal y en uno de origen sefardí radicado en Israel (flecha de color violeta). El color de esta figura solo puede apreciarse en la versión electrónica del artículo.
Otro caso es el de un paciente procedente de la selva de Perú que había sido diagnosticado de HFHN. El análisis del gen CLDN16 que, como se ha indicado codifica la claudina 16, detectó la mutación p.R149Q en homocigosis. Esta mutación solo se había detectado en heterocigosis en un paciente de Japón38. Es preciso recordar que a finales del siglo XIX tuvo lugar una emigración de ciudadanos japoneses al Perú para trabajar en el área agrícola.
Desde el siglo XV existió mucha presencia portuguesa en Canarias. Lanzarote no podía ser la excepción. Durante la primera mitad del siglo XV, Portugal pugnó con Castilla por la posesión de esa isla. De hecho, el portugués Antão Gonçalves fue Gobernador y Capitán General de Lanzarote los años 1448 y 144939. Más adelante, los portugueses, excluidos de las Indias como extranjeros y admitidos sin trabas en Canarias, suplieron en esas islas la falta de brazos castellanos40 aunque, a veces, la causa de su llegada era más concreta, a saber, huían de la Inquisición41. En los siglos siguientes y en las escasas circunstancias en las que la capacidad agrícola de la isla era buena gracias a las lluvias, a los lanzaroteños que regresaban de «practicar el nomadismo» por otras islas canarias, se unían personas procedentes de otras latitudes. Así, se sabe que en 1640 llegaron unos 200 lusos a Lanzarote merced, sobre todo, al intercambio comercial que existía entre Lanzarote y Madeira. Por todo lo expresado, no es de extrañar que nuestro Grupo haya detectado la mutación p.(G162V) en el gen CLDN16 de dos pacientes hermanos de Lanzarote con HFHN que ya han sido trasplantados y que esta mutación fuera identificada en primer lugar en un paciente portugués42.
Hipomagnesemia familiar con hipercalciuria y nefrocalcinosis. Claudina 19Con respecto al otro gen implicado en la HFHN, el CLDN19, en el estudio original de Konrad et al. ya mencionado, se incluían siete pacientes españoles pertenecientes a distintas familias a los que se les detectó una misma mutación en homocigosis, p.G20D (c.59G>A) a la que denominaron mutación española/hispánica20. Esos autores sugirieron que p.G20D es una mutación fundadora. Vargas-Poussou et al. publicaron un estudio en el que describieron otros dos pacientes españoles no relacionados y 13 franceses, pertenecientes a 12 familias, con la mutación p.G20D, la mayoría en homocigosis. Las familias que provenían del suroeste de Francia eran de origen español. Los datos obtenidos mediante un análisis de microsatélites en estas familias fueron consistentes con un efecto fundador43. Posteriormente, nuestro grupo ha publicado los resultados del estudio de una cohorte española compuesta por 34 pacientes con HFHN, 20 niñas y 14 niños, miembros de 30 familias aparentemente no relacionadas44. Los datos clínicos de estos pacientes mostraron un alto riesgo de progresión hacia la enfermedad renal crónica terminal (62% con deterioro de la función renal y 20% trasplantados), que concuerda con lo observado en la serie de los pacientes franceses. Nuestros resultados también están de acuerdo con los del grupo francés en cuanto al alto porcentaje, 88% y 91% respectivamente, de pacientes con anomalías oculares graves como miopía magna, nistagmo y coloboma. En contraste, los nueve pacientes con mutaciones en el gen CLDN16 estudiados por el grupo francés, la mayoría de los cuales provenían del norte de África, no tenían anomalías oculares. El análisis de mutaciones en nuestra cohorte mostró que todos los pacientes tienen mutaciones en el gen CLDN19. La mutación p.G20D se detectó en el 93% de los pacientes no relacionados y estaba presente en homocigosis en el 83% de los casos44.
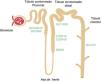
Hipouricemia tubular renalEn 1950, Praetorius y Kirk describieron el caso de un paciente con una hipouricemia llamativa (0,3mg/dl) en el que el aclaramiento de ácido úrico era superior al de creatinina. Esto hecho, hizo asumir que el riñón de dicho individuo secretaba ácido úrico. Fue el primer caso descrito de hipouricemia tubular renal45. El transportador URAT1 que reabsorbe el urato filtrado fue identificado por Enomoto et al. en 200246. Está localizado en la membrana apical de las células del túbulo proximal y es codificado por el gen SLC22A12. La salida del ácido úrico hacia el espacio peritubular se realiza mediante transportadores basolaterales. En 2003, Jutabna et al. identificaron un nuevo transportador de iones orgánicos voltaje sensible, transportador de glucosa 9 (GLUT9), que facilita la salida de urato de la célula47 (fig. 2). Es codificado por el gen SLC2A9. En un estudio reciente, nuestro Grupo ha estudiado 10 pacientes con mutaciones en SLC22A1248. Dos mutaciones asociadas con hipouricemia renal, c.1400C>T (p.T467M) y c.1245_1253de (p.L415_G417del), son muy frecuentes en la población romaní de la Península Ibérica, lo que sugiere una incidencia alta de esta tubulopatía en esa población48,49. Además, cuatro pacientes eran portadores de la mutación p.T125M en SLC2A9. Esta mutación se identificó inicialmente en un paciente de origen sefardí radicado en Israel50. La expulsión de los judíos de España fue ordenada en 1492 por los Reyes Católicos. Como algunos judíos equiparaban España con la Sefarad bíblica, recibieron el nombre de sefardíes, quienes, además de su religión, mantuvieron muchas de sus costumbres españolas y, particularmente, conservaron su lengua que deriva del castellano que se hablaba en el siglo XV.
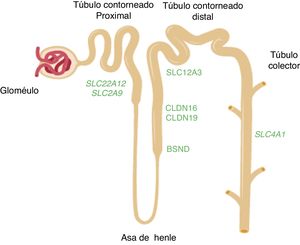
Esquema de la nefrona en el que se muestran los segmentos del túbulo donde se expresan los genes mencionados en el texto. Los genes SLC22A12 y SLC2A9 que codifican los transportadores de ácido úrico URAT1 y GLUT9 respectivamente, se expresan en el túbulo proximal renal. Los genes CLDN16 y CLDN19 que codifican las claudinas 16 y 19 respectivamente, se expresan en las zonas de unión estrechas de la rama gruesa ascendente del asa de Henle. El gen BSND que codifica la barttina se expresa en este último segmento tubular aunque, también, en las células de la stria vascularis del oído interno. El gen SLC12A3 que codifica el cotransportador de NaCl sensible a tiazidas se expresa en las células del túbulo contorneado distal. El gen SLC4A1 codifica las isoformas del intercambiador de aniones 1 (AE1) propias de eritrocitos y riñón. En ese último caso, la proteína se localiza en el ducto colector renal.
Las tubulopatías se definen como alteraciones clínicas en las que existe una disfunción tubular específica con afectación escasa o nula de la función glomerular.
Se trata de enfermedades hereditarias raras que son causadas por alteraciones en genes que se expresan distintas partes de la nefrona.
La mayoría de estas enfermedades tienen un patrón de herencia autosómico recesivo, y suelen ser mas frecuentes en zonas aisladas geográficamente o con un mayor grado de consanguinidad.
Los desplazamientos poblacionales son la causa de la difusión de algunas de estas enfermedades. El conocimiento de estos desplazamientos permite a los investigadores perseguir los pasos que han seguido determinadas mutaciones desde el origen del «ancestro fundador» hasta otros lugares del planeta muy distantes.
FinanciaciónNuestros estudios fueron financiados por el Instituto de Salud Carlos III – Subdirección General de Evaluación y Fomento de la Investigación (PI11/00342, PI14/00760, y PI17/00153) y por el Fondo Europeo de Desarrollo Regional «Una manera de hacer Europa». No ha existido ningún tipo de participación por parte de estas instituciones en la realización de la investigación ni la preparación del manuscrito.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.