Las infecciones son la complicación más frecuente tras el trasplante renal (TR)1, suponiendo entre 15-20% de la mortalidad en TR2. Los adenovirus son virus ADN de doble cadena y sin envoltura, cuya infección se relaciona con estados de inmunosupresión como el trasplante de órgano sólido (TOS)3. El trasplante de intestino e hígado, la inducción con anticuerpos-antilinfocitarios y las diferencias serológicas donante-receptor suponen factores de riesgo adicionales4. La incidencia de viremia asintomática en el primer año pos-TR es 4,1-6,5% con hasta 10% de enfermedad invasiva3. La afectación más frecuente en el TR es la cistitis hemorrágica (CH) cuya sintomatología mimetiza una infección del tracto urinario3. Su diagnóstico consiste en la detección de carga viral en muestras del órgano afecto, siendo la histopatología el «gold-standard»5. Presentamos un caso de CH secundaria a adenovirus en una paciente con trasplante renopancreático y tratada exitosamente con cidofovir intravesical.
Se trata de una mujer de 57 años con diabetes mellitus tipo 1 y enfermedad renal crónica secundaria, que recibió un primer trasplante renopancreático. Se realizó tratamiento de inducción con anticuerpos antilinfocitarios asociado a un tratamiento de mantenimiento basado en tacrólimus, ácido micofenólico (MPA) y corticoides. La evolución fue favorable, con funciones renal y pancreática normales.
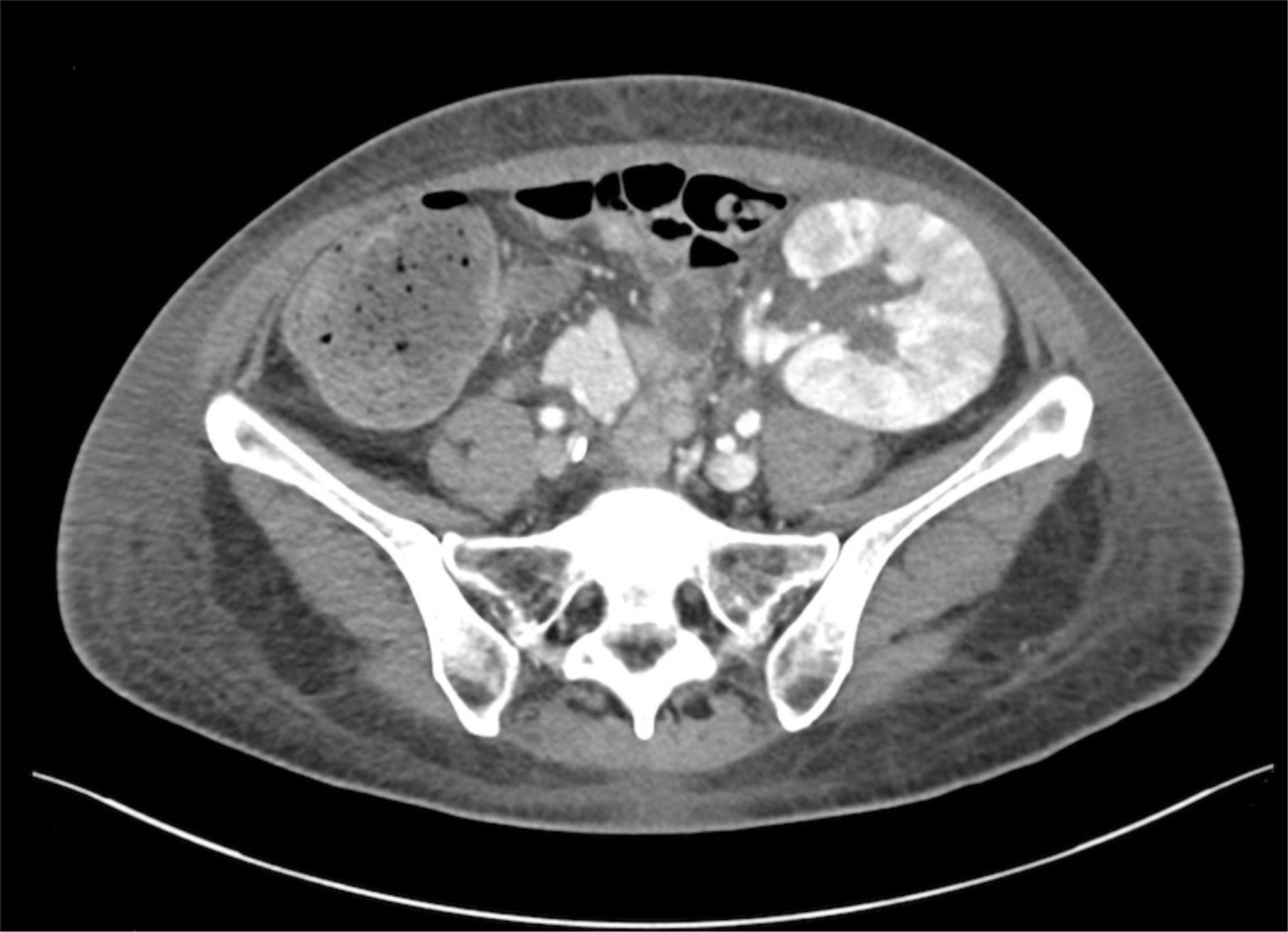
Siete meses después del trasplante, ingresa por un cuadro febril con síntomas respiratorios de un mes de evolución y hematuria macroscópica. Los exámenes complementarios evidencian elevación de reactantes inflamatorios, bicitopenia (anemia y leucopenia) y deterioro de la función del injerto renal. La ecografía renovesical fue normal. Se orientó inicialmente como una infección respiratoria viral con sobreinfección bacteriana añadida, iniciando antibioterapia empírica de amplio espectro y tratamiento profiláctico con trimetroprim/sulfametoxazol dada la linfopenia mantenida; además, se suspendió el MPA, manteniéndose con biterapia inmunosupresora. Ante la ausencia de bacteriuria y negatividad en los estudios microbiológicos iniciales (urinocultivo, hemocultivos, cultivo de esputo, PCR de frotis nasofaríngeo para SARS-CoV-2, VRS e Influenzavirus A y B), ampliamos el estudio con una tomografía computarizada toracoabdominal que evidenció una esplenomegalia y signos sugestivos de nefritis en el injerto renal (fig. 1). Asimismo, ampliamos el estudio microbiológico con frotis respiratorio ampliado y PCR sanguínea para diversos virus con positividad para el adenovirus (440,017 copias/mL), así como su presencia en orina (5,071,409 copias/mL), confirmando la CH secundaria a adenovirus. Dada la persistencia de fiebre y bicitopenia tras la reducción de la inmunosupresión, se planteó el uso de terapia antiviral con cidofovir.
El cidofovir es un antiviral con actividad contra diversos virus ADN, incluido el adenovirus, aunque su uso en TR está limitado por su potencial nefrotoxicidad. Las guías americanas recomiendan su uso en infecciones graves, resistentes o diseminadas por adenovirus5, pero su administración intravenosa conlleva riesgos de nefrotoxicidad. Sin embargo, la administración intravesical ha mostrado ser una alternativa prometedora, especialmente en el tratamiento de CH por poliomavirus BK en el trasplante de progenitores hematopoyéticos (TPH), con tasas de respuesta completa del 88% sin efectos adversos significativos6. En el TR, existe un caso de esta vía de administración en la literatura en un receptor de TR con CH secundaria a adenovirus con resolución clínica tras infusión intravesical7. Estas experiencias destacan la potencial eficacia de esta vía de administración para minimizar la nefrotoxicidad. Sin embargo, la evidencia aún es limitada y la dosis óptima no está establecida, variando en la literatura entre 1-5mg/kg en 60-100mL de NaCl al 0,9%6. Debido al papel de la inmunidad celular como principal actor frente a infecciones virales, la terapia celular mediante infusiones de linfocitos T específicos frente adenovirus o multivirus se encuentra en desarrollo en el TPH8, sin datos en el TOS5.
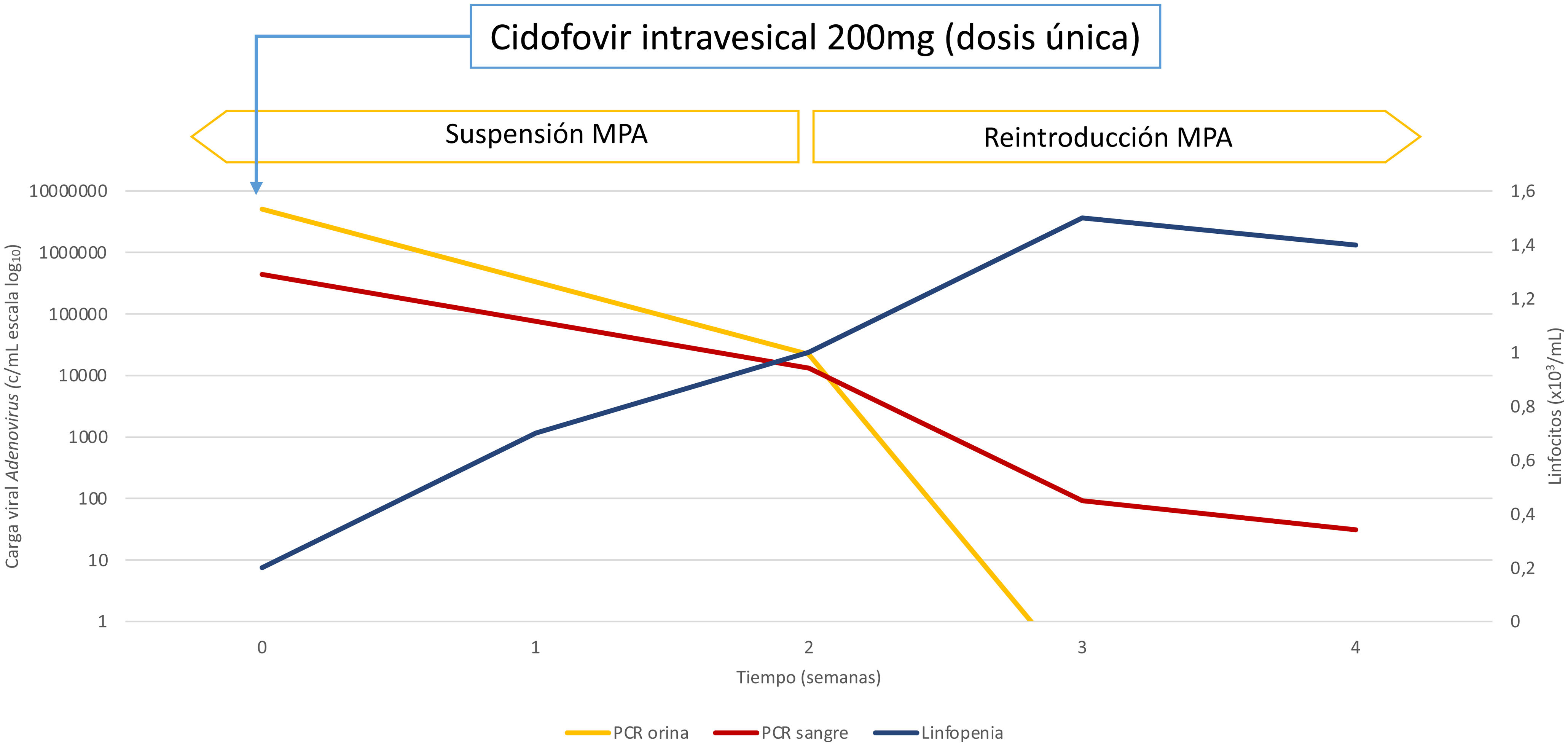
En nuestro caso, se optó por una dosis única de cidofovir intravesical de 200mg, con permanencia intravesical de 1 hora. Tras el tratamiento, la paciente presentó mejoría clínica, con negativización de la viremia y reducción de la viruria del 99,56% al mes del tratamiento (fig. 2). Posteriormente, se reinició MPA a dosis bajas con persistente descenso de la viruria y mantenimiento de la función renal con mejoría de las citopenias y resolución completa de la hematuria.
En conclusión, el adenovirus debe considerarse en el diagnóstico diferencial de la hematuria inexplicada en pacientes inmunodeprimidos, especialmente si se precede de síntomas respiratorios. Este caso destaca la potencial utilidad del cidofovir intravesical en el tratamiento de CH por adenovirus en TR, proporcionando una alternativa eficaz y menos nefrotóxica. Se requieren estudios adicionales para confirmar su seguridad, eficacia y establecer pautas claras de dosificación en este contexto clínico.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores del presente trabajo declaran no tener ningún conflicto de intereses.