Introducción: La normohidratación es uno de los mayores objetivos en hemodiálisis (HD) y diálisis peritoneal (DP). La bioimpedancia por espectroscopia (BIS) se postula como el método más prometedor para la evaluación y seguimiento del estado de hidratación en pacientes en diálisis. Objetivo: Comparar la composición corporal de pacientes prevalentes en HD y DP en un intervalo de seis meses. Pacientes y métodos: Estudio observacional de 62 pacientes en HD y 19 en DP comparando los parámetros clínicos, bioquímicos y de bioimpedancia. Resultados: En el estudio comparativo, los pacientes en DP fueron más jóvenes (50 ± 10 vs. 57 ± 14 años, p = 0,031). El índice de comorbilidad de Charlson (4,8 ± 3 vs. 7,5 ± 3, p < 0,001), tiempo en diálisis (16,9 ± 18,01 vs. 51,88 ± 68,79 meses, p = 0,020) y proteína C reactiva [3 (3-9,3) vs. 5,25 (1-76,4)] fueron menores. Los niveles de proteínas totales (7,46 ± 0,44 vs. 7,04 ± 0,55 g/dl, p = 0,005), y transferrina (205 ± 41 vs. 185 ± 29 mg/dl, p = 0,024) fueron más elevados. BIS: agua intracelular (AIC) (19,67 ± 3,61 vs. 16,51 ± 3,36 litros, p = 0,010), masa muscular total (MM) (37,20 ± 8,65 vs. 32,57 ± 8,72 kg, p = 0,029), masa celular total (MCT) (20,53 ± 5,65 vs. 17,56 ± 5,91 kg, p = 0,033) y ángulo de fase (Phi 50) (5,81 ± 0,86 vs. 4,74 ± 0,98, p = 0,000) fueron más elevados que en HD. Sobrehidratados 22% en HD y 10% en DP, en las condiciones referidas en métodos. A los seis meses en DP observamos aumento de peso (73,75 ± 12,27 vs. 75,22 ± 11,87 kg, p = 0,027), grasa total (MG) (26,88 ± 10 vs. 30,02 ± 10 kg, p = 0,011) y relativa (MG %) (35,75 ± 9,87 vs. 39,34 ± 9,12, p = 0,010); disminución de AIC (18,56 ± 3,45 vs. 17,65 ± 3,69 l, p = 0,009), MM (36,95 ± 8,88 vs. 34 ± 9,70 kg, p = 0,008) y MM relativa (MM %) (50,85 ± 12,33 vs. 45,40 ± 11,95%, p = 0,012). En el análisis multivariante, la variación (¿) de peso guarda relación con el ¿ de grasa (p < 0,001). Encontramos correlación entre el incremento de grasa y el decremento de masa muscular (p = 0,01). A los seis meses en HD no se observaron cambios en estos parámetros, salvo una reducción en el agua extracelular (15,11± 2,45 vs. 14,00 ± 2,45, p = 0,001). Conclusiones: BIS permite valorar los cambios en la composición corporal y ayuda a establecer el peso seco e introducir cambios en las pautas de tratamiento.
Introduction: Proper hydration is one of the major aims in haemodialysis (HD) and peritoneal dialysis (PD). Bioimpedance spectroscopy appears to be a promising method for the evaluation and follow up of the hydration status in dialysis patients (P). Objectives: We compared body composition between stable patients on HD and PD after six months. Patients and method: An observational study with 62 P on HD and 19 P on PD was performed. Clinical, biochemical and bioimpedance parameters were analysed. Results: In the comparative study, PD P were younger (50±10 vs 57±14 years, P=.031). The Charlson Comorbidity Index (4.8±3 vs 7.5±3, P<.001), time on dialysis (16.9±18.01 vs 51.88±68.79 months, P=.020) and C-Reactive Protein [3 (3-9.3) vs 5.25 (1-76.4)] were lower. Total protein levels (7.46±0.44 vs 7.04±0.55 g/dl, P=.005) and transferrin levels (205±41 vs 185±29 mg/dl, P=.024) were higher. BIS: Intracellular water (19.67±3.61 vs 16.51±3.36 litres, P=.010), lean tissue mass (LTM) (37.20±8.65 vs 32.57±8.72 kg, P=.029), total cellular mass (TCM) (20.53±5.65 vs 17.56±5.91 kg, P=.033), and bioelectrical impedance phase angle (Phi 50) (5.81±0.86 vs 4.74±0.98, P=.000) were higher than in HD P. Overhydration: 22% in HD y 10% in PD, in conditions referred to in methods. Six months later, PD P increased in weight (73.75±12.27 vs 75.22±11.87 kg, P=.027), total fat (FAT) (26.88±10 vs 30.02±10 kg, P=.011) and relative fat (Rel FAT) (35.75±9.87 vs 39.34±9.12, P=.010); and decreased in ICW (18.56±3.45 vs 17.65±3.69 l, P=.009), LTM (36.95±8.88 vs 34±9.70 kg, P=.008) and relative LTM (Rel LTM) (50.85±12.33 vs 45.40±11.95%, P=.012). In the multivariate analysis, weight variation (¿) was related to ¿ FAT (P<.001). We found a correlation between fat increase and lean tissue mass decrease. Six months later, in HD P, we observed a reduction in ECW (15.11±2.45 vs 14.00±2.45, P.001), without changes in other parameters. Conclusions: Bioelectrical impedance analysis facilitates the assessment of changes in body composition so as to correct dry weight and to introduce changes in treatment schedule.
INTRODUCCIÓN
Conseguir el normal estado de hidratación es uno de los mayores objetivos de la terapia con hemodiálisis (HD) y diálisis peritoneal (DP). El concepto de peso seco es parte integral de la terapia de diálisis1. El estado anormal de sobrehidratación se ha relacionado con hipertensión arterial, síntomas y signos de edema pulmonar y periférico, fallo cardíaco, hipertrofia ventricular izquierda y otros efectos cardiovasculares adversos2. El incremento de la masa ventricular izquierda se relaciona con peor evolución cardiovascular en pacientes en DP3 y se ha descrito que el estado de hidratación es un predictor importante e independiente de mortalidad en pacientes en HD crónica4.Una buena estrategia para mantener a los pacientes euvolémicos parece esencial. La evaluación de la normovolemia, sin embargo, es difícil, ya que no existe un método que pueda ser utilizado a diario en la práctica clínica. La evaluación clínica del peso seco es el método más utilizado, pero esto hace que la sobrehidratación y deshidratación subclínica sean frecuentes y pueden ser causa de incremento de la morbilidad5. Entre las pruebas que se pueden emplear para fijar el peso seco, la radiografía de tórax es de ayuda en el manejo clínico, pero no cumple con las premisas de ser rápida y no invasiva; el diámetro de vena cava inferior y sus variaciones respiratorias son buenas medidas de la precarga6, pero también están influenciadas por factores cardiovasculares como la disfunción diastólica, hipertensión pulmonar y enfermedad pulmonar obstructiva crónica7. Los marcadores bioquímicos como BNP (péptido atrial natriurético) tienen un valor pronóstico y pueden reflejar indirectamente la sobrehidratación debido a su efecto sobre la masa ventricular izquierda5, pero su nivel parece que depende más de la situación primaria del ventrículo. Es difícil establecer la concentración adecuada en los pacientes en diálisis y frecuentemente permanece elevado en los pacientes considerados euhidratados8.
Los métodos de referencia para medir el agua corporal como es el deuterio y el bromuro de sodio para el agua extracelular son laboriosos y no se usan habitualmente en la práctica clínica9.
Las nuevas técnicas de bioimpedancia están siendo utilizadas para evaluación y seguimiento del estado de hidratación. En un estudio realizado para evaluar los límites de detección de los métodos utilizados en la determinación del estado de hidratación de los pacientes en diálisis, la bioimpedancia por espectroscopia ha demostrado una alta sensibilidad, postulándose como el método más prometedor para un tratamiento práctico del paciente en diálisis7. Utiliza la variación de la frecuencia de la corriente aplicada y distingue entre volumen extracelular y agua corporal total. La variación de frecuencia aplicando corrientes de entre 5 y 1000 kHz lleva a determinar el agua extracelular (AEC) y el agua corporal total (ACT); el agua intracelular (AIC) es extrapolada por análisis a diferentes frecuencias8,10.
Está bien establecido que los cambios en el peso corporal que se producen en el tiempo en pacientes en diálisis peritoneal se deben a cambios tanto en el agua corporal como en la masa magra y en la masa grasa. La bioimpedancia por multrifrecuencia ofrece la posibilidad de evaluar la composición corporal y el estado de hidratación del paciente11.
El monitor de composición corporal (Body Composition Monitor [BCM], Fresenius Medical Care) ha sido validado para su uso en la práctica clínica para determinación del estado de hidratación10. Se ha demostrado que una sobrehidratación relativa mayor del 15%, medida por BCM, se relaciona con un incremento de mortalidad cardiovascular en pacientes en hemodiálisis4.
Recientemente, se ha puesto en relación la sobrehidratación con la inflamación, desnutrición y ateroesclerosis en pacientes en DP12.
El objetivo de nuestro estudio es comparar la composición corporal de pacientes prevalentes en HD y DP en un corte transversal y evaluar los cambios de ésta realizando dos estudios con una diferencia de seis meses en ambas técnicas, HD y DP, en una unidad con especial atención a mantener al paciente en su peso seco.
MÉTODOS
Pacientes
Realizamos un estudio transversal de pacientes prevalentes en HD (n: 62) y DP (n: 19) seguidos en el mismo centro durante un período que incluyó dos mediciones de bioimpedancia con seis meses de diferencia. El número de pacientes al inicio fue de 65 en HD y 19 en DP. A los 6 meses había 49 pacientes en HD y 14 en DP. Todos los pacientes eran mayores de 18 años. Se excluyeron los pacientes que presentaban una contraindicación para la realización de bioimpedancia: un dispositivo electrónico implantado, cualquier tipo de implante metálico, amputación, embarazo o lactancia. Todos los pacientes firmaron un consentimiento que fue aprobado por el Comité Ético.
De 62 pacientes en HD, 21 utilizaban hemodiafiltración on line y 41 realizaban HD convencional. De los 19 pacientes en DP, 10 estaban en DP automatizada (DPA) y 9 en DP continua ambulatoria (DPCA); se utilizó icodextrina en el 49% en ambas técnicas y 23 pacientes (27%) eran diabéticos.
Medidas
En el corte transversal inicial se compararon en ambas técnicas los parámetros clínicos: edad, sexo, índice de comorbilidad de Charlson13, tiempo en diálisis, peso, índice de masa corporal (IMC), tensión arterial (TA) sistólica y TA diastólica.
Datos de laboratorio: se determinó proteína C reactiva (PCR) por inmunoturbidimetría; creatinina, proteínas totales, albúmina, transferrina, hemoglobina fueron analizadas utilizando métodos certificados en el Departamento de Bioquímica del Hospital Severo Ochoa. El índice de resistencia a la eritropoyetina se definió como la dosis semanal de de eritropoyetina (U/kg prediálisis/dosis) dividida por el nivel de hemoglobina (Hb) en g/dl.
La bioimpedancia se realizó prediálisis inmediatamente antes de la segunda sesión de la semana y en los pacientes en DP coincidiendo con el test de equilibrio peritoneal y con el peritoneo lleno. Se utilizó un equipo de análisis de composición corporal de bioimpedancia por espectroscopia (BCM, de Fresenius Medical Care). Los parámetros de bioimpedancia fueron: ACT en litros (l), AEC en l, AIC en l, cociente AEC/AIC, masa muscular (MM) en kg, MM % en porcentaje, índice de masa muscular en kg/m2, grasa total (MG) en kg, MG % en porcentaje, ángulo de fase (Phi 50), masa celular total (MCT) en kg, sobrehidratación (OH) en l. El estado de OH se calculó normalizando la OH al AEC y considerando OH si era mayor de 15%4.
Los parámetros clínicos, bioquímicos y de bioimpedancia fueron analizados a los seis meses con ambas técnicas de diálisis.
Análisis estadístico
El análisis estadístico fue realizado utilizando el programa estadístico SPSS 12 (Chicago Ilinois, SL, USA). Las variables normalmente distribuidas se expresan como media y desviación estándar, y las que no siguen una distribución normal, como mediana y rango (máximo y mínimo). La comparación entre grupos se realizó mediante t de Student o U de Mann Whitney y o χ2 según la naturaleza de la variable. Las variables categóricas se expresan también como número y porcentaje. La significación estadística se ha fijado en p < 0,05. Para el estudio univariante se ha utilizado la correlación de Pearson o de Spearman, según la naturaleza de la variable. El análisis multivariante se ha realizado mediante correlación lineal, considerando como variable dependiente el incremento de peso e introduciendo por pasos sucesivos las variables que alcanzan alguna significación en el análisis univariante.
RESULTADOS
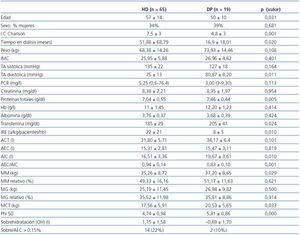
Los datos de un total de 65 pacientes en HD y 19 en DP fueron analizados. Los parámetros demográficos, clínicos, bioquímicos y de bioimpedancia del corte inicial están referidos en la tabla 1. Los pacientes en DP fueron más jóvenes (50 ± 10 vs. 57 ± 14 años, p = 0,031) con índice de comorbilidad de Charlson menor (4,8 ± 3 vs. 7,5 ± 3, p < 0,001), menor tiempo en diálisis (16,9 ± 18,01 vs. 51,88 ± 68,79 meses, p = 0,020), menor PCR [3 (3-9,3) vs. 5,25 (1-76,4)] y tenían valores de proteínas totales (PT) (7,46 ± 0,44 vs. 7,04 ± 0,55 g/dl, p = 0,005) y transferrina (205 ± 41 vs. 185 ± 29 mg/dl, p = 0,024) más elevados que los pacientes en HD. Los pacientes en DP tenían una función renal residual (FRR) de 5,33 ± 3,89 ml/min, mantenían una diuresis de 1115 ± 758 ml/día y una ultrafiltración de 887 ± 445 ml al día. El volumen ultrafiltrado en la sesión de los pacientes en HD el día de la bioimpedancia fue de 2372 ± 921 ml.
En cuanto a los parámetros de bioimpedancia los pacientes en DP tuvieron valores de AIC (19,67 ± 3,61 vs. 16,51 ± 3,36 litros, p = 0,010), MM (37,20 ± 8,65 vs. 32,57 ± 8,72 kg, p = 0,029), MCT (20,53 ± 5,65 vs. 17,56 ± 5,91 kg, p = 0,033) y ángulo de fase (5,81 ± 0,86 vs. 4,74 ± 0,98, p = 0,000) mayores que los pacientes en HD. En las condiciones en las que se realiza el estudio, un total de 14 pacientes estuvieron sobrehidratados en HD y 2 pacientes en DP (22 y 10% respectivamente).
Los pacientes diabéticos presentaban globalmente TA sistólica mayor (p = 0,012) y ángulo de fase menor (p = 0,008), sin diferencia en el resto de los parámetros de composición corporal.
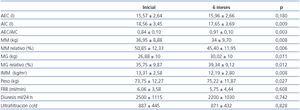
En los pacientes en DP a los seis meses (tabla 2) se produce un aumento significativo de peso (73,75 ± 12,27 vs. 75,22 ± 11,87 kg, p = 0,027) con aumento de la grasa total (26,88 ± 10 vs. 30,02 ± 10 kg, p = 0,011) y relativa (35,75 ± 9,87 vs. 39,34 ± 9,12%, p = 0,010), y disminución de AIC (18,56 ± 3,45 vs. 17,65 ± 3,69 l, p = 0,009), MM total (36,95 ± 8,88 vs. 34 ± 9,70 kg, p = 0,008) y relativo (50,85 ± 12,33 vs. 45,40 ± 11,95%, p = 0,012). Globalmente, existe correlación entre la variación (¿) de peso y el ¿ de grasa, pero no con el ¿ de agua extracelular. En el análisis multivariante, el ¿ de peso guarda relación con el ¿ de grasa (p < 0,001). Existe correlación entre el incremento de grasa y el decremento de MM (p = 0,01). En el análisis multivariante considerando como variable dependiente el decremento de MM e introduciendo por pasos la edad, el sexo, la técnica de diálisis y el IMC, únicamente la edad influye en el decremento de MM (p = 0,012).
Al analizar los datos según la técnica de DP, se observa que existe una tendencia a menor incremento de grasa en DPA (1,58 ± 3,05 vs. 3,5 ± 3,05) a pesar de una carga de glucosa mayor (206 ± 58 vs. 62,98 ± 75,5, p = 0.006).
En los pacientes en HD sólo se reduce el AEC en forma significativa (p = 0,001); el resto de los parámetros de bioimpedancia no varía en la medición realizada a los 6 meses (tabla 3).
DISCUSIÓN
Este estudio pone de manifiesto las diferencias en la composición corporal de los pacientes en HD y DP. En el corte inicial las diferencias en los parámetros nutricionales (valores de PT, transferrina) y de bioimpedancia (AIC, MM, MCT y ángulo de fase) pueden atribuirse a la menor edad, el menor tiempo en diálisis y mejor estado nutricional del grupo de DP. A pesar de ello, es evidente un aumento significativo de peso en el período de observación de seis meses en los pacientes en DP que no se produce en los pacientes en HD. El incremento de peso es fundamentalmente de grasa. Estos datos podrían indican por un lado que la glucosa aportada por la DP puede ser responsable del incremento de grasa que se produce en estos pacientes, y que el control de volumen extracelular es más limitado en DP que en HD, como consecuencia de la progresiva reducción de la FRR
En HD se produce un decremento de AEC sin variaciones en los otros parámetros en el período de seis meses.
En DP la MM se reduce, probablemente de forma secundaria al mayor sedentarismo que conlleva la diálisis, lo cual podría por un lado contribuir al incremento de grasa en DP y por otro lado probablemente indicar la necesidad de realizar ejercicio físico habitual. Nos llama la atención que no sea significativa la disminución de MM en los pacientes en HD; creemos podría atribuirse al escaso tiempo entre las dos mediciones. Realizaremos su seguimiento en períodos más prolongados.
En las condiciones en las que se realiza el estudio, un 22% de nuestros pacientes en HD y un 10% en DP están sobrehidratados según los criterios descritos por otros autores4. No hemos realizado estudios de bioimpedancia posdiálisis porque se requiere que transcurra un mínimo de 30 minutos para su realización y no ha sido posible obtener consentimiento de los pacientes. No obstante, en este estudio, en el caso de la HD se está valorando el estado de sobrehidratación en situación de máxima sobrehidratación (pre-HD) y dudamos que ambas situaciones sean comparables.
Cuando se ha podido medir pre y pos-HD y la sobrehidratación se ha calculado sobre la media, en centros con similar atención a alcanzar el peso seco en cada sesión de diálisis, un 10% de los pacientes estuvieron sobrehidratados11, dato similar al de nuestros pacientes en DP.
Nuestros resultados indican que nuestros pacientes en DP ganan peso sobre todo a expensas del incremento de grasa. Además, un ligero incremento del AEC, probablemente debido a una discreta disminución de la diuresis, contribuye a su ganancia de peso aunque estos cambios no sean estadísticamente significativos.
En nuestros pacientes en DP, la prevalencia de sobrehidratación (10%) fue menor que en otros centros reportados15,16.
Como es sabido, el control de la TA es peor en DP automatizada que en DPCA debido a un peor balance negativo de sodio en DPA por la existencia de un coeficiente de cribado de sodio en la membrana peritoneal17,18. El uso de icodextrina puede favorecer un mejor control de la situación de volumen y reducir la masa ventricular izquierda19. En nuestra experiencia20 no existe diferencia en el control de la TA ni en la función renal residual en ambas técnicas de DP, probablemente por la insistencia en la restricción de sal en la dieta y el amplio uso de icodextrina.
La tendencia observada en nuestros pacientes en DPA es de un incremento de grasa menor, a pesar de una carga peritoneal de glucosa mayor que en DPCA, quizás en relación con un tiempo de permanencia menor de la glucosa en la cavidad peritoneal y con una menor absorción total de ésta.
La alta prevalencia de hipertensión arterial y sobrecarga de volumen en los centros de HD y la dificultad para establecer el peso seco de los pacientes de diálisis21 sitúa a la bioimpedancia como un arma más a la hora de valorar los cambios sufridos en la composición corporal que orienta al clínico para establecer el peso seco del paciente en HD y para introducir cambios en las pautas de líquidos en los pacientes en DP.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Parámetros clínicos, bioquímicos y de bioimpedancia del corte inicial
Tabla 2. Evolución a los 6 meses de los 14 pacientes en diálisis peritoneal
Tabla 3. Evolución a los 6 meses de 49 pacientes en hemodiálisis