La enfermedad renal diabética es la primera causa de enfermedad renal crónica terminal en nuestro medio. El bloqueo del sistema renina-angiotensina aldosterona (BSRAA) enlentece la progresión de la enfermedad renal diabética. Nuestros objetivos son: estudiar pacientes tratados con BSRAA, comparando su evolución según el filtrado glomerular, su perfil de seguridad y si se asocia a una progresión mayor de la enfermedad renal crónica.
Materiales y métodosEstudio retrospectivo de 197 pacientes con enfermedad renal diabética. Se dividieron en tres grupos según tratamiento: pacientes que no recibieron BSRAA (no BSRAA), pacientes que en algún momento lo recibieron (BSRAA discontinuado) y pacientes que recibieron BSRAA (BSRAA mantenido). Se estudiaron características clínicas y analíticas: función renal, ionograma, hemoglobina glicosilada, filtrado glomerular según CKD-EPI y MDRD. Analizamos su evolución (basal, año y 3 años) en relación con el grupo de tratamiento, supervivencia, factores de riesgo y pronóstico renal.
ResultadosLos pacientes no BSRAA presentaron en el momento basal peor función renal y edad más avanzada (p<0,05) en comparación con los que recibieron BSRAA. Los pacientes que recibieron BSRAA no mostraron mayor toxicidad, ni más progresión de la enfermedad renal crónica, y no evidenciamos diferencias en el pronóstico renal. La mortalidad fue mayor en pacientes no BSRAA, de mayor edad y peor función renal (p<0,05). En el análisis multivariado los factores de riesgo de mortalidad fueron edad avanzada y peor función renal.
ConclusionesEl tratamiento con BSRAA es más frecuente en pacientes con FGe≥30mL/min/1,73m2. No observamos diferencias en la evolución de la función renal entre los tres grupos. La mayor mortalidad observada en pacientes que no recibieron BSRAA se relacionó con la edad avanzada y peor función renal.
Diabetic kidney disease is the leading cause of end-stage chronic kidney disease. The renin-angiotensin-aldosterone system (RAAS) blockade has been shown to slow the progression of diabetic kidney disease. Our objectives were: to study the percentage of patients with diabetic kidney disease treated with RAAS blockade, to determine its renal function, safety profile and assess whether its administration is associated with increased progression of CKD after 3 years of follow-up.
Materials and methodsRetrospective study. 197 diabetic kidney disease patients were included and divided into three groups according to the treatment: patients who had never received RAAS blockade (non-RAAS blockade), patients who at some point had received RAAS blockade (inconstant-RAAS blockade) and patients who received RAAS blockade (constant-RAAS blockade). Clinical characteristics and analytical variables such as renal function, electrolytes, glycosylated haemoglobin and glomerular filtration rate according to chronic kidney disease -EPI and MDRD formulas were assessed. We also studied their clinical course (baseline, 1 and 3 years follow-up) in terms of treatment group, survival, risk factors and renal prognosis.
ResultsNon-RAAS blockade patients had worse renal function and older age (p<0.05) at baseline compared to RAAS blockade patients. Patients who received RAAS blockade were not found to have greater toxicity or chronic kidney disease progression and no differences in renal prognosis were identified. Mortality was higher in non-RAAS blockade patients, older patients and patients with worse renal function (p<0.05). In the multivariate analysis, older age and worse renal function were risk factors for mortality.
ConclusionsTreatment with RAAS blockade is more common in diabetic kidney disease patients with eGFR≥30ml/min/1.73m2. In our study, there were no differences in the evolution of renal function between the three groups. Older age and worse renal function were associated with higher mortality in patients who did not receive RAAS blockade.
La diabetes mellitus (DM) es una pandemia con 415 millones de afectados en el mundo. Según las proyecciones de la Federación Internacional de Diabetes se espera que esta cifra aumente hasta 642 millones en 2040, en su gran mayoría en países en desarrollo1.
La DM reduce significativamente la esperanza de vida, siendo la enfermedad cardiovascular la principal causa de mortalidad1,2. El 30% de los pacientes con DM tipo 1 y el 10-40% de los pacientes con DM tipo 2, desarrollarán a lo largo de su evolución enfermedad renal diabética (ERD), que en su estadio más avanzado dará lugar a la enfermedad renal crónica (ERC) terminal que precisa terapia renal sustitutiva (TRS)1. La ERD es una de las principales causas de ERC avanzada y TRS. En Cataluña, esta supone la segunda causa de inicio de TRS, con una incidencia de un 22%3. A los 10 años del diagnóstico de DM2 un 25% presentará microalbuminuria, un 5% presentará macroalbuminuria y un 0,8% elevación de creatinina o insuficiencia renal avanzada4.
El sistema renina-angiotensina-aldosterona (SRAA) está especialmente implicado en la regulación cardiorrenal del paciente con DM. La angiotensina II, actuando en receptores tipo 1 (AT1), ejerce múltiples efectos: induce vasoconstricción, aumenta la reabsorción tubular de Na+, aumenta el estrés oxidativo, y favorece la producción renal de citocinas fibrogénicas e inflamatorias. Así, la inhibición de su formación o el bloqueo de su acción a través del receptor tipo 1 de la angiotensina II han demostrado ser beneficiosos en la protección cardiorrenal en el paciente afecto de ERD5–7.
Debido a la capacidad de los inhibidores de enzima convertidora de angiotensina (IECA) y los bloqueadores de los receptores de angiotensina II (ARA2) para reducir al mismo tiempo la mortalidad, el riesgo cardiovascular y la progresión de la nefropatía, la mayoría de las directrices renales actuales recomiendan estos fármacos de primera línea para los pacientes diabéticos con ERC1,8–10. En la ERD los efectos renoprotectores del bloqueo del SRAA (BSRAA) son superiores al de otros fármacos antihipertensivos. El BSRAA mediante la administración de IECA o ARA2 retrasa la aparición y el aumento de albuminuria, reduce su cuantía y enlentece el deterioro del filtrado glomerular (FGe)11–13. No obstante, en la actualidad el nivel de evidencia del potencial efecto beneficioso es bajo en los pacientes con ERC avanzada14,15.
Pese a los efectos antiproteinúricos del BSRAA, muchos pacientes diabéticos que reciben este tratamiento no se logra frenar la progresión de la nefropatía, por lo que se buscan estrategias a fin de conseguir una modulación del SRAA más eficaz o estrategias independientes del SRAA. Del mismo modo, la tendencia clínica habitual es retirar dichos fármacos en pacientes con FGe<30mL/min, es decir ERC estadios 4-5. Un estudio con tamaño muestral pequeño mostró que la retirada de los BSRAA, IECA/ARA2 en pacientes con ERC avanzada (46% diabéticos) retrasa la necesidad de TRS16. A destacar que la mayoría de los pacientes presentaban edad avanzada (media 73 años) y algunos enfermedad renovascular. Además, se observó un aumento no significativo de la proteinuria17. Por tanto, el efecto beneficioso del BSRAA en pacientes con ERD avanzada es controvertido. Nos proponemos revisar pacientes con ERD para determinar el porcentaje de estos que son tratados con BSRAA, comparando los porcentajes según FGe mayor o menor a 30mL/min y estadio de ERC. A su vez, estudiamos el perfil de seguridad de estos fármacos y si la administración de bloqueantes del SRAA se asocia a una progresión mayor o no de la ERC y a un mejor pronóstico vital.
Material y métodosSelección de la muestraEstudio observacional y retrospectivo en el cual se han incluido 197 pacientes en seguimiento por ERD desde el año 2009 hasta el 2014. Los criterios de inclusión fueron: pacientes mayores de 18 años que presentan DM tipo 2 y ERD (ERC ≤ 60ml/min y/o albuminuria ≥ 30mg/g en dos determinaciones), los cuales han sido o son seguidos en consultas externas del servicio de Nefrología del Hospital del Mar como mínimo por un año. Los criterios de exclusión fueron pacientes menores de 18 años, ausencia de ERD y seguimiento inferior a un año.
Variables clínicasLos datos del estudio se recogieron de la historia clínica de los 197 pacientes afectos de DM tipo 2. Las variables estudiadas fueron la edad, el sexo, la raza del paciente y el tiempo de evolución de la diabetes. Se recogieron parámetros de función renal como creatinina o urea, la estimación de la tasa de FGe se ha llevado a cabo con las fórmulas MDRD y CKD-EPI. Estudiamos la hemoglobina glicosilada (HbA1c) como marcador de control glucémico. También se estudió la presión arterial sistólica (PAS), la presión arterial diastólica (PAD) y el tratamiento con hipotensores, principalmente BSRAA (IECA, ARA2, antialdosterónicos). Se evaluaron las causas de retiradas de BSRAA, ya sea en forma de deterioro de función renal (disminución de un 30% del FGe o aumento de un 30% de la creatinina sérica), hiperpotasemia (potasio sérico por encima de 5,5 mEq/l) y otras causas. Además se estudiaron las complicaciones aparecidas en el periodo (cardiopatía isquémica, accidente vascular cerebral, retinopatía diabética y vasculopatía periférica) en el transcurso del seguimiento y la necesidad de TRS, bien en forma de trasplante renal, hemodiálisis o diálisis peritoneal. Finalmente, también se registró la mortalidad durante el seguimiento del paciente.
Todos los parámetros analíticos y tratamientos fueron recogidos en el momento basal, al año y a los tres años de seguimiento, considerándose para el estudio el momento basal la primera visita en CCEE de nefrología. Para la interpretación de los datos dividimos a los participantes en tres grupos según la pauta de tratamiento con BSRAA: pacientes que nunca han recibido tratamiento (no BSRAA) (n=42), pacientes que recibieron BSRAA en algún momento del seguimiento (BSRAA discontinuado) (n=73) y pacientes que siguieron tratamiento con BSRAA durante todo el periodo de seguimiento (BSRAA-mantenido) (n=82). En relación al FGe los participantes fueron divididos en dos grupos:<30mL/min/1,73m2 o estadio 4/5 de ERC (n=60) y ≥30ml/min/1,73m2 (n=137).
Análisis estadísticoEl procesamiento y análisis de datos se realizó mediante el programa estadístico IBM SPSS® versión 19.0. Las variables cuantitativas de distribución normal se presentan como media y desviación estándar. Las variables que no siguieron una distribución normal se presentan como mediana y rango intercuartílico. Las variables cualitativas se expresan como porcentaje. Se ha utilizado el test de chi cuadrado para la comparación de variables cualitativas y para la comparación de las medias entre dos muestras usamos la t-Student para datos independientes y U Mann-Whitney en caso de no normalidad de la variable. Para la comparación entre medias con más de dos categorías se ha utilizado el test de ANOVA, junto a la prueba de Tukey para comparaciones múltiples entre diferentes grupos. En cuanto al análisis de supervivencia y el inicio de tratamiento renal sustitutivo se utilizaron curvas de Kaplan-Meier y test de Log-Rank. Se realizó un análisis de regresión multivariable Cox de riesgos proporcionales para evaluar los factores de riesgo de mortalidad ajustados por las siguientes variables: edad, función renal, antecedentes de cardiopatía isquémica, antecedente de accidente cerebrovascular, antecedente de vasculopatía periférica, antecedente de retinopatía diabética, sexo y tratamiento con BSRAA. Se consideró significación estadística cuando la p fue menor de 0,05.
ResultadosCaracterísticas de la poblaciónSe analizaron 197 pacientes con una edad media de 70±9 años, de estos el 60% eran varones (n=118). En la tabla 1 se muestran las características basales, los parámetros analíticos referentes a función renal y los parámetros relacionados con la enfermedad diabética en la totalidad de la muestra estudiada y dividido según los grupos establecidos de FGe. Como se muestra, la totalidad de los pacientes realizaba tratamiento antihipertensivo de base. Al inicio del periodo de seguimiento 60 (30,5%) pacientes presentaban un FGe<30mL/min/1,73m2. Media de PAS 146±21mmHg y PAD 72±13mmHg, una hemoglobina glicosilada (HbA1c) 7,6±1,6% y hemoglobina media 12,3±1,6g/dl. La media de FGe MDRD fue de 40±11mL/min/1,73m2, y FGe CKD-EPI 37,6±14mL/min/1,73m2. La media de duración de la DM fue de 16±10 años y la presencia de retinopatía diabética fue en 164 pacientes (83,2%). La proteinuria media fue 676 (52-9632) mg/24 horas, el cociente albuminuria (MAU/Cr) 175,5(1,3-4920) mg/g y la creatinina sérica 1,79±0,6mg/dl. Los niveles medios de sodio y potasio fueron de 141,5±3,1 mmol/l y 4,8±0,6 mmol/l, respectivamente.
Características demográficas, clínicas y analíticas basales de la población
| Total | FGe<30 | FGe≥30 | p | |
|---|---|---|---|---|
| (n=197) | (n=60) | (n=137) | ||
| Características | ||||
| Sexo (varones/mujeres) | 118 (60%)/79 (40%) | 27 (45%)/33 (55%) | 91 (66%)/46(34%) | 0,007 |
| Edad primera visita (años) | 70±9 | 75±8 | 68±10 | <0,001 |
| Hipertensión arterial en tratamiento | 100% | 100% | 100% | 0,518 |
| Presión arterial sistólica (mmHg) | 146±21 | 148±27 | 145±18 | 0,464 |
| Presión arterial diastólica (mmHg) | 72±13 | 69±14 | 73±13 | 0,058 |
| Duración de la DM (años) | 16±10 | 16±11 | 16±9 | 0,808 |
| Retinopatía diabética | 164 (83,2%) | 51 (85%) | 113 (82,5%) | 0,836 |
| Parámetros bioquímicos | ||||
| Creatinina (mg/dl) | 1,79±0,6 | 2,33±0,6 | 1,55±0,3 | <0,001 |
| Urea (mg/dl) | 86,3±35 | 108,5±35 | 76,4±29,7 | <0,001 |
| Hemoglobina (g/l) | 12,3±1,6 | 11,9±1,7 | 12,5±1,6 | 0,024 |
| HbA1c(%) | 7,6±1,6 | 7,5±1,8 | 7,6±1,5 | 0,575 |
| Sodio (mmol/l) | 141,5±3,1 | 141,8±3,3 | 141,3±3,03 | 0,347 |
| Potasio (mmol/l) | 4,8±0,56 | 4,8±0,77 | 4,79±0,47 | 0,864 |
| Filtrado glomerular-MDRD (mL/min) | 40±11 | 27,6±6 | 44±8,8 | <0,001 |
| Filtrado glomerular-CKD-EPI (mL/min) | 37,6±14 | 23,8±4,5 | 43,7±12,4 | <0,001 |
| Proteinuriaa(mg/día) | 676 (52-9.632) | 772 (52-5.850) | 556 (86-9.632) | 0,319 |
| Alb/Cra(mg/g) | 175,5 (1,3-4.920) | 422,75 (2-4.920) | 151 (1,3-1.237) | 0,016 |
Alb/Cr: cociente albúmina/creatinina; DM: diabetes mellitus; FGe: filtrado glomerular estimado; HbA1c: hemoglobina glicosilada.
Es de interés destacar que los pacientes en estadios 4/5 presentaron una edad media mayor que la de los pacientes con FGe≥30mL/min/1,73m2 (p<0,001). La distribución del sexo fue diferente según función renal: en los de FGe≥30mL/min/1,73m2 la mayoría fueron hombres, mientras que con FGe<30mL/min/1,73m2 la mayoría fueron mujeres. A su vez, los pacientes con FGe<30mL/min/1,73m2 (n=60), presentaron menor hemoglobina que aquellos con un FGe≥30mL/min/1,73m2 (n=137) (p=0,024). Se observó una tendencia a menor HbA1c en pacientes con FG<30mL/min/1,73m2.
Tratamiento con bloqueo del sistema renina-angiotensina-aldosterona en pacientes afectos de enfermedad renal diabéticaEn el momento basal del estudio, primera visita al Servicio de Nefrología, un 62% (n=122) de pacientes seguía tratamiento con BSRAA, este número disminuye al año de seguimiento (53%; n=105). A los 3 años de seguimiento un 50,3% de los pacientes recibían BSRAA (n=80).
La tabla 2 recoge la distribución del tratamiento según el diferencial del FGe con las fórmulas MDRD y CKD-EPI entre el basal y el año de seguimiento y el basal y el tercer año de seguimiento. No se observaron diferencias en cuanto a la disminución de FGe entre los grupos estudiados. No obstante, sí que presentaron diferencias significativas entre las tasas de FGe entre los grupos de tratamiento en los tres puntos de estudio (p<0,001 en los tres casos), presentando aquellos pacientes con FG<30mL/min/1,73m2 menor frecuencia de tratamiento que los pacientes con FGe≥30mL/min/1,73m2. Asimismo, según resultados esperados la frecuencia de retirada fue muy superior en pacientes con FGe<30mL/min/1,73m2 (p=<0,001).
Diferencias de filtrado glomerular según grupo de tratamiento
| Grupo de tratamiento | Media±SD | p | |
|---|---|---|---|
| FGe1CKD-EPI-dife | No BSRAA | -2,43±7,88 | |
| BSRAA discontinuado | -1,96±9,3 | 0,536 | |
| BSRAA mantenido | - 0,15±10,66 | ||
| Total | -1,2±9,6 | 0,261 | |
| FGe3CKD-EPI-dife | No BSRAA | -7,52±11,00 | |
| BSRAA discontinuado | -6,3±12,55 | 0,196 | |
| BSRAA mantenido | -2,32±11,35 | ||
| Total | -4,98±11,89 | 0,072 | |
| FGe1MDRD-dife | No BSRAA | -3,61±6,52 | |
| BSRAA discontinuado | -2,4±7,7 | 0,41 | |
| BSRAA mantenido | -0,5±8,4 | ||
| Total | -1,9±7,8 | 0,09 | |
| FGe3MDRD-dife | No BSRAA | -8,12±10,20 | |
| BSRAA discontinuado | -6,9±12,4 | 0,26 | |
| BSRAA mantenido | -3,3±10,60 | ||
| Total | -5,7±11,4 | 0,09 |
Comparación de medias a través del test ANOVA de un factor. Se consideran significativos los valores p<0,05.
FGe1CKD-EPI-dife: diferencias en las tasas de filtrado glomerular estimadas con la fórmula CKD-EPI, entre el momento inicial y el año de seguimiento; FGe3CKD-EPI-dife: diferencias en las tasa de filtrado glomerular estimadas con la fórmula CKD- EPI entre el momento inicial y el tercer año de seguimiento; FGe1MDRD-dife: diferencias en las tasas de filtrado glomerular estimadas con la fórmula MDRD, entre el momento inicial y el año de seguimiento; FGe3MDRD-dife: diferencias en las tasa de filtrado glomerular estimadas con la fórmula MDRD, entre el momento inicial y el tercer año de seguimiento.
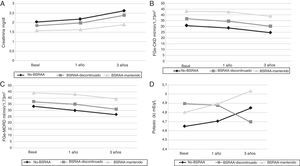
Los parámetros bioquímicos se compararon con los tres grupos de tratamiento mediante la realización de un ANOVA de un factor y test de Tukey, si se observaban diferencias estadísticamente significativas. Las determinaciones de PAS y PAD, no mostraron diferencias estadísticamente significativas al compararlas con los grupos de tratamiento, a excepción de la PAD del primer año de seguimiento (p=0,007). Observamos que los pacientes que no recibieron en ningún momento del seguimiento BSRAA presentaron peor función renal. Dichas diferencias ya se observaban en el momento basal, desde el inicio del seguimiento por nefrología (tabla 3). Así, la creatinina estaba disminuida en los pacientes que recibían BSRAA siempre en comparación con los pacientes que no recibieron BSRAA durante periodo de seguimiento o bien lo recibieron en algún momento de la observación. Dichas diferencias se observaron en el momento basal, al año y a los 3 años de seguimiento (fig. 1A). Sorprendentemente, no se encontraron diferencias en la proteinuria entre los diferentes grupos según el BSRAA. Se observó incremento en el potasio sérico en pacientes del grupo BSRAA mantenido y no BSRAA, y en cambio una disminución en los pacientes del grupo BRSAA discontinuado (fig. 1D).
Distribución de tratamientos según filtrado glomerular
| FGe<30 | FGe≥30 | p | |
|---|---|---|---|
| Basal | <0,001 | ||
| No-BSRAA | 17 (40,5%) | 24 (15,2%) | |
| BSRAA-discontinuado | 19 (45,2%) | 54 (35,1%) | |
| BSRAA-mantenido | 6 (14,3%) | 76 (49,4%) | |
| Al año | <0,001 | ||
| No-BSRAA | 23 (38,3%) | 18 (13,6%) | |
| BSRAA-discontinuado | 30 (50%) | 43 (32,6%) | |
| BSRAA-mantenido | 7 (11,7%) | 71 (53,8%) | |
| A los tres años | <0,001 | ||
| No-BSRAA | 21 (32,3%) | 11 (12,9%) | |
| BSRAA-discontinuado | 33 (50,8%) | 25 (29,4%) | |
| BSRAA-mantenido | 11 (16,9%) | 49 (57,6%) | |
Se observaron diferencias estadísticamente significativas entre la tasa de FGe calculados con la fórmula MDRD y la distribución de los pacientes en los tres grupos de tratamiento.
BSRAA-discontinuado: durante el seguimiento se les prescribió BSRAA, pero durante un periodo de tiempo menor al del seguimiento completo (3 años); BSRAA-mantenido: durante el seguimiento se les prescribió BSRAA y se mantuvo de manera continuada su administración durante los tres años; no-BSRAA: durante el seguimiento no se les prescribió BSRAA.
Evolución de diversos parámetros bioquímicos a lo largo del seguimiento. A) Evolución de los niveles de creatinina sérica a lo largo del seguimiento. En el gráfico se observa la creatinina sérica a lo largo del estudio según los diferentes grupos de tratamiento. Se observan diferencias en cuanto al tratamiento y los valores de la creatinina sérica (p<0,001; p<0,001; p<0,001). No obstante no se observaron diferencias durante el periodo de seguimiento en cada grupo individualmente. Resultados expresados en media de la creatinina sérica mg/dl.
B) Evolución de las tasas de FGe-CKD-EPI a lo largo del seguimiento. No se observaron diferencias estadísticamente significativas entre el momento basal y el primer año, ni entre el inicio y el tercer año. No obstante, sí que se observaron entre los grupos de tratamiento y las tasas de FGe.
C) Evolución de la tasa de FGe-MDRD a lo largo del seguimiento. No se observaron diferencias estadísticamente significativas entre el momento basal y el primer año, ni entre el basal y tercer año. No obstante, sí que se observaron entre los grupos de tratamiento y las tasas de FGe.
D) Evolución de las concentraciones de potasio sérico a lo largo del seguimiento. No se encontraron diferencias estadísticamente significativas entre el tratamiento y las concentraciones.
BSRAA: bloqueantes del sistema renina angiotensina aldosterona.
Las variaciones del FGe calculado con ambas fórmulas a lo largo del seguimiento en función del grupo de tratamiento se muestran en la tabla 2. No existieron diferencias estadísticamente significativas en ninguno de los dos periodos de estudio considerados, entre el momento basal y el primer año, ni entre el periodo basal ni el tercer año. La evolución media de las tasas de FGe calculadas con las dos fórmulas puede verse en las figuras 1B y C.
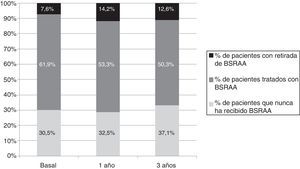
Retiradas del bloqueo del sistema renina-angiotensina-aldosteronaLa evolución temporal de la prescripción de BSRAA se encuentra recogida en la figura 2. En el momento basal del estudio, primera visita en nefrología, del total de 137 pacientes en tratamiento con BSRAA, este tratamiento se retiró por completo en 15 casos (12%), 14 de ellos en monoterapia y uno en terapia combinada IECA-ARA2. Además, un paciente presentó retirada del tratamiento con antialdostéronico pero persistió el tratamiento con ARA2.
Evolución temporal de las frecuencias de prescripción de tratamiento con BSRAA. Se representa en porcentaje (%) el número de pacientes que nunca recibieron tratamiento con BSRAA durante el periodo de seguimiento y los que sí lo recibieron. Dentro de los que sí les fue prescrito se indica el % de pacientes en que fue retirado.
BSRAA: bloqueantes del sistema renina angiotensina aldosterona.
Al año de seguimiento, de los 133 pacientes en tratamiento con BSRAA, se retiraron en 28 pacientes (21%). Por indicaciones clínicas entre el momento basal y el primer año se inició medicación en pacientes que no lo tomaban previamente. Al finalizar el seguimiento del estudio (tercer año), del total de 100 pacientes en tratamiento con BSRAA (total de 159 pacientes seguidos), se retiraron los BSRAA en 20 pacientes (20%).
Comparación de la evolución de la función renal según la retirada o no de bloqueo del sistema renina-angiotensina-aldosterona durante el periodo de seguimientoAquellos pacientes con FGe menores presentaron con menor frecuencia tratamiento con BSRAA en el momento basal y a lo largo del seguimiento (tabla 3). Además, el número de tratamientos retirados fue mayor en aquellos pacientes que presentaron una menor función renal. De hecho, la principal justificación de las retiradas que se realizaron a lo largo del seguimiento fue el deterioro de la función renal. El deterioro de la función renal fue la causa de retirada del BSRAA en 13 de las 15 retiradas en el momento basal, 22 de las 28 al año y 19 de las 20 al tercer año de seguimiento. La hiperpotasemia fue una causa de retirada con una frecuencia menor, con un total de 5 retiradas: 3 fueron en el momento basal y 2 al primer año del seguimiento. Hipotensión arterial sintomática junto con otras fue causa de retirada con una menor frecuencia.
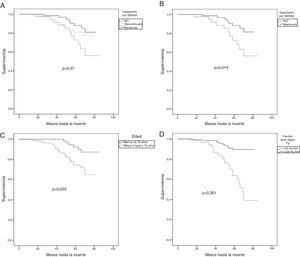
Desarrollo de complicaciones asociadas a enfermedad renal diabética y mortalidadPara estudiar la mortalidad utilizamos las curvas de Kaplan-Meier y test de Log-Rank (fig. 3). Se dividió la muestra según el tratamiento recibido sin BSRAA, con BSRAA mantenido o discontinuado durante el periodo (fig. 3A), sin obtenerse diferencias estadísticamente significativas. Posteriormente analizamos la muestra excluyéndose los pacientes en los que se discontinuó el tratamiento (fig. 3B). Los pacientes que no recibieron tratamiento con BSRAA presentaban mayor mortalidad (p=0,014). Además, los pacientes fueron divididos según la edad en menores de 70 años y 70 años o más (fig. 3C). Los que tenían 70 años o más presentaron mayor mortalidad (p=0,003). Por último, dividimos la cohorte según función renal medida por FG con fórmula CKD-EPI (<30mL/min vs≥30mL/min) (fig. 3D). Los pacientes con peor función renal presentaron mayor mortalidad (p<0,001).
Estudio de la supervivencia mediante curvas de Kaplan-Meier y test de Log-Rank. Comparación de supervivencia de los pacientes dividido según: A) tratamiento sin BSRAA, de forma mantenida y discontinuada. B) Tratamiento o no con BSRAA (p=0,014). C) Menores de 70 años vs. igual o mayores de 70 años (p=0,003). D) Función renal medida por FGe CKD-EPI con FGe<30mL/min vs. FGe>o igual a 30mL/min (p<0,0001).
Analizamos los factores de riesgo para mayor mortalidad durante el seguimiento de los pacientes. En el análisis multivariado de regresión de Cox para riesgos proporcionales encontramos que el FGe<30mL/min y una mayor edad son factores de riesgo independientes de mortalidad y no lo fue el uso de BSRAA con significación estadística (tabla 4).
Análisis multivariado de regresión de Cox de riesgos proporcionales para mortalidad
| Variables | HR (95% IC) | p |
|---|---|---|
| Edad (años) | 1,08 (1,02-1,14) | 0,008 |
| Función renal (FGe CKD<30mL/min) | 4,30 (1,77-10,45) | 0,001 |
| Antecedente retinopatía diabética | 1,62 (0,64-4,15) | 0,312 |
| Antecedentes vasculopatía periférica | 1,58 (0,45-5,58) | 0,481 |
| Antecedente accidente vasculocerebral | 1,10 (0,14-8,58) | 0,933 |
| Antecedente cardiopatía isquémica | 1,92 (0,53-6,96) | 0,318 |
| Sexo (varón versus mujer) | 0,90 (0,42-1,93) | 0,789 |
| Tratamiento con BSRAA | 1,08 (0,63-1,86) | 0,775 |
BSRAA: bloqueantes del sistema renina angiotensina aldosterona; FG: filtrado glomerular estimado; HR: hazard ratio; IC: intervalo de confianza.
Cuando se estudió la necesidad de TRS en comparación con los diferentes grupos de BSRAA a lo largo del seguimiento no se observaron diferencias. Así, la necesidad de TRS (trasplante renal o diálisis) fue similar independientemente del tratamiento. Tampoco observamos diferencias en cuanto al BSRAA y la necesidad de TRS en el estudio combinado tanto de diálisis como de trasplante renal (datos no mostrados).
DiscusiónEn nuestro estudio hemos observado que un 79% de los pacientes con ERD en nuestro medio han seguido tratamiento con BSRAA (un 41,5% de forma mantenida y un 37,5% de forma discontinuada). En pacientes con FGe<30mL/min la prescripción de tratamiento fue menor en comparación con pacientes con FGe conservado18. El uso de BSRAA en pacientes con ERC estadios 4-5 es controvertido. Mientras hay estudios que postulan su efecto beneficioso, otros estudios sugieren que tras su retirada se observa un aumento de la tasa de FGe19. Estudios previos han mostrado que la prescripción de los BSRAA ha ido aumentando con el tiempo, incluso se sugiere que la aparición de fórmulas que han facilitado el cálculo del FGe ha podido facilitar el aumento de su prescripción20. Así, en Canadá se observó una prescripción del 67% en pacientes afectos de ERC atendidos en asistencia primaria18. De modo similar, un 67% de pacientes afectos con ERC estadios 4-5 seguían tratamiento con BSRAA en Polonia21. En nuestro medio, no conocemos estudios previos diseñados con la finalidad de conocer la prescripción de BSRA en pacientes afectos de ERD avanzada.
Una de las principales dianas, no solo para el tratamiento de la hipertensión arterial sino para retrasar la progresión de la insuficiencia renal en la ERD es el BSRAA22,23. Diversos estudios han demostrado que tanto los IECA como los ARA2 son capaces de frenar la progresión de la ERD. El estudio RENAAL analizó 1.513 diabéticos tipo 2 con nefropatía, tratados con losartán o placebo además de su tratamiento antihipertensivo convencional, y mostró un retraso en la progresión de la ERC24. Por otro lado, en pacientes diabéticos tipo 2 normotensos microalbuminúricos seguidos durante 7 años, Ravid et al. observaron que el tratamiento con enalapril se asociaba con una reducción del 42% del riesgo absoluto de desarrollar nefropatía diabética establecida y la suspensión del tratamiento se acompañaba de un nuevo empeoramiento de la función renal25. Murakami et al. observaron mejor función renal en la década del 2000 al 2009 comparada con la del 2010 al 2015 en diabéticos con ERC avanzada, atribuyendo esta diferencia al uso más extendido de BSRAA20.
Respecto al posible efecto del doble bloqueo estudios recientes en pacientes con ERD como el ONTARGET contraindican el uso del tratamiento combinado de IECA y ARA2, dado que se ha demostrado una disminución de la excreción urinaria de albúmina, pero a expensas de una disminución de la tasa de FGe26. En las guías del European Renal Best Practice Workgroup Diabetes de manejo de la ERD en pacientes con ERC estadio 3b o mayor (FGe<45mL/min) no se recomienda el uso de la terapia combinada IECA-ARA210.
El BSRAA, enlentece la progresión de la ERD1,7. En cambio, en nuestro estudio no observamos diferencias en cuanto a la progresión de la función renal (en términos de creatinina plasmática, FGe y necesidad de TRS) entre los grupos divididos según tratamiento con BSRAA. Dichas diferencias podrían estar relacionadas con varios factores: 1) peor función renal en el momento basal, 2) menor tiempo de seguimiento de los pacientes y 3) tamaño muestral pequeño (sin poder alcanzar la potencia estadística necesaria), especialmente pacientes con ERD y FGe<30mL/min/1,73m2.
Los pacientes que no siguieron tratamiento con BSRAA eran pacientes con una función renal inicial más deteriorada y edad avanzada, lo que puede condicionar los resultados posteriores, haciendo que este grupo de pacientes (mencionados en el estudio como no BSRAA) puedan presentar un mayor deterioro de las tasas de FGe y que este sea más rápido, condicionando a la vez una mayor necesidad de TRS. No obstante, en nuestro estudio no encontramos mayor necesidad de TRS en ninguno de los grupos estudiados, dicho efecto podría explicarse por diferentes factores: a) el tiempo corto del estudio (3 años), b) el tamaño muestral pequeño y c) las diferencias de edad entre grupos.
En nuestro estudio observamos un aumento de mortalidad estadísticamente significativo entre el grupo que no recibió nunca BSRAA en comparación con el grupo que lo recibió siempre, en los pacientes con edad mayor de 70 años y los pacientes con peor función renal (FGe<30mL/min). Sin embargo, en el análisis multivariado de factores de riesgo independientes de mortalidad observamos que únicamente la edad y la función renal fueron estadísticamente significativos. Estudios previos de nuestro grupo y otros, mostraron que en pacientes con ERC terminal la edad es un factor de riesgo independiente de mortalidad27.
En relación con el grupo de tratamiento de los pacientes, en nuestro estudio se observó que existía una asociación entre el FGe que presentaba el paciente y el grupo de tratamiento al que pertenecía, de manera que aquellos que presentaban una función renal más precaria y edad más avanzada generalmente eran excluidos del tratamiento con BSRAA. En los pacientes en que se retiró el BSRAA no se observó una mejoría de la función renal (disminución creatinina o aumento del FGe) a largo plazo. En contraste, otros estudios realizados en pacientes con ERC estadios 3-4 (48% DM en grupo mantenimiento y 45% DM en grupo retirada) e hiperpotasemia que han demostrado que el mantenimiento del tratamiento con BSRAA es beneficioso para la preservación de la función renal28.
En relación con las retiradas de BSRAA durante el seguimiento se observó que un 12% de los pacientes en tratamiento con BSRAA se retiró en el periodo basal, el 20% al primer año de seguimiento y el 19% en el tercer año de seguimiento. El principal motivo fue el empeoramiento de la función renal (87% del total de retiradas), seguido por la hiperpotasemia (10%). Dicho porcentaje es similar al previamente reportado en otros estudios29.
Las principales limitaciones de nuestro estudio son el tamaño muestral, con un número reducido de participantes (sobre todo el grupo de pacientes en estadios 4-5), la diferencia de edad entre los grupos de tratamiento (7 años), así como el periodo de seguimiento corto, que podrían distorsionar los resultados obtenidos. Además, otra de las limitaciones que presenta es el carácter retrospectivo del mismo. Por último, este estudio se realizó en un solo centro (Hospital del Mar), los participantes fueron todos de raza caucásica y la mayoría de ellos de edad avanzada.
Actualmente existe un estudio en marcha llamado «STOP-ACEi». Se trata de un ensayo clínico multicéntrico, aleatorizado controlado en el que se han incluido 410 pacientes con ERC grado 4-5 con tratamiento con IECA, ARA2 o ambos. Se aleatorizan en dos brazos: control (continuar con el tratamiento con BSRAA) o retirarlo, con 205 pacientes en cada uno. El seguimiento será de 3 años y el endpoint primario será valorar la evolución de la función renal30. Probablemente el resultado de dicho estudio ayudará a esclarecer la decisión de tratamiento en este tipo de pacientes.
En resumen, los resultados de este trabajo demuestran que en la población afecta de ERD los pacientes que no seguían BSRAA presentaron de forma basal peor función renal (aumento de la creatinina sérica y FGe disminuido) y edad avanzada. La evolución de los pacientes que no recibieron tratamiento, pese a función renal basal más deteriorada, fue similar a los pacientes que recibieron tratamiento en términos de necesidad de TRS y eventos cardiovasculares. La mortalidad fue mayor en los pacientes con una peor función renal y una edad más avanzada. Es necesario realizar estudios con poblaciones de características similares respecto a edad y grado de afectación renal, así como con mayor tiempo de seguimiento. Así mismo, nuevos estudios prospectivos y multicéntricos de retirada de BSRAA en pacientes con ERD avanzada serán de gran utilidad en el futuro.
Autoría/colaboradoresSB y COG han contribuido igualmente en el trabajo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido financiado por las siguientes becas: Fondo de Investigación Sanitaria-Instituto Carlos III-FEDER (ISCIII-FEDER PI16/00620); Fondo de Investigación Sanitaria-Instituto Carlos III-FEDER (ISCIII-FEDER PI14/00557); y Red de Investigación Renal, Fondo de Investigación Sanitaria-Instituto Carlos III, Subprograma RETICS (RD16/0009/0013_REDinREN).
Este trabajo ha sido realizado en el marco de Doctorado de Medicina de la Universitat Autónoma de Barcelona (UAB).