Introducción: Se ha observado una relación entre el aumento de la transferencia de solutos (aumento del D/P de creatinina) y la disminución de la ultrafiltración, el aumento de la mortalidad y el riesgo de fracaso de la técnica en pacientes en diálisis peritoneal (DP). Las altas tasas de transporte de solutos se asocian con una mayor excreción peritoneal de proteínas (EPP) y esto se ha relacionado con un mayor riesgo de peritonitis. Nuestro objetivo fue evaluar la posible asociación entre la EPP, el número de episodios de peritonitis y el D/P de fósforo. Material y métodos: Se realizó un estudió longitudinal de cohorte prospectivo en pacientes en DP, a los que se les midió el D/P de fósforo, la EPP, el número de episodios de peritonitis, parámetros de adecuación, así como diferentes variables clínicas y bioquímicas. Resultados: Se incluyeron 60 pacientes en programa de DP ambulatoria. Se encontró una correlación significativa positiva (r = 0,369; p = 0,005) entre el D/P de fósforo y la EPP, al igual que entre la EPP y el número de episodios de peritonitis (r = 0,65; p = 0,044). Finalmente, se encontró que a mayor EPP y a mayor D/P de fósforo, menor nivel sérico de albumina (r = –0,50, p = 0,001 y r = –0,621, p = 0,000, respectivamente). Conclusiones: La EPP se asocia significativamente con el número de episodios de peritonitis y el D/P de fósforo.
Introduction: There is a relationship between increased transfer of solutes (increased D/P creatinine) and decreased ultrafiltration, increased mortality and risk of technique failure in peritoneal dialysis patients. High rates of solute transport are associated with increased peritoneal protein excretion (PPE) and this has been associated with an increased risk of peritonitis. Our objective was to evaluate the possible association between the PPE, the number of episodes of peritonitis and the D/P phosphate. Material and methods: A prospective longitudinal cohort study in PD patients. D/P phosphate, PPE, the number of episodes of peritonitis, as well as adequacy parameters and clinical and biochemical variables were measured. Results: We included 60 patients on ambulatory peritoneal dialysis. We found a significant positive correlation (r=.369, P=.005) between the D/P phosphate and PPE, as well as between the PPE and the number of episodes of peritonitis (r=.65, p=.044). Finally, we found that the higher PPE and D/P phosphate, the lower serum albumin was (r=–0.50, p=.001 and r=–0.621, p=.000, respectively). Conclusions: PPE is significantly associated with the number of episodes of peritonitis and the D/P phosphate.
INTRODUCCIÓN
La supervivencia técnica en diálisis peritoneal (DP) sigue siendo menor que en hemodiálisis (HD)1. Los episodios de peritonitis y el fallo en la ultrafiltración (UF) son las causas más importantes de abandono del tratamiento2.
La excreción peritoneal de proteínas (EPP) es universalmente considerada como un efecto adverso de la DP3. El transporte peritoneal de proteínas se produce esencialmente a través de poros intercelulares grandes y está limitado más bien por el tamaño, más que por la restricción de carga4. Las proteínas plasmáticas están presentes en el efluente peritoneal de los pacientes en DP. Esto conduce a una pérdida de proteínas peritoneales en promedio de 5 a 10,5 g por día en pacientes estables, pero puede aumentar a 20 g durante un episodio de peritonitis. La mayor parte de las proteínas son albúmina; sin embargo, existen otras, como la transferrina, las inmunoglobulinas, las proteínas del complemento, la ß2-microglobulina y la α2-macroglobulina5,6.
La EPP puede operar como un marcador de disfunción de poros grandes, lo que sugiere disfunción endotelial sistémica, inflamación y, eventualmente, mayor riesgo cardiovascular y de peritonitis en los pacientes con DP3,7.
La presencia de una alta tasa de transporte de solutos pequeños puede ser una manifestación local o sistémica de inflamación, debido al aumento de la permeabilidad no selectiva de proteínas durante la inflamación peritoneal con la generación local de prostaglandinas, principalmente prostaciclina y prostaglandina E26,8.
Existe una relación entre el aumento de la transferencia de solutos (D/P de creatinina) y la disminución de la UF con el tiempo en DP, lo cual, además, se asocia con mayor pérdida peritoneal de proteínas, hipoalbuminemia y malnutrición. Este proceso se ve acentuado por episodios de peritonitis y se ha asociado con aumento de la mortalidad y mayor riesgo de fracaso de la técnica en pacientes en DP9-13. La hipoalbuminemia se ha considerado como un marcador de comorbilidad, más que de malnutrición6.
El D/P de fósforo obtenido mediante una prueba de equilibrio peritoneal (PEP) correlaciona de manera adecuada con el D/P de creatinina. Algunos autores consideran que el aclaramiento de creatinina proporciona una buena estimación del aclaramiento de fósforo; sin embargo, los primeros en categorizar el transporte de fósforo en una población fueron Bernardo et al.14, observando que la distribución de la población en las diferentes categorías era diferente a la distribución presentada para la categorización de transporte de creatinina, por lo que sugirieron que, a pesar de tener una adecuada correlación el D/P de fósforo con el D/P de creatinina, esta última no es una medida suficientemente adecuada para clasificar a los pacientes de acuerdo con el transporte de fósforo. Por otra parte, el D/P de fósforo no puede considerarse equivalente al D/P de creatinina, dado que no existe concordancia entre ambas a pesar de tener una adecuada correlación, lo cual fue demostrado en un estudio de nuestro servicio por E. López (comunicación personal actualmente sometida a revisión editorial), quien encontró una baja concordancia entre ambos parámetros a pesar de tener una adecuada correlación.
El objetivo del estudio fue evaluar la posible asociación entre la EPP, el número de episodios de peritonitis y el D/P de fósforo en una población mexicana en DP continua ambulatoria.
MATERIAL Y MÉTODOS
Se trata de un estudio observacional, prospectivo, en el cual se incluyeron pacientes prevalentes de la consulta de DP del Instituto Nacional de Cardiología Ignacio Chávez, mayores de 16 años, que se encontraran en DP por lo menos desde un mes antes de iniciar el estudio. Se excluyeron los pacientes que cursaban con un evento de peritonitis activa o que hubiesen concluido un tratamiento antibiótico dentro de los dos meses previos al inicio del estudio. Se eliminaron los pacientes que presentaban fallo de ultrafiltrado (UF menor a 400 ml tras la aplicación de una bolsa de 2000 ml al 4,25 % tras 4 horas de estancia en cavidad peritoneal), con problemas mecánicos del catéter (tiempo de entrada del líquido dializante mayor de 12 minutos y de salida mayor de 30 minutos) o con una celularidad en el líquido peritoneal mayor o igual a 100 leucocitos por campo de alto poder en el momento del estudio.
A todos los pacientes se les realizó una PEP modificada15 empleando una solución al 4,25 % de glucosa, habiendo mantenido en cavidad durante 8 a 12 horas previas una solución al 1,5 %. Se tomaron muestras basales de sangre para la medición de albúmina, proteínas totales, colesterol, triglicéridos y calcio, así como muestras séricas a las 0, 2 y 4 horas para la medición de fósforo y creatinina. Las muestras de líquido de diálisis se tomaron igualmente a las 0, 2 y 4 horas y se determinó en ellas glucosa, creatinina, fósforo y nitrógeno de urea. Al final de la PEP se realizó un conteo celular del líquido de diálisis para descartar proceso infeccioso activo.
Se estimó la EPP a partir de una colección completa de líquido de diálisis en 24 horas (expresada en g/24 h). Para cuantificar el contenido total de proteínas en el dializado, se utilizó un ensayo colorimétrico modificado (rojo pirogalol) que ha demostrado ser un método preciso y que no se ve afectado por las altas concentraciones de glucosa en el dializado3,4.
Se calculó el Kt/V de urea, aclaramiento de fósforo y de creatinina semanal y ajustado a superficie corporal, tanto en su forma renal como peritoneal y total, además del equivalente de nitrógeno proteico ajustado a peso (nPNA).
Se categorizó el tipo de transporte peritoneal de solutos de acuerdo al transporte de creatinina16 y fósforo.
El Kt/V, nPNA y el aclaramiento de fósforo y creatinina se obtuvieron mediante las siguientes fórmulas:
1) Kt/V urea semanal = 7 x (CE x VE/CB x t)/V, donde CE es concentración de urea en el efluente, VE es volumen del efluente, CB es concentración de urea en suero y V es volumen de distribución en litros; fórmula de Watson según género:
Hombres = 2,447 – (0,09156 x edad) + (0,1074 x estatura cm) + (0,3362 x peso kg)
Mujeres = –2,097 + (0,1069 x estatura cm) + (0,2466 x peso kg)
2) Aclaramiento de fósforo = (concentración de PO4 [líquido de diálisis u orina] [en mg/dl]/PO4 sérico en mg/dl) x volumen de drenaje de líquido dializante x 7 (corregido a 1,73 m2 superficie corporal (SC) y expresado en litros/semana).
3) Aclaramiento de creatinina = (concentración de creatinina [líquido de diálisis u orina] [en mg/dl]/creatinina sérica en mg/dl) x volumen de drenaje de líquido dializante x 7 (corregido a 1,73 m2 SC y expresado en litros/semana).
4) nPNA = fórmula de Randerson
34,6 + (5,86 x [(BUN LD x vol LD 24 h) + (BUN urinario x volorina 24 h)]), donde BUN es nitrógeno ureico en sangre y LD, líquido de diálisis.
Volumen de distribución de urea (fórmula de Watson)/0,58
Los pacientes fueron seguidos por un período de 8 meses, documentando durante este el número de episodios de peritonitis. Como indicador de comorbilidad se empleó el índice de Charlson17.
ANÁLISIS ESTADÍSTICO
Los resultados se expresan como promedio ± desviación estándar o bien como proporciones, según corresponda. La comparación de medias se llevó a cabo con prueba T para muestras independientes o bien con ANOVA de 1 factor para el caso de más de dos grupos. De acuerdo con la distribución de cada variable, en algunos casos se emplearon alternativas no paramétricas a las pruebas antes mencionadas (U Mann-Whitney o ANOVA de Kruskal-Wallis). La comparación de proporciones se efectuó con prueba χ2. La búsqueda de asociación entre dos variables se realizó mediante el coeficiente de correlación de Pearson. Para fines de segmentación o clasificación de algunas variables, se empleó la herramienta de intervalos óptimos o bien la creación de un árbol de clasificación por método CHAID (Chi Squared Automatic Interaction Detector). Se consideró un valor de p < 0,05 como significativo. Se empleó el paquete estadístico SPSS versión 15 para Windows.
RESULTADOS
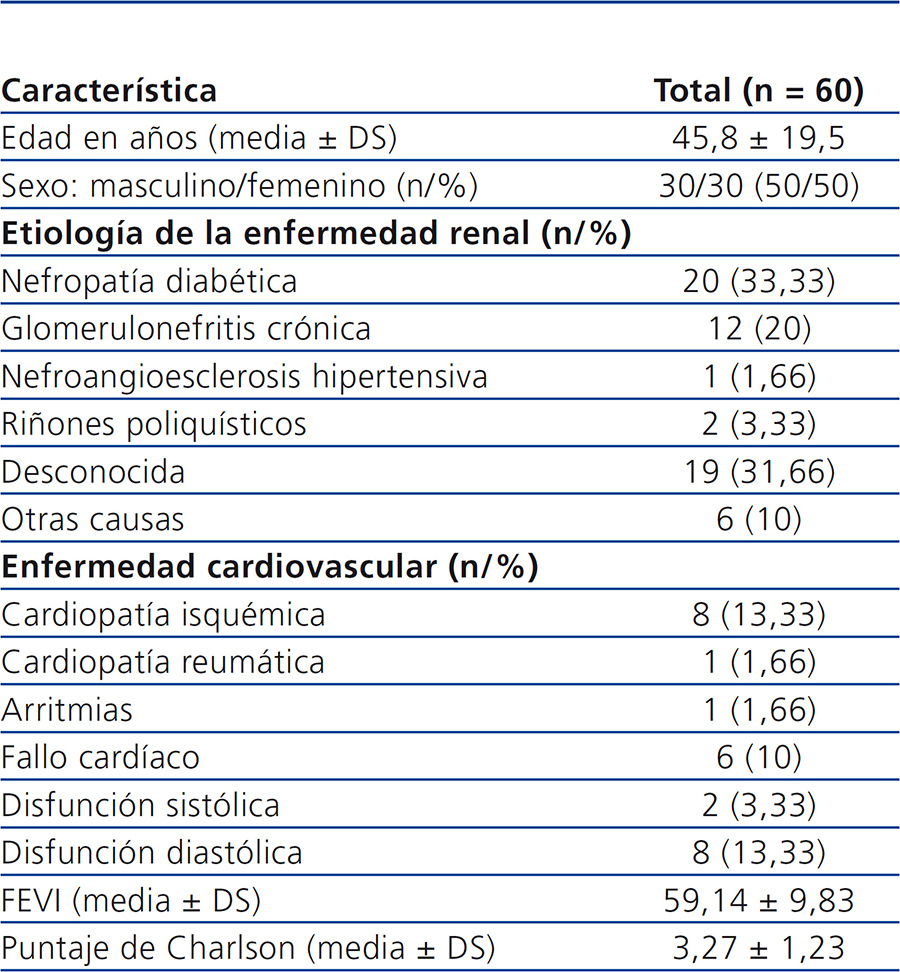
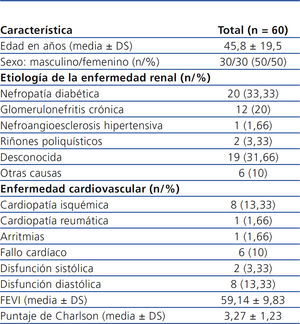
Se incluyeron 60 pacientes de la consulta de DP. Solo se eliminaron 2 pacientes para el análisis final debido a que se perdieron del seguimiento. De los pacientes que iniciaron el estudio, 30 eran de sexo femenino (50 %), con una edad promedio de 45,8 ± 19,54 años (tabla 1). Los valores bioquímicos basales para el grupo total fueron: creatinina sérica 11,26 ± 4,05 mg/dl, BUN 54,28 ± 14,57 mg/dl, fosfatasa alcalina 140,35 ± 90,46 U/l, calcio x fósforo 50,13 ± 16,05, y para la proteína C reactiva (PCR) 7,3 ± 9,8 mg/dl
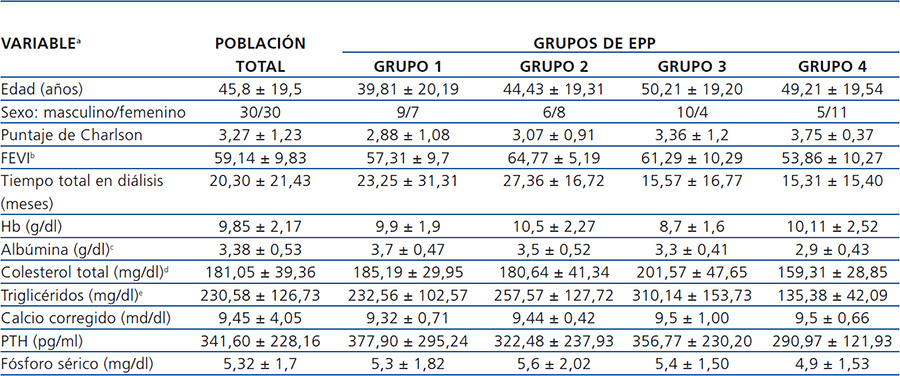
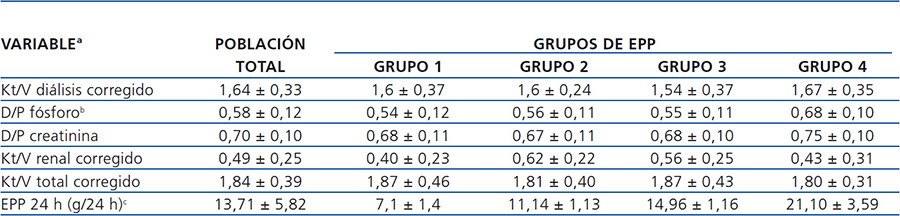
La población total estudiada fue dividida, según la EPP total en 24 horas y empleando el método de intervalos óptimos, en cuatro grupos: grupo 1: ≤ 9,11 g/24 h, grupo 2: 9,12 a 12,66 g/24 h, grupo 3: 12,67 a 17,39 g/24 h y grupo 4: ≥ 17,40 g/24 h. También, como parte del análisis y empleando la misma estrategia de intervalos óptimos, se dividieron los pacientes de acuerdo al valor de albúmina sérica (albúmina ≤ 3,4 mg/dl y albúmina > 3,4 mg/dl).
Al analizar por grupos de EPP, no encontramos diferencia significativa en la distribución de edad, sexo y el puntaje de comorbilidad de Charlson.
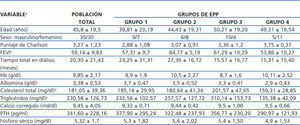
En lo que respecta al valor de la fracción de eyección del ventrículo izquierdo, encontramos una diferencia significativa entre el grupo 2 y el grupo 4, siendo mayor en el grupo 2. Para el caso de la albúmina sérica, la diferencia se encontró entre el grupo 1 y el grupo 4, siendo menor en el grupo 4. Finalmente, para el colesterol y los triglicéridos séricos la diferencia significativa se encontró entre el grupo 3 y el grupo 4, con valores mayores en el grupo 3. El resto de las características clínicas y de laboratorio se describen en la tabla 2 y tabla 3, sin haberse identificado otras diferencias significativas entre grupos.
Casos de peritonitis
Durante el seguimiento, 18 pacientes presentaron al menos un cuadro de peritonitis, 10 pacientes presentaron un solo episodio, 5 pacientes dos episodios y 3 pacientes tres episodios de peritonitis, que corresponden al 16,7, 8,3 y 5 % respectivamente. Treinta y nueve pacientes no presentaron ningún episodio de peritonitis (66,7 %). Al comparar el número de episodios de peritonitis por sexo, se encontró un número significativamente mayor en el sexo masculino (12 vs. 6, p = 0,000).
Excreción peritoneal de proteínasy episodios de peritonitis
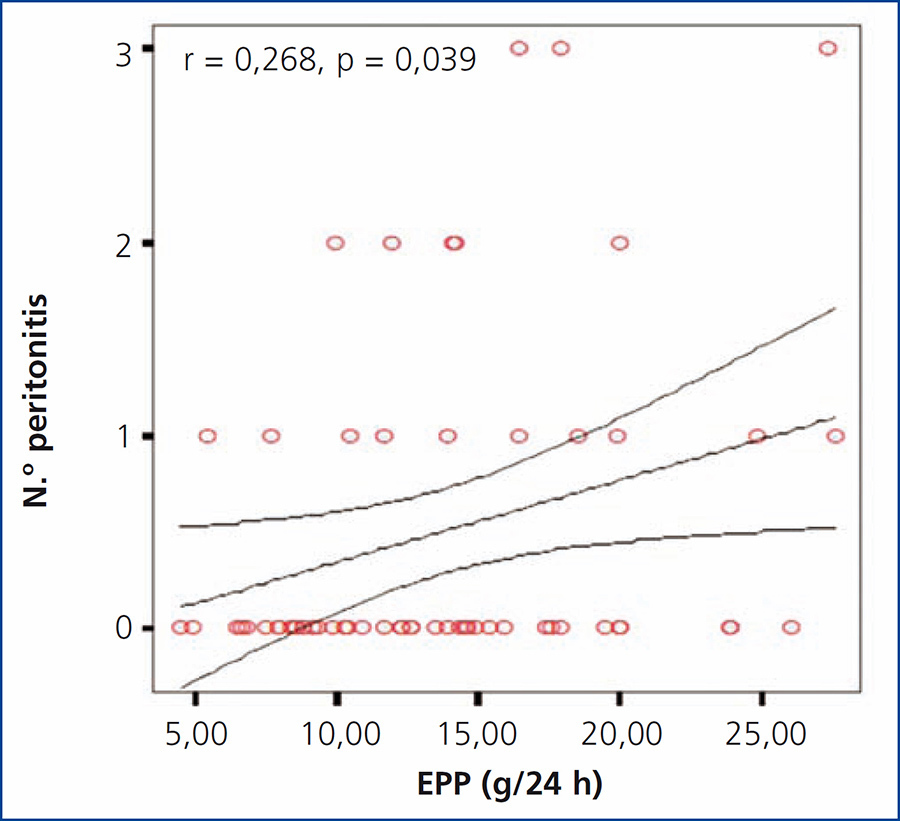
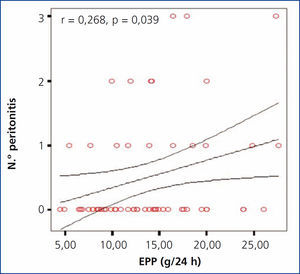
Se investigó la posible asociación entre la EPP en 24 horas y el número de eventos de peritonitis, encontrando una correlación significativa positiva (r = 0,65; p = 0,044), como se muestra en la gráfica (figura 1). No se encontró una diferencia significativa al comparar entre los diferentes grupos de EPP con el número de episodios de peritonitis; sin embargo, se observó una tendencia al alza en el número de peritonitis en los grupos con mayor EPP, encontrado una mayor diferencia entre el grupo 1 y el grupo 4 (2 en grupo 1 vs. 7 en grupo 4).
Categoría del trasporte de creatinina y fósforo en relación con los casos de peritonitis
Como otra parte del análisis, la población total estudiada se dividió de acuerdo con las categorías definidas por los parámetros empleados de transporte de solutos. Para el caso del D/P de creatinina, se consideraron 4 grupos según lo propuesto por Twardowski. En lo que respecta al D/P de fósforo, usamos los 5 grupos obtenidos basándonos en un árbol de clasificación, como se detalla a continuación: grupo 1 (≤ 0,50), grupo 2 (0,51-0,55), grupo 3 (0,56-0,66), grupo 4 (0,67-0,76) y grupo 5 (> 0,76).
El número de episodios de peritonitis no fue significativamente diferente entre los grupos de acuerdo a las categorías de transporte tanto para creatinina como para fósforo.
La asociación entre el D/P de fósforo y el número de episodios de peritonitis, si bien no fue significativa, sí mostró una tendencia (r = 0,23, p = 0,094). Al evaluar la asociación entre el D/P de creatinina y el número de episodios de peritonitis, tampoco se encontró una correlación significativa (r = 0,21, p = no significativa).
D/P de creatinina y D/P de fósforo con relación a la excreción peritoneal de proteínas
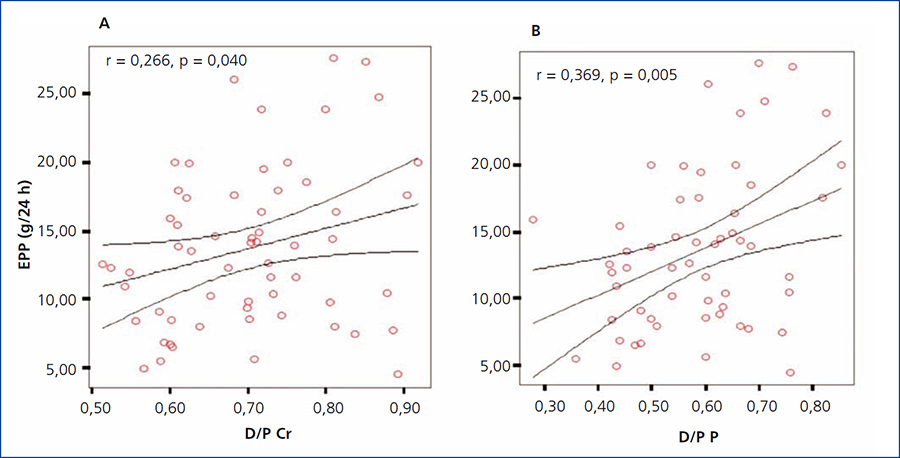
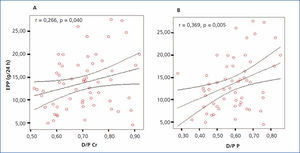
Aplicando la prueba de asociación de Pearson, se encontró una correlación positiva significativa (r = 0,266; p = 0,040) entre el D/P de creatinina y la EPP. Aplicando la misma prueba de asociación, pero ahora entre el D/P de fósforo y la EPP, encontramos una mayor y significativa fuerza de asociación (r = 0,369; p = 0,005) (figura 2 A y B).
Grupos de excreción peritoneal de proteínas y la categoría de transporte de creatinina y fósforo
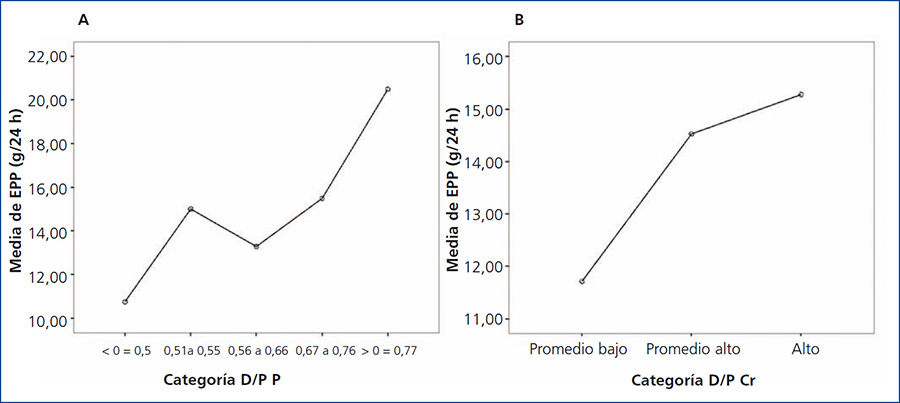
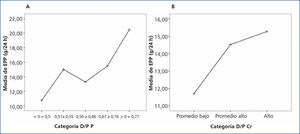
Al comparar la EPP entre grupos de acuerdo al transporte de creatinina, no se encontraron diferencias significativas; sin embargo, se observó una tendencia al alza en los valores de EPP en los grupos de transporte para creatinina más rápidos. Por otra parte, sí se encontraron diferencias significativas (p = 0,042) al comparar la EPP entre categorías de transporte de fósforo, siendo mayor la EPP en los grupos con transporte alto (figura 3 A y B).
Comorbilidades y grupos de excreción peritoneal de proteínas
En lo que se refiere a comorbilidades, la proporción de casos con cardiopatía isquémica no fue significativamente diferente entre grupos de EPP; sin embargo, se observó una tendencia a un mayor porcentaje de casos de cardiopatía isquémica en los grupos con mayor EPP. Tampoco se identificaron diferencias significativas al comparar los porcentajes de pacientes con disfunción sistólica o diastólica o con evento vascular cerebral (EVC) por grupos de EPP.
Diabetes y supervivencia
Se reportaron 21 casos de pacientes diabéticos que corresponden al 35 % del total de la muestra de pacientes estudiados. Al comparar la supervivencia entre los pacientes diabéticos y los no diabéticos, no se encontró diferencia significativa.
La proporción de pacientes diabéticos fue significativamente diferente entre grupos de EPP, siendo mayor en los grupos con una elevada EPP.
Tiempo total de diálisis peritoneal y excreción peritoneal de proteínas
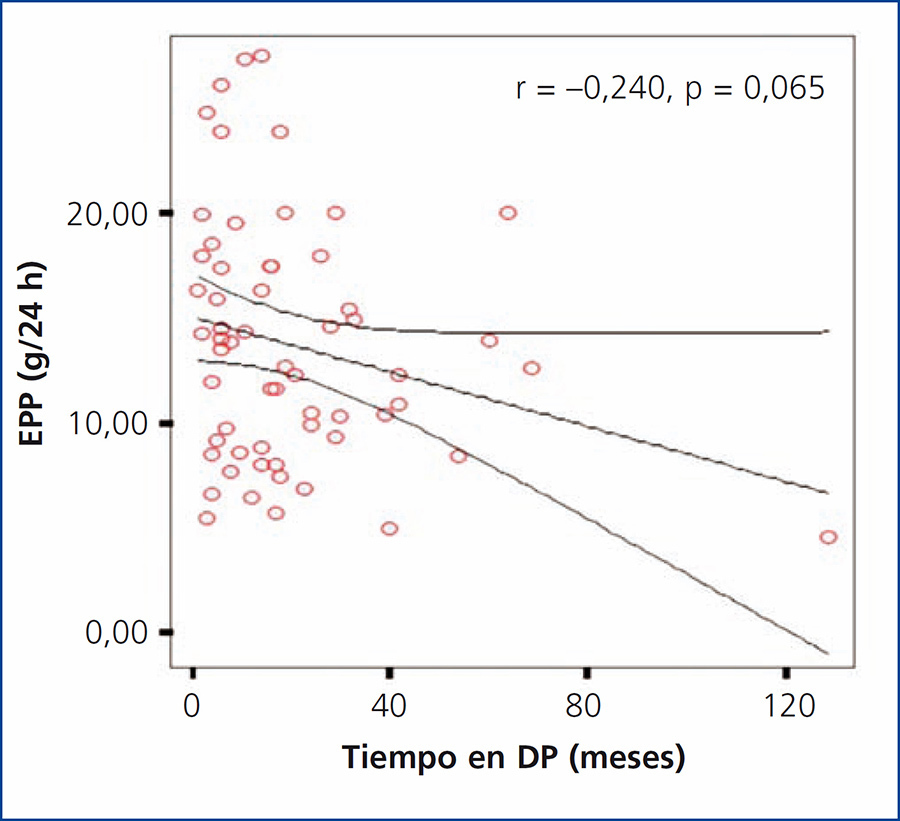
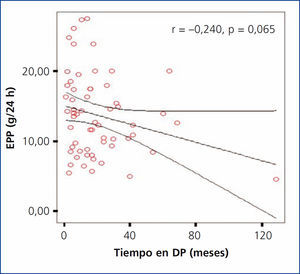
En nuestro estudio se encontró un tiempo promedio de estancia en DP para la población total de 20,30 ± 21,43 meses (rango 1-129). Al evaluar si existía una asociación entre el tiempo de diálisis y la EPP, se encontró una correlación negativa no significativa (r = –0,240; p = 0,65); sin embargo, se observó una tendencia a presentar menor EPP en los pacientes que tenían mayor tiempo en diálisis (figura 4). Al comparar el tiempo en diálisis entre grupos de EPP, tampoco se encontraron diferencias significativas.
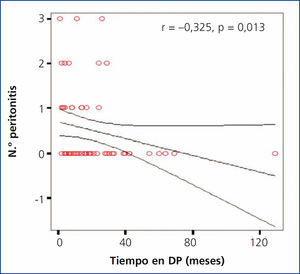
Número de peritonitis y tiempo total de diálisis
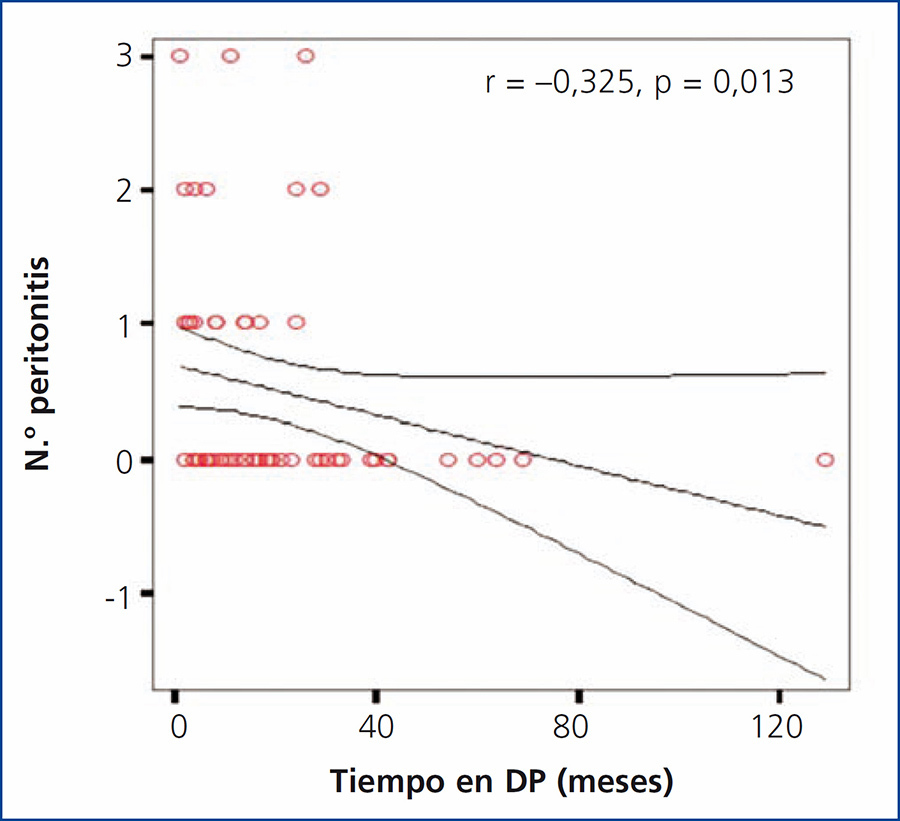
Se encontró una correlación negativa significativa entre el tiempo total de estancia en diálisis y el número de episodios de peritonitis (r = –0,325; p = 0,013) (figura 5).
Asociación de la albúmina con las diferentes variables
El valor de albúmina sérica promedio en la muestra total de pacientes fue de 3,38 ± 0,53 g/dl (rango 2,1-4,5). Para fines de comparación y de acuerdo con la distribución de los valores de albúmina sérica, se crearon dos grupos: grupo 1: albúmina sérica ≤ 3,4 g/dl, y grupo 2: albúmina sérica > 3,4 g/dl. Al evaluar la EPP entre dichos grupos, se encontró que el grupo con menor valor de albúmina sérica tenía una EPP significativamente mayor en comparación con el grupo con mayor albúmina sérica (p = 0,001). También se encontró una diferencia significativa entre grupos de albúmina sérica al comparar el D/P de creatinina y el D/P de fósforo, siendo ambos menores en el grupo con mayor albúmina sérica (p = 0,000 para ambas variables). No encontramos diferencia significativa entre los grupos de albúmina respecto al tiempo de estancia en diálisis.
Al comparar entre grupos de albúmina la proporción de pacientes en cada categoría de transporte de creatinina, encontramos que la proporción de pacientes con transporte alto fue significativamente mayor en el grupo con albúmina más baja (p = 0,006). Para el caso de las diferentes categorías de transporte de fósforo, la proporción de pacientes en las dos categorías de transporte más alto fue significativamente mayor también en el grupo con mayor albúmina sérica (p = 0,002).
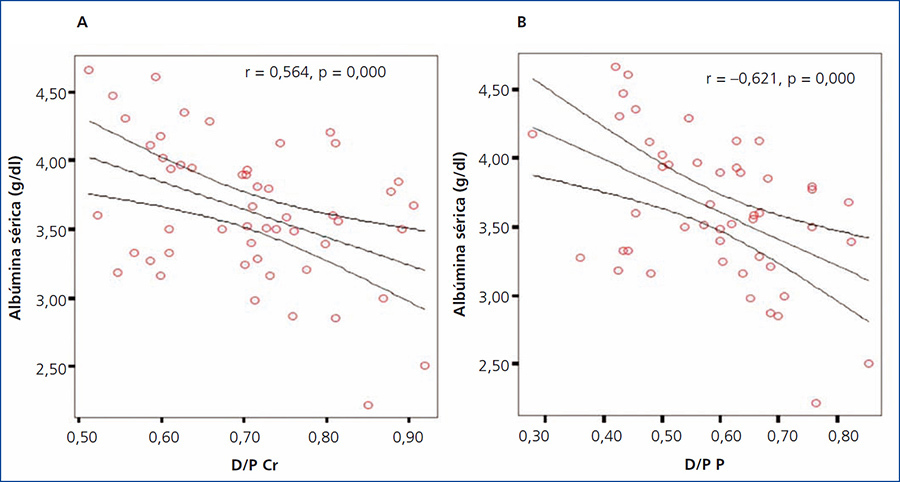
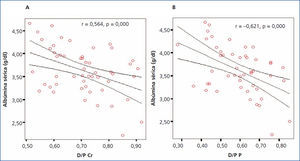
Al evaluar la posible asociación entre el valor de albúmina sérica y el D/P de creatinina y fósforo, encontramos para ambos casos una correlación negativa significativa (r = –0,564, p = 0,000 y r = –0,621, p = 0,000 para D/P de creatinina y D/P de fósforo, respectivamente), observando que a mayor valor de albúmina sérica, menor D/P de creatinina y fósforo (figura 6 A y B).
Desenlace final
De los 60 pacientes incluidos para este estudio, hallamos que al final del seguimiento 47 pacientes (80 %) continuaban en DP, 5 pacientes (8,33 %) fallecieron, 3 pacientes (5 %) cambiaron de modalidad a HD debido a pérdida de cavidad secundaria a peritonitis, 3 pacientes (3,33 %) recibieron trasplante y 2 pacientes (3,33 %) se perdieron a efectos de seguimiento.
DISCUSIÓN
El mayor problema de los pacientes en DP hoy en día sigue siendo la pérdida de la cavidad peritoneal útil. Los cuadros de peritonitis y el fallo en UF son las causas más importantes de abandono del tratamiento. Se ha demostrado que de un solo episodio de peritonitis pueden resultar cambios morfológicos y funcionales de la membrana peritoneal. La peritonitis se asocia con una disminución de la UF neta, con incremento del aclaramiento de solutos, aumento de la absorción de glucosa y aumento de la pérdida peritoneal de proteínas. La asociación entre la EPP y el número de episodios de peritonitis está relacionada con una mayor pérdida de la cavidad peritoneal y, por lo tanto, es una de las principales causas de cambio de modalidad dialítica2.
En nuestra población estudiada encontramos una incidencia de episodios de peritonitis del 18 %, por debajo de lo reportado en la literatura, que ha estimado que el 45 % de los pacientes sufre una peritonitis por lo menos una vez durante los primeros seis meses de tratamiento con DP continua ambulatoria (DPCA) y la tasa aumenta al 60-70 % durante el primer año. Se observó una recurrencia del 44 %, la cual es mayor a lo reportado en otras series, que llega a ser de entre el 20 y 30 % y es una de las razones más frecuentes para la interrupción de la DPCA.
En tres de nuestros pacientes en estudio, fue necesario cambio de modalidad de DPCA a HD. Al evaluar la causa de este cambio, encontramos que en los tres casos se debió a recurrencia de peritonitis, lo que ocasionó disfunción de la cavidad peritoneal.
Al comparar la incidencia de peritonitis por sexo, hallamos una mayor frecuencia tanto de episodios como de recurrencia de peritonitis en el sexo masculino, (66,66 y 62,5 %, respectivamente), datos que son semejantes a los de otros estudios, donde se reporta una frecuencia de hasta el 55 %.
Los valores de EPP encontrados en este estudio fueron similares a lo reportado en otras publicaciones5,18,19, además de que nuestros resultados confirman la asociación reconocida entre la EPP y el número de episodios de peritonitis en pacientes en DP. Asimismo, observamos que a mayor EPP la frecuencia de peritonitis aumenta.
Al evaluar el tiempo de estancia en DP con respecto a la EPP y los episodios de peritonitis, encontramos que los pacientes que tenían un mayor tiempo en diálisis presentaban menos episodios de peritonitis y una menor EPP, aunque este último punto no fue estadísticamente significativo. Lo anterior sugiere que ocurren cambios estructurales y funcionales dentro de la membrana peritoneal2.
El estado de transporte alto de pequeños solutos de la membrana peritoneal, como se define por una PEP estándar, se ha asociado con aumento de la mortalidad y el riesgo de fracaso de la técnica en pacientes en DP. Este tipo de trasporte se asocia fuertemente con la genética, la inflamación, con una gran superficie peritoneal vascular y, en particular, con condiciones de comorbilidad. El daño en la membrana peritoneal también puede asociarse con el tiempo de estancia en diálisis, así como con el uso de soluciones de diálisis bioincompatibles y con el número de episodios de peritonitis20.
Se ha contemplado la hipótesis de que los pacientes con altas tasas de transporte de solutos pueden tener una mayor pérdida de proteínas en el líquido dializante, lo cual llevaría al desarrollo de hipoalbuminemia y malnutrición. También existe evidencia que sugiere que los pacientes con este tipo de transporte tienen una UF menos eficaz, lo que resulta en expansión de volumen e hipoalbuminemia dilucional13. Lo anterior también se observó en nuestro estudio, ya que aquellos pacientes que pertenecían al grupo de albúmina de menor valor se relacionaron con un D/P de creatinina y fósforo más alto, así como con una mayor EPP.
En nuestra población hallamos una mayor transferencia de solutos en los pacientes con mayor excreción de proteínas, observando una mejor asociación de la EPP con el D/P de fósforo, en comparación con el D/P de creatinina. Encontramos que el D/P de fósforo era menor que el D/P de creatinina en los cuatro grupos de EPP. Una posible explicación a esto es la forma en que el fósforo se distribuye en el organismo, ya que alrededor del 5 al 10 % del fósforo plasmático está fijo a proteínas, a diferencia de la creatinina, que no va ligada a proteínas21. En el caso del grupo 4 de EPP, encontramos que el valor del D/P de fósforo es más cercano al D/P de creatinina. Al evaluar este fenómeno, hallamos que dicho grupo con mayor EPP se asoció con niveles más bajos de albúmina sérica, lo cual pudiera explicar la menor diferencia entre los valores de D/P de creatinina y D/P de fósforo, ya que al disminuir las proteínas en suero también disminuye la cantidad de fósforo que se une a ellas. También se observó asociación entre el D/P de fósforo y el número de episodios de peritonitis y, aunque este hallazgo no fue estadísticamente significativo, hubo una tendencia a presentar más episodios de peritonitis a mayor D/P de fósforo.
Se han identificado algunas variables asociadas al pronóstico de la función peritoneal, entre las que se encuentran la EPP, el tipo de transporte peritoneal de solutos, el número de episodios de peritonitis, el tiempo en diálisis, entre otros, y, si bien el D/P de creatinina se ha considerado también como un marcador pronóstico, nosotros observamos que el D/P de fósforo tuvo mejor correlación que el D/P de creatinina con la EPP y el número de episodios de peritonitis, por lo que dicho parámetro podría ser considerado como una nueva herramienta de evaluación pronóstica, además de su utilidad para fines de adecuación de diálisis. Lo anterior deberá evaluarse en un estudio con un mayor tamaño muestral y con seguimiento a largo plazo.
En lo que se refiere a la subpoblación de pacientes con diabetes mellitus, encontramos que dichos pacientes presentaban mayor EPP. Esta mayor pérdida peritoneal de proteínas en pacientes diabéticos parece estar relacionada con un elevado transporte peritoneal de solutos. Estudios previos han sugerido que esta mayor permeabilidad de la membrana peritoneal a las proteínas podría ser un resultado de las lesiones microvasculares diabéticas en un patrón similar al observado en el daño a la membrana glomerular22.
Se estudió de forma dirigida si los episodios de peritonitis que presentaron los pacientes antes de realizar el estudio tenían alguna relación con los episodios presentados durante el estudio, así como su relación con la hipoalbuminemia y el D/P de fósforo, encontrando que de los 60 pacientes estudiados solo 12 pacientes habían presentado episodios previos de peritonitis y estos episodios habían aparecido con un lapso de tiempo mayor de dos meses antes de iniciar el estudio. De estos 12 pacientes, solo 3 presentaron uno o más episodios de peritonitis durante el seguimiento del estudio y en dos de estos pacientes fue necesario el cambio de modalidad dialítica a HD debido a pérdida de la cavidad. Solo 4 pacientes, de los 12 casos con episodios previos de peritonitis, presentaban albúminas séricas menores de 3,4 g/dl y 6 tenían un D/P de fósforo alto. No identificamos una asociación significativa entre el número de episodios previos de peritonitis con el nivel sérico de albúmina ni tampoco con el D/P de fósforo.
Existen dos principales limitantes en nuestro estudio. La primera es el limitado tamaño de muestra y la segunda es el tiempo de seguimiento, corto. Otra limitante de nuestro estudio es el tipo de población estudiada, ya que se incluyeron únicamente un 35 % de pacientes con diabetes, en comparación con otros estudios, donde se han incluido hasta un 50 %.
Concluimos que la EPP se asocia significativamente con el número de episodios de peritonitis y con el valor de albúmina sérica. Observamos una asociación significativa entre la EPP y el D/P de fósforo y de este con la albúmina sérica. El D/P de fósforo tuvo una mejor asociación con el número de peritonitis en comparación con el D/P de creatinina.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Tabla 1. Población en estudio: características clínicas basales
Tabla 2. Características clínicas y bioquímicas basales del grupo total y por excreción peritoneal de proteínas
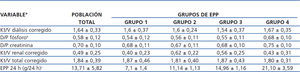
Tabla 3. Características de adecuación basales del grupo total y por excreción peritoneal de proteínas
Figura 1. Gráfica de correlación entre la excreción peritoneal de proteínas y el número de episodios de peritonitis
Figura 2. Gráfica de correlación entre el D/P y la excreción peritoneal de proteínas
Figura 3. Gráfico de medias para excreción peritoneal de proteínas según categoría de transporte
Figura 4. Correlación entre tiempo en diálisis y la excreción peritoneal de proteínas
Figura 5. Correlación entre el tiempo total en diálisis y el número de episodios de peritonitis
Figura 6. Correlación entre albúmina sérica y el D/P