La enfermedad renal crónica (ERC) y la fibrilación auricular (FA) frecuentemente coexisten, amplificando el riesgo de eventos cardiovasculares y de mortalidad. En pacientes con ERC estadio3 y FA no valvular los anticoagulantes orales de acción directa (ACOD) han demostrado, comparados con antagonistas de la vitaminaK (AVK), igual o superior eficacia en la prevención de ictus y embolismo sistémico, y mayor seguridad. No existen ensayos aleatorizados de la eficacia y la seguridad de ACOD y AVK en la ERC avanzada. Por otra parte, estudios observacionales sugieren que los ACOD, comparados con warfarina, se asocian a menor riesgo de daño renal agudo y de generación/progresión de la ERC. En este trabajo se revisan los aspectos epidemiológicos y fisiopatológicos de la asociación ERC y FA, las evidencias de la eficacia y seguridad de la warfarina y de los ACOD en las diversas fases de la ERC con FA, así como la comparación entre warfarina y ACOD en la eficacia y seguridad anticoagulante, y en sus efectos renales.
Chronic kidney disease (CKD) and atrial fibrillation (AF) frequently coexist, amplifying the risk of cardiovascular events and mortality. In patients with CKD stage3 and non-valvular AF, direct oral anticoagulants (DOACs) have shown, compared to vitaminK antagonists (VKA), equal or greater efficacy in the prevention of stroke and systemic embolism, and greater safety. There are no randomized trials of the efficacy and safety of DOACs and VKA in advanced CKD. On the other hand, observational studies suggest that DOACs, compared to warfarin, are associated with a lower risk of acute kidney damage and generation/progression of CKD. This paper reviews the epidemiological and pathophysiological aspects of the CKD and AF association, the evidence of the efficacy and safety of warfarin and ACODs in various stages of CKD with AF as well as the comparison between warfarin and ACODs in efficacy and anticoagulant safety, and in its renal effects.
La enfermedad renal crónica (ERC) es definida por la presencia de alteraciones estructurales o funcionales con relevancia clínica presentes al menos durante 3meses. Sus manifestaciones más frecuentes son el descenso del filtrado glomerular (FG) y/o la presencia de albuminuria. Se aceptan fórmulas de estimación del FG (FGe) como MDRD (modification of diet in renal disease) y CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration)1-3.
El cálculo del cociente albúmina/creatinina en la primera orina de la mañana es el método más aceptado de determinación de la albuminuria. La combinación de FGe (ml/min) y albuminuria (mg/g) sirve para establecer los diferentes estadios de ERC2,3: estadio 1: FG>90 y albuminuria; estadio2: FG 60-89 y albuminuria; estadio3a: FG 45-59; estadio3b: FG 30-44; estadio4: FG: 15-29; estadio5: FG<15; estadio5D: diálisis. En cualquiera de los estadios la presencia de albuminuria implica mayor riesgo renal y vascular. El estadio2 identifica ERC ligera; el 3, ERC moderada; el 4, ERC severa, y el 5 y 5D representan fallo renal sin y con terapia renal sustitutiva, respectivamente4.
La prevalencia de ERC en España es del 15%. Es más prevalente en varones, en personas de edad avanzada y en sujetos con enfermedad cardiovascular (ECV) o con factores de riesgo cardiovascular5. La ERC es un relevante factor de riesgo de ECV. La diabetes mellitus (DM) y la hipertensión arterial (HTA) son las causas más importantes de ERC.
La prevalencia de fibrilación auricular (FA) en población general es del 0,95%, y en sujetos de más de 60años alcanza el 8,5%, asociándose, además, con ECV y con HTA6.
La ERC se asocia a FA. En sujetos con aumento de albuminuria y/o reducción del FG hay mayor incidencia de FA. En un gran estudio poblacional de 10.328 sujetos seguidos durante 10años, comparados con los que tenían un FGe≥90ml/min/1,73m2, la hazard ratio (HR) de FA era 1,3 (IC95%: 1,1-1,6) en los que tenían ERC estadio2, y 3,2 (IC95%: 2,3-4,5) en aquellos con ERC estadio4. El riesgo era especialmente elevado cuando se combinaba un descenso del FGe y macroalbuminuria (HR 13; IC95%: 6-28)7. En un metaanálisis de 25 estudios en sujetos con ERC y diálisis la prevalencia de FA era del 11,6%8. Una mayor edad y más tiempo en diálisis se asocian de forma independiente con FA9. En pacientes ≥67años la incidencia de FA en los tres primeros meses de diálisis peritoneal era de 19/100 pacientes/año, y de 37/100 pacientes/año en hemodiálisis (HD)10.
Ante la consistencia de la asociación entre ERC y FA las guías incluyen la ERC como un factor de riesgo de FA11.
Son varios los mecanismos que pueden explicar la mayor frecuencia de FA en la ERC. Ambas comparten factores de riesgo (edad avanzada, HTA, diabetes, ECV, obesidad, entre otros) y mecanismos patogénicos, como inflamación, estrés oxidativo y aumento de actividad del sistema renina-angiotensina-aldosterona (SRAA). Por otra parte, en la ERC hay mecanismos adicionales, como calcificaciones vasculares, aumento de la actividad simpática, de la rigidez arterial y del FGF23 (fibroblast growth factor)12 que, directa ó indirectamente, propician la aparición de FA. La asociación ERC y FA persiste en todos los subgrupos de ERC tras el ajuste a otras comorbilidades y factores de riesgo vascular, lo que sugiere implicación de elementos adicionales propios de la ERC13.
Consecuencias de la fibrilación auricular en la enfermedad renal crónicaEfecto de la fibrilación auricular sobre la función renal en la enfermedad renal crónicaLa ERC favorece la aparición y el mantenimiento de la FA, y esta, a su vez, repercute en la función renal. En un estudio prospectivo poblacional, tras 6años de seguimiento, el riesgo de aparición de FA en sujetos con FGe entre 60 y 30 y <30ml/min/1,73m2 era del 22 y del 57%, respectivamente. A su vez, en los sujetos con FA inicial se objetivó, durante el seguimiento, un aumento del riesgo de descenso del FG y de aparición de proteinuria, independiente de la presencia de HTA tratada o DM14. La ERC favorece la recurrencia de la FA tras ablación con catéter y, a su vez, la restauración del ritmo sinusal produce mejoría mantenida de la función renal15,16. En adultos con ERC la aparición de FA favorece la progresión de la enfermedad renal17. Además del posible efecto hemodinámico de la FA sobre la función renal, esta relación bidireccional entre ERC y FA apoya el concepto de que las dos condiciones comparten vías anormales de señalización molecular que contribuyen a su patogénesis18,19.
Efecto de la fibrilación auricular sobre eventos cardiovasculares en la enfermedad renal crónicaEn la ERC hay mayor riesgo de eventos cardiovasculares (CV) y tromboembólicos que se fundamenta en alteraciones fisiopatológicas que favorecen la hipercoagulabilidad, como mayor estasis sanguínea atrial izquierda y el aumento de mediadores procoagulantes y proinflamatorios20,21.
En la ERC se observan, además, alteraciones de la estructura del coágulo de fibrina que se incrementan con el grado de ERC y pueden condicionar mayor resistencia a la fibrinólisis22,23.
La FA aumenta 4-5 veces el riesgo de ictus. En todos los grados de ERC la presencia de FA aumenta la incidencia de ictus y la mortalidad8,24. Los sujetos con ERC y FA tienen mayor riesgo de ictus y de mortalidad que aquellos con ERC sin FA8,25.
En el estudio Chronic Renal Insufficiency Cohort (CRIC) se comprobó que, en sujetos con ERC y FGe 20-60ml/min/1,73m2, la FA de nueva aparición se asociaba de forma independiente a mayor riesgo de insuficiencia cardiaca (IC), infarto de miocardio, ictus y muerte26. En sujetos con ERC en terapia con diálisis y FA de nueva aparición el ajuste al riesgo competitivo de muerte hospitalaria puede reducir la importancia de la participación de la FA en el ictus y así mitigar la eficacia de algunas estrategias terapéuticas preventivas en el ictus27.
Estratificación del riesgo de ictus en la fibrilación auricular con enfermedad renal crónicaUn elemento clave en la prevención del ictus relacionado con la FA es una estratificación efectiva del riesgo. La puntuación CHADS2 y CHA2DS2-VASc constituye una herramienta validada para evaluar el riesgo de accidente cerebrovascular y embolismo sistémico12. En enfermos en diálisis, tanto CHADS2 como CHA2DS2-VASc predicen el riesgo de ictus28.
Dado que la disfunción renal es un potente predictor de riesgo de ictus, se ha propuesto su inclusión en la estratificación de dicho riesgo. La adición del Ccreat. estimado por la fórmula de Cockcroft-Gault (C-G) al CHADS2 (añadiendo 2 puntos en caso de Ccreat. <60ml/min, el denominado R2CHADS2) mejora ligeramente el índice neto de reclasificación de riesgo de ictus y embolismo sistémico comparado con CHADS2 y CHA2DS2-VASc. Sin embargo, el rendimiento de R2CHADS2, en términos de estadístico «c», es modesto29. La adición de FGe por MDRD a CHADS2 y CHA2DS2-VASc tampoco añade información independiente predictiva de ictus30. El sistema de puntuación ATRIA (anticoagulation and risk factors in atrial fibrillation), que incluye un FGe <45ml/min y la proteinuria, ofrece, comparado con CHADS2 y CHA2DS2-VASc, una ligera mejora marginal del estadístico «c» en la predicción de ictus en pacientes con FA31.
La ERC se asocia con factores de riesgo de ictus incluidos en CHADS2 y CHA2DS2-VASc, por lo que no sorprende la falta de un efecto aditivo «independiente» de los parámetros de función renal cuando se añaden a aquellos. El CHA2DS2-VASc sigue siendo el instrumento de puntuación más recomendado para estratificación de riesgo de ictus11.
Varios modelos de puntuación de riesgo de hemorragia, entre ellos HAS-BLED, incluyen la disfunción renal, disfunción que aumenta el riesgo de sangrado. Las guías establecen que, en líneas generales, un riesgo elevado de hemorragia no debe condicionar exclusión de terapia anticoagulante. Más bien han de identificarse y corregirse los factores de riesgo de hemorragia que sean tratables11.
Prevención de ictus y anticoagulación oral en la enfermedad renal crónica con fibrilación auricularEl tratamiento más efectivo para la tromboprofilaxis del ictus y embolismo sistémico en sujetos con FA es la anticoagulación oral. Desde hace más de 50años disponemos de fármacos (los cumarínicos warfarina y acenocumarol) que inhiben el metabolismo de la vitaminaK, necesaria para la síntesis de varios factores de coagulación, y desde hace 10años tenemos otros fármacos inhibidores del factorXa (rivaroxabán, apixabán, edoxabán y betrixabán [este último no comercializado en Europa]) y de la trombina (dabigatrán) conocidos como anticoagulantes orales de acción directa (ACOD).
Dosis ajustadas de warfarina, comparadas con «no tratamiento» o con terapia antiplaquetaria, reducen la incidencia de ictus en pacientes con FA no valvular32. Pese a su efectividad, los antagonistas de la vitaminaK (AVK) tienen inconvenientes: estrecho rango terapéutico, lentitud en el comienzo y desaparición de sus efectos, interacciones farmacológicas y restricciones dietéticas además de requerimiento de monitorización y ajuste de dosis33.
La anticoagulación es especialmente compleja en los pacientes con ERC. En esta situación concurren fenómenos procoagulantes y prohemorrágicos. Los primeros están condicionados, entre otros, por las frecuentes alteraciones vasculares, el aumento de mediadores proinflamatorios, la disfunción endotelial, más resistencia a la fibrinólisis y una mayor agregación plaquetaria21,23,34. Los fenómenos prohemorrágicos derivan de una disfunción plaquetaria en etapas más avanzadas de la ERC y su defectuosa adhesión al subendotelio, y son potenciados, además, por la coexistencia frecuente de anemia34.
Warfarina en la enfermedad renal crónicaHay pocos estudios con warfarina en pacientes con FA y ERC, que en estadios 4, 5 y 5D han sido excluidos sistemáticamente de los ensayos clínicos. La administración de warfarina en dosis ajustada (international normalized ratio [INR] de 2-3), en comparación con aspirina más dosis bajas fijas de warfarina, en un número limitado de pacientes con ERC estadio3 redujo un 76% el riesgo de ictus/embolismo sistémico sin incremento de las hemorragias mayores35.
En una revisión sistemática y metaanálisis de estudios observacionales que incluían 11 cohortes (41.767 con ERC estadios3 y4, y 6.776 con ERC estadio5D), la warfarina reducía el riesgo de ictus y de mortalidad (36 y 25%, respectivamente), sin aumento del riesgo de hemorragias mayores en el grupo con ERC estadios3-4. En los pacientes con ERC en terapia sustitutiva con diálisis la warfarina no disminuía el riesgo de ictus/embolismo sistémico ni de mortalidad, con un aumento significativo de las hemorragias mayores. Se concluye de este estudio36 que la warfarina tiene una relación riesgo/beneficio favorable en la ERC moderada, pero no en los que tienen ERC estadio5D. Sin embargo, cuando se analizan los estudios (todos observacionales) sobre el efecto de la warfarina en sujetos con FA y ERC en diálisis se comprueba que hay resultados muy variables: reducción de la mortalidad total, efectos neutros, incremento de hospitalizaciones recurrentes de causa CV y, en algunos estudios, un aumento de ictus embólico y hemorrágico37-39. Esta disparidad puede deberse, en parte, a diferencias en la calidad de la anticoagulación. Estudios observacionales que disponen de resultados de INR objetivan que el tiempo en rango terapéutico (TRT), medida de calidad de anticoagulación (se recomienda que sea >70%), es más bajo en sujetos con ERC, lo que se relaciona con eventos embólicos y hemorrágicos40. Cuanto más bajo es el FG, menor es el TRT y mayor el número de ictus41.
El impacto de la ERC en el TRT puede atribuirse a varias causas: aunque la warfarina se elimina por vía hepática, es posible que la ERC afecte a su metabolismo y a su biodisponibilidad alterando la actividad del citocromo p450 2C942; en la ERC puede haber menos adherencia terapéutica debido a la frecuente polimedicación de estos enfermos; por último, las restricciones dietéticas por el riesgo de hiperkaliemia y la disbiosis intestinal, frecuente en la ERC43, pueden afectar a la ingesta y a la producción intestinal de vitaminaK.
Frecuentemente en la ERC moderada/severa se requiere una menor dosis de warfarina para mantener una anticoagulación terapéutica, hay un deficiente control de anticoagulación y un mayor riesgo de hemorragias44,45.
Anticoagulantes orales de acción directa en la enfermedad renal crónica y fibrilación auricularEn los cuatro estudios fase3 de los ACOD (dabigatrán, rivaroxabán, apixabán y edoxabán) se analizaron la eficacia en prevención de ictus/embolismo sistémico y la seguridad (complicaciones hemorrágicas mayores) de los ACOD en pacientes con FA no valvular de moderado-alto riesgo comparándolos con warfarina46-49. Un metaanálisis de los cuatro ensayos demuestra que los ACOD tienen mayor eficacia en la reducción de ictus/embolismo sistémico, tendencia a menor riesgo de hemorragias mayores, menor mortalidad y menos riesgo de ictus hemorrágico, y mayor riesgo de hemorragia gastrointestinal50. En definitiva, un perfil favorable riesgo-beneficio de los ACOD comparados con warfarina.
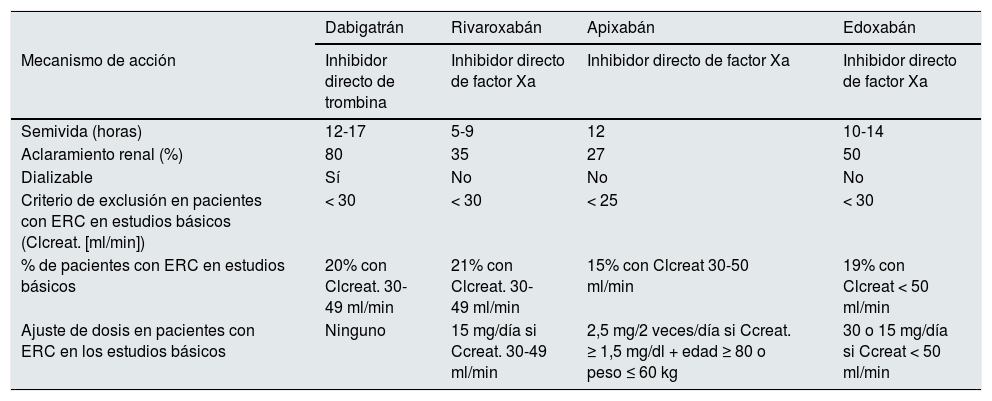
Cuando se considera el uso de ACOD en pacientes con ERC y FA no valvular es importante tener en cuenta su metabolismo51,52. Todos son resecretados por el intestino a través de la glicoproteínaP; excepto el dabigatrán, los demás son metabolizados en diferente grado por el citocromo p450, subtipo 3A4, y sobre todo difieren en el grado de excreción renal (tabla 1). Son estas características farmacodinámicas las que han condicionado, en los estudios de ACOD, uno de los criterios de exclusión (pacientes con ERC estadios4, 5 y5D). La función renal también fue el determinante de la dosis (tabla 1). Pese a la ausencia de estudios clínicos de seguridad y en base a estudios farmacocinéticos, se han propuesto recomendaciones de prescripción y ajuste de dosis de los ACOD según la función renal, recomendaciones que varían según las agencias reguladoras y guías53-55 (tabla 2).
Metabolismo de los anticoagulantes orales de acción directa (ACOD) y pacientes con enfermedad renal crónica (ERC) incluidos en ensayos básicos de los AD
| Dabigatrán | Rivaroxabán | Apixabán | Edoxabán | |
|---|---|---|---|---|
| Mecanismo de acción | Inhibidor directo de trombina | Inhibidor directo de factor Xa | Inhibidor directo de factor Xa | Inhibidor directo de factor Xa |
| Semivida (horas) | 12-17 | 5-9 | 12 | 10-14 |
| Aclaramiento renal (%) | 80 | 35 | 27 | 50 |
| Dializable | Sí | No | No | No |
| Criterio de exclusión en pacientes con ERC en estudios básicos (Clcreat. [ml/min]) | < 30 | < 30 | < 25 | < 30 |
| % de pacientes con ERC en estudios básicos | 20% con Clcreat. 30-49 ml/min | 21% con Clcreat. 30-49 ml/min | 15% con Clcreat 30-50 ml/min | 19% con Clcreat < 50 ml/min |
| Ajuste de dosis en pacientes con ERC en los estudios básicos | Ninguno | 15 mg/día si Ccreat. 30-49 ml/min | 2,5 mg/2 veces/día si Ccreat. ≥ 1,5 mg/dl + edad ≥ 80 o peso ≤ 60 kg | 30 o 15 mg/día si Ccreat < 50 ml/min |
Clcreat.: aclaramiento de creatinina.
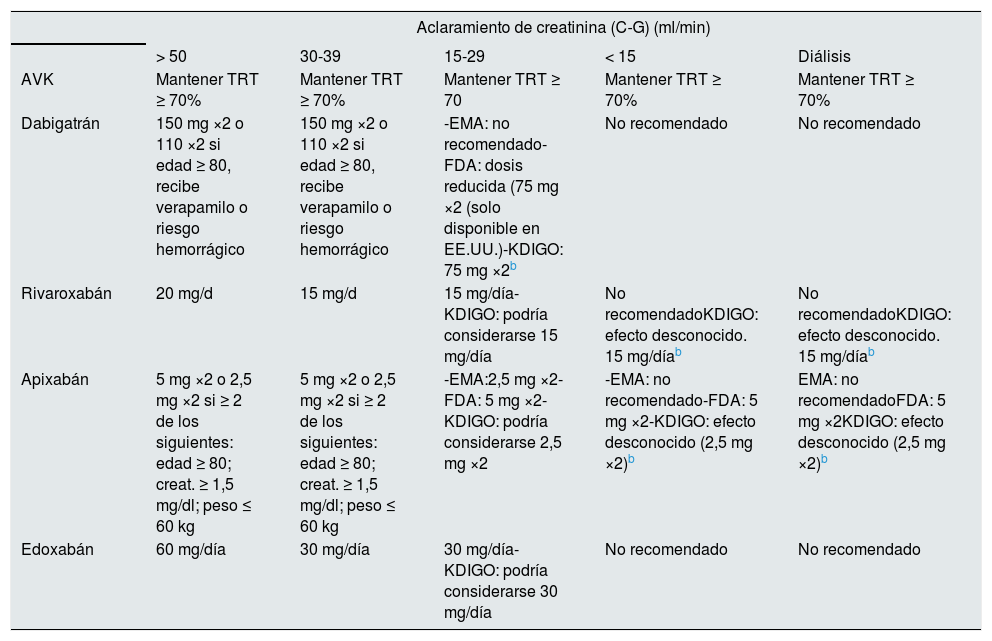
Dosis de anticoagulantes orales según función renal (según EMA, FDA y KDIGO)a
| Aclaramiento de creatinina (C-G) (ml/min) | |||||
|---|---|---|---|---|---|
| > 50 | 30-39 | 15-29 | < 15 | Diálisis | |
| AVK | Mantener TRT ≥ 70% | Mantener TRT ≥ 70% | Mantener TRT ≥ 70 | Mantener TRT ≥ 70% | Mantener TRT ≥ 70% |
| Dabigatrán | 150 mg ×2 o 110 ×2 si edad ≥ 80, recibe verapamilo o riesgo hemorrágico | 150 mg ×2 o 110 ×2 si edad ≥ 80, recibe verapamilo o riesgo hemorrágico | -EMA: no recomendado-FDA: dosis reducida (75 mg ×2 (solo disponible en EE.UU.)-KDIGO: 75 mg ×2b | No recomendado | No recomendado |
| Rivaroxabán | 20 mg/d | 15 mg/d | 15 mg/día-KDIGO: podría considerarse 15 mg/día | No recomendadoKDIGO: efecto desconocido. 15 mg/díab | No recomendadoKDIGO: efecto desconocido. 15 mg/díab |
| Apixabán | 5 mg ×2 o 2,5 mg ×2 si ≥ 2 de los siguientes: edad ≥ 80; creat. ≥ 1,5 mg/dl; peso ≤ 60 kg | 5 mg ×2 o 2,5 mg ×2 si ≥ 2 de los siguientes: edad ≥ 80; creat. ≥ 1,5 mg/dl; peso ≤ 60 kg | -EMA:2,5 mg ×2-FDA: 5 mg ×2-KDIGO: podría considerarse 2,5 mg ×2 | -EMA: no recomendado-FDA: 5 mg ×2-KDIGO: efecto desconocido (2,5 mg ×2)b | EMA: no recomendadoFDA: 5 mg ×2KDIGO: efecto desconocido (2,5 mg ×2)b |
| Edoxabán | 60 mg/día | 30 mg/día | 30 mg/día-KDIGO: podría considerarse 30 mg/día | No recomendado | No recomendado |
AVK: antagonistas de vitamina K; C-G: Cocroft-Gault; EMA: European Medecines Agency; FDA: Food Drug Administration; KDIGO: Kidney Disease Improving Global Outcomes; TRT: tiempo en rango terapeútico.
No hay datos de la eficacia y la seguridad clínica; las dosis de dabigatrán 75 mg ×2, rivaroxabán 15 mg/día y apixabán 5 mg ×2 incluidos por FDA son basadas en datos farmacocinéticos y farmacodinámicos limitados. KDIGO sugiere considerar dosis bajas de apixabán de 2,5 mg ×2 en FG < 15 ml/min y en diálisis.
Es importante destacar varios hechos:
- 1.
La ausencia de ensayos aleatorizados de ACOD en sujetos con ERC estadios4, 5 y5D.
- 2.
En los estudios básicos la dosis inicial de ACOD no se modificó con los cambios evolutivos de la función renal.
- 3.
La determinación de la función renal en estos estudios con ACOD se hizo mediante el Clcret. estimado con la fórmula de Cockcroft-Gault.
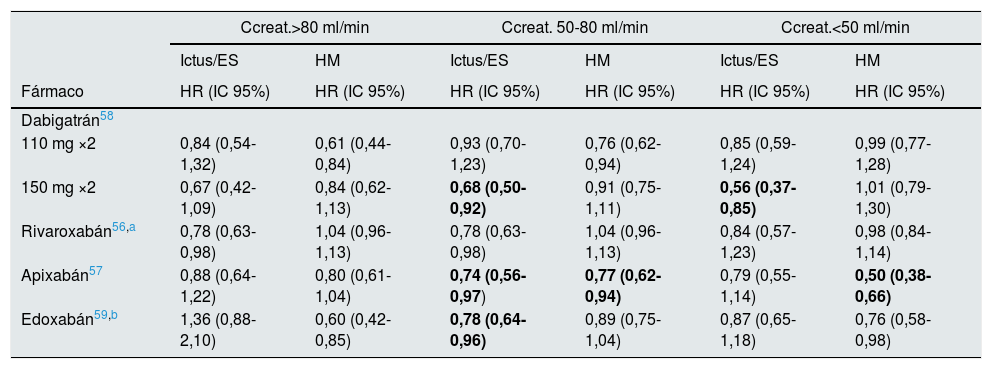
Los cuatro ensayos faseIII que comparan ACOD con warfarina hicieron un subanálisis de la eficacia y la seguridad en el subgrupo de sujetos con ERC definiendo la función renal según el Ccreat. (normal: Ccreat. >80ml/min; ERC ligera: Ccreat. 50-80ml/min; ERC moderada: Ccreat. 30-50ml/min). Todos excluyen del ensayo sujetos con Ccreat <30ml/min, salvo el estudio de apixabán, que excluye a los que tienen un Ccreat <25ml/min. De un total de 70.952 enfermos incluidos en los cuatro estudios, 45.265 tenían ERC ligera/moderada (estadios2 y3) y muy pocos (n=390) ERC severa (estadio4)56-59.
Como se puede observar en la tabla 3, los ACOD representan una alternativa más eficaz y segura que la warfarina en sujetos con ERC ligera/moderada. Es más, algunas de las ventajas y de los efectos beneficiosos de los ACOD frente a warfarina no se detectan en sujetos con función renal normal.
Hazard ratio de ictus/embolismo sistémico y hemorragia mayor en los tratados con anticoagulantes orales de acción directa frente a los tratados con warfarina según el grado de función renal
| Ccreat.>80 ml/min | Ccreat. 50-80 ml/min | Ccreat.<50 ml/min | ||||
|---|---|---|---|---|---|---|
| Ictus/ES | HM | Ictus/ES | HM | Ictus/ES | HM | |
| Fármaco | HR (IC 95%) | HR (IC 95%) | HR (IC 95%) | HR (IC 95%) | HR (IC 95%) | HR (IC 95%) |
| Dabigatrán58 | ||||||
| 110 mg ×2 | 0,84 (0,54-1,32) | 0,61 (0,44-0,84) | 0,93 (0,70-1,23) | 0,76 (0,62-0,94) | 0,85 (0,59-1,24) | 0,99 (0,77-1,28) |
| 150 mg ×2 | 0,67 (0,42-1,09) | 0,84 (0,62-1,13) | 0,68 (0,50-0,92) | 0,91 (0,75-1,11) | 0,56 (0,37-0,85) | 1,01 (0,79-1,30) |
| Rivaroxabán56,a | 0,78 (0,63-0,98) | 1,04 (0,96-1,13) | 0,78 (0,63-0,98) | 1,04 (0,96-1,13) | 0,84 (0,57-1,23) | 0,98 (0,84-1,14) |
| Apixabán57 | 0,88 (0,64-1,22) | 0,80 (0,61-1,04) | 0,74 (0,56-0,97) | 0,77 (0,62-0,94) | 0,79 (0,55-1,14) | 0,50 (0,38-0,66) |
| Edoxabán59,b | 1,36 (0,88-2,10) | 0,60 (0,42-0,85) | 0,78 (0,64-0,96) | 0,89 (0,75-1,04) | 0,87 (0,65-1,18) | 0,76 (0,58-0,98) |
Ccreat.: aclaramiento de creatinina; ES: embolismo sistémico; HM: hemorragia mayor.
La comparación de los efectos de los ACOD frente a warfarina en sujetos con y sin ERC también se hizo mediante metaanálisis que incluían los cuatro estudios faseIII de los ACOD. En el metaanálisis de Zou et al.60 los ACOD, comparados con warfarina, producían similar disminución del riesgo de ictus/embolismo sistémico en sujetos con función renal normal (RR: 0,93; IC95%: 0,81-1,01). Sin embargo, la reducción del riesgo era mayor en los casos de ERC ligera y moderada (estadios2 y3): RR: 0,79; IC95%: 0,68-0,91, y RR: 0,87; IC95%: 0,69-0,94), respectivamente. La disminución de hemorragias mayores en los tratados con ACOD era mayor que en los que recibían warfarina tanto en los sujetos con función renal normal como en aquellos con ERC.
Resultados similares se obtuvieron en el metaanálisis de Del Carpio et al.61. La reducción del riesgo de ictus/embolismo sistémico en los tratados con ACOD frente a los tratados con warfarina fue superior en los que tenían ERC ligera y moderada (RR: 0,79; IC95%: 0,66-0,94, y RR: 0,71; IC95%: 0,62-0,81), respectivamente, mientras que fue similar en los que tenían una función renal normal (RR: 0,95; IC95%: 0,81-1,15). En ambos metaanálisis se observa una tendencia a una mayor reducción de hemorragias con los ACOD cuanto mayor es el grado de ERC, aunque existe mucha heterogeneidad.
En la evaluación de la Cochrane de los pacientes con ERC y FA no valvular incluidos en los estudios faseIII de los ACOD (12.155 con ERC estadio3; 390 estadio4) los sujetos tratados con ACOD comparados con los que recibían warfarina tenían menos riesgo de ictus/embolismo sistémico (RR: 0,81; IC95%: 0,65-1) y tendencia a menos hemorragias mayores (RR: 0,79; IC95%: 0,59-1,04)62. La mayor limitación de este trabajo, como reconocen los autores, es que solo representa a los pacientes con ERC estadio3.
Todos estos metaanálisis tienen el inconveniente de que los subgrupos incluidos según función renal no eran predeterminados y el análisis comparativo no era preespecificado en los estudios faseIII. Pese a ello, los resultados secundan una mayor eficacia y seguridad de los ACOD frente a warfarina en presencia de ERC ligera/moderada.
En una reciente revisión sistemática de estudios aleatorizados, estudios de cohortes y series de casos63 se constata que en la ERC moderada dabigatrán y apixabán, comparados con warfarina, reducían el riesgo de ictus/embolismo sistémico (HR: 0,55; IC95%: 0,34-0,85, y HR: 0,61; IC95%: 0,39-0,94), respectivamente), mientras que edoxabán y apixabán se asociaban a menor número de hemorragias mayores que warfarina.
Probablemente la mejor información que sustenta la elección de una anticoagulación óptima (ACOD frente a warfarina) sea la proporcionada por el «beneficio clínico neto» (BCN), que incorpora el riesgo de ictus/embolismo sistémico y de hemorragias mayores. Se calcula según la fórmula:
Tasa de ictus/embolismo sistémico en warfarina −tasa de ictus/embolismo sistémico en ACOD) −factor de ponderación ×(tasa de hemorragias mayores en ACOD −tasa de hemorragias mayores en warfarina) (el factor de ponderación refleja el impacto relativo, en términos de muerte e incapacidad, de las hemorragias mayores).
En un reciente metaanálisis de los estudios faseIII de los ACOD se analizó el BCN64. Los ACOD, comparados con warfarina, tenían un BCN positivo en sujetos con ERC ligera (1,59; IC95%: 1,03-2,15) y moderada (2,74; IC95%: 1,72-3,76). También en los sujetos con función renal normal los ACOD tenían un BCN superior a warfarina. A destacar que el BCN era progresivamente mayor con el incremento del estadio de la ERC. En la población frágil, el mayor determinante del BCN a favor de los ACOD era la menor tasa de hemorragias mayores con estos últimos. Por tanto, basados en el análisis del BCN, los ACOD son preferibles a la warfarina en la FA en los sujetos con ERC ligera-moderada (estadios2 y3).
Los estudios faseIII incluyen sujetos con función renal normal y ERC ligera y moderada (estadios2 y3), muy pocos casos de ERC severa (estadio4) y ninguno de estadios5 y5D.
Un reciente estudio prospectivo aleatorizado, abierto, que incluyó un reducido número de enfermos (42-46/grupo) con ERC y FA no valvular tratados con HD, comparó el efecto de tres estrategias de anticoagulación oral (AVK, rivaroxabán 10mg/día y rivaroxabán 10mg/día +vitaminaK2) sobre la progresión de depósitos cálcicos cardioaórticos (objetivo primario).Tras 18meses de seguimiento no se observaron diferencias significativas en la progresión de las calcificaciones CV entre los grupos. El número de complicaciones hemorrágicas severas fue significativamente menor en los tratados con rivaroxabán. No obstante, el estudio no tenía ni el diseño ni la potencia adecuados para comparar eventos CV ni hemorrágicos65.
En un estudio retrospectivo que incluyó sujetos con ERC y FA tratados con diálisis, tanto dabigatrán (n=281) como rivaroxabán (n=244), comparados con warfarina (8.064), se asociaron a mayor riesgo de hemorragia y muerte66. Sin embargo, el análisis de una amplia base datos de enfermos con ERC, estadios4 (n=1.349) y 5/5D (n=5.395) y FA no valvular y seguimiento de 1,5años, evidenció que, tras ajuste riguroso de covariables basales (propensity score), los enfermos tratados con rivaroxabán (n=1.896) tenían una reducción significativa del 32% (IC95%: 1-53%) de las complicaciones hemorrágicas comparados con los tratados con warfarina (n=4.848), sin diferencias en ictus y embolismo sistémico67.
En otro estudio observacional que comparó apixabán con warfarina en sujetos con ERC estadios4 (n=197) y 5D (n=105) se comprobó que los que recibían apixabán tenían, a partir de los 6meses de seguimiento, menos riesgo de hemorragia, siendo igual el riesgo de ictus/embolismo sistémico68.
Una investigación adicional retrospectiva de sujetos con FA y ERC en terapia con HD69 comparó warfarina (n=23.172) con apixabán (n=2.351). Los tratados con apixabán en dosis de 2,5mg/2 veces/día tenían menos hemorragias mayores (HR: 0,72; IC95%: 0,59-0,87) (p<0,001) y similar riesgo de ictus/embolismo sistémico (HR: 0,88; IC95%: 0,69-1,12; p=0,29), mientras que apixabán en dosis de 5mg/2 veces/día, comparado con warfarina, reducía el riesgo de ictus/embolismo sistémico (HR: 0,64; IC95%: 0,42-0,87; p=0,04) y de mortalidad (HR: 0,63; IC95%: 0,46-0,85; p=0,003).
Este último estudio, juntamente con otro de rivaroxabán o dabigatrán y 14 estudios de warfarina frente a no terapia, se incluyen en un reciente metaanálisis en red que concluye que en pacientes con FA tratados con HD la anticoagulación oral no se asocia a un menor riesgo de tromboembolismo; en estos enfermos apixabán 5mg/2 veces/día reduce la mortalidad; warfarina, dabigatrán y rivaroxabán se asocian con mayor riesgo de hemorragia que apixabán70.
Sin embargo, otros datos sugieren similar eficacia y seguridad de rivaroxabán y apixabán en enfermos con ERC 5 y 5D. Un análisis retrospectivo de 2.623 sujetos con FA no valvular y ERC estadios 5/5D no encontró, tras riguroso ajuste de covariables basales, diferencias en el riesgo de ictus-embolismo sistémico ni de hemorragias mayores entre los enfermos tratados con rivaroxabán (n=787) y apixabán (n=1.836). La mayoría de los enfermos recibían dosis estándar de estos ACOD71.
En resumen, hay datos derivados de estudios aleatorizados que demuestran un mayor beneficio clínico neto de los ACOD frente a warfarina en la ERC ligera/moderada (estadios2 y3) con FA no valvular. No hay estudios aleatorizados sólidos de ACOD en estadios4, 5 y5D. Estudios observacionales sugieren que en estos casos apixabán, y en algunos estudios rivaroxabán, pueden ofrecer ventajas frente a warfarina (menos ictus/embolismo sistémico y/o menos hemorragias mayores).
Pese a la falta de ensayos específicos en sujetos con ERC y FA, el uso de ACOD es frecuente en estos enfermos. En el reciente registro multinacional que analiza los factores principales que determinan la elección del tipo de anticoagulante oral en enfermos con FA no valvular de nuevo diagnóstico se incluyen 2.623 sujetos con ERC estadios3-5. El 45,8% de estos recibía tratamiento con ACOD72.
Efecto de los anticoagulantes orales sobre la función renalDaño renal agudo/nefropatía asociada a anticoagulantesLos ACOD son eficaces y seguros como terapia anticoagulante en sujetos con ERC ligera-moderada y FA. También son eficaces y seguros (haciendo el adecuado ajuste de dosis) cuando la función renal se reduce una vez iniciada la terapia anticoagulante73.
Especial consideración merece el deterioro agudo de la función renal relacionado con la terapia anticoagulante oral. En 2009 un grupo de la universidad de Ohio publicó 9 casos de daño renal agudo (DRA) en sujetos tratados con warfarina. Su expresión clínica incluía, además de la elevación de la creatinina sérica, hematuria micro o macroscópica, ausencia de otras causas de insuficiencia renal aguda y, frecuentemente, valores supraterapéuticos de INR. Patológicamente se caracterizaba por la presencia de eritrocitos dismórficos en el espacio de Bowman, necrosis tubular, depósitos tubulares de hemosiderina y cilindros hemáticos intratubulares74. En todos los casos existían diferentes formas de nefropatía crónica subyacente (3casos con nefropatía IgA). Esta entidad se denominó «nefropatía relacionada con warfarina» (NRW). Recientemente se ha publicado un caso de nefropatía asociada a acenocumarol en un paciente con FA, un INR de 6,2 y nefropatía IgA75.
Posteriores estudios demostraron en sujetos tratados con warfarina, con y sin ERC subyacente y con una tasa del 16-33%, episodios de DRA asociados a valores de INR >3 y sin otra causa aparente de insuficiencia renal aguda. Estos episodios han sido catalogados como NRW76-78.
Hay que destacar, sin embargo, que dado el riesgo inherente a realizar biopsia renal en sujetos con INR elevado, en la mayoría de esos estudios el diagnóstico de NRW fue clínico. El DRA en este tipo de enfermos, en los que con frecuencia existe mucha comorbilidad cardiovascular, puede ser de otro origen (IC, ateroembolismo, hemorragia digestiva, inicio del bloqueo del SRAA, nefritis tubulointersticial, obstrucción por coágulos, entre otros). Además de la ERC, otras comorbilidades, como edad avanzada, DM, HTA y ECV, son factores de riesgo para estos episodios de DRA que, por otra parte, aceleran la progresión de la ERC y se asocian a menor supervivencia76,79.
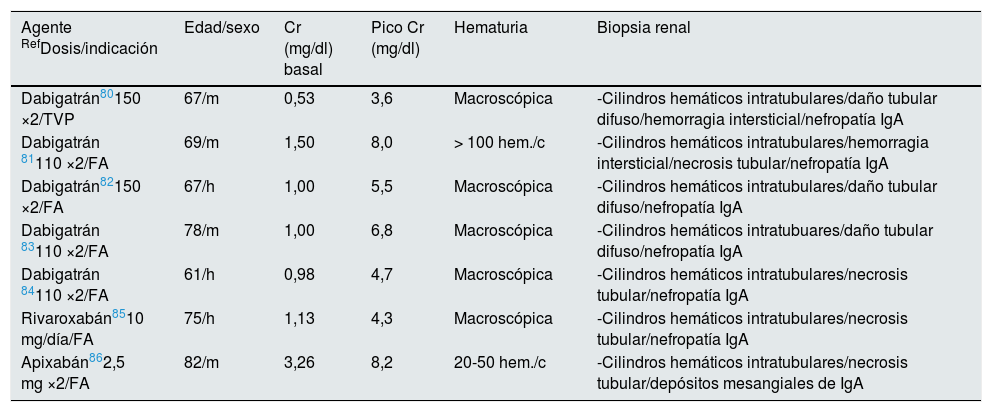
También se han publicado casos de DRA relacionado con los ACOD con hallazgos clínicos y patológicos similares a los encontrados en la NRW80-86. Este hecho ha promovido la sustitución de NRW por «nefropatía asociada a anticoagulantes» (NAA). En nuestro conocimiento se han publicado 7casos de NAA asociada a ACOD confirmada por biopsia renal (tabla 4). En todos, el DRA y los datos patológicos de hemorragia glomerular y cilindros hemáticos tubulares se insertaban sobre ERC (nefropatía IgA). Al igual que ocurre con los dicumarínicos, puede haber otras causas de DRA relacionado con los ACOD, entre ellas ateroembolismo y nefritis tubulointersticial87,88.
Casos publicados de nefropatía aguda asociada a anticoagulantes (biopsiados) en sujetos tratados con anticoagulantes orales de acción directa
| Agente RefDosis/indicación | Edad/sexo | Cr (mg/dl) basal | Pico Cr (mg/dl) | Hematuria | Biopsia renal |
|---|---|---|---|---|---|
| Dabigatrán80150 ×2/TVP | 67/m | 0,53 | 3,6 | Macroscópica | -Cilindros hemáticos intratubulares/daño tubular difuso/hemorragia intersticial/nefropatía IgA |
| Dabigatrán 81110 ×2/FA | 69/m | 1,50 | 8,0 | > 100 hem./c | -Cilindros hemáticos intratubulares/hemorragia intersticial/necrosis tubular/nefropatía IgA |
| Dabigatrán82150 ×2/FA | 67/h | 1,00 | 5,5 | Macroscópica | -Cilindros hemáticos intratubulares/daño tubular difuso/nefropatía IgA |
| Dabigatrán 83110 ×2/FA | 78/m | 1,00 | 6,8 | Macroscópica | -Cilindros hemáticos intratubuares/daño tubular difuso/nefropatía IgA |
| Dabigatrán 84110 ×2/FA | 61/h | 0,98 | 4,7 | Macroscópica | -Cilindros hemáticos intratubulares/necrosis tubular/nefropatía IgA |
| Rivaroxabán8510 mg/día/FA | 75/h | 1,13 | 4,3 | Macroscópica | -Cilindros hemáticos intratubulares/necrosis tubular/nefropatía IgA |
| Apixabán862,5 mg ×2/FA | 82/m | 3,26 | 8,2 | 20-50 hem./c | -Cilindros hemáticos intratubulares/necrosis tubular/depósitos mesangiales de IgA |
Cr.: creatinina; FA: fibrilación auricular; h: hombre; m: mujer; TVP: trombosis venosa profunda.
Son varios los posibles mediadores patogénicos del DRA en la NAA: la disrupción de la barrera de filtración glomerular promueve el paso de hematíes al espacio de Bowman y a túbulos renales. La formación de cilindros hemáticos produce obstrucción y daño tubular. La hemoglobina ejerce efectos tóxicos tubulares y, tras ser incorporada a las células tubulares, el hemo y el hierro promueven daño tubular secundario a la producción de especies reactivas de oxígeno, estrés oxidativo, daño mitocondrial, apoptosis y producción de citoquinas proinflamatorias, entre otros89.
El mecanismo por el que los anticoagulantes orales alteran la permeabilidad de la barrera glomerular y promueven hematuria no está aclarado. Hay modelos experimentales de DRA por anticoagulantes que remedan lo observado en los casos de NAA90,91. La administración de inhibidores de receptores tipo1 activados por proteasa (PAR1) a animales de experimentación produce hematuria, cilindros hemáticos tubulares y aumento de creatinina91. Diversos subtipos de PAR que pueden ser activados por trombina, por factorXa y por la proteínaC activada (PCa) se encuentran localizados en endotelio, mesangio y podocitos, entre otras células92,93. Se ha especulado que los anticoagulantes orales, al inhibir la trombina, impiden la activación de los receptores PAR localizados en el endotelio, lo que aumenta su permeabilidad. Otros datos experimentales, sin embargo, demuestran que la activación de los PAR1 por trombina promueve un aumento de permeabilidad glomerular, inflamación y daño podocitario94,95.
Se desconoce la causa de esta discrepancia. Se ha demostrado un doble y opuesto efecto de la trombina sobre la permeabilidad endotelial mediada por activación de PAR1. A bajas concentraciones disminuye la permeabilidad endotelial, mientras que a elevadas concentraciones la aumenta96.
También es posible la participación de la proteína PCa (activada por la trombina), que a través de la estimulación de los PAR3 podocitarios y de la formación de dímeros con PAR2/PAR1 previene la apoptosis podocitaria97.
La elevada frecuencia de nefropatía IgA subyacente comprobada en la mayoría de los casos biopsiados con NAA sugiere una relación entre estas dos entidades que podrían potenciarse mutuamente. La anticoagulación supraterapéutica induciría un aumento de la permeabilidad de la barrera glomerular y de la hematuria, que serían de mayor intensidad en presencia de nefropatía subyacente. La hematuria, a su vez, produce daño podocitario, ejerce efectos tóxicos sobre las células tubulares y magnifica el proceso inflamatorio de la nefropatía subyacente98.
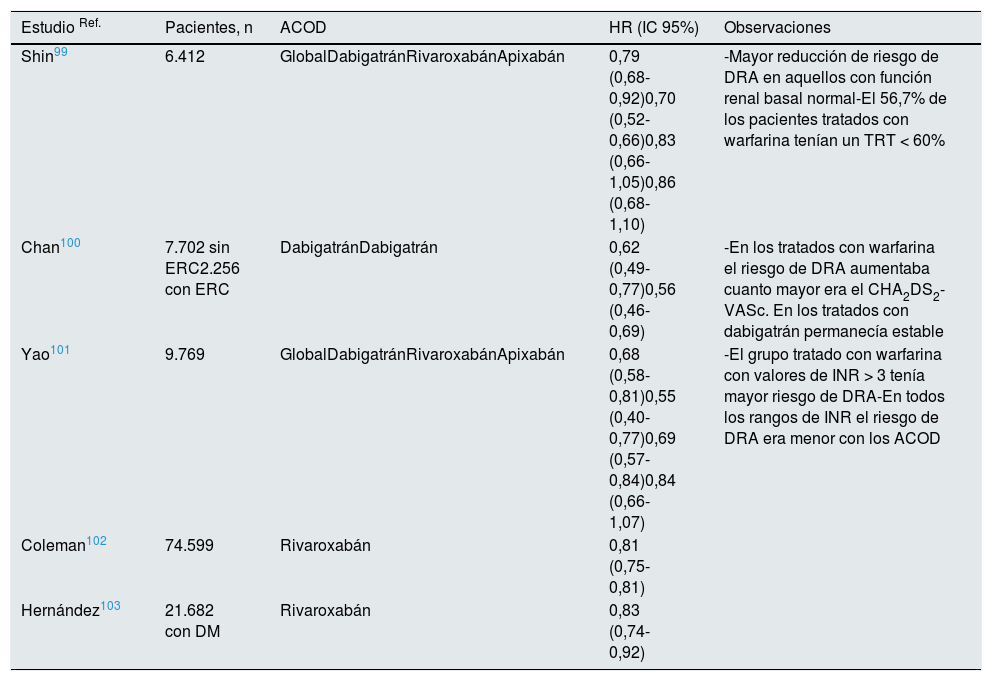
La mayoría de los estudios en sujetos con FA que comparan warfarina con ACOD no tienen un diseño adecuado ni controles de creatinina con intervalos preespecificados que permitan una determinación precisa de la frecuencia de DRA. Hay, sin embargo, varios estudios post hoc que han analizado el DRA en los sujetos con FA tratados con ACOD frente a los tratados con warfarina99-103. Como se puede ver en la tabla 5, en la mayoría de los estudios el tratamiento con ACOD se asocia a menor riesgo de DRA que la warfarina.
Hazard ratio de daño renal agudo (DRA) en los sujetos con FA no valvular tratados con anticoagulantes orales de acción directa (ACOD) frente a los tratados con warfarina
| Estudio Ref. | Pacientes, n | ACOD | HR (IC 95%) | Observaciones |
|---|---|---|---|---|
| Shin99 | 6.412 | GlobalDabigatránRivaroxabánApixabán | 0,79 (0,68-0,92)0,70 (0,52-0,66)0,83 (0,66-1,05)0,86 (0,68-1,10) | -Mayor reducción de riesgo de DRA en aquellos con función renal basal normal-El 56,7% de los pacientes tratados con warfarina tenían un TRT < 60% |
| Chan100 | 7.702 sin ERC2.256 con ERC | DabigatránDabigatrán | 0,62 (0,49-0,77)0,56 (0,46-0,69) | -En los tratados con warfarina el riesgo de DRA aumentaba cuanto mayor era el CHA2DS2-VASc. En los tratados con dabigatrán permanecía estable |
| Yao101 | 9.769 | GlobalDabigatránRivaroxabánApixabán | 0,68 (0,58-0,81)0,55 (0,40-0,77)0,69 (0,57-0,84)0,84 (0,66-1,07) | -El grupo tratado con warfarina con valores de INR > 3 tenía mayor riesgo de DRA-En todos los rangos de INR el riesgo de DRA era menor con los ACOD |
| Coleman102 | 74.599 | Rivaroxabán | 0,81 (0,75-0,81) | |
| Hernández103 | 21.682 con DM | Rivaroxabán | 0,83 (0,74-0,92) |
FA: fibrilación auricular; ERC: enfermedad renal crónica; TRT: tiempo en rango terapéutico; DM: diabetes mellitus.
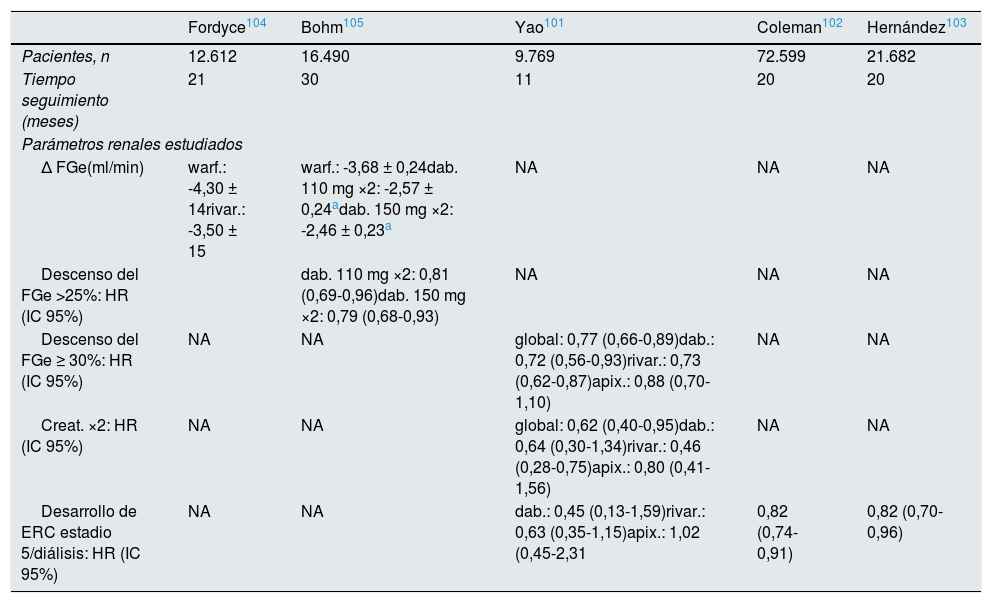
Varios estudios observacionales y análisis de vida real que usan una extensa base de datos de sujetos con seguimiento variable y equiparación rigurosa de covariables (diferencias absolutas estandarizadas <0,1 [propensity score]), aunque también con limitaciones, son más adecuados para identificar un posible papel de los anticoagulantes orales en la génesis y la progresión de la ERC (tabla 6)101-105. Analizando diversos parámetros de función renal (variación del Ccreat, descenso del FGe >25 o 35%, duplicación de la creatinina y desarrollo de ERC estadio5 o inclusión en diálisis) se observa que, en los pacientes con FA, los ACOD son más renoprotectores que la warfarina. El beneficio era más evidente con rivaroxabán y dabigatrán. Cuando se analizaba el subgrupo de sujetos con dosis supraterapéuticas de warfarina (INR >3) el beneficio renal de los ACOD era todavía mayor.
Estudios comparativos de anticoagulantes de acción directa frente a warfarina sobre la función renal (generación/progresión de ERC)
| Fordyce104 | Bohm105 | Yao101 | Coleman102 | Hernández103 | |
|---|---|---|---|---|---|
| Pacientes, n | 12.612 | 16.490 | 9.769 | 72.599 | 21.682 |
| Tiempo seguimiento (meses) | 21 | 30 | 11 | 20 | 20 |
| Parámetros renales estudiados | |||||
| Δ FGe(ml/min) | warf.: -4,30 ± 14rivar.: -3,50 ± 15 | warf.: -3,68 ± 0,24dab. 110 mg ×2: -2,57 ± 0,24adab. 150 mg ×2: -2,46 ± 0,23a | NA | NA | NA |
| Descenso del FGe >25%: HR (IC 95%) | dab. 110 mg ×2: 0,81 (0,69-0,96)dab. 150 mg ×2: 0,79 (0,68-0,93) | NA | NA | NA | |
| Descenso del FGe ≥ 30%: HR (IC 95%) | NA | NA | global: 0,77 (0,66-0,89)dab.: 0,72 (0,56-0,93)rivar.: 0,73 (0,62-0,87)apix.: 0,88 (0,70-1,10) | NA | NA |
| Creat. ×2: HR (IC 95%) | NA | NA | global: 0,62 (0,40-0,95)dab.: 0,64 (0,30-1,34)rivar.: 0,46 (0,28-0,75)apix.: 0,80 (0,41-1,56) | NA | NA |
| Desarrollo de ERC estadio 5/diálisis: HR (IC 95%) | NA | NA | dab.: 0,45 (0,13-1,59)rivar.: 0,63 (0,35-1,15)apix.: 1,02 (0,45-2,31 | 0,82 (0,74-0,91) | 0,82 (0,70-0,96) |
apix.: apixabán; dab.: dabigatrán; ERC:enfermedad fenal crónica; FGe: filtrado glomerular estimado; HR: hazard ratio; NA: no disponible; rivar.: rivaroxabán; warf.: warfarina.
El mayor efecto renoprotector de los ACOD comparado con warfarina puede fundamentarse en su efecto dosis-respuesta más previsible y menos riesgo de hemorragias, en la existencia de menos eventos de DRA que pueden condicionar deterioro progresivo de función renal y en el posible efecto antiinflamatorio de los ACOD. En modelos experimentales de daño renal hipertensivo mediado por AII se ha demostrado un aumento de la expresión de PAR2 y de genes proinflamatorios (TNFα, PAI y MCP-1) en los podocitos. El tratamiento con rivaroxabán inducía una reducción de la expresión de PAR2 y de los genes proinflamatorios, así como una atenuación de las anomalías estructurales podocitarias106.
Por otra parte, los AVK disminuyen la actividad de la matrix Gla protein (MGP), vitaminaK dependiente, lo que puede promover calcificación vascular107 y calcifilaxis en sujetos en diálisis. El aumento de la rigidez arterial secundario a la calcificación arterial favorece la HTA sistólica y el aumento de la pulsatilidad aórtica no amortiguada y deletérea para el riñón108.
Una información más rigurosa del efecto de la anticoagulación oral sobre la función renal en sujetos con FA no valvular la dará el resultado del ensayo clínico Factor Xa-inhibition in renal patients with non-valvular atrial fibrillation — observational registry (XARENO)109. En él se analizará el efecto que sobre la función renal y sobre los eventos hemorrágicos y CV en pacientes con ERC estadios3-4 (FGe: 15-50ml/m) y FA no valvular tienen tres estrategias de anticoagulación oral: rivaroxabán, AVK y no anticoagulación.
Control de la función renal durante la terapia con anticoagulantes oralesEn los estudios comparativos de warfarina frente a ACOD en pacientes con FA no valvular se comprueba que es muy frecuente el deterioro de la función renal. En el plazo de 2años, aproximadamente uno de cada 4 pacientes tiene un descenso del FGe de al menos el 30%, y uno de cada 7 tiene un episodio de DRA101. Esto es muy importante, porque el descenso de la función renal se asocia a mayor riesgo de ictus, hemorragia y mortalidad110.
Por otra parte, los cambios de función renal obligan a hacer ajustes de dosis de anticoagulantes. Se enfatiza la necesidad de hacer controles frecuentes de función renal en estos enfermos. Las guías proponen un control semestral del FG y, con más frecuencia, en casos de ERC11. Se ha recomendado como fórmula empírica el tiempo en meses que resulta de dividir el FG/10. Este tema suscita un aspecto que consideramos importante: ¿Cómo determinamos la función renal? En los estudios faseIII de los ACOD se usa el aclaramiento de creatinina calculado (C-G), pero en la práctica clínica se usan fórmulas de estimación del FG (CKD-EPI y MDRD).
En un estudio de 831 sujetos con ERC y FA se analizó la concordancia de estimación de la función renal de C-G con CKD-EPI y MDRD. Se comprobó coincidencia en el 64%, pero en el 29% de los sujetos estas últimas infraestimaban la función renal, lo que condicionaría infradosis de ACOD. En ese estudio se usan resultados de MDRD y CKD-EPI corregidos a una superficie corporal estándar de 1,73m2, mientras que el C-G no está corregido111. Otro estudio, sin embargo, demuestra que, en comparación con C-G, tanto CKD-EPI como MDRD con frecuencia sobreestiman la función renal, lo que implicaría sobretratamiento con ACOD112. Esta discrepancia en las posologías de los nuevos anticoagulantes orales empleando ecuaciones distintas es mayor en los pacientes ancianos con deterioro de la función renal y para las posologías de dabigatrán y rivaroxabán. En ese estudio, tanto CKD-EPI como MDRD se corrigen a superficie corporal real. Estos resultados concuerdan con los obtenidos en otro estudio en el que el Ccreat. realizado con orina de 24h es similar al estimado por C-G e inferior al FGe por MDRD y CKD-EPI113. Por tanto, hay que subrayar las limitaciones de las fórmulas de estimación del FG, sobre todo en sujetos mayores, a la hora de ajustar dosis de ACOD (si las usamos, se aminora la diferencia con C-G con la corrección a superficie corporal real). El ajuste de la dosis de ACOD en pacientes con ERC se determinará usando el Ccreat. estimado por C-G.
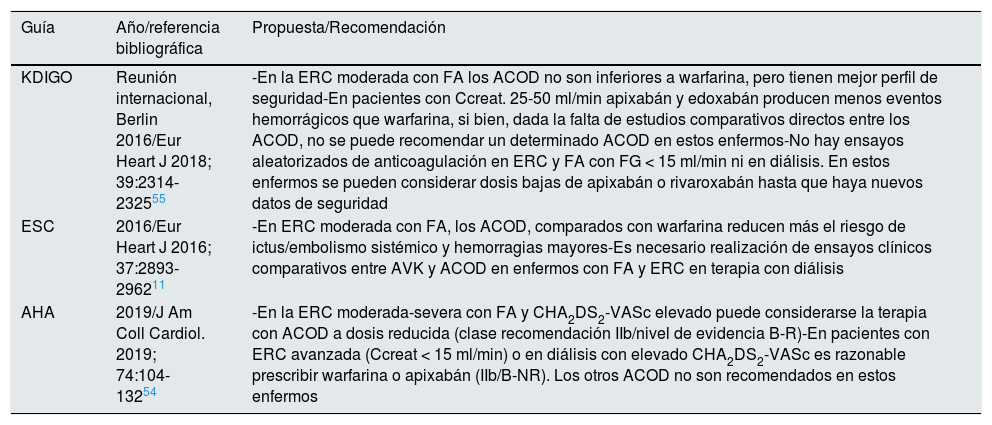
Propuesta de terapia anticoagulante en la enfermedad renal crónica con fibrilación auricular. Opinión de los autores y razonamientoLas propuestas/recomendaciones de las guías actualizadas sobre tratamiento anticoagulante oral de la FA asociada a ERC son imprecisas y diversas (tabla 7).
Declaración de las guías sobre anticoagulación oral en la enfermedad renal crónica (ERC) con fibrilación auricular (FA) asociada
| Guía | Año/referencia bibliográfica | Propuesta/Recomendación |
|---|---|---|
| KDIGO | Reunión internacional, Berlin 2016/Eur Heart J 2018; 39:2314-232555 | -En la ERC moderada con FA los ACOD no son inferiores a warfarina, pero tienen mejor perfil de seguridad-En pacientes con Ccreat. 25-50 ml/min apixabán y edoxabán producen menos eventos hemorrágicos que warfarina, si bien, dada la falta de estudios comparativos directos entre los ACOD, no se puede recomendar un determinado ACOD en estos enfermos-No hay ensayos aleatorizados de anticoagulación en ERC y FA con FG < 15 ml/min ni en diálisis. En estos enfermos se pueden considerar dosis bajas de apixabán o rivaroxabán hasta que haya nuevos datos de seguridad |
| ESC | 2016/Eur Heart J 2016; 37:2893-296211 | -En ERC moderada con FA, los ACOD, comparados con warfarina reducen más el riesgo de ictus/embolismo sistémico y hemorragias mayores-Es necesario realización de ensayos clínicos comparativos entre AVK y ACOD en enfermos con FA y ERC en terapia con diálisis |
| AHA | 2019/J Am Coll Cardiol. 2019; 74:104-13254 | -En la ERC moderada-severa con FA y CHA2DS2-VASc elevado puede considerarse la terapia con ACOD a dosis reducida (clase recomendación IIb/nivel de evidencia B-R)-En pacientes con ERC avanzada (Ccreat < 15 ml/min) o en diálisis con elevado CHA2DS2-VASc es razonable prescribir warfarina o apixabán (IIb/B-NR). Los otros ACOD no son recomendados en estos enfermos |
ACOD: anticoagulantes orales de acción directa; AHA: American Heart Association; AVK: antagonistas de la vitamina K; Ccreat.: aclaramiento de creatinina; ESC: European Society Cardiology; FG: filtrado glomerular; KDIGO: Kidney Disease Improving Global Outcomes.
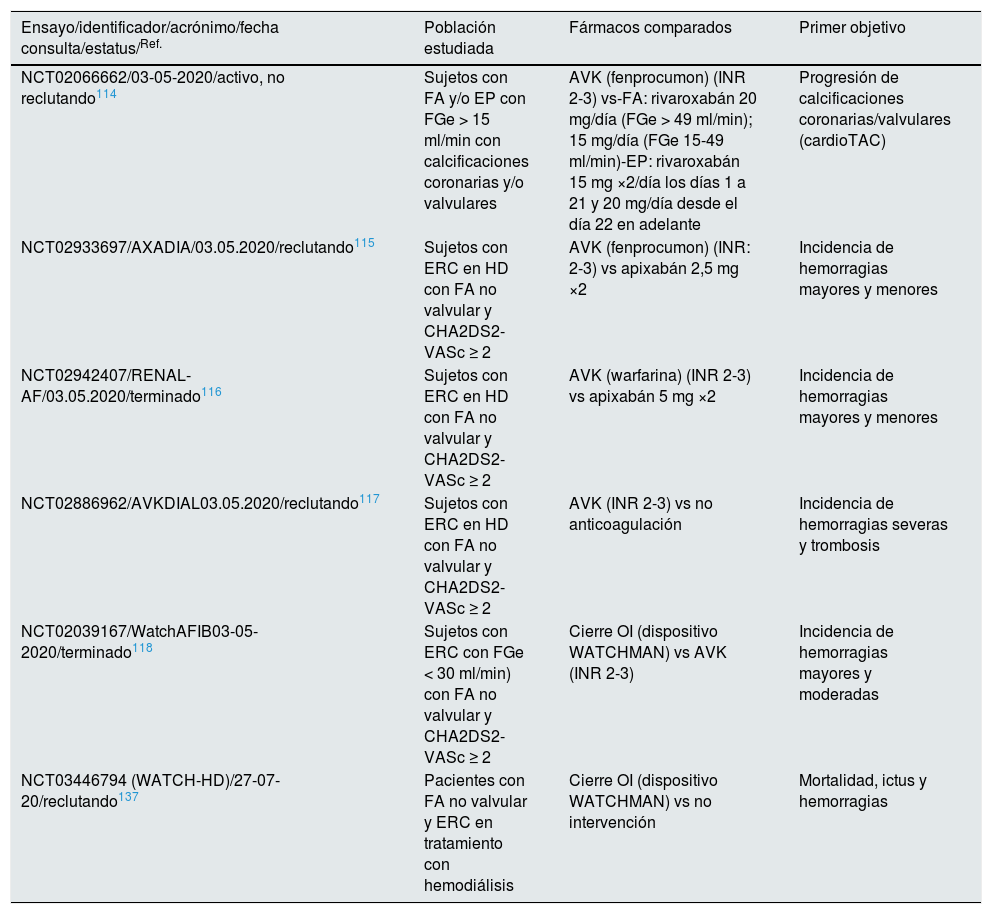
Teniendo en cuenta la evidencia actual de los beneficios de ACOD en la ERC ligera-moderada con FA no valvular, la ausencia de ensayos clínicos aleatorizados con anticoagulantes orales en sujetos con ERC estadios4, 5 y5D, los datos de estudios observacionales en estos últimos y los inconvenientes del uso de los AVK en sujetos con ERC, nos parece razonable la siguiente propuesta de terapia anticoagulante en los pacientes con ERC y FA no valvular, propuesta que podrá ser modificada tras los resultados de los ensayos clínicos actuales en ERC con FA114-119 (tabla 8).
Ensayos clínicos actuales en anticoagulación oral en la enfermedad renal crónica (ERC) con fibrilación auricular (FA)
| Ensayo/identificador/acrónimo/fecha consulta/estatus/Ref. | Población estudiada | Fármacos comparados | Primer objetivo |
|---|---|---|---|
| NCT02066662/03-05-2020/activo, no reclutando114 | Sujetos con FA y/o EP con FGe > 15 ml/min con calcificaciones coronarias y/o valvulares | AVK (fenprocumon) (INR 2-3) vs-FA: rivaroxabán 20 mg/día (FGe > 49 ml/min); 15 mg/día (FGe 15-49 ml/min)-EP: rivaroxabán 15 mg ×2/día los días 1 a 21 y 20 mg/día desde el día 22 en adelante | Progresión de calcificaciones coronarias/valvulares (cardioTAC) |
| NCT02933697/AXADIA/03.05.2020/reclutando115 | Sujetos con ERC en HD con FA no valvular y CHA2DS2-VASc ≥ 2 | AVK (fenprocumon) (INR: 2-3) vs apixabán 2,5 mg ×2 | Incidencia de hemorragias mayores y menores |
| NCT02942407/RENAL-AF/03.05.2020/terminado116 | Sujetos con ERC en HD con FA no valvular y CHA2DS2-VASc ≥ 2 | AVK (warfarina) (INR 2-3) vs apixabán 5 mg ×2 | Incidencia de hemorragias mayores y menores |
| NCT02886962/AVKDIAL03.05.2020/reclutando117 | Sujetos con ERC en HD con FA no valvular y CHA2DS2-VASc ≥ 2 | AVK (INR 2-3) vs no anticoagulación | Incidencia de hemorragias severas y trombosis |
| NCT02039167/WatchAFIB03-05-2020/terminado118 | Sujetos con ERC con FGe < 30 ml/min) con FA no valvular y CHA2DS2-VASc ≥ 2 | Cierre OI (dispositivo WATCHMAN) vs AVK (INR 2-3) | Incidencia de hemorragias mayores y moderadas |
| NCT03446794 (WATCH-HD)/27-07-20/reclutando137 | Pacientes con FA no valvular y ERC en tratamiento con hemodiálisis | Cierre OI (dispositivo WATCHMAN) vs no intervención | Mortalidad, ictus y hemorragias |
AVK: antagonistas de la vitamina K; EP: embolismo pulmonar; FGe: filtrado glomerular estimado; HD: hemodiálisis; OI: orejuela izquierda.
En estos enfermos ha de considerarse la terapia con anticoagulantes orales, preferiblemente ACOD, sobre todo si el factor de riesgo es DM o una edad de 65-74años.
Justificación. Un factor de riesgo de ictus no relacionado con el género produce un riesgo significativo de ictus y muerte. No existen estudios aleatorizados, pero hay datos que demuestran en estos enfermos un beneficio neto de la anticoagulación oral120. Hay, sin embargo, mucha heterogeneidad, por lo que la decisión ha de basarse en las características individuales que tengan en cuenta el riesgo hemorrágico y los factores clínicos que condicionan el aumento del riesgo tromboembólico. La DM y una edad 65-74años son los factores que se asocian a mayor tasa de tromboembolismo121. La presencia de ERC, manifestada por aumento de excreción de albúmina y/o ligera/moderada reducción de FG, aumentaría todavía más este riesgo122,123.
Aunque no hay estudios controlados en estos enfermos de riesgo moderado, los ACOD, en comparación con warfarina, han demostrado, en sujetos con ERC estadios2-3, FA no valvular y riesgo alto, una eficacia igual o superior con menor riesgo hemorrágico57,64. Por otra parte, hay datos sugestivos de una mejor preservación de la función renal con los ACOD101-105.
Enfermedad renal crónica estadios 2-3 y riesgo tromboembólico alto (CHAD2DS2-VASc ≥2 en hombres y ≥3 en mujeres)En estos enfermos está indicado el tratamiento con anticoagulantes orales (preferentemente ACOD; ver tabla 2).
Justificación. En sujetos con ERC estadio3 y AF no valvular y elevado riesgo la warfarina reduce la incidencia de ictus y embolismo sistémico35. En un estudio con un número importante de sujetos con ERC y CHAD2DS2-VASc de 4-5 (n=13.435), la warfarina, en comparación con los que no reciben anticoagulación oral, reducía la incidencia combinada de ictus embólico o ictus hemorrágico o muerte124.
En varios metaanálisis que incluyen los estudios faseIII de los ACOD, los enfermos con ERC estadios2-3 que recibían ACOD presentaban menos ictus y embolismo sistémico y menos complicaciones hemorrágicas mayores (un beneficio clínico neto positivo) que los que recibían warfarina60,61,64. La posible mejor preservación de la función renal con los ACOD es otro argumento que apoyaría su preferencia a los dicumarínicos en estos pacientes.
Enfermedad renal crónica estadios 4 y 5En enfermos con ERC estadios 4 y 5 y FA no valvular debe considerarse el tratamiento con anticoagulantes orales (preferentemente ACOD, ver tabla 2).
Justificación. Son muy pocos los enfermos con ERC estadios4 y5 y FA incluidos en estudios controlados. Creemos, sin embargo, que estos pacientes pueden beneficiarse de la terapia anticoagulante. En un estudio observacional de sujetos con ECV, FA y diferentes estadios de ERC (n=1.966 con ERC estadio 4; n=478 con estadio5) la warfarina reducía significativamente la mortalidad, la readmisión por infarto de miocardio y el ictus isquémico sin incremento del riesgo hemorrágico125. Resultados similares se obtuvieron en otro estudio prospectivo observacional de 8.962 sujetos con FA y diferentes estadios de ERC, entre ellos 341 enfermos con FG <30ml/min/1,73m2 (86% con CHAD2DS2-VASc >2)126. La terapia con AVK se asociaba a menor mortalidad, menor incidencia de ictus isquémico y embolismo sistémico. Basalmente, el porcentaje de sujetos con elevado riesgo de sangrado (HAS-BLED ≥3) era más elevado en la ERC estadio4 (38%) y5 (52%) comparado con el 12% en estadio3 y el 5% en estadio2. Se observó beneficio clínico neto (BCN) (beneficio de la reducción del ictus isquémico frente al aumento de ictus hemorrágico). El BCN en los que tenían un FG <30ml/min/1,73m2 fue de 6,69 (IC95%: 3,27-12,78)126.
Estudios observacionales en sujetos con ERC estadios4 y5 y FA han comprobado que rivaroxabán y apixabán comparados con warfarina producen menos complicaciones hemorrágicas, sin diferencia en ictus isquémico ni en embolismo sistémico67-68. En un metaanálisis reciente de 43.850 pacientes con ERC estadios4, 5 y5D, en la mayoría de los que recibían anticoagulación oral por FA apixabán se asociaba a menor número de hemorragias mayores que warfarina (OR: 0,27; IC95%: 0,07-0,95), sin diferencias en las complicaciones tromboembólicas127.
Enfermos con enfermedad renal crónica 5D (diálisis)En los enfermos con ERC tratados con diálisis y FA no valvular, con alto riesgo tromboembólico (CHAD2DS2-VASc ≥2 hombres, ≥3 mujeres), se considerará el tratamiento con anticoagulantes orales. Apixabán puede ofrecer ventajas frente a los AVK en caso de que el tiempo en rango terapéutico (TRT) sea bajo, existan calcificaciones vasculares o factores de riesgo de calcifilaxis.
Justificación. Ante la falta de estudios aleatorizados y los diversos resultados en eficacia y seguridad de la anticoagulación oral en pacientes con ERC y FA tratados con diálisis, hay mucha controversia en relación a su conveniencia. En estudios que incluían una elevada proporción de pacientes con bajo riesgo los AVK no producen beneficios significativos en la mortalidad ni en eventos tromboembólicos128. Sin embargo, en los subgrupos de pacientes con ERC tratados con diálisis y elevado riesgo tromboembólico la warfarina producía un descenso significativo de la mortalidad y una reducción no significativa del objetivo compuesto de muerte/ictus/embolismo sistémico/hemorragias37.
En la ERC tratada con AVK hay una sustancial reducción del TRT, lo que se asocia a eventos embólicos y hemorrágicos40. Solo el 21% de los enfermos en diálisis tratados con warfarina tienen un TRT >60%129.
Un estudio observacional y un metaanálisis han demostrado que en sujetos con ERC tratados con diálisis y FA con elevado riesgo tromboembólico (CHAS >5) apixabán se asociaba a mayor seguridad (menos hemorragias) y similar eficacia que warfarina69,70.
Las calcificaciones coronarias y extracoronarias son muy prevalentes en los sujetos con ERC y se asocian a mortalidad CV130. La proteína de matriz Gla inhibe la calcificación vascular, para cuya acción requiere su carboxilación vitaminaK dependiente. La administración de AVK se asocia a efectos negativos arteriales y cardiacos, y a calcificaciones coronarias y extracoronarias131-133.
La arteriolopatía crónica calcificante (calcifilaxis) es un trastorno vascular poco frecuente pero potencialmente mortal. Las alteraciones del metabolismo fosfocálcico, la DM y el síndrome metabólico, entre otros, juntamente con el tratamiento con AVK, son factores de riesgo de calcifilaxis en pacientes con ERC en diálisis134-136.
Si, tras descartar contraindicaciones para anticoagular y consensuar con el paciente el tratamiento, se decide anticoagulación oral, apixabán es una opción terapéutica sin los inconvenientes y efectos deletéreos arriba señalados de los AVK. Apixabán ha sido incluido recientemente en las guías AHA/ACC/HRS como una opción razonable para pacientes con FA y alto riesgo tromboembólico con ERC estadios5 y5D54.
Contraindicaciones para anticoagulación oralEn la ERC hay mayor riesgo de hemorragia. Cuando estos enfermos reciben terapia con anticoagulación oral ha de prestarse especial atención al tratamiento adecuado de todos los factores que potencian el sangrado (control adecuado de la presión arterial y de la anemia, entre otros). Se realizará terapia médica y/o quirúrgica de las causas tratables de hemorragias si las hubiera.
En casos de antecedentes de hemorragia cerebral o hemorragias recurrentes no tratables se evitará la anticoagulación oral. Las guías consideran como posible opción terapéutica el cierre de la orejuela izquierda (COI) en pacientes con FA y contraindicación clara para anticoagulación oral a largo plazo11. No hay ensayos aleatorizados de COI en sujetos con ERC. En un estudio observacional de 1.014 sujetos incluidos en un registro multicéntrico de COI el análisis del subgrupo de 375 sujetos con ERC (estadios3, 4 y5) revela que el COI es un procedimiento seguro y eficaz en la reducción de ictus y del riesgo de hemorragia en estos enfermos119. En la actualidad se está realizando el ensayo clínico NCT03446794 (WATCH-HD), que estudiará en pacientes con ERC tratados con HD y FA no valvular de alto riesgo tromboembólico y hemorrágico, el efecto de la implantación del dispositivo WATCHMAN® para ocluir la orejuela izquierda sobre la mortalidad, ictus, embolismo sistémico y hemorragias mayores137.
Conceptos clave- 1.
En la ERC hay una mayor prevalencia e incidencia de FA, que aumentan con el grado de la enfermedad renal. La presencia de FA en la ERC favorece el riesgo de ictus, de eventos CV y de mortalidad, y de deterioro progresivo de la función renal.
- 2.
La anticoagulación oral con dicumarínicos en la ERC ligera-moderada (estadios2-3) con FA produce un beneficio neto. Resultados derivados de estudios aleatorizados demuestran un mayor beneficio clínico neto de los ACOD frente a warfarina en la FA no valvular con ERC ligera/moderada.
- 3.
No hay estudios aleatorizados sólidos de la anticoagulación oral en estadios4, 5 y5D de ERC con FA. Estudios observacionales con warfarina en ERC estadio5D han aportado resultados diversos. Con frecuencia los sujetos con ERC y FA tratados con dicumarínicos tienen un deficiente control de anticoagulación con disminución del tiempo en rango terapéutico y un mayor riesgo de hemorragia. Los AVK pueden favorecer las calcificaciones vasculares y son un factor de riesgo de calcifilaxis. Estudios observacionales sugieren que, en estadios4, 5 y5D, apixabán y rivaroxabán pueden ser más eficaces y/o seguros que warfarina.
Dado el mayor riesgo de hemorragia en la ERC, ha de prestarse especial atención al control de los factores de riesgo de sangrado (control adecuado de la presión arterial y de la anemia) y se realizará terapia médica y/o quirúrgica de las causas tratables de hemorragia. En casos de antecedentes de hemorragia cerebral o hemorragias recurrentes no tratables se evitará la anticoagulación oral y se considerará el cierre de la orejuela izquierda.
Varios ensayos aleatorizados actualmente en marcha con AVK, ACOD y cierre de la orejuela izquierda ayudarán a guiar las decisiones terapéuticas en los enfermos con FA no valvular y ERC estadio5D.
- 4.
La terapia con dicumarínicos, sobre todo en casos de ERC y valores supraterapéuticos de INR, puede asociarse a DRA (nefropatía por anticoagulantes). Este DRA aumenta el riesgo de ictus, de hemorragia y de deterioro progresivo de la función renal. Los ACOD también pueden producir nefropatía por anticoagulantes, sobre todo en sujetos con nefropatía subyacente.
Hay estudios observacionales que sugieren que, comparados con warfarina, los ACOD reducen el riesgo de DRA y de la generación-progresión de ERC en pacientes con FA.
En los enfermos con FA no valvular con frecuencia se observa deterioro de la función renal que se asocia a un aumento de eventos CV. Es importante la determinación periódica de la función renal (que se hará preferentemente usando el Ccreat. (C-G)) para hacer los adecuados reajustes de dosis de los ACOD que, en diferente proporción, se excretan por vía renal.
Ninguno.