Introducción: El conocimiento de los factores que determinan el transporte peritoneal de potasio en diálisis peritoneal (DP) es incompleto. Los objetivos de este estudio fueron comparar el transporte peritoneal de potasio en pruebas de equilibrio peritoneal (PEP) con soluciones de glucosa al 2,27 y al 3,86%, y desvelar factores con influencia en este fenómeno. Método: Noventa pacientes en DP fueron sometidos a PEP al 2,27 y al 3,86%, en orden aleatorio. Comparamos el transporte de potasio en ambas pruebas, buscando correlaciones del cociente D/P de potasio a 240 minutos (variable principal) con marcadores de función peritoneal durante PEP, y con diferentes variables demográficas, clínicas y bioquímicas, usando una estrategia multivariante. Resultados: El D/P de potasio presentó buena concordancia en ambas PEP, mostrando asociación univariante con el D/P de creatinina, pero no con potasio plasmático, ultrafiltración o descenso de sodio. La edad, tipo de DP, carga peritoneal de glucosa, icodextrina, tratamiento con IECA-ARA o calcioantagonistas, potasio urinario y filtrado glomerular tuvieron una correlación univariante con el transporte de potasio. En el análisis multivariante, el D/P de creatinina a 240 minutos (B = 0,40 [IC 95%: 0,26-0,53] 2,27%; B = 0,36 [0,21-0,51] 3,86%; p <0,0005) fue el predictor esencial del D/P de potasio a 240’. La excreción urinaria de potasio también tuvo una correlación inversa con la variable principal. Asimismo, el tratamiento con IECA-ARA se asoció de forma consistente con el transporte peritoneal de potasio, pero sólo en la PEP al 3,86% (B = 0,08 [0,04-0,12]; p <0,0005). Conclusiones: Las PEP al 2,27 y al 3,86% estiman de manera concordante el transporte peritoneal de potasio. Aunque el transporte de creatinina es el predictor principal del de potasio, la excreción urinaria de potasio y el tratamiento con IECA-ARA se asocian de manera independiente con el fenómeno citado.
Background: There are gaps in the knowledge of factors which influence peritoneal potassium transport in peritoneal dialysis (PD). The aims of this study were to compare peritoneal potassium transport in PD patients undergoing 2.27% and 3.86% peritoneal equilibration tests (PET), and to disclose clinical correlates of this phenomenon. Method: Ninety PD patients underwent 2.27% and 3.86% PET, in a random order. We compared peritoneal potassium transport in both tests, and searched for correlations between D/P potassium at 240 minutes (main study variable) and PET-derived markers of peritoneal function and selected demographic, clinical and biochemical variables, using a multivariate approach. Main results: D/P potassium showed a good agreement between both PET, and presented a univariate association with creatinine transport, but not with plasma potassium, ultrafiltration or sodium dip. Age, PD modality, peritoneal glucose load, icodextrin, ACEI-ARA and calcium antagonist therapy, urinary potassium and glomerular filtration rate were other univariate correlates of potassium transport. Multivariate analysis confirmed D/P creatinine at 240 minutes (B = 0.40 [95% CI 0.26-0.53] 2.27%, B = 0.36 [0.21-0.51] 3.86%,p <0.0005) as the main predictor of D/P potassium at 240’. Urinary potassium, rather than glomerular filtration rate, sustained also an inverse correlation with the dependent variable. Treatment with ACEI-ARA was consistently associated with peritoneal potassium transport (3.86% PET) (B = 0,08 [0.04-0.12], p <0.0005). Conclusions: The 2.27% and the 3.86% PET show a good agreement at the time of estimating peritoneal potassium transport. Urinary potassium excretion and treatment with ACEI-ARA (3.86% test) show an independent association with peritoneal potassium transport rates.
INTRODUCCIÓN
La prueba de equilibrio peritoneal (PEP) es el método de referencia para la categorización del transporte peritoneal en pacientes tratados con diálisis peritoneal (DP), en la práctica clínica. Aunque su uso sistemático se centra en creatinina y glucosa, se ha adaptado para analizar las características del transporte de otros solutos1. La PEP clásica se realiza con solución de glucosa al 2,27/2,5%, pero la variante en la que se emplea solución al 3,86/4,25% gana adeptos de manera progresiva, ya que permite una valoración más precisa de las capacidades de ultrafiltración (UF) y del transporte de agua libre de los pacientes1-3. Las PEP basadas en soluciones al 1,36, al 2,27 o al 3,86% parecen aportar resultados similares en cuanto al transporte de creatinina, con algunas diferencias esperables respecto a otros solutos, como la glucosa o el sodio4,5. Por otra parte, existen notables lagunas en nuestro conocimiento de los factores que influyen en el transporte peritoneal de potasio durante la DP. De manera notable, una fracción significativa del potasio recuperado del efluente peritoneal durante un intercambio de DP podría tener origen celular, diferenciado del potasio transportado por vías difusiva y convectiva desde la circulación6,7. Los mecanismos que gobiernan el flujo transcelular de potasio no están claros, aunque tanto fenómenos locales de apoptosis como el medio ácido y la deshidratación celular en presencia de soluciones hipertónicas podrían desempeñar algún papel en este fenómeno8. Estas circunstancias plantean la posibilidad de que la composición de las soluciones de DP u otros factores clínicos o bioquímicos pudieran influir, de manera específica, en el transporte peritoneal de potasio. La PEP puede ser de ayuda para analizar estas cuestiones.
Hemos realizado un estudio para comparar, en el ámbito clínico, los perfiles de transporte de potasio en 90 pacientes que se sometieron a PEP con soluciones de glucosa al 2,27 y al 3,86%, y tamponadas con lactato, así como determinar factores demográficos, clínicos y bioquímicos que pudieran influir en los resultados del transporte de potasio en ambas pruebas.
POBLACIÓN Y MÉTODO
Diseño general
Siguiendo un diseño prospectivo, 90 pacientes en DP se sometieron, en orden aleatorio, a dos PEP usando soluciones con glucosa al 2,27 y al 3,86%. La demora media entre ambas pruebas fue de 4 meses (amplitud, 0-6). Comparamos los perfiles de saturación de diferentes solutos de bajo peso molecular durante ambas pruebas, con especial interés en el comportamiento del potasio. Analizamos la correlación entre los perfiles de saturación de potasio observados y diferentes variables demográficas (edad, sexo, tiempo en DP, modalidad de DP, diabetes, historial de peritonitis, medicaciones), de laboratorio (diuresis, filtrado glomerular FG, potasio urinario, hemoglobina, albúmina plasmática, proteína C reactiva [PCR]) y de funcionalismo peritoneal (tasas de transporte de urea, creatinina y glucosa, UF, cribado de sodio).
Población
Fueron considerados elegibles para el estudio todos los pacientes tratados en nuestra unidad de DP que cumplieran dos condiciones: situación clínica estable, sin peritonitis o intercurrencias, durante los 2 meses previos al estudio, y consentimiento informado para su participación. Por otra parte, fueron excluidos del análisis los pacientes que presentaron peritonitis, hemoperitoneo o disfunción de catéter peritoneal, los que precisaron retirada de catéter por cualquier causa y los que, en general, presentaron algún episodio clínico significativo durante la realización del estudio.
Protocolo del estudio
En todos los pacientes se estimaron la adecuación de DP y la función renal residual durante el mes previo a cada PEP. Todas ellas siguieron el protocolo general habitual para estas pruebas, con alguna modificación menor. En resumen, tras un cambio nocturno al 2,27%, se infundieron dos litros de dializado al 2,27 o al 3,86% en la cavidad peritoneal. Se recogieron muestras de efluente, de acuerdo a procedimientos estándar, a los 0, 60, 90, 120 y 240 minutos. Al final de la permanencia de 4 horas, se procedió al vaciado total de la cavidad peritoneal. Las muestras sanguíneas se extrajeron a los 120 minutos de cada test. Todos los pacientes usaron soluciones convencionales tamponadas con lactato, de las empresas Baxter (Deerfield, Illinois, EE.UU.) (n = 81) o Fresenius (Heidelberg, Alemania) (n = 9).
Procesamiento de muestras y cálculos secundarios
Las concentraciones de sodio y potasio en plasma, dializado y orina se estimaron mediante un método de electrodo selectivo indirecto. Los niveles en plasma y dializado de glucosa, urea, creatinina (corregida para glucosa) y albúmina se determinaron mediante autoanalizador, con softwares adaptados a cada muestra. Los niveles plasmáticos de PCR se midieron por inmunoturbidimetría (Roche Diag., Mannheim, Alemania).
El FG se computó como la media de los aclaramientos renales de urea y creatinina. El transporte peritoneal general (cociente D/P de creatinina a 240 minutos D/PCr-240’) se categorizó de acuerdo a los resultados de la PEP al 2,27%. Los cocientes D/P de potasio y creatinina se calcularon como el cociente entre las concentraciones en efluente en cada punto de la PEP y las concentraciones en plasma en el punto medio de la prueba. El descenso de sodio se computó como DNa-60’ – DNaNa-0’. El valor D/D0 de glucosa se calculó como el cociente entre las concentraciones de glucosa en efluente en cada Na-0’ punto de muestreo y la concentración en el punto 0 minutos. La UF durante la PEP se calculó por la diferencia de pesos de la bolsa antes de la infusión y tras el drenaje final. Se definió el fallo de UF por un valor de UF <400 ml durante la PEP al 3,86%.
La variable dependiente principal del estudio fue el cociente D/P de potasio a 240 minutos (D/PK-240’). Comparamos la concordancia en las estimaciones de esta variable en las PEP al 2,27 y al 3,86%. También buscamos correlaciones entre la variable principal, por un lado, y las variables demográficas, clínicas y bioquímicas, así como los marcadores escrutados de funcionalismo peritoneal (D/PCr-240’, UF durante la PEP y descenso de sodio a 60 minutos).
Análisis estadístico
Las variables numéricas se presentan como medias o medianas (amplitud), según el ajuste a la normalidad de su distribución. Las comparaciones directas entre variables se realizaron mediante las pruebas de la t de Student, ANOVA (numéricas) y distribución de la chi cuadrado (categóricas). La correlación entre variables numéricas se estudió mediante el coeficiente de correlación de Spearman. La concordancia entre variables numéricas se evaluó mediante gráficos de Bland Altman, usando la prueba de la t de Student para datos pareados para el análisis de sesgos sistemáticos. El análisis multivariante se basó en técnicas de regresión múltiple progresiva y por pasos. Utilizamos el programa SPSS 17.0 para el procesamiento de datos.
RESULTADOS
Aspectos generales
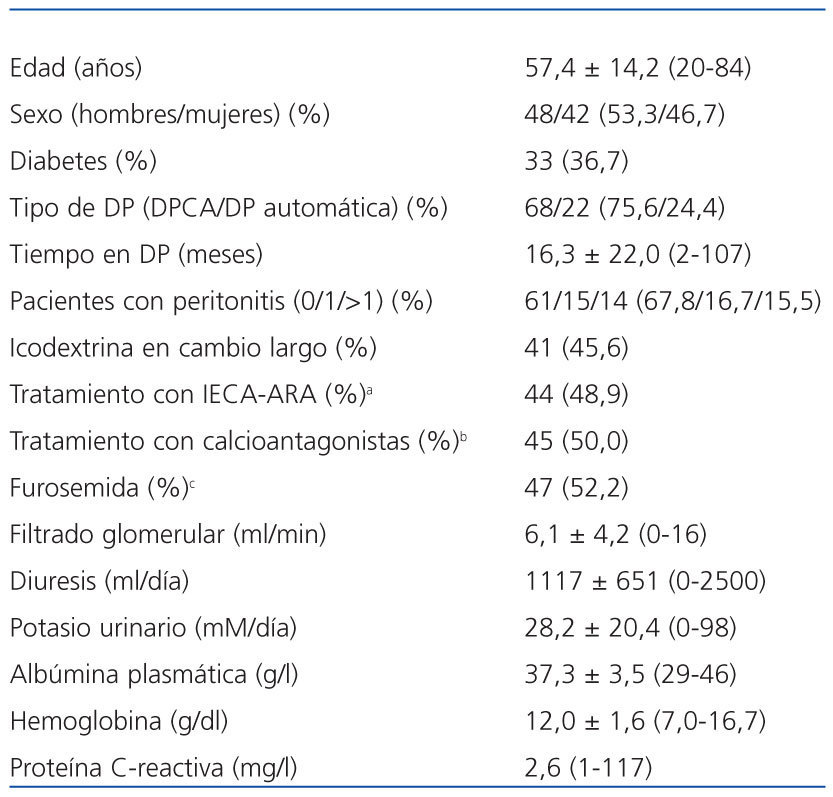
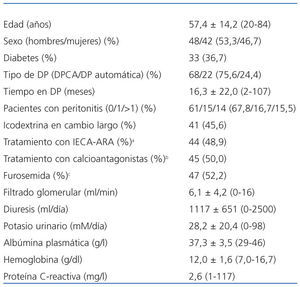
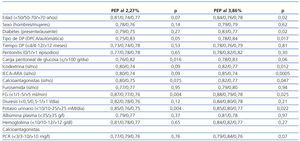
Las características principales de la población estudiada se resumen en la tabla 1. Las cargas peritoneales diarias de glucosa en el momento de las PEP eran de 87,2 ± 47,0 g (27,2-233,7; 2,27%) y 90,4 ± 45,9 g (21,2-236,0; (3,86%; p = 0,46). En cuanto a los resultados generales de las PEP, los perfiles de D/PCr fueron muy similares en las pruebas al 2,27 y al 3,86% (datos no expuestos). La población estudiada incluía a 17 bajos transportadores (18,9%), a 63 medios transportadores (70,0%) y a 10 altos transportadores (11,1%). Los valores medios de UF durante las PEP fueron 131,4 ± 256,7 ml (−480 a −600; 2,27%) y 542,0 ± 344,5 ml (−150 a 1.300; 3,86%). Veintiséis pacientes (28,9%) cumplieron el criterio dignóstico de fallo de UF. Los niveles plasmáticos de potasio fueron 4,74 ± 0,72 mM/l (2,8-6,1; 2,27%) y 4,73 ± 0,62 mM/l (3,5-6,1; 3,86%; p =0,70). Los valores medios de glucemia fueron 111,7 ± 48,6 mg/dl (52-269) y 112,5 ± 48,5 mg/dl (66-318), respectivamente (p = 0,85).
Comparación de los perfiles de transporte de potasio en ambas PEP
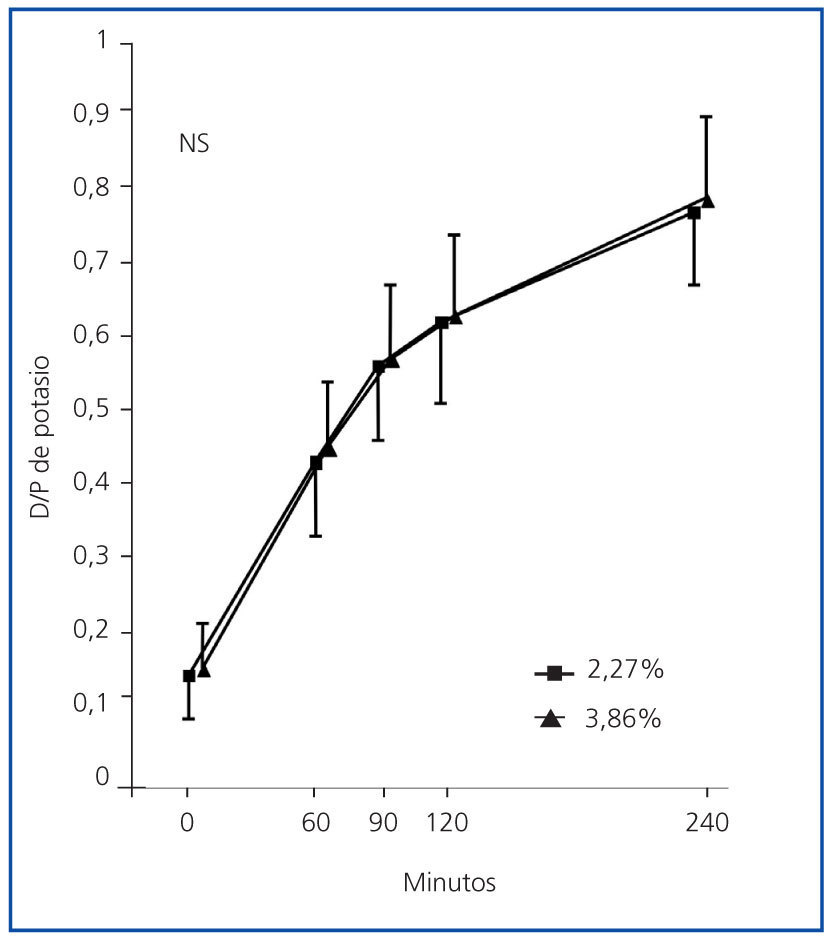
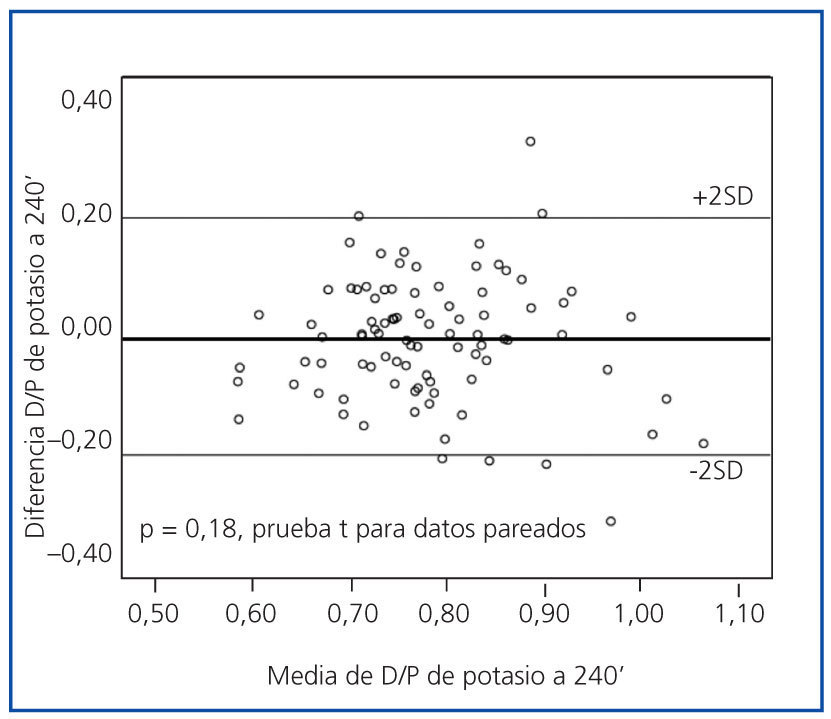
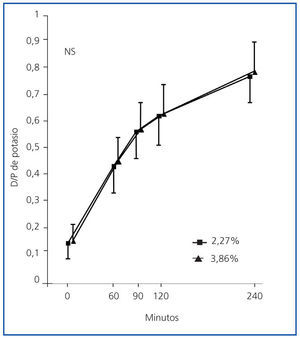
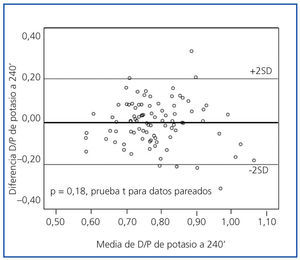
Los perfiles de saturación de potasio fueron muy similares en las PEP al 2,27 y al 3,86% (figura 1). La concordancia fue buena, sin sesgos sistemáticos entre ambas pruebas, a los 60 (p = 0,09), 90 (p = 0,71), 120 (p = 0,17) y 240 minutos (figura 2).
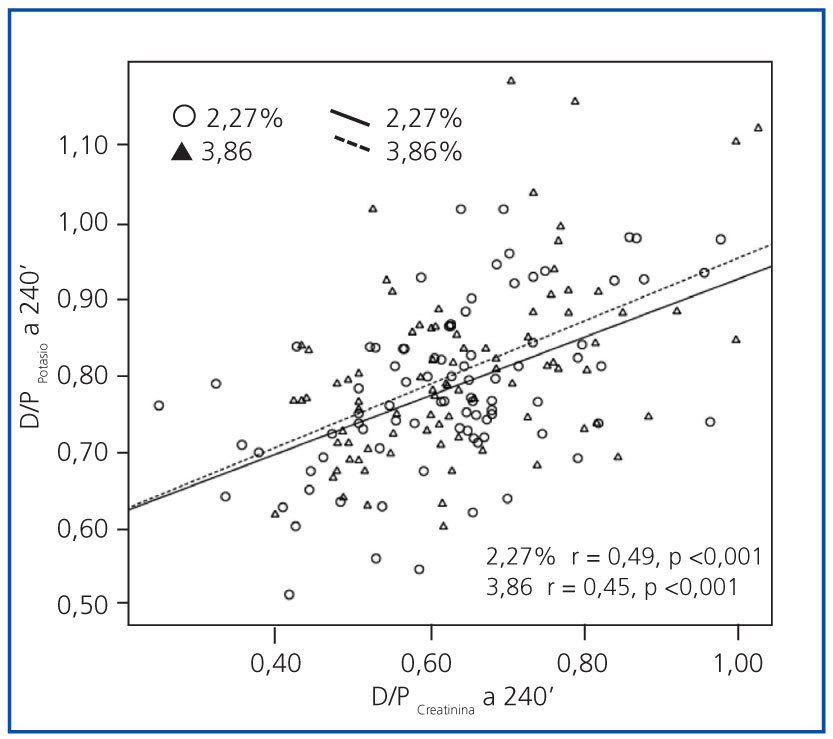
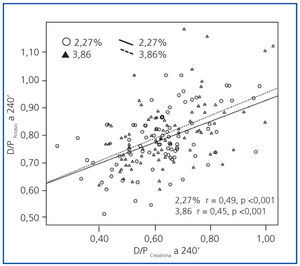
Observamos una buena correlación univariante entre los transportes de potasio y creatinina en ambas PEP (figura 3). La correlación entre el D/PK-240’ y el D/D0 de glucosa a 240 minutos resultó más estrecha en la PEP al 2,27% (r = −0,49; p <0,0005) que en PEP al 3,86% (r = −0,29; p =0,006). El cociente D/P de urea a 240 minutos mostró una correlación con el más D/PK-240’ pobre que el de creatinina en ambas PEP (r = 0,35; p <0,0005 [2,27%], r = 0,22, p =0,04 [3,86%]). Por otra parte, no observamos correlaciones univariantes significativas entre la variable principal por un lado y el potasio plasmático (r = −0,01, p = 0,96, 2,27%, r = −0,05, p = 0,64, 3,86%), la UF (r = 0,13, p = 0,22, 2,27%; r = 0,03, p = 0,75, 3,86%) o el descenso del sodio en dializado a 60 minutos (r = 0,02, p = 0,88, 2,27%, r = 0,10, p = 0,34, 3,86%), por otro.
Correlaciones demográficas, clínicas y bioquímicas del transporte peritoneal de potasio
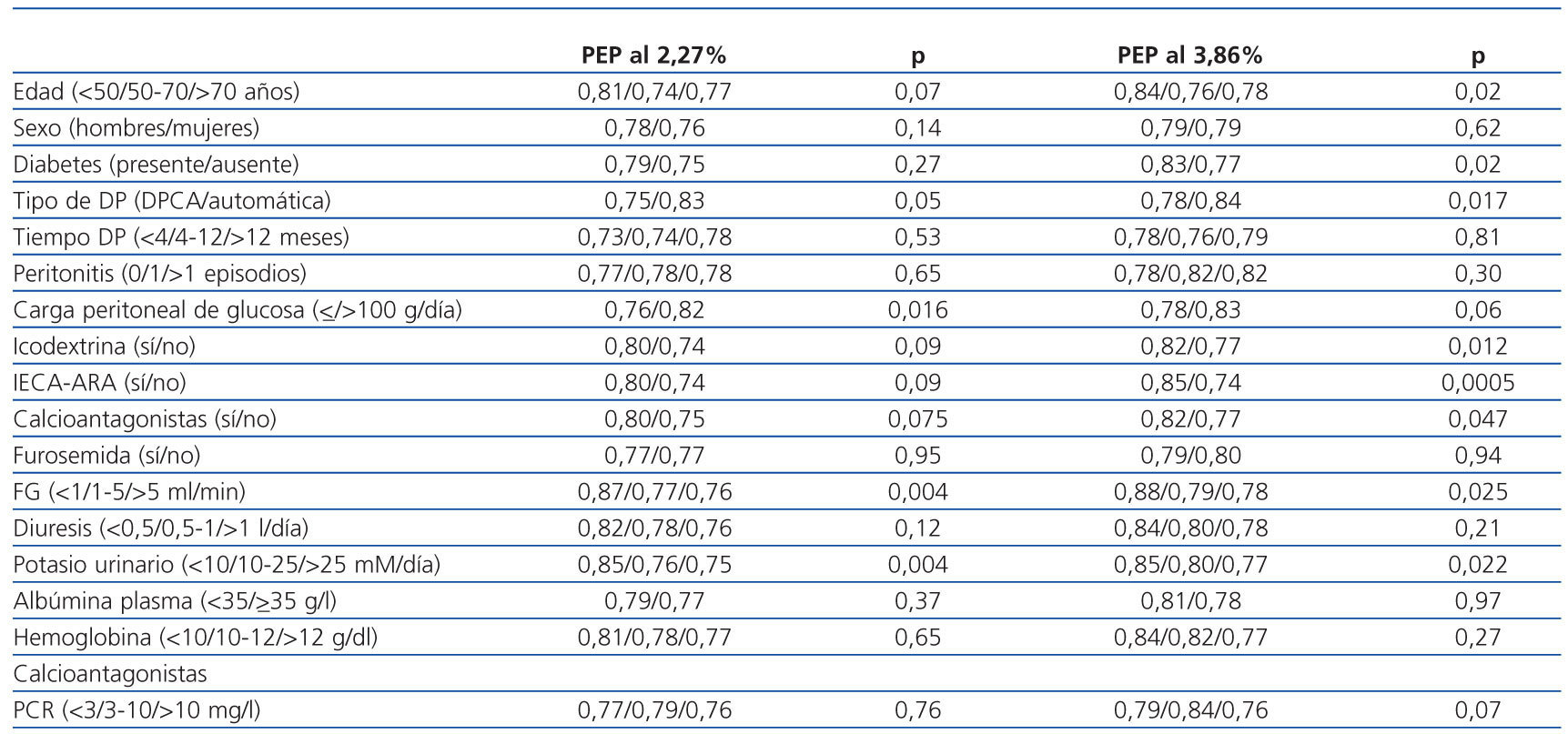
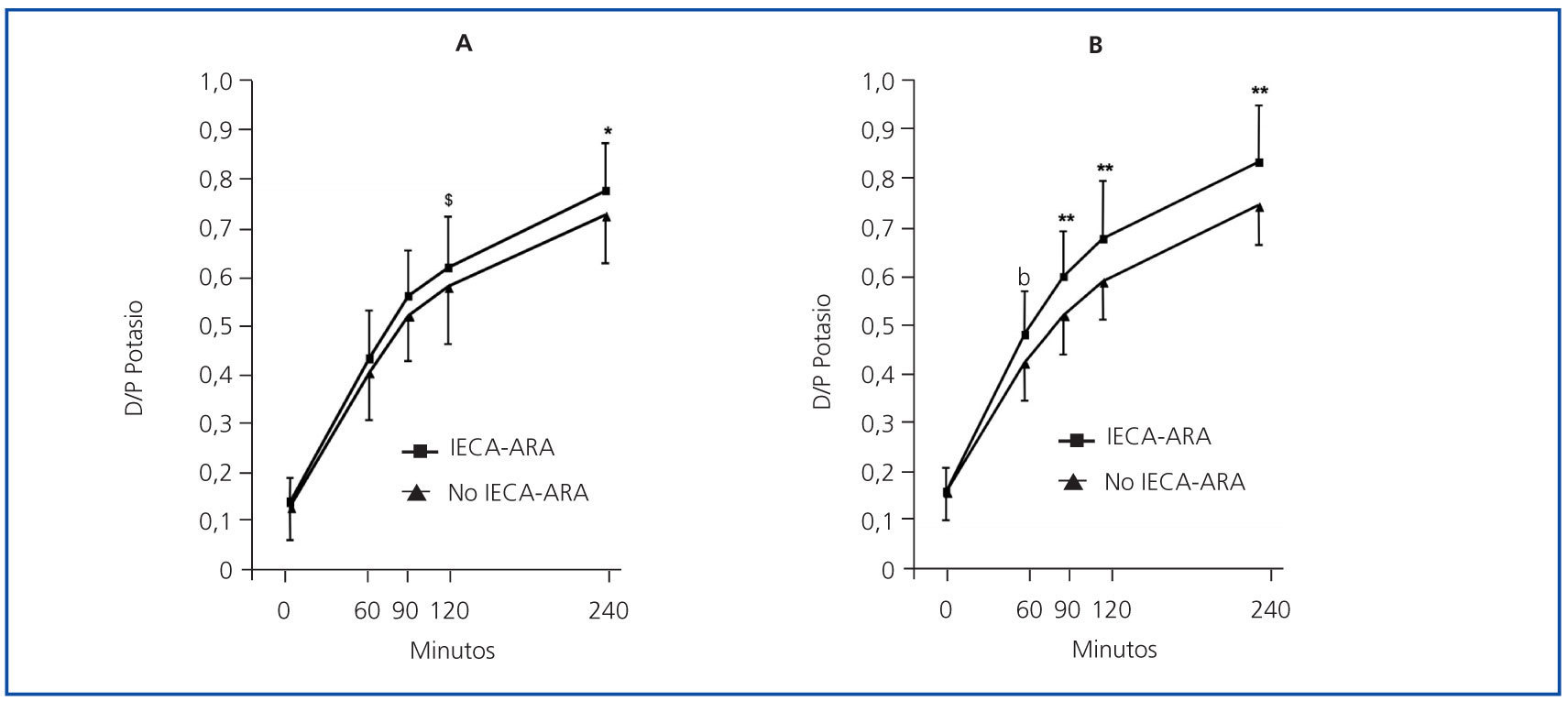
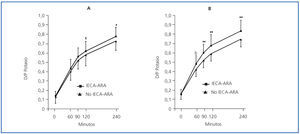
En la tabla 2 se exponen las correlaciones univariantes entre el cociente D/PK-240’ por un lado y las diferentes variables demográficas, clínicas y bioquímicas escrutadas, por otro. Era patente una clara tendencia a valores más altos de D/P de potasio en los pacientes tratados con IECA-ARA (figura 4), especialmente durante la PEP al 3,86% (figura 4b). Los niveles medios de potasio en plasma eran de 4,84 ± 0,69 mM/l (2,8-5,8) (IECA-ARA) frente a 4,64 ± 0,64 mM/l (3,1, 6,1) (no IECAARA) durante la PEP al 2,27% (p = 0,18), y 4,89 ± 0,68 (3,5-6,1) y 4,61 ± 0,65 mM/l (3,6-5,8), respectivamente, durante la PEP al 3,86% (p = 0,06).
Análisis multivariante
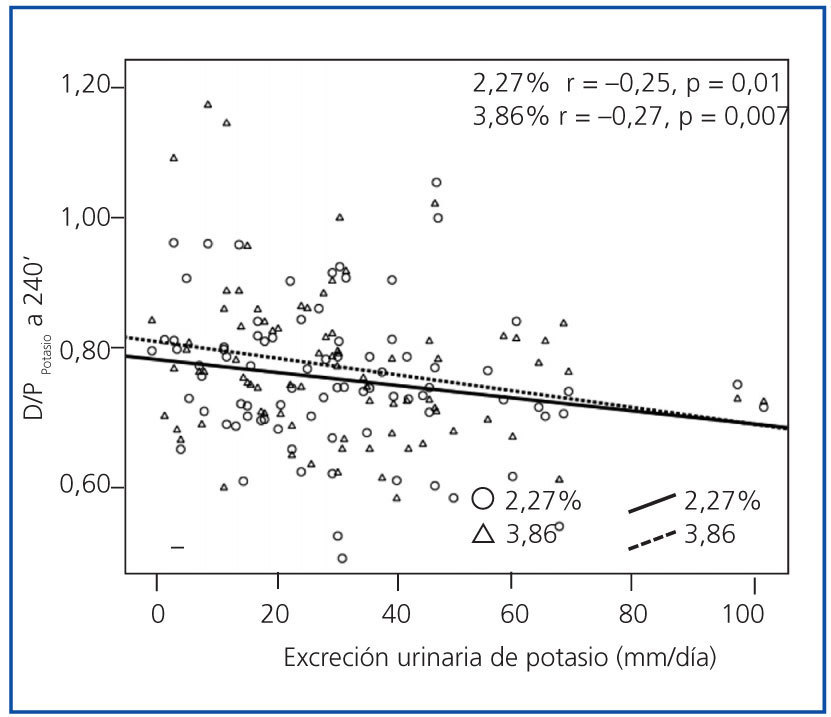
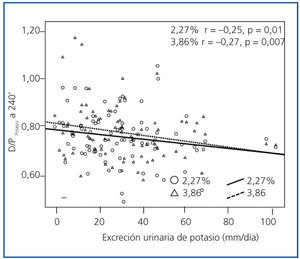
En el análisis de regresión múltiple (tabla 3) se identificó la categoría general de transporte peritoneal (estimada por D/PCr-240’) como el predictor más consistente del cociente D/PK-240’. Los cocientes D/D0 de glucosa y D/P de urea a 240 minutos generaban modelos menos consistentes que el D/PCr-240’ en ambas PEP. Por otra parte, el tratamiento con IECA-ARA fue también un potente predictor del D/PK-240’, pero sólo en la PEP al 3,86%, mientras que en la PEP al 2,27% se observaba una tendencia similar, pero no significativa. Además, tanto el FG (tabla 2) como la excreción urinaria de potasio (figura 5) tuvieron una correlación univariante inversa con la variable principal. El FG se mantenía como predictor independiente del cociente D/PK-240’ (B = −0,005 [IC 95% −0,009 a 0,000], p = 0,036 PEP al 2,27%; B = −0,005 [−0,010 a 0,000], p = 0,038 PEP al 3,86%) sólo si no se incluía el potasio urinario en el modelo de regresión, pero esta última variable tuvo una asociación mucho más estable con la variable dependiente principal (tabla 3).
DISCUSIÓN
Nuestros resultados concuerdan con los de los escasos estudios previos de los que se dispone7,9, al mostrar una buena concordancia entre las PEP con glucosa al 2,27 y al 3,86% a la hora de estimar el transporte peritoneal de potasio. Sin embargo, esta equivalencia podría resultar de la interacción de varias fuerzas opuestas. Así, el transporte de agua libre debería producir una saturación más lenta de potasio en la PEP al 3,86% que en la del 2,27%, especialmente durante las primeras 2 horas de la prueba, pero tanto la difusión como la convección de potasio por los poros pequeños parecen compensar rápidamente este efecto. Otros mecanismos pueden influir en el transporte de potasio, dependiendo de la concentración de glucosa en el dializado. En primer lugar, la hipertonicidad y el pH ácido de las soluciones basadas en glucosa y lactato pueden generar vasodilatación local, aumentando así el transporte de solutos (incluyendo el potasio). Sin embargo, este efecto podría ser no lineal, es decir, que las soluciones al 3,86% podrían no ser más vasodilatadoras que las del 2,27%10. De hecho, el transporte de creatinina posee una excelente concordancia en PEP al 2,27 y al 3,86%3-5. Por otra parte, el flujo transcelular de potasio podría representar una fracción significativa del transporte peritoneal de este catión durante un intercambio de DP6,7. Las razones de este fenómeno no están claras. Es posible que parte del potasio transportado proceda de células muertas que liberan su contenido a la cavidad peritoneal, pero estudios recientes8 sugieren que la salida de potasio de células viables podría representar un mecanismo más importante. En primer lugar, el bajo pH del dializado podría favorecer el intercambio transcelular de potasio y protones7, aunque este efecto debe ser autolimitado, ya que el pH se equilibra rápidamente durante un intercambio de DP. Además, un dializado rico en glucosa genera una alta osmolaridad local, que puede provocar deshidratación celular y salida de potasio de las células11. Si este mecanismo fuera significativo, las soluciones al 3,86% deberían generar más transporte de potasio que las del 1,36 o del 2,27%. Este mecanismo operaría en contrabalance con el efecto putativo del transporte de agua libre. Se ha indicado que este último se correlaciona directamente con la liberación de potasio de las células,11 lo que apoyaría esta hipótesis. En todo caso, está claro que los mecanismos mencionados requieren una mayor clarificación. Por ejemplo, las soluciones de glucosa hipertónica estimulan la secreción de insulina12 que, a su vez podría favorecer la captación celular de potasio, con un impacto no definido en el transporte peritoneal de potasio13.
Un hallazgo notable de nuestro estudio fue la observación de tasas significativamente aumentadas de transporte peritoneal de potasio en pacientes tratados con IECA-ARA, un efecto particularmente evidente durante las PEP al 3,86% (figura 4). Los efectos de estas familias de fármacos sobre la función y la estructura peritoneales son objeto de controversia. En primer lugar, los pacientes tratados con IECA-ARA presentan perfiles específicos de comorbilidad y tienen tasas más altas de transporte peritoneal desde el inicio de DP14. Por otra parte, la administración a corto plazo de IECA-ARA a pacientes en DP puede inducir vasodilatación peritoneal15, aunque este efecto no parece modificar significativamente el transporte general de solutos16-18. La administración a largo plazo de IECA-ARA puede atenuar los cambios en la membrana inducidos por la DP19,20, como consecuencia, al menos en parte, de la capacidad de estos fármacos para prevenir la fibrosis y estabilizar la superficie vascular peritoneal20-22. El efecto específico de los IECAARA sobre el transporte peritoneal de potasio ha recibido poca atención en el pasado. Así, Rojas-Campos, et al18 no observaron ningún efecto aparente del losartán sobre el transporte de potasio. Sin embargo, este estudio se realizó a corto plazo y se utilizó solución al 2,5% para el análisis del transporte de solutos. Además, los resultados del estudio mostraban una tendencia no significativa al aumento del cociente D/P de potasio en pacientes tratados con losartán, pero no con verapamil o prazosín18. En nuestro estudio, el impacto de los IECA-ARA sobre el transporte de potasio fue mucho más evidente durante las PEP al 3,86% (tabla 3 y figura 4). Nuevamente, no está clara la razón de esta diferencia. Los IECA-ARA podrían provocar la liberación de potasio a la cavidad peritoneal induciendo apoptosis de las células peritoneales, de manera análoga a lo que sucede en otros tejidos23,24, pero esta hipótesis es muy especulativa. Los IECAARA podrían también bloquear mecanismos compensadores generales orientados a atenuar la extrusión de potasio de las células, y este efecto sería más evidente cuanto mayor fuera el estímulo para la liberación de potasio (como en la PEP al 3,86%). La hiperpotasemia es un efecto secundario bien conocido de los IECA-ARA25,26. La inhibición de la excreción urinaria de potasio es el mecanismo principal de este efecto pero, en pacientes en diálisis con función renal ausente o muy alterada, el bloqueo del eje renina-angiotensina-aldosterona podría afectar a mecanismos compensadores orientados a facilitar la excreción fecal y la captación celular de potasio27-29.
Tanto el FG como la excreción urinaria de potasio mostraron una correlación inversa con el transporte peritoneal de potasio, pero la segunda variable tuvo una asociación mucho más consistente con la variable principal del estudio. Esta asociación pudo ser estudiada en detalle porque sólo 7 pacientes del grupo de estudio estaban anúricos al inicio del mismo. Una asociación inversa entre FG y transporte peritoneal de potasio parece, a primera vista, paradójica, porque el descenso del FG debería activar los mecanismos de adaptación al potasio, favoreciendo la captación celular y, en consecuencia, reduciendo el transporte transcelular de este catión. Por el contrario, resulta tentador especular que la excreción urinaria de potasio sea un marcador indirecto de la actividad de aldosterona, aunque los niveles de esta hormona no se analizaron en este estudio. Como ya hemos comentado, niveles elevados de aldosterona podrían favorecer la captación celular de potasio28, oponiéndose a su extrusión de las células peritoneales en repuesta a la acidez e hipertonicidad del dializado.
El tratamiento con calcioantagonistas tuvo una cierta asociación directa con el transporte peritoneal de potasio en el análisis univariante, pero esta correlación no resistió los ajustes de la regresión múltiple. Estos fármacos se estudiaron por su capacidad para bloquear la extrusión de potasio de las células endoteliales por canales dependientes de calcio30. Estos canales han sido identificados en el mesotelio peritoneal31. El verapamil no parece modificar a corto plazo el transporte peritoneal de solutos en pacientes en DP aunque, por razones inciertas, podría aumentar la UF18.
En conclusión, tanto la PEP clásica al 2,27% como la modificada al 3,86% poseen una buena concordancia en la estimación del transporte peritoneal de potasio. La excreción urinaria de potasio y el tratamiento con IECA-ARA (PEP al 3,86%) muestran correlación independiente con la citada variable. Son necesarios estudios ulteriores para aclarar las interacciones entre mecanismos sistémicos de adpatación a la insuficiencia renal y la fisiopatología de la membrana peritoneal durante el tratamiento con DP.
Tabla 1. Población del studio
Tabla 2. Correlaciones clínicas del transporte peritoneal de potasio durante la PEP. Análisis univariante
Tabla 3. Correlaciones clínicas del transporte peritoneal de potasio durante la PEP. Análisis multivariante
Figura 1.
Figura 2.
Figura 3.
Figura 4.
Figura 5.