INTRODUCCIÓN
La amiloidosis se caracteriza por presentar depósitos a nivel del tejido, predominantemente extracelular, de material proteico cuya estructura molecular terciaria característica en disposición de b-plegada es la responsable de su insolubilidad y resistencia a la digestión proteolítica. Se clasifican según el tipo de proteína fibrilar constituyente.
La amiloidosis secundaria se caracteriza por presentar típicamente depósitos de proteína fibrilar AA de estructura no inmunoglobulínica. Esta proteína (SAA) deriva de un precursor plasmático de síntesis hepática, con carácter de reactante de fase aguda ante estímulos inflamatorios persistentes o en presencia de necrosis tisular. Se han identificado varias formas de proteínas SAA1. La amiloidosis sistémica AA puede complicar a un importante número de enfermedades o procesos inflamatorios crónicos, siendo características la fiebre mediterránea familiar, la artritis reumatoide2, la poliartritis crónica juvenil3 la espondiloartritis anquilopoyética4-6, la enfermedad inflamatoria intestinal, las osteomielitis o las infecciones respiratorias cronificadas por bronquiectasias. Otras entidades que pueden asociarse a amiloidosis AA, pero en menor frecuencia son algunas neoplasias malignas como el carcinoma renal o la enfermedad de Hodgkin7,8. Su asociación con procesos neoformativos benignos también ha sido reportada en la literatura8,9, aunque de forma mucho más esporádica.
Presentamos 2 casos que muestran la asociación entre tumoraciones benignas y el desarrollo de amiloidosis secundaria (AA).
CASO CLÍNICO (1). AMILOIDOSIS ASOCIADA A ADENOMA HEPÁTICO TRAS TRATAMIENTO CON ANTICONCEPTIVOS ORALES
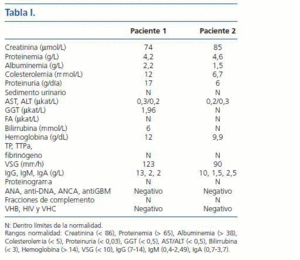
Paciente mujer de 34 años, sin antecedentes familiares ni personales de interés. Inicia ingesta de anticonceptivos orales (ACO) en 1989 hasta 1996. En 1999 tiene primer embarazo a término sin complicaciones referidas. En 2000 reinicia la toma de ACO. En 2001 segundo embarazo sin alteraciones no reiniciando tratamiento con ACO desde entonces. En 2002 se le detecta hiperlipidemia que se trata con simvastatina. En mayo de 2003 la paciente refiere aparición progresiva de edemas maleolares y palpebrales matutinos por lo que acude al servicio de urgencias de nuestro centro. El estudio analítico realizado muestra un síndrome Nefrótico puro, y un patrón bioquímico de colestasis (tabla I).
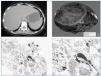
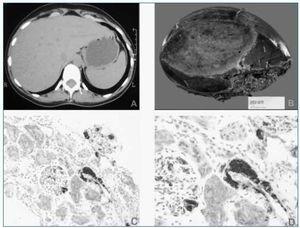
Las pruebas de imagen realizadas (ecografía y TAC abdominal) muestran una imagen de gran tamaño compatible con adenoma hepático en lóbulo hepático derecho (fig. 1a), con riñones de tamaño y ecoestructura normal. Se realiza seguidamente biopsia rectal que demuestra la existencia de depósitos de amiloide de tipo AA en los vasos de la submucosa (técnica de inmunohistoquimia).
Con el diagnóstico de síndrome Nefrótico secundario a amiloidosis en paciente con probable adenoma hepático, se remite al Servicio de Cirugía que programa su ingreso para intervención quirúrgica. En julio de 2003 se realiza hepatectomía parcial derecha (fig. 1b). El diagnóstico de adenoma hepático es confirmado histológicamente, observándose también depósitos de amiloide de tipo AA en el tejido renal, hepático y tumoral (figs. 1c, d).
El curso postoperatorio de la paciente fue tórpido, con aparición de ascitis de elevado volumen y progresivo deterioro de la función renal. En este contexto clínico, desarrolla shock séptico por E. coli de origen peritoneal requiriendo el uso de drogas vasoactivas y tratamiento sustitutivo renal con técnicas de depuración continua. Tras el cuadro agudo y varios días en la unidad de cuidados intensivos, la paciente evoluciona favorablemente pero sin recuperar la función renal, quedando en programa de hemodiálisis periódica. A los 10 meses, la paciente recibe un trasplante renal con el que sigue en la actualidad con buena evolución (creatinina sérica: 120 μmol/L, albúmina plasmática: 35 g/L, proteinuria: 0,5 g/día).
DISCUSIÓN DEL CASO 1
El adenoma hepático asociado al uso crónico de anticonceptivos se describió por primera vez en 197310. Desde entonces su descripción ha dejado de ser una rareza, probablemente por la mayor utilización de estos fármacos. Su incidencia en mujeres que nunca han utilizado anticonceptivos es aproximadamente de 1 por millón versus un 30-40 por millón en pacientes en tratamiento crónico con los mismos. Como factores de riesgo se han mencionado la edad juvenil, un alto contenido estrogénico del fármaco y la dosis y duración del tratamiento11,12. Los adenomas hepáticos asociados a ACO suelen ser más frecuentemente múltiples, de mayor tamaño y tienen una mayor tendencia al sangrado que los primarios13-16. En algunos casos se ha comprobado la regresión de estos adenomas con el cese del tratamiento anticonceptivo, siendo entonces frecuente la recurrencia con el embarazo o la reintroducción del tratamiento, es decir, en situaciones de hiperestrogenismo17-20. El mecanismo patogénico por el que la terapia estrogénica contribuye al desarrollo de los adenomas hepáticos no está bien clarificada, aunque la hipótesis más invocada es que induciría la transformación y proliferación de los hepatocitos vía receptores esteroideos presentes en estas células21. Aunque el riesgo de malignización no está claramente aceptado en la literatura, algunos autores defienden que no es excepcional22. El manejo terapéutico de los adenomas es controvertido. Las pacientes asintomáticas con consumo crónico de ACO y lesiones hepáticas de pequeño tamaño (< 5 cm), serían, según algunos autores, tributarias tan solo de vigilancia tras el cese del tratamiento ya que ha sido documentada la completa regresión del tumor tras la discontinuación del fármaco23-25. Otros autores propugnan la cirugía, independientemente del tamaño tumoral por el riesgo de crecimiento, malignización o rotura26. En todas aquellas pacientes sintomáticas y/o con adenomas de tamaño mayor a 5 cm la cirugía sería de elección.
Hay escasa documentación en la literatura sobre la asociación entre el adenoma hepático y el desarrollo de amiloidosis sistémica secundaria (AA). Se ha descrito, que el desarrollo de amiloidosis secundaria (AA) podría ser explicado por la hiperproducción de TNF-a por parte de las células tumorales, con capacidad estimulatoria para la producción de sustancia amiloide27. Algunos casos de dicha asociación son reportados, con motivo de la desaparición de los depósitos de amiloide tras la regresión o exéresis del tumor28. Por este motivo, en nuestro caso, la cirugía fue el tratamiento de elección, teniendo en cuenta el riesgo quirúrgico de un paciente afecto de amiloidosis sistémica. La exéresis de la neoplasia no se siguió de mejoría del cuadro renal, muy probablemente debido a las graves complicaciones hemodinámicas que padeció la enferma en el postoperatorio inmediato. Actualmente, a los 30 meses de la exéresis tumoral, la paciente es portadora de un injerto renal con excelente función renal.
CASO CLÍNICO (2). ENFERMEDAD DE CASTLEMAN Y AMILOIDOSIS SECUNDARIA
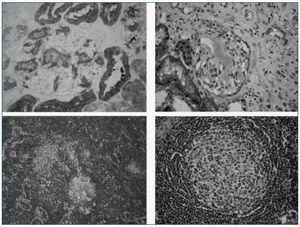
Paciente mujer de 20 años, sin antecedentes personales ni patológicos de interés, que ingresa en nuestro Servicio por presentar astenia y edemas maleolares de 1 mes de evolución, siendo el resto de la exploración física normal. Los hallazgos de laboratorio mostraron un síndrome Nefrótico puro (tabla I). Los estudios inmunológicos y serológicos no mostraron ninguna alteración. Seguidamente, se realizó una biopsia renal guiada por ecografía en la que se observaron extensos depósitos de material proteico amiloideo de tipo AA (técnica de immunohistoquímica) (fig. 2). Dado el diagnóstico de amiloidosis renal secundaria (AA) se procedió a seguir el estudio etiológico. Se realizó un aspirado de médula ósea que fue normal. El estudio de imagen por TAC abdominal mostró la presencia de una masa retroperitoneal de 6 x 5 x 6 cm adyacente a cava inferior junto a varias adenopatías retroperitoneales. Por laparoscopia se realizó exéresis y biopsia de la masa. El estudio microscópico reveló una estructura de característica linfoadenopática con proliferación nodular de células dendríticas y aspecto hialino, típica de la enfermedad de Castleman (EC), así como depósito de material amiloideo de tipo AA. Debido a la persistencia del síndrome Nefrótico pese a la resección quirúrgica de la masa linfoadenopática, se inició tratamiento con colchicina y tratamiento médico sintomático, siendo infructuoso, ya que la enfermedad renal progresó a insuficiencia renal crónica terminal requiriendo a los 9 meses, inicio de tratamiento sustitutivo. Después de 6 años, la paciente recibió un primer trasplante renal de donante cadáver, con el que sigue en la actualidad con buena evolución (creatinina sérica: 110 μmol/L, albúmina plasmática: 37 g/L, proteinuria: 0,2 g/día).
DISCUSIÓN DEL CASO 2
La hiperplasia linfoadenopática gigante o enfermedad de Castleman (EC) es una heterogénea entidad clínico-patológica catalogada dentro de las enfermedades linfoproliferativas atípicas. Fue descrita por primera vez en 1956 por Castleman y cols., como una gran masa adenopática, de localización mediastínica y de comportamiento clínico benigno. Posteriores trabajos han mostrado su potencial localización a nivel extramediastínico29. Los 2 patrones histológicos básicos descritos en la EC son la variante hialino-vascular que acontece en el 80-90% de los casos, y la compuesta por células plasmáticas (10-20%). La primera, formada por proliferación de capilares vasculares en centros germinales de folículos linfáticos que adoptan un aspecto hialino, presenta clásicamente, una única localización, frecuentemente mediastínica y sigue un curso benigno tras su exéresis. La variante de células plasmáticas, menos frecuente, presenta hiperplasia folicular con interposición de células plasmáticas, suele ser multicéntrica y frecuentemente presenta síntomas en forma de síndrome inflamatorio sistémico. El pronóstico de la segunda forma histológica es peor, no siendo excepcional su progresión a linfoma. Esta forma multicéntrica, se ha asociado frecuentemente a la infección por el VIH, así como también en pacientes infectados o coinfectados por el VHH 830, siendo el tratamiento antiviral en algunos casos útil para lograr su regresión31. Algunas formas mixtas también han sido descritas.
Hay muy pocos casos reportados en la literatura de enfermedad de Castleman asociada a amiloidosis. De los 17 casos descritos sólo 9 presentaban síndrome Nefrótico secundario a amiloidosis renal32. También se ha descrito otras afecciones renales asociadas a la EC, como nefropatía a cambios mínimos, nefropatía membranosa y membranoproliferativa33. La patogenia de la amiloidosis AA asociada a EC no está muy clara. Algunos autores han postulado el papel de la citoquina IL-6, presente en elevadas cantidades en los centros germinales de los nódulos linfáticos, como responsable de la aparición de proteínas reactantes de fase aguda responsables de la aparición de los depósitos amiloideos (PCR, SAA)34,35. Varios autores han mostrado la curación de la EC después de la resección de la masa linfoide, logrando así, la regresión de los depósitos de amiloide y finalmente la desaparición del síndrome Nefrótico asociado36,37. Sin embargo, otras experiencias han mostrado la persistencia de los depósitos amiloideos tras la cirugía38,39.
En nuestro caso, probablemente la gran cantidad de material amiloideo que presentaba la paciente depositado a nivel renal, hizo que no fuese posible su desaparición, a pesar de que el estímulo causante desapareciera.
CONSIDERACIONES
Como es sabido, el hallazgo de sustancia amiloide tipo AA en una muestra de tejido obliga a descartar una enfermedad inflamatoria crónica como posible condicionante del depósito. Los dos casos aquí referidos muestran cómo a la lista de enfermedades inflamatorias más habitualmente encontradas como origen de una amiloidosis secundaria, se han de añadir las tumoraciones benignas. Es importante recalcar que, un diagnóstico precoz de estas entidades, puede llevar a la curación de la enfermedad amiloidea secundaria, y por tanto, del daño parenquimatoso multiorgánico que se establece. En los dos casos aquí referidos, la afectación amiloidea renal en forma de síndrome Nefrótico, no desapareció a pesar de la desaparición del estímulo desencadenante; en el primer caso, las graves complicaciones postquirúrgicas con severo trastorno hemodinámico aparecidas, fueron posiblemente el elemento clave que impidió la potencial recuperación de la función renal de la paciente. En el segundo caso, los extensos depósitos de material amiloideo en los diferentes compartimentos renales, y principalmente a nivel glomerular y vascular, hicieron infructuosa su regresión a pesar también de la desaparición del estímulo originario. Sin embargo, es relevante resaltar el hecho de que la favorable evolución clínica tanto a nivel renal como extrarrenal de ambas pacientes a los dos años de haber recibido un trasplante renal, parece indicar la resolución de la enfermedad sistémica amiloidea.
Como enfermedad sistémica, la amiloidosis AA, tiene en la afectación cardíaca un especial interés en cuanto al pronóstico vital de la enfermedad, así como en permitir la indicación para entrar en programa de trasplante renal. En ambos casos clínicos, el estudio funcional miocárdico por ecocardiografía, tanto en el momento del diagnóstico de la enfermedad como posteriormente durante el estudio pretrasplante, fueron favorables, sugiriendo la no afectación cardíaca en ambas pacientes. Por tanto, parece que una vez desaparecido el estímulo causante del desarrollo de la enfermedad amiloidea, la opción terapéutica del trasplante renal como tratamiento electivo en estos enfermos es posible y con excelentes resultados clínicos.
Tabla 1.
Figura 1.
Figura 2.