INTRODUCCIÓN
Los síndromes periódicos asociados a criopirinas (CAPS) o criopirinopatías están constituidos fundamentalmente por tres entidades, a menudo con solapamiento clínico: el síndrome autoinflamatorio familiar por frío (FCAS), el síndrome de Muckle-Wells (MWS) y la enfermedad inflamatoria multisistémica de inicio neonatal (NOMID). En todos ellos existen mutaciones en único gen: el NRLP3 (CIAS1) situado en el cromosoma 1q44 y que codifica una proteína denominada criopirina (NALP3)1. El modo de herencia de estos trastornos es autosómico dominante con penetrancia variable.
La criopirina forma parte del complejo multiproteico del inflamasoma, que, a través de diversos pasos, induce la formación de la interleucina 1β (IL-1β) y la interleucina 18 (IL-18). En condiciones normales, la activación del inflamasoma se produce por diversos estímulos, como los patrones moleculares asociados a patógenos, tales como el ARN viral o bacteriano, o bien por los patrones moleculares asociados a daño, tales como los cristales de ácido úrico o irritantes cutáneos2.
Se piensa que, en los CAPS, las mutaciones puntuales del gen NALP promueven la formación aberrante del inflamasoma y un producción inapropiadamente elevada de IL-1β. Se cree que las distintas mutaciones tendrían un diferente impacto sobre la actividad del inflamasoma, lo cual, modulado por la base genética individual, condicionaría la aparición de las distintas entidades clínicas3.
EXPOSICIÓN DEL CASO
Mujer de 41 años, exfumadora, con antecedentes de úlcera gástrica y hemorragia digestiva secundaria a ingesta de antiinflamatorios no esteroideos, bocio difuso multinodular diagnosticado dos años antes y con biopsia compatible con amiloidosis AA, enfermedad renal crónica (ERC 3) de cuatro años de evolución y conjuntivitis recurrentes con glaucoma bilateral secundario a abuso de corticoides. Intervenciones quirúrgicas: amigdalectomizada, trabeculoplastia de ambos ojos por glaucoma y ooforectomía derecha por torsión de quiste ovárico. Desde los 6 meses, episodios de urticaria inducida por frío de 24-48 horas de evolución (pico de ataque a las 2-3 horas) con lesiones de tipo habonoso, que dejaban marca eritematosa residual y cursaban con ardor y dolor, que a partir de los 11 años se acompañaban de artritis bilateral (rodillas, tobillos, codos y articulaciones interfalángicas), conjuntivitis, escalofríos, sensación distérmica y astenia, siendo más frecuentes en invierno y desencadenados por frío, aire acondicionado, estrés y menstruación. En los últimos episodios, malestar abdominal con náuseas y anorexia. Los cuadros precisaban reposo y remitían progresivamente con ayuda de antitérmicos y corticoides. En los últimos años los síntomas eran más intensos e incapacitantes, con aumento del número de episodios que se solapaban hasta encontrarse con escasos períodos libres de síntomas. Adicionalmente, pérdida de audición en los últimos años (audiometría: hipoacusia perceptiva bilateral con descenso importante en agudos).
Antecedentes familiares
Hija con mutación CIAS/NALP3 (síndrome autoinflamatorio familiar por frío). Madre, tío y abuelo materno con cuadros de urticaria, artralgias-artritis, conjuntivitis y síndrome pseudogripal asociados a frío, presentando el abuelo además insuficiencia renal.
En los estudios complementarios destacaba: creatinina: 2,2 mg/dl; urea 54 mg/dl; aclaramiento de creatinina: 31,4 ml/min/1,73 m2; albúmina 3,8 mg/dl, IgM 384 mg/dl, C4 14,1 mg/dl, hemoglobina, amiloide A suero: 21,8 mg/l. Proteínas totales, colesterol total, pruebas de función hepática, creatinfosfoquinasa, IgA, IgG, C3, hormonas tiroideas normales; anticuerpos antinucleares negativos. Orina: 5-7 leucocitos/campo; proteinuria: 180 mg/24 horas. Ecocardiograma: sin alteraciones. Ecografía abdominal: riñones de tamaño conservado, aumento difuso de ecogenicidad.
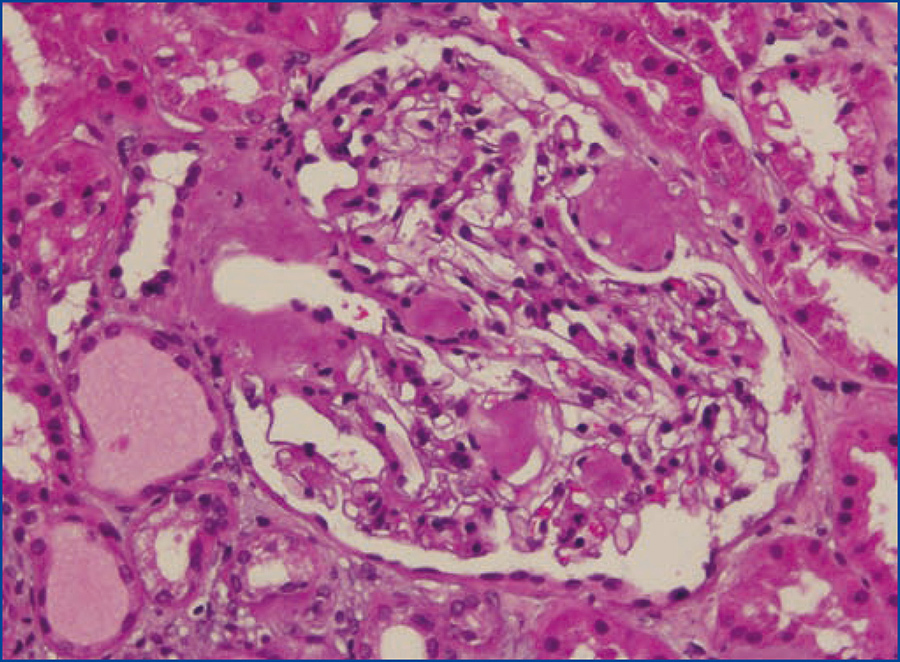
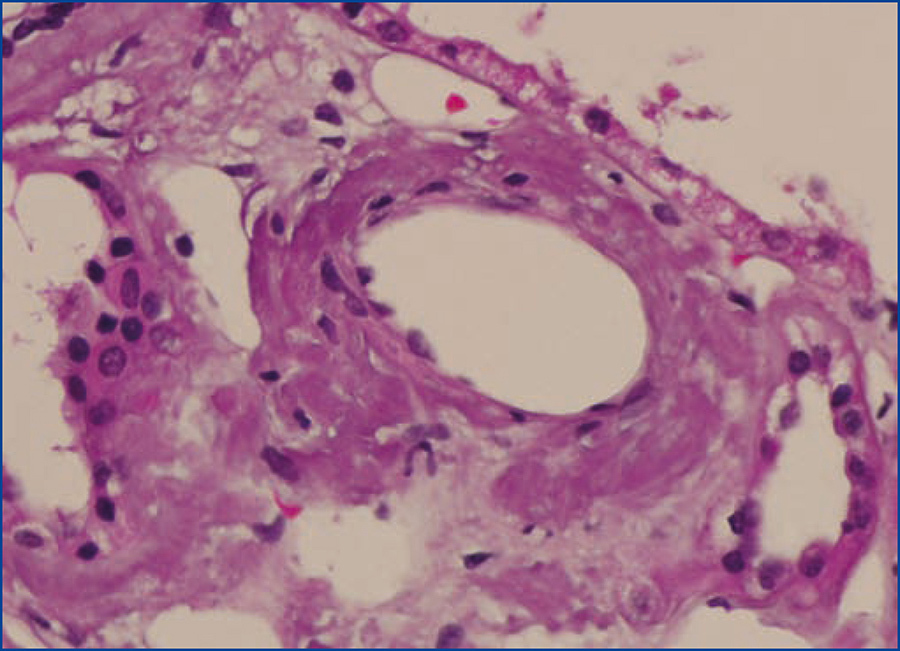
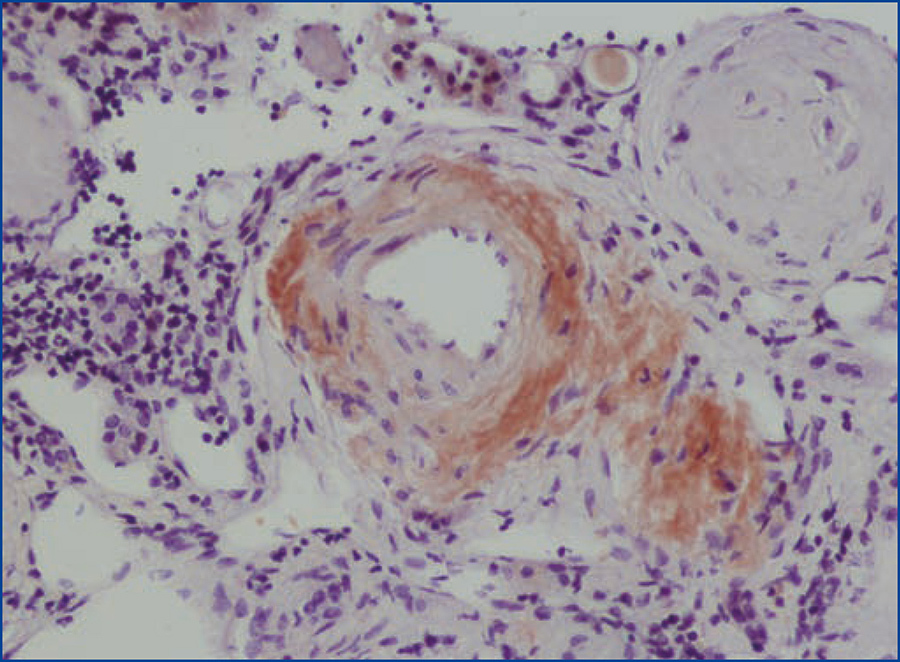
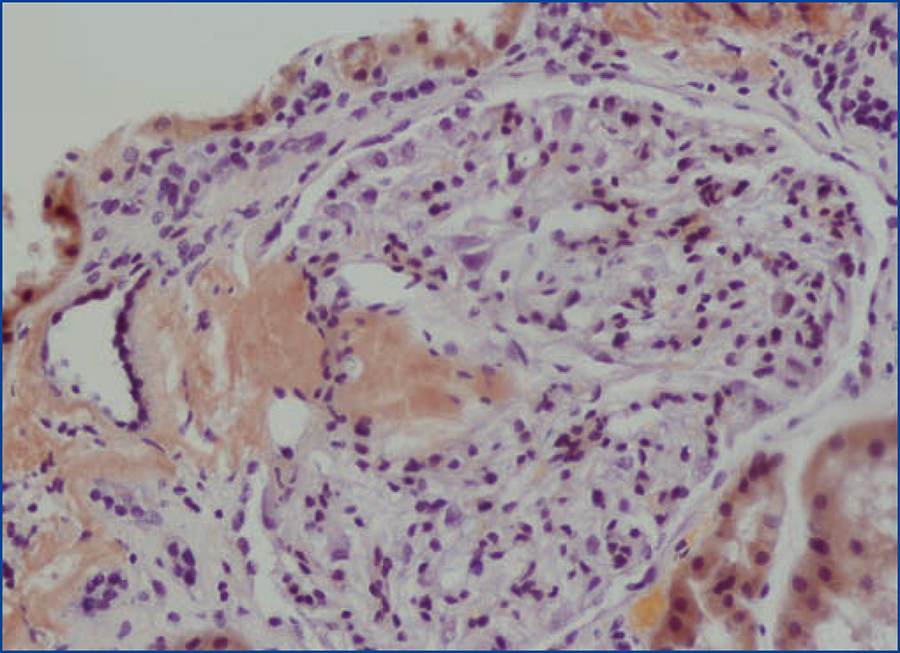
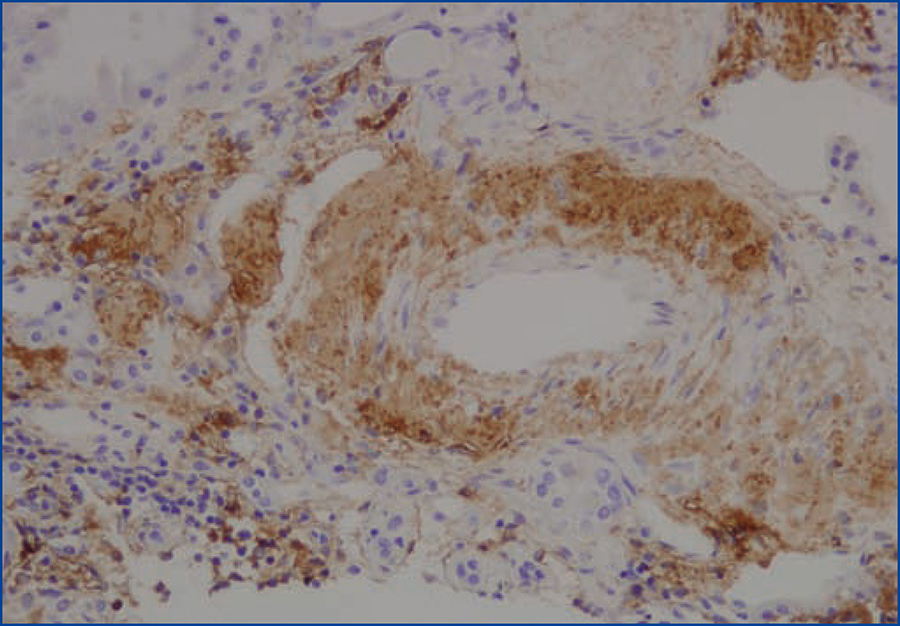
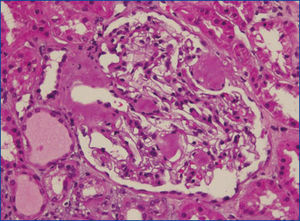
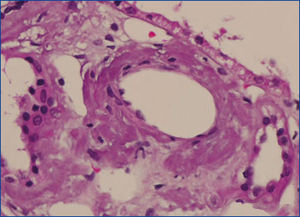
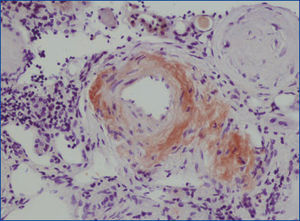
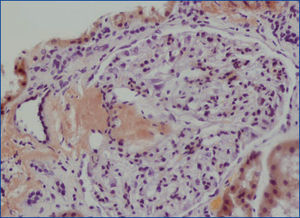
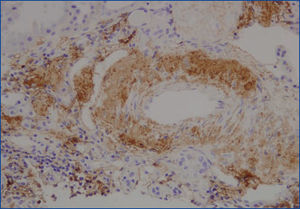
Se decide realizar una biopsia renal, que muestra 26 glomérulos, de los cuales 17 están esclerosados. En algunos de los glomérulos no esclerosados se observan muy focales depósitos nodulares de material hialino eosinófilo, acelular y débilmente ácido peryodico (PAS+) más frecuente en el polo vascular (figura 1), material que se observa también y en mayor cantidad en intersticio y en pared de arterias y arteriolas (figura 2). Este material se tiñe con la técnica de rojo congo (figura 3 y figura 4), tinción que desaparece tras el tratamiento con permanganato, y muestra birrefringencia verde manzana con luz polarizada. Con técnicas de inmunohistoquímica, el material acelular muestra tinción con amiloide A (figura 5). Se observa además una fibrosis intersticial y atrofia tubular moderadas (20 %). Con estos datos histológicos, se realiza el diagnóstico de amiloidosis renal secundaria (AA) con afectación glomerular, vascular e intersticial.
En otro centro hospitalario se le practicó tiroidectomía total y en el estudio histológico se demostró también la presencia de abundantes depósitos de amiloide entre los folículos tiroideos.
DISCUSIÓN
El caso clínico-patológico descrito es compatible con una amiloidosis reactiva (tiroidea y renal) e insuficiencia renal secundaria como complicación de un síndrome periódico asociado a criopirinas (síndrome de Muckle-Wells) (mutación NLRP3). Durante los episodios agudos se ha descrito en esta entidad una importante inflamación con leucocitosis y elevación de las concentraciones de proteínas de fase aguda, como la proteína C reactiva y el amiloide sérico A (SAA)4.
La amiloidosis reactiva es una complicación severa del CAPS (aproximadamente en el 25 % de los casos de Muckle-Wells)5 y tiene una fisiopatología similar a otras amiloidosis secundarias. Está causada por un depósito extracelular de fibrillas en los tejidos, que son polímeros de una proteína precursora: SAA. Se han identificado como moduladores del riesgo de desarrollo de amiloidosis las concentraciones de SAA, los polimorfismos del gen SAA y el origen étnico. La amiloidosis con afectación renal suele cursar con proteinuria de rango nefrótico; sin embargo, en nuestro caso clínico resultó normal, lo que posiblemente traduce un menor depósito de amiloide a nivel de los glomérulos y, por tanto, una menor alteración de la barrera de filtración.
La amiloidosis se define por la acumulación extracelular de una proteína que muestra positividad con la técnica de rojo congo, birrefringencia verde manzana con luz polarizada y que en el estudio ultraestructural forma fibrillas de 10 nm no ramificadas y dispuestas de forma aleatoria. El material amiloide puede estar compuesto por una variedad de diferentes polipéptidos, que incluye cadenas ligeras de inmunoglobulinas (AL amiloide), cadenas pesadas (AH amiloide) proteína A amiloide (AA amiloide), beta-2-microglobulina, transtiretina, procalcitonina, beta-amiloide proteína, cistatina C, etc. La amiloidosis AA o secundaria se asocia a diferentes tipos de entidades, como enfermedades autoinmunes crónicas y enfermedades infecciosas crónicas, pero también aparece como complicación de la fiebre mediterránea familiar y en los CAPS. Independientemente de la causa, el amiloide presenta siempre las mismas características histológicas y ultraestructurales6. En nuestro caso, la biopsia renal muestra las características típicas de una amiloidosis secundaria tipo AA con depósitos de material amiloide preferentemente a nivel vascular, pero también en glomérulos e intersticio, con birrefringencia verde manzana con luz polarizada y que se pierde tras el tratamiento con permanganato. La positividad con inmunohistoquímica para amiloide A confirma el diagnóstico.
La paciente se viene tratando desde hace unos dos meses con canakinumab, un anticuerpo monoclonal anti-IL-1β, con desaparición completa de la sintomatología clínica, encontrándose pendiente de control evolutivo de la función renal y de la audición.
PREGUNTAS
1)Dr. Miguel Ángel Frutos (Málaga): Sorprende que esta paciente con importantes depósitos en la biopsia renal de amiloide AA no haya presentado en su evolución proteinuria. ¿Qué explicación tendría este hallazgo?
Respuesta (Juan Mosquera): El depósito de material amiloide en este caso es preferentemente a nivel vascular e intersticial con escasos depósitos glomerulares, presentes solo en dos glomérulos, lo cual puede explicar la escasa proteinuria.
2) Dr. Francisco Rivera (Ciudad Real): Estoy de acuerdo cuando afirmáis que la amiloidosis renal puede cursar con mínima proteinuria cuando los depósitos son exclusivamente vasculares o intersticiales. Hace años publicamos un caso de amiloidosis vascular de tipo AA asociada a enfermedad de Still que cursó con mínima proteinuria y deterioro renal7.
Respuesta (Luis Bolaños): En la amiloidosis renal, tanto AL como AA, se produce un depósito preferente de fibrillas a nivel glomerular, ocasionando de forma secundaria la aparición de proteinuria significativa. Sin embargo, de manera mucho más ocasional, tal y como ocurre en nuestro caso clínico, el depósito de las fibrillas de amiloide se sitúa de forma predominante en los vasos sanguíneos, lo que produce un estrechamiento de estos8. En estos casos, el patrón de afectación renal es diferente con ERC progresiva y con poca o ninguna proteinuria. Diversos estudios bioquímicos sugieren que el lugar de depósito vendría determinado al menos en parte por el tamaño de los fragmentos de amiloide A, mostrando los más pequeños un depósito preferente en el glomérulo, y los más grandes, en los vasos sanguíneos9.
3) Dr. Rafael Poveda (Barcelona): Habéis presentado una enfermedad ciertamente infrecuente con amiloidosis secundaria. ¿Se probó en algún momento tratamiento con colchicina?
Respuesta (Luis Bolaños): La colchicina constituye un fármaco aceptado en la prevención de la amiloidosis secundaria en la fiebre mediterránea familiar. En estos casos, reduce la frecuencia de ataques de dolor abdominal, la incidencia de enfermedad renal y estabiliza la función renal en pacientes con proteinuria ligera10. En otros contextos clínicos, como la enfermedad inflamatoria intestinal o la enfermedad de Behcet, su utilidad es anecdótica. Se desconoce si su mecanismo de acción se debe a una reducción directa de la producción de fibrillas de amiloide o a una disminución de la actividad de la enfermedad primaria.
En nuestro caso clínico, el tratamiento con canakinumab produjo un control completo del proceso inflamatorio y, por tanto, del estímulo de la producción de nuevo amiloide, por lo que se desestimó el tratamiento con colchicina.
4) Dr. Manuel Solé (Barcelona): Mi comentario está relacionado con la presencia de estados inflamatorios ocultos poco expresivos y que son de diagnóstico difícil y tardío. Sus efectos, como en este caso, se conocen solo cuando alcanzan estadios avanzados de ERC. ¿Qué analítica no debería faltar nunca?
Respuesta (Luis Bolaños): Los tres CAPS conocidos (FCAS, MWS y CINCA [chronic, infantil, neurological, cutaneous and articular syndrome]/NOMID) son muy infrecuentes y tienen su origen en mutaciones en el gen NLRP3. En los dos primeros, la herencia es autosómica dominante y más raramente esporádicos, mientras que en el último la mayoría son esporádicos y raramente autosómicos dominantes.
En todos ellos, la sintomatología clínica compatible (fundamentalmente episodios de inflamación episódica), así como la presencia de familiares afectos con clínica similar, deben alertarnos ante la posibilidad de que estemos ante este tipo de trastornos. En un segundo paso, se realizará un estudio genético, con determinación del tipo de mutación en gen NLRP3 bien en el caso índice o bien en algún familiar afecto, que nos indicará el fenotipo más probable. Por último, ante la sospecha de un MWS será necesario realizar un audiograma bilateral y determinar diversos parámetros analíticos: niveles de proteína A sérica y proteína C reactiva, parámetros de función renal y determinación de proteinuria, con realización de biopsia renal en el caso de que exista insuficiencia renal y/o proteinuria significativa, determinando con todo ello la existencia y el grado de afectación auditiva y renal.
5) Dr. Vicente Barrio (Madrid): ¿Disponéis en este caso de estudios genéticos?
Respuesta (Luis Bolaños): A la paciente del caso clínico no se le había practicado un estudio genético; sin embargo, a la hija de la paciente, de 5 años de edad, sí se le había practicado, mostrando una mutación en el gen NLRP3.
Las distintas mutaciones descritas en el gen NLRP3 asociadas a CAPS pueden asociarse a fenotipos únicos: FCAS, MWS o CINCA/NOMID, o bien pueden asociarse a dos fenotipos distintos: FCAS-MWS o bien CINCA/NOMID-MWS. En los niños con una determinada mutación asociada a los fenotipos FCAS-MWS, su sintomatología clínica en ese momento de la vida puede ser únicamente los síndromes inflamatorios de repetición, existiendo la posibilidad de desarrollar el resto de las complicaciones en edades más avanzadas. En el caso de la hija de la paciente, esta presentaba sintomatología únicamente de síndromes inflamatorios de repetición. A pesar de que no existe experiencia a largo plazo con los agentes antiinterleucina 1, el tratamiento precoz permitiría potencialmente la prevención del daño audiológico y renal grave e irreversible que podría producirse en décadas posteriores de la vida si se desarrollase el MWS.
6) Dr. Rafael Poveda (Barcelona): Además de la afectación renal amiloidótica, me ha llamado la atención la presencia de sordera. ¿Comparten alguna vía común de lesión?
Respuesta (Luis Bolaños): La sordera neurosensorial en el MWS es bilateral, progresiva y puede ocurrir en la adolescencia o en la edad adulta, siendo el momento de aparición similar en miembros de la misma familia11.Tanto en el MWS como en el CINCA/NOMID, se produce una inflamación de la cóclea sin aparición concomitante de depósitos amiloides ni en el aparato de Corti ni en el nervio coclear. Estudios de autopsias de pacientes con estos síndromes mostraron atrofia del nervio coclear y ausencia del órgano de Corti, lo que sugiere que la inflamación provoca un daño irreversible sobre estas localizaciones, indicando además la importancia de una identificación y tratamiento precoces12,13.
7) Dr. Rafael Poveda (Barcelona): ¿Se conoce alguna otra afectación sistémica descrita en pacientes con el MWS?
Respuesta (Luis Bolaños): Esta entidad fue descrita por primera vez en una familia británica en el año 1962 por los doctores Muckle y Wells. En la literatura científica, además de la tríada clásica de episodios autoinflamatorios recurrentes (fiebre, rash cutáneo, artralgias, dolor abdominal y conjuntivitis), sordera neurosensorial y amiloidosis secundaria, se han descrito otras alteraciones: artritis mono y oligoarticular (fundamentalmente en rodillas, tobillos, hombros y pequeñas articulaciones de las extremidades), cefalea crónica e irritabilidad secundarias a un aumento de la presión intracraneal por una meningitis crónica aséptica de intensidad leve, lesiones desmielinizantes14, lesiones cutáneas (aftosis, ictiosis, hipertricosis e hiperpigmentación), retraso de crecimiento y retraso mental leve15.
8) Dr. Miguel Perdiguero (Alicante): La cuantificación seriada de la sustancia amiloide AA durante el tratamiento con canakinumab ¿aportaría datos como marcador de respuesta?
Respuesta (Luis Bolaños): La sustancia amiloide AA es la proteína precursora en la amiloidosis secundaria o reactiva. Se trata de una proteína de fase aguda, fundamentalmente producida en el hígado ante la estimulación de citocinas proinflamatorias, como la interleucina 1. Durante la inflamación activa, sus concentraciones en suero pueden alcanzar concentraciones de 1000 mg/l, lo que constituye más de 1000 veces su concentración constitucional16,17. Puesto que en los CAPS se produce una producción excesiva de citocinas inflamatorias (IL-1β, IL-18), la presencia de una sustancia amiloide AA dentro de límites normales indica un adecuado control del proceso inflamatorio y, por tanto, un marcador de respuesta al tratamiento con los diversos agentes antiinterleucina 1.
9) Dr. Miguel Perdiguero (Alicante): En cualquier caso, mi comentario se dirige también a la posible pérdida de efectividad de los tratamientos con monoclonales debido a la presencia de anticuerpos contra los agentes biológicos y, con ello, pérdida de eficacia y decisión de cambiar a otros alternativos.
Respuesta (Luis Bolaños): Dentro de las reacciones adversas a agentes biológicos, la generación de anticuerpos neutralizantes se encuadra dentro de las reacciones de tipo beta, que comportan el desarrollo de inmunogenicidad contra la proteína terapéutica y la posible disminución parcial o total del efecto del agente. La producción de anticuerpos contra un agente biológico específico depende del grado de humanización del anticuerpo monoclonal y de la forma (subcutánea [s.c.], intravenosa [i.v.], intramuscular) y de la frecuencia de administración. En el caso de anticuerpos humanos o humanizados, en principio menos inmunogénicos, también es posible el desarrollo de anticuerpos antiidiotipo IgG o IgE18.
En el caso concreto del canakinumab, se trata de un anticuerpo monoclonal humanizado contra IL-1β, con una frecuencia de administración cada 8 semanas s.c. (o i.v.), aprobado por la Food and Drug Administration (FDA) y la Agencia Europea de Medicamentos (EMEA) en el año 2009 para su uso en el FCAS y MWS. Se trata de una agente con escasa experiencia de uso en el mercado, no habiéndose descrito hasta la actualidad la aparición de anticuerpos neutralizantes. En el caso hipotético de pérdida de eficacia por anticuerpos neutralizantes, las alternativas actualmente disponibles en el mercado son: el rilonacept, aprobado para su uso en FCAS y MWS en mayores de 12 años (FDA 2008 y EMEA 2009) y el anakinra, que ha sido utilizado en el CAPS fuera de ficha técnica con buen resultado.
Agradecimientos
Queremos agradecer a Novartis su continuada colaboración en la organización de la Reunión de GloSen y el Club de Nefropatología.
Conflictos de interés
Los autores declaran que no tienen conflictos de interés potenciales relacionados con los contenidos de este artículo.
Figura 1. Depósitos de material amiloide en polo vascular y en penacho glomerular con hematoxilina-eosina.
Figura 2. Depósitos de amiloide en arterias con hematoxilina-eosina.
Figura 3. Rojo congo en polo vascular glomerular.
Figura 4. Depósitos de material amiloide en arterias con técnica de rojo congo.
Figura 5. Depósito de amiloide A en pared arterial con técnica de inmunohistoquímica.