Los pacientes receptores del trasplante de un órgano sólido son sometidos a una inmunosupresión crónica que les previene del rechazo del órgano trasplantado. Gracias al tratamiento inmunosupresor y a las mejoras en el abordaje de estos pacientes, actualmente las expectativas de supervivencia a 5 años son altas. Sin embargo, la inmunosupresión mantenida les predispone a un mayor riesgo de desarrollar cáncer, del que el 40-50% corresponde a cáncer cutáneo. El cáncer cutáneo no melanoma (carcinoma basocelular, carcinoma escamoso y queratosis actínica) representa el 95% de las neoplasias cutáneas que aparecen en receptores del trasplante de un órgano sólido, y no solo la incidencia es mayor sino que también tiene un comportamiento más agresivo. El otro 5% corresponde al melanoma, al sarcoma de Kaposi y a otros menos frecuentes. Estos pacientes presentan mayor riesgo de cáncer cutáneo, tanto por la inmunosupresión que padecen y el efecto directo de ciertos fármacos como por una serie de carcinógenos que comparten con la población inmunocompetente. Las bases para la prevención son fundamentalmente la información y la educación sanitaria en medidas de fotoprotección y autoexploración, la detección y tratamiento precoz de las queratosis actínicas para prevenir la progresión hacia carcinomas invasivos, la modificación de los agentes inmunosupresores en aquellos de mayor riesgo y el control dermatológico, medidas que es absolutamente necesario iniciar en el momento en que el paciente entra en lista de espera para un trasplante.
INTRODUCCIÓN
Los pacientes receptores del trasplante de un órgano sólido (RTOS) se someten a una inmunosupresión crónica que les previene del rechazo del órgano trasplantado. Gracias al tratamiento inmunosupresor (IS) y a las mejoras en el abordaje de estos pacientes, actualmente las expectativas de supervivencia a 5 años tras un trasplante renal alcanzan el 85%. Sin embargo, la inmunosupresión mantenida les predispone a un mayor riesgo de desarrollar cáncer, del que el 40-50% corresponde a cáncer cutáneo (CC).
Dentro del concepto de CC se engloban diferentes tipos de neoplasias cutáneas con pronósticos muy distintos, cuyo comportamiento biológico se ve más o menos modificado en el paciente RTOS respecto al inmunocompetente (IC). Así, en el CC no melanoma (CCNM) se incluye al carcinoma basocelular (CBC), al carcinoma escamoso (CE), a su forma intraepitelial o in situ, la queratosis actínica (QA) y al carcinoma de células de Merkel (CCM), los cuales representan el 95% de las neoplasias cutáneas que aparecen en RTOS. El otro 5% corresponde al melanoma, el sarcoma de Kaposi (SK) y a otros tipos de tumores menos frecuentes1,2.
El aumento del riesgo de cada tipo de tumor cutáneo respecto a la población IC varía según el tipo; así, se ha descrito que el CE es de 65 a 250 veces más frecuente y el SK de 80 a 500 veces, mientras que el CBC es 10 veces más frecuente y el melanoma solo 2-3 veces2-4.
CÁNCER CUTÁNEO NO MELANOMA
Tipos de cáncer cutáneo no melanoma
Carcinoma basocelular
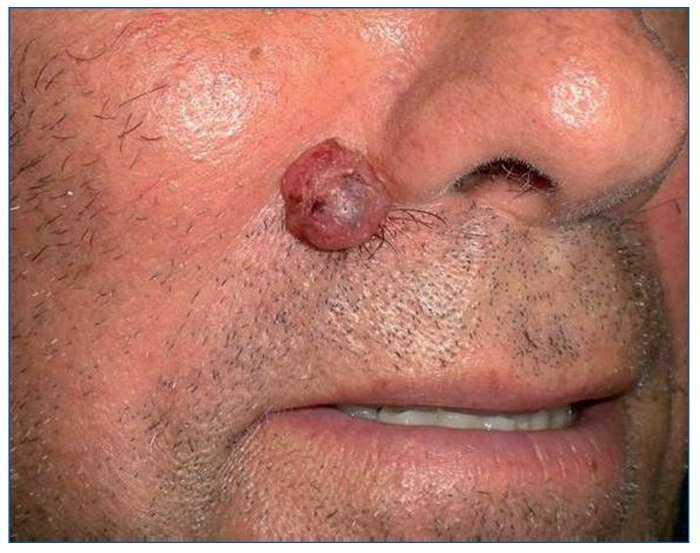
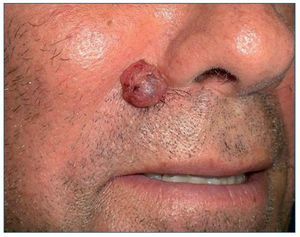
El CBC es el tumor más frecuente en el ser humano. Aparece únicamente en áreas con folículos pilosos, sobre todo en áreas fotoexpuestas, por lo que será excepcional encontrarlo en mucosas, palmas o plantas. Tiene un crecimiento lento, con un comportamiento localmente agresivo, y da lugar a metástasis solo de manera anecdótica. Aunque algunos casos superficiales pueden tratarse de forma no quirúrgica, el tratamiento de elección es la exéresis quirúrgica. Clínicamente se presenta como un tumor de superficie lisa, brillante, con bordes perlados, telangiectasias gruesas en superficie, ocasionalmente puntos de pigmento, y puede estar ulcerado en el centro dando lugar a una costra recidivante (fig. 1).
Figura 1. Carcinoma basocelular nodular en paciente receptor de un trasplante renal.
Queratosis actínicas
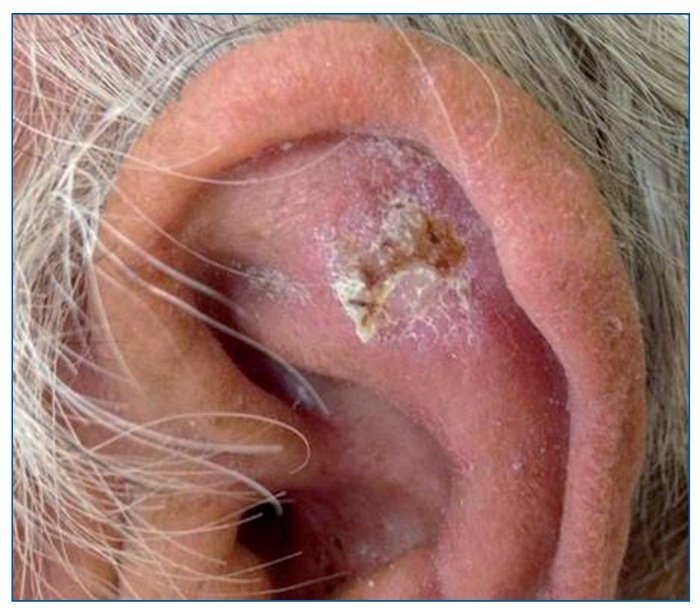
Las QA son las lesiones precursoras del CE, en las que histológicamente se encuentran queratinocitos atípicos que no han traspasado la membrana basal de la epidermis. Clínicamente son unas máculas eritematosas, rasposas al tacto y que aparecen en áreas de piel sometidas de forma crónica a la radiación ultravioleta (UV) (fig. 2). Su riesgo de progresión a CE invasivo es bajo, y pueden permanecer como tales toda la vida y algunas incluso involucionan espontáneamente. El campo de cancerización es un término que se utiliza para describir un área de piel sometida a un mismo agente carcinogénico (radiación UV), en la que se encuentra la confluencia de QA, QA subclínicas, queratinocitos atípicos y clonas de células mutadas.
Figura 2. Queratosis actínica de gran tamaño en el pabellón auricular de un paciente receptor de un trasplante renal.
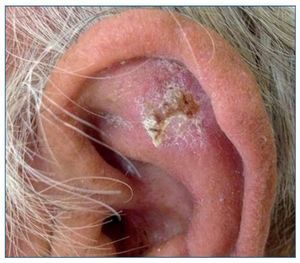
Carcinoma escamoso cutáneo
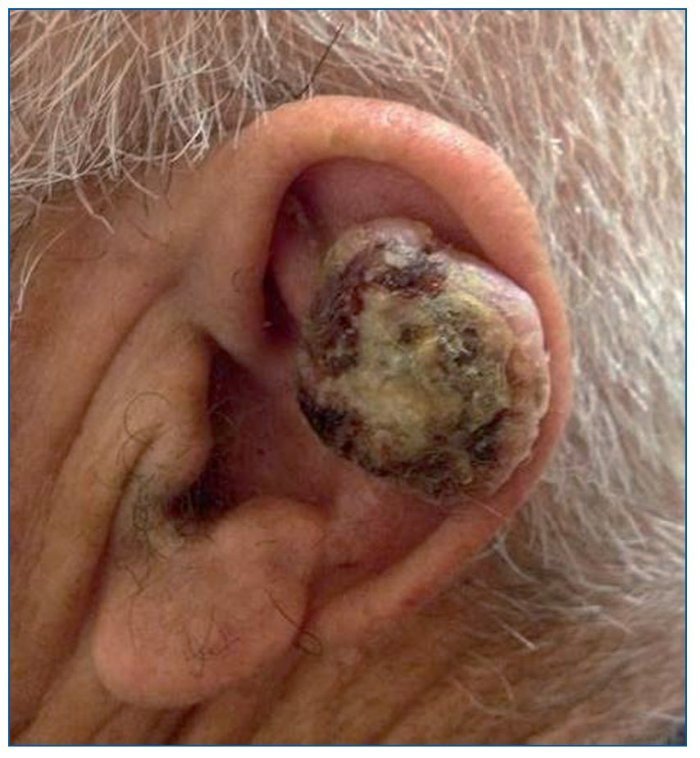
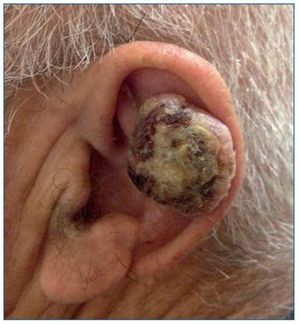
El CE de piel es el segundo tumor más frecuente en personas de raza blanca. Su aparición está directamente relacionada con la exposición crónica al sol, por lo que aparecerá sobre todo en áreas de piel fotoexpuesta (fig. 3). Sin embargo, este tumor también se puede encontrar en mucosas (oral y genital), en cuyo caso el virus del papiloma humano (VPH) puede estar implicado en su patogenia. Aunque puede aparecer sobre piel sana, es típica su aparición sobre una QA o un campo de cancerización. Esta neoplasia tiene agresividad local y un riesgo de producir metástasis menor del 5%. El tratamiento se realiza mediante una exéresis quirúrgica.
Figura 3. Carcinoma escamoso infiltrante de alto riesgo en el pabellón auricular de un paciente receptor de un trasplante renal.
Epidemiología
La incidencia de CCNM aumenta a medida que pasa el tiempo desde el trasplante, y aparece en torno al 5% de los pacientes a los 2 años del trasplante, del 10-27% a los 10 años y del 40-60% a los 20 años5-8. Estos datos son variables según el país, y la incidencia acumulada a los 10 años en España es de las más altas, con datos muy parecidos a los publicados en la población australiana5,7-9.
Sin embargo, parece que el aumento de incidencia para el CBC es de forma longitudinal, mientras que la de CE es exponencial. Así, la mayoría de estudios describen una inversión del cociente CBC/CE (4 o 5/1 en población IC), que pasaría a ser 1/1,8 y hasta 1/10, por tanto, el CE es el tumor más frecuente en la población RTOS. Hay que destacar que en 2 de los mayores estudios desarrollados en nuestro territorio se observó una reducción de este cociente, sin llegar a invertirse5,8.
Comportamiento biológico
El CCNM, además de ser más frecuente que en la población IC, tiene una serie de particularidades, como son su aparición en edades más tempranas y la mayor incidencia de tumores múltiples. Además, el CE es más agresivo, con mayor y más rápida progresión local (más profundidad de infiltración, mayor extensión subclínica y más invasión perineural o intravascular), mayor índice de recidiva local (13%) y mayor riesgo de metástasis a distancia (4-11%)10,11. Asimismo, la clínica puede ser diferente y simular verrugas virales, queratosis seborreicas o queratoacantomas, y el dolor se ha descrito como un signo de mayor agresividad del tumor12. El CBC, por el contrario, parece que tiene la misma agresividad que en el paciente IC, aunque un estudio reciente demostró una agresividad incrementada en forma de una mayor extensión agresiva subclínica en estos tumores11. Finalmente, las QA son también más prevalentes, más extensas y numerosas y presentan una más rápida progresión hacia CE invasivo, en el que se ha visto que hasta un 20-30% de las QA individuales progresan a CE en un período de 5-10 años. Además, son más resistentes a los tratamientos13.
Los resultados de agresividad están basados en estudios que analizan indicadores de agresividad aislados. No existen estudios prospectivos que comparen la agresividad del CCNM en RTOS y población general y, al hacer revisión sistemática de los trabajos publicados, no hay diferencias tan grandes en el grado de metástasis entre RTOS e IC. Es necesario remarcar, sin embargo, que estos datos se ven limitados por los diversos sesgos derivados de los pocos estudios disponibles, de la falta de registros rigurosos de tumores de bajo riesgo y del más estricto seguimiento de los RTOS. En cualquier caso, la tasa de metástasis por CCNM en general es baja.
Factores de riesgo para el cáncer cutáneo no melanoma
Entre los factores responsables del aumento de la incidencia y agresividad del CCNM en los RTOS se deben considerar factores demográficos (no modificables), factores predisponentes y factores adquiridos, que son los más fáciles de modificar (tabla 1)14.
Factores de riesgo demográficos (no modificables)
El sexo y la edad en el momento del trasplante influyen en el riesgo de CCNM; así, es más frecuente en varones y cuanto más tarde se realice el TOS, sobre todo en los receptores mayores de 50-60 años15-17. Cuanto mayor es el paciente se produce menor eficacia en la reparación del ADN, menor eficacia del sistema inmunológico y mayor acumulación de los efectos nocivos de la radiación UV en su piel. Una prueba de ello es el trabajo de Webb, en el que el 50% de los pacientes que reciben el trasplante después de los 60 años desarrolla algún CC, mientras que solo lo hace el 6% de los que lo reciben antes de los 40 años, aunque hay que destacar que no especifica en cuánto tiempo lo desarrollan17.
El fototipo de Fitzpatrick es la escala utilizada para clasificar la piel en función de su tolerancia a la radiación UV, y está demostrado que los fototipos bajos, en general las personas rubias o pelirrojas a las que les cuesta broncearse y se queman con frecuencia, son un factor de riesgo independiente para el desarrollo de CCNM en RTOS16. Finalmente, algún estudio ha demostrado que los pacientes que se trasplantan por una enfermedad poliquística renal autosómica dominante tendrán un riesgo 2,6 veces superior de desarrollar CCNM que los que reciben el trasplante por otras causas, en parte justificado porque presentan una predisposición genética que se vería acelerada por la IS18. Sin embargo, otros estudios contradicen esta teoría19.
Factores predisponentes
Entre los factores predisponentes destaca el antecedente de CCNM pretrasplante20. En la población IC, el riesgo de un segundo CCNM es mucho mayor en los pacientes que ya han desarrollado uno previamente. En los RTOS también es así, la incidencia acumulada de CCNM a los 5 años del trasplante es del 31% en los pacientes con antecedentes de CCNM respecto al 7,4% de los pacientes sin antecedente de CCNM21. Pero además, los pacientes con antecedentes de CCNM tienen también mayor riesgo de otros cánceres sólidos y linfoproliferativos, fallo renal y fallecimiento21. Esta situación puede condicionar la estrategia del trasplante, principalmente en lo que concierne a la elección del momento de realizarlo. En general, en pacientes con antecedente de CBC, QA o CE invasivo de bajo grado, tras un tratamiento curativo, el momento del trasplante no debe demorarse. Sin embargo, si nos encontramos con un paciente que desarrolla un CE de alto riesgo, definido por el tamaño y las características microscópicas del tumor, se aconseja esperar un mínimo de 2 años (según el número de factores de riesgo) antes de realizarle el trasplante22. En caso de encontrarnos ante un paciente TOS que ha desarrollado al menos un CE y ha de retrasplantarse, se recomienda buscar un donante muy compatible para disminuir la IS de inducción, esperar un tiempo prudencial antes del retrasplante y utilizar fármacos inhibidores de mTOR22.
Otros factores predisponentes son los relacionados con la radiación UV, incluyendo la latitud de residencia y la radiación solar acumulada laboral o recreativa. La radiación UV tiene un efecto mutagénico directo sobre el ADN celular y, además, induce una inmunosupresión local, como consecuencia de la inhibición de la presentación y reconocimiento de antígenos secundaria a la disminución del número de células de Langerhans en la piel. Así, se ha descrito mayor incidencia de CCNM en los receptores de trasplante renal (RTR) con mayor exposición solar acumulada, en aquellos con exposición solar laboral a largo plazo y con menor latitud del país de residencia6,8. Además, otro hecho que apoya esta teoría es que la mayoría de tumores se localizan preferentemente en áreas fotoexpuestas.
El órgano trasplantado también se ha descrito como factor predisponente, siendo el riesgo de CCNM mayor en los trasplantados de corazón, más que de riñón y más que de hígado, aunque esta asociación esté probablemente más relacionada con la IS necesaria para evitar el rechazo que con el tipo de trasplante. Finalmente, algunas genodermatosis, como la epidermodisplasia verruciforme o el síndrome de Gorlin, predisponen al mayor desarrollo de CCNM.
Finalmente, en este grupo también se incluyen ciertos biomarcadores que en los últimos años se ha visto que podrían ser de utilidad para identificar a los pacientes RTOS con mayor riesgo de desarrollar CCNM. Se sabe que los fármacos IS tienen un impacto en el desarrollo de CCNM, lo cual sugiere que la modulación del inmunofenotipo en sangre periférica debe jugar un papel importante en el desarrollo de cánceres en el período postrasplante23,24. Así, la monitorización de componentes del inmunofenotipo en sangre periférica permitiría clasificar los pacientes en alto o bajo riesgo y valorar la necesidad de modificar el régimen IS en los pacientes de alto riesgo y evitar reducciones innecesarias en los de bajo riesgo23. En este sentido, Sherston et al demostraron que el aumento de linfocitos T reguladores y su demetilación en sangre periférica, así como el descenso de células NK, son factores predictivos del desarrollo de CE postrasplante y de recurrencia del CE en los pacientes de alto riesgo25. Además, aclararon que este inmunofenotipo linfocitario es estable en el período postrasplante25. Por otro lado, Bottomley et al reportaron recientemente que el aumento de linfocitos T CD8+ senescentes (CD8+, CD57+) permitiría identificar pacientes TR con mayor riesgo de CE26.
Factores modificables
Dentro de este grupo deberíamos incluir también la radiación UV, en el sentido de que es necesaria una buena educación sanitaria sobre protección solar en la edad escolar, que debería reforzarse en el momento en que el paciente entra en diálisis, en caso de los trasplantes renales, o en el momento en que se considera como posible candidato al trasplante, en el caso de los otros órganos.
Los VPH de alto riesgo oncogénico son responsables del CE de cérvix y de al menos una parte de los CE de cabeza y cuello y genitales; sin embargo, el papel de este virus en el desarrollo de CE en pacientes RTOS todavía se ha de esclarecer, aunque hay una serie de hechos que apoyan esta relación.
Por un lado, se ha observado la coexistencia frecuente de verrugas virales y carcinomas en estos pacientes. Además se ha demostrado la presencia de signos de displasia histológica en verrugas virales, así como signos histológicos de infección viral en lesiones malignas y premalignas. De hecho, con técnicas de biología molecular se ha detectado la presencia de secuencias génicas del VPH en el 65-90% de los CE de RTOS, cifras mucho mayores que las halladas en la población IC27. Los serotipos hallados con más frecuencia, son los mismos que los involucrados en el desarrollo de CCNM en la epidermodisplasia verruciforme (VPH5 y VPH8), situación clínica que remeda a la de los pacientes RTOS, aunque no es raro encontrar diferentes serotipos en un mismo tumor28.
El voriconazol es un fármaco antifúngico de amplio espectro del grupo de los triazoles, aprobado desde 2002 para la profilaxis y tratamiento de las infecciones fúngicas en pacientes trasplantados de pulmón. Entre sus efectos adversos destacan los cambios en la visión, la elevación de las enzimas hepáticas y la fotosensibilidad que aparece hasta en el 8-10% de los pacientes. Además se ha visto que potencia el daño en el ADN celular e impide su reparación. Ya hay varios estudios que han demostrado que este fármaco no solo aumenta la fotosensibilidad, sino que es un factor de riesgo independiente para desarrollar CE y que, además, este riesgo es mayor cuanto más larga es la exposición y mayor es la dosis. Así, se recomienda suspender el tratamiento con voriconazol si el paciente desarrolla CE o melanoma29.
Finalmente, la inmunosupresión es el factor modificable más importante que influye en el desarrollo de CCNM. La inmunosupresión crónica que producen los fármacos IS facilita que clones de células previamente mutadas por la radiación UV escapen de la inmunovigilancia y proliferen. En relación con este tema se ha puesto de manifiesto que son la duración y la intensidad de la IS los factores determinantes más que el tipo de IS3,15,30.
Los mecanismos por los que los IS aumentan el riesgo de CC son la inhibición de la reacción inmune para eliminar las células tumorales, la permisibilidad de infecciones virales que se relacionan con el desarrollo de cáncer y el efecto directo de algunos IS en el desarrollo de cáncer, como los inhibidores de la calcineurina, que inhiben la reparación del ADN, o la azatioprina, que es mutagénica y actúa de forma sinérgica con la radiación UVA. Sin embargo, los inhibidores selectivos de la vía de señalización de mTOR (sirolimus y everolimus) son nuevos IS con mejor perfil de riesgo, ya que tienen efectos antineoplásicos y algunos estudios ya han demostrado la menor incidencia de CC en pacientes con sirolimus respecto a los que tomaban inhibidores de la calcineurina, pero los datos son muy limitados31. Hasta el momento, no queda claro qué IS o qué combinaciones tienen el mayor papel en el riesgo de CC, pero parece que regímenes de 3 IS (esteroides, ciclosporina, azatioprina o rapamicina) tienen 3 veces más riesgo de CC que regímenes con solo 2 IS (esteroides y azatioprina o rapamicina)32,33.
Prevención del cáncer cutáneo no melanoma
Entre las medidas de prevención primaria son fundamentales la información y la educación sanitaria en medidas de fotoprotección y autoexploración, y entre las de prevención secundaria, la detección y el tratamiento precoz de las QA y el campo de cancerización para evitar su progresión a CE invasivos, la modificación de los agentes IS en aquellos de mayor riesgo y el control dermatológico periódico, medidas que deben iniciarse en el momento en que el paciente entra en lista de espera para un trasplante.
Prevención primaria
Fotoprotección. La protección frente a la radiación UV es la única medida sobre la que se puede actuar. Por este motivo es imprescindible que este grupo de pacientes tomen conciencia de la necesidad de cambiar los hábitos de exposición solar, utilizar prendas de ropa adecuadas (gorro de ala ancha, manga larga, etc.) y fotoprotección diaria con filtros solares con alto factor de protección (SPF 50+). Esta medida, en apariencia tan sencilla, no siempre se cumple, bien por desconocimiento de su importancia por parte de los pacientes, en ocasiones no informados suficientemente, bien por el elevado coste de los protectores solares, no financiados por el sistema nacional de salud en la mayoría de los países. A ello hay que añadir, en ocasiones, la poca aceptabilidad de los pacientes a utilizarlos por motivos cosméticos, pese a que hoy en día se han hecho muchos avances para mejorar la galénica de estos productos sin perder eficacia34. No obstante, se ha demostrado que la fotoprotección aumenta cuando el paciente recibe explicaciones de forma especializada y repetida por un dermatólogo de forma oral y escrita35.
Esta simple medida ha demostrado que previene la aparición de nuevas QA y CE invasivos34,36,37. Un estudio que comparaba 2 grupos similares de pacientes RTOS, de los que uno se aplicaba protectores solares diariamente durante 24 meses y el otro grupo solo la crema vehículo, demostró que el primer grupo desarrollaba un menor número de QA, algunas de las QA preexistentes desaparecían y, lo que es más importante, no desarrollaba ningún CE durante el período de estudio34.
No se debe olvidar, sin embargo, que los pacientes que utilicen fotoprotector de forma diaria deberán tomar suplementos de vitamina D, sobre todo en caso de RTR, porque tienen más riesgo de osteoporosis y de neoplasias internas34,38.
Prevención secundaria
Tratar las queratosis actínicas para prevenir su progresión a carcinoma escamoso. Ya hemos comentado que la incidencia de QA en RTOS está francamente aumentada respecto a la población general y tienen mayor riesgo de progresar a CE invasivo. Como somos incapaces de identificar la lesión que evolucionará a CE, la eliminación de todas las QA y del campo de cancerización es la clave para la prevención de un carcinoma invasivo. Para ello se dispone, por un lado, de las terapias tradicionales, que son las adaptadas a la lesión y que actúan de forma inespecífica, con la gran desventaja de que solo permiten tratar la lesión visible y no el campo de cancerización. Entre estas terapias tradicionales encontramos la crioterapia, el legrado, la electrocoagulación y el láser de CO2. Sin embargo, actualmente se dispone de otras terapias que permiten tratar no solo la QA sino también el campo de cancerización; entre ellas cabe destacar, por su efectividad y seguridad demostrada en pacientes RTOS, el imiquimod, la terapia fotodinámica (TFD), el 5-fluorouracilo y el diclofenaco en gel de ácido hialurónico. En el caso de los RTOS es mejor utilizar una terapia que permita tratar el campo de cancerización, pero sin olvidar que determinadas lesiones aisladas se resolverán mejor con una terapia ablativa y dirigida a la lesión, por lo que es fundamental recordar que ambos tipos de terapias no son incompatibles, sino complementarias39.
Prevenir la aparición de nuevos carcinomas escamosos en pacientes de alto riesgo. Se ha evaluado la utilidad de distintos tratamientos para la prevención secundaria de nuevos CE en pacientes de alto riesgo. Entre ellos se incluyen los retinoides sistémicos, la capecitabina, la nicotinamida, la TFD, el tratamiento con inhibidores de mTOR o la modificación de la pauta de tratamiento inmunosupresor.
• Retinoides sistémicos. Los retinoides orales (acitretino) se recomiendan en los pacientes de alto riesgo, es decir, aquellos con antecedentes de CE invasivo de alto riesgo o numerosos CE en un corto período (5-10/año) o en localizaciones de riesgo (cabeza y cuello), con el objeto de reducir el número de QA y retrasar la aparición de nuevos CE en estos pacientes40.
Existen pocos ensayos clínicos aleatorizados que avalen su eficacia en pacientes TOS, y la mayoría de ellos incluyen solo un pequeño número de pacientes y no disponen de brazo control41. No se dispone de datos con isotretinoina, pero podría plantearse su uso sobre todo en mujeres en edad fértil, ya que su efecto teratogénico desaparece al mes después de la última dosis. A pesar de la escasez de datos, es un fármaco utilizado ampliamente y puede decirse que los efectos beneficiosos en la prevención de QA y CE invasivos que ofrecen los retinoides orales ocurren solo durante el tratamiento y que su toxicidad mucocutánea limita su uso prolongado. La dosis inicial debería ser baja y aumentarla progresivamente hasta la dosis máxima tolerada por el paciente. Además hay que considerar también que tienen un efecto inmunoestimulador que podría tener consecuencias sobre el órgano trasplantado, además de tener efecto sobre la osteoporosis, que hay que añadir al efecto de los corticoides y la posible deficiencia de vitamina D.
• Capecitabina. La capecitabina es un fármaco quimioterápico que en el cuerpo se convierte en 5-fluorouracilo. Es un fármaco aprobado para el tratamiento de cáncer de mama y colon-recto, pero también ha mostrado eficacia junto al interferón-α en el tratamiento del CE metastásico. En mujeres con cáncer de mama se observó que al recibir tratamiento con capecitabina sus QA se inflamaban y curaban. Esto motivó que Endrizzi et al probaran la eficacia de la capecitabina a dosis bajas (1 g/m2) los días 1 y 14 de ciclos de 21 días, y observaron una disminución en la incidencia de CE y en el número de QA42.
Los efectos adversos que incluían fueron fatiga, náuseas, síndrome mano-pie y disfunción renal, que fueron de grado variable y que en algunos casos requirieron reajustar la dosis. Aunque este tratamiento puede ser beneficioso en algunos casos, faltan ensayos clínicos aleatorizados que avalen su eficacia42-44. Es importante recordar que antes de empezar este tratamiento hay que descartar una deficiencia de dihidropirimidina DH y valorar la función renal (aumenta la toxicidad).
• Nicotinamida. Aunque solo se dispone de un ensayo clínico fase III en pacientes IC, la nicotinamida (vitamina B3) a dosis de 500 mg/12 h ha demostrado ser eficaz y segura para reducir la aparición de nuevos CCNM en pacientes con elevado riesgo45. Otro ensayo clínico fase II, que incluía solo 22 RTR, demostró también una disminución de CCNM, aunque sin alcanzar la significación estadística46. Dado que se trata de una vitamina sin efectos secundarios, se posiciona como una buena opción para el futuro, a la espera de que aparezcan nuevos ensayos clínicos.
• Terapia fotodinámica. La TFD es una técnica que actúa mediante la destrucción selectiva de queratinocitos atípicos a través de la fotoactivación de un fotosensibilizador en presencia de oxígeno. Las células metabólicamente activas, como las células neoplásicas, acumulan más fotosensibilizadores que las células normales. El fotosensibilizador genera especies reactivas del oxígeno bajo iluminación con fuentes de luz artificial de determinada longitud de onda (560-570 nm), lo que provoca efectos fotoquímicos y fototérmicos selectivos sobre el tejido irradiado. Como fotosensibilizantes se usan los precursores de la protoporfirina IX, como el ALA (ácido 5-deltaaminolevulínico) y sus derivados, como el MAL (metilaminolevulinato).
Está técnica está aprobada para el tratamiento de las QA, CBC superficiales y enfermedad de Bowen, aunque se utiliza para otras muchas enfermedades dermatológicas. El principal inconveniente de esta técnica es que requiere de mucho tiempo, tanto por parte del médico como del paciente, es de elevado coste y, en ocasiones, el dolor durante la sesión puede hacer necesario interrumpirla prematuramente. Un estudio demostró además que sesiones de TFD cada 3 meses en pacientes TOS reducen el riesgo de nuevos CE y QA en el área tratada47. Sin embargo, el efecto desaparece al dejar el tratamiento, no se pueden tratar grandes áreas y todavía faltan estudios para determinar la frecuencia ideal con la que repetir el tratamiento.
• Cambio a inhibidores de mTOR. Los fármacos inhibidores de mTOR son moléculas con propiedades antiangiogénicas, antiproliferativas y antivirales, y existen varios estudios que han evaluado su eficacia en la prevención de la aparición de nuevos CE en RTOS48. En este sentido, vale la pena destacar el estudio TUMORAPA, en el que se evalúa la eficacia de la rapamicina en la prevención secundaria de CE en RTR49. La cohorte estudiada fueron pacientes RTR que tomaban inhibidores de la calcineurina y habían desarrollado al menos un CE, a los que se les sustituyó el anticalcineurínico por rapamicina y se vio que el cambio disminuía el riesgo de nuevos tumores y retrasaba el tiempo de su aparición. La necesidad de suspender el tratamiento con rapamicina se debió, en la mayoría de casos, a los efectos adversos, que fueron menores en aquellos en que la conversión a sirolimus se hizo con un protocolo de conversión progresivo (más de 1 semana) en lugar de rápido (menos de 1 semana). Se debe destacar que la reducción del riesgo fue mayor cuando la conversión se realizó tras el primer CE que tras los sucesivos. Por tanto, una conversión precoz a rapamicina parece más beneficiosa49.
Sin embargo, en otro estudio con una cohorte grande retrospectiva de RTOS (3.500), la exposición a sirolimus (488) no se asoció a una reducción en la incidencia de CE50. Este estudio tiene las limitaciones de ser un estudio retrospectivo, incluir diferentes tipos de trasplantes, no realizar un subanálisis por órganos trasplantados y no aportar datos sobre la dosis de sirolimus, el uso concomitante con anticalcineurínicos u otros fármacos como el voriconazol ni tampoco especificar el tipo de CE.
• Modificación de la inmunosupresión. Finalmente, en los pacientes que desarrollen un CC de alto riesgo vale la pena plantearse la disminución de la inmunosupresión en la medida de lo posible, intentando evitar el rechazo del órgano trasplantado51,52.
MELANOMA
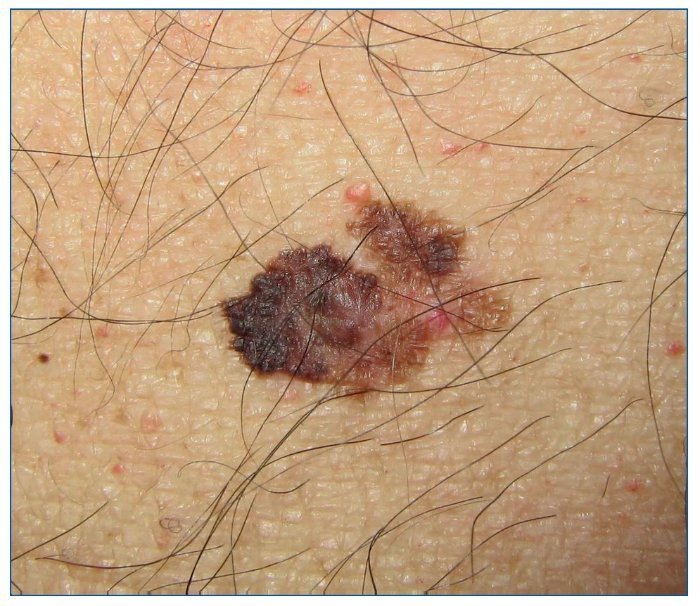
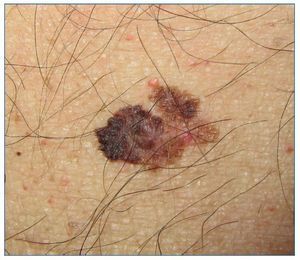
El melanoma es una neoplasia originada en los melanocitos y, a diferencia del CCNM, tiene una alta tendencia a la diseminación metastásica (fig. 4). En relación con el melanoma y los pacientes RTOS nos planteamos 3 posibles escenarios: paciente con antecedente de melanoma antes de someterse al trasplante, el melanoma que aparece después del trasplante y el melanoma que aparece en el receptor a causa de un melanoma en el donante.
Figura 4. Melanoma estadio IB en paciente receptor de trasplante de hígado.
Melanoma antes del trasplante de un órgano sólido
Es difícil valorar el riesgo de recidiva en el período postrasplante de un melanoma presente y tratado antes del trasplante. La Clínica Mayo, en un seguimiento de 10,5 años, no apreció un aumento del riesgo de recurrencia local ni metastásica en 59 pacientes con melanoma antes del TOS comparado con la población IC53. Otra revisión europea de 9 casos con 5 años de seguimiento encontró similares resultados54. Sin embargo, otro estudio publicado por el CTTR (Cincinnati Transplant Tumor Registry) encontró que 6 de 31 pacientes con antecedente de melanoma pretrasplante desarrollaron recurrencia y fallecieron entre 6 meses y 2,5 años después de recibir el trasplante, por lo que recomienda que el paciente debe estar al menos 5 años libre de enfermedad antes de someterle a un TOS55. Sin embargo, algunos de estos estudios no reportan el factor pronóstico más importante del melanoma, el índice de Breslow, por lo que es difícil compararlos entre ellos. Así, aunque no existe una recomendación óptima del tiempo que hay que esperar, el International Transplant Skin Cancer Collaborative Group (ITSCC) recomienda que no es necesario retrasar un trasplante si se trata de un melanoma in situ bien tratado, pero sí que hay que aumentar la frecuencia de los controles y esperar un mínimo de 2 años en caso de estadio Ia y 5 años en caso de estadios más avanzados, quedando evidentemente descartados los pacientes con melanoma metastásico22.
Melanoma en el período postrasplante
La incidencia de melanoma en el período postrasplante se ha calculado de 0 a 8 veces mayor que en la población IC, aunque el tamaño de la muestra de los estudios es pequeño56,57. En los adultos representa menos del 5% de las neoplasias cutáneas, mientras que en la población pediátrica el melanoma representa el 12% de los tumores cutáneos58.
Se ha descrito un mayor riesgo de desarrollar melanoma regional y metastásico en el período postrasplante durante los 4 primeros años del trasplante en varones de edad avanzada y que han recibido tratamiento IS de inducción con anticuerpos monoclonales. Por el contrario, se han descrito como factores de riesgo para el desarrollo del melanoma in situ los pacientes varones de edad avanzada que han recibido azatioprina y un trasplante renal, ya que este puede aparecer en cualquier momento tras el trasplante53,54.
En cuanto al pronóstico, parece que se ha visto que la supervivencia a 3 años sería algo menor que en la población IC, sobre todo en los melanomas con mayor índice de Breslow, que se reduce del 87 al 51,2% en los melanomas con Breslow 1,5-3 mm o Clark 3-4. Sin embargo, en tumores más finos, la supervivencia sería similar a la población IC53,54.
Por tanto, ante un paciente que desarrolle melanoma en el período postrasplante, de entrada el abordaje debe ser similar al paciente IC. Además, los protocolos de ITSCC y SCOPE recomiendan reducir la IS en pacientes que desarrollan melanoma. En cuanto al efecto del sirolimus, a pesar de que en modelos murinos se ha demostrado que tiene efecto beneficioso, no hay estudios en humanos que avalen el cambio de fármaco para mejorar el pronóstico.
Melanoma derivado del donante
La trasplantología va evolucionando y la demanda de órganos crece día a día, lo que condiciona que los criterios de donante sean cada vez más laxos y se acepten como donantes a sujetos más mayores e incluso con antecedentes de neoplasias, de las que en el momento de fallecer se encontraban libres de enfermedad. Esta modificación en el criterio hace que exista un riesgo de transmisión del cáncer al receptor que hay que valorar en función del tipo de neoplasia53,59.
Así como un paciente con antecedente de CE de piel no metastásico puede ser donante en cualquier momento, el antecedente de melanoma debería ser criterio de exclusión, ya que se ha visto que en el 74% de los casos se transmite. Si se combinan las series y casos publicados, los órganos de 17 donantes con melanoma fueron trasplantados a 44 receptores, de los cuales 35 desarrollaron melanoma y 23 fallecieron por él60.
Por tanto, ante un donante con antecedente de melanoma conocido, este se debe excluir totalmente, pero siempre existe un bajo riesgo de obtener un órgano de un donante con melanoma que pasó inadvertido. Por este motivo se recomienda revisar de manera exhaustiva la historia clínica y la presencia de cicatrices en el cuerpo del donante y, sobre todo, prestar especial atención a los pacientes jóvenes cuya causa de muerte fue un accidente vascular-cerebral o un tumor cerebral primario61.
SARCOMA DE KAPOSI
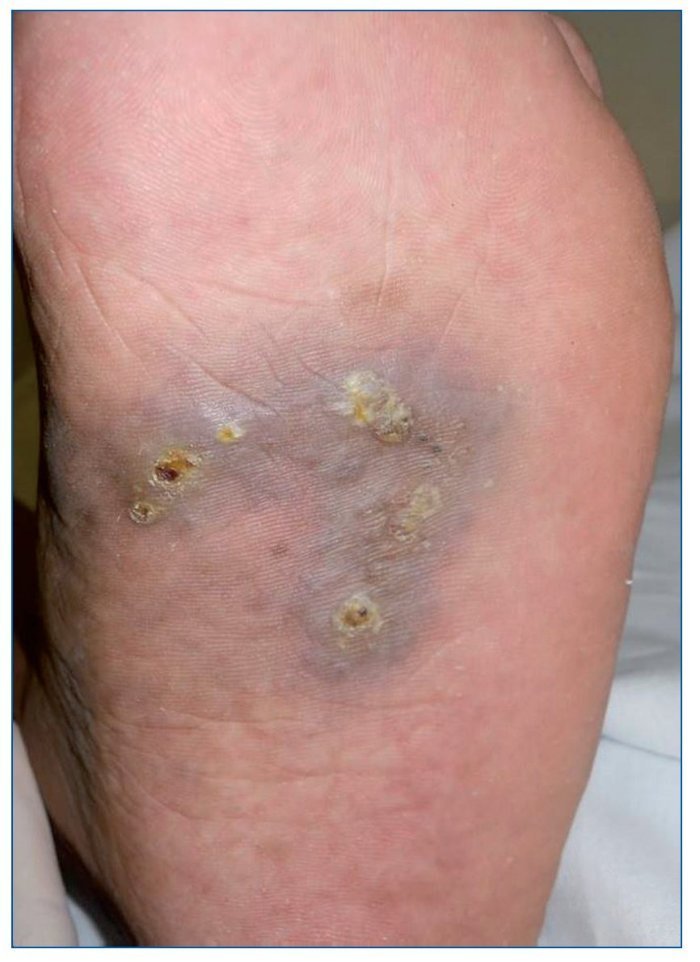
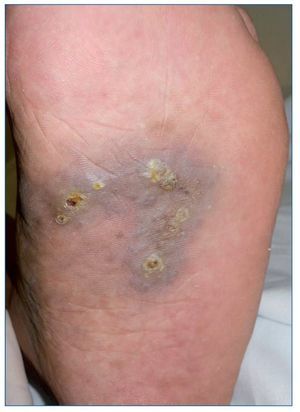
El SK es una neoplasia vascular que afecta principalmente a la población inmunodeprimida (RTOS o población infectada por el virus de la inmunodeficiencia humana), aunque también existe la forma clásica que afecta sobre todo a pacientes ancianos. Su particularidad es que se trata de una neoplasia multicéntrica que afecta principalmente a la piel, pero puede afectar también a mucosas, ganglios linfáticos, sistema gastrointestinal, pulmones e hígado (fig. 5). Su patogenia se ha relacionado con el virus del herpes humano tipo 8 (VHH8) y su aparición en el paciente RTOS tiene un impacto en la duración del injerto y la supervivencia, probablemente por la modificación de la IS.
Figura 5. Sarcoma de Kaposi: placa violácea con pápulas queratósicas en la planta de un paciente receptor de un trasplante pulmonar 4 meses antes.
Se calcula que es 80-500 veces más frecuente que en inmunocompetentes, con una incidencia del 0,7-5%. Sin embargo, debido probablemente a la modificación de los fármacos inmunosupresores y la utilización de fármacos antivirales, parece que la incidencia estaría disminuyendo.
Factores de riesgo
La aparición de SK en RTOS está directamente relacionada con la IS y aparece con más frecuencia en varones de más de 50 años, raza negra, RTR, en el corto período postrasplante (primeros 2 años), en los pacientes seropositivos para VHH8, en los homosexuales o en los que provienen de áreas endémicas como el Mediterráneo, Oriente Medio, el Caribe o África62.
La infección por VHH8 puede adquirirse como una infección nueva a partir del riñón donante, por una reactivación de infección latente en áreas endémicas (más frecuente), por una infección primaria tras contacto sexual o no sexual, o por tranfusiones (riesgo: 0,1%).
Tratamiento
La base del tratamiento del SK postrasplante es la modificación de la IS. Tan solo la reducción o eliminación de la IS consigue unas tasas de curación completa del 30%, pero ello no siempre es posible sin llevar a la pérdida del injerto. Además, el SK, un tumor muy vascular y ligado directamente con la infección por VHH8, es una buena diana para los fármacos inhibidores de mTOR por sus efectos antiangiogénicos e inhibidores de la estimulación de VEGF (factor de crecimiento del endotelio vascular) y antivirales. Así, diferentes estudios han demostrado que el cambio de inhibidores de la calcineurina a un inhibidor de mTOR estabiliza las lesiones, las reduce e incluso las hace desaparecer a los 3 meses del cambio de IS manteniendo la función renal63-68.
Cuando se trata de lesiones aisladas o tumorales pequeñas pueden tenerse en cuenta otros tratamientos, como la cirugía, la crioterapia, el imiquimod o el timolol tópicos. La radioterapia debe reservarse para cuando no se tengan otras opciones, ya que produce importantes edemas como secuela y una coloración pardusca que hace difícil valorar las recidivas. En casos extensos se debe plantear el tratamiento sistémico con quimioterápicos como vinblastina, bleomicina, paclitaxel, docetaxel o doxorrubicina liposomal.
Con relación a la presencia de un SK en el período pretrasplante o un paciente que haya tenido un SK y deba recibir otro trasplante, debemos intentar utilizar siempre un inhibidor de mTOR de entrada para minimizar el riesgo de recidiva del SK.
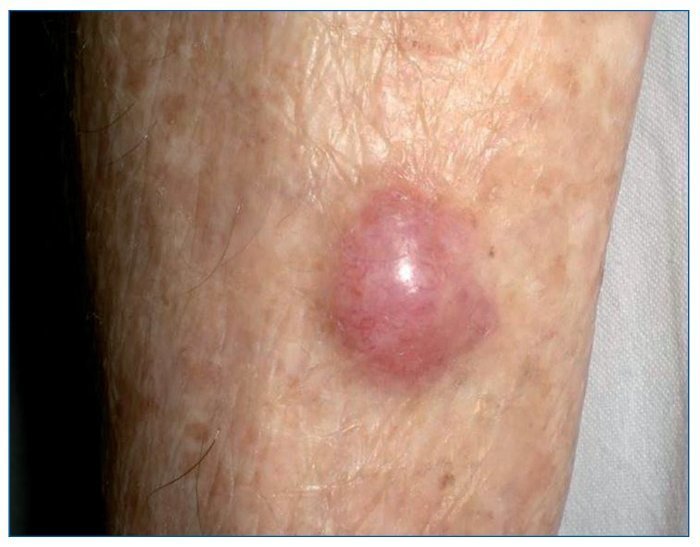
CARCINOMA DE CÉLULAS DE MERKEL
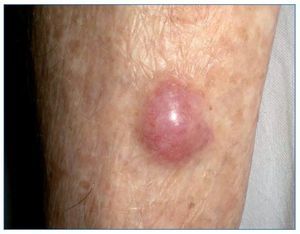
El CCM es un tumor cutáneo poco frecuente de origen neuroendocrino que habitualmente se engloba en el grupo de CCNM (fig. 6). Su patogenia se ha relacionado con la exposición crónica a la radiación UV y a la infección por el poliomavirus de células de Merkel (MCPyV). Al igual que el melanoma, es un tumor agresivo con alta mortalidad, y se ha descrito una supervivencia a 5 años del 30-64%.
Figura 6. Carcinoma de células de Merkel en la zona pretibial.
Tan solo hay 2 trabajos que comparen las características diferenciales del CCM en los RTOS respecto a los IC65,66. En un estudio que incluía 110 CCM en 190.000 RTOS se calculó una incidencia 12,8/100.000 personas/año, con un aumento del riesgo de 24 veces69. Otro estudio en el que comparaban 8 CCM en RTOS con 89 en IC se observó una reducción significativa de la supervivencia global y específica independiente del estadio de presentación70. Asimismo se observó que el CCM es más frecuente en varones mayores de 50 años, caucásicos y que, a diferencia del SK, es más frecuente cuanto más tiempo ha pasado desde el trasplante.
SÍNDROMES LINFOPROLIFERATIVOS
Los síndromes linfoproliferativos son la segunda neoplasia más frecuente en los RTOS y la primera en los RTOS pediátricos. La mayoría se origina en las células linfoides B, son virus Epstein-Barr positivos y extranodales. Los linfomas cutáneos primarios, a diferencia de otras neoplasias cutáneas, son poco frecuentes en estos pacientes. Un estudio multicéntrico europeo que incluía 35 linfomas en RTOS observó que el 69% eran linfomas T (50% micosis fungoides, 11% foliculotropa); el 37%, linfomas CD30+ y el 31%, linfomas B, distribución similar a la observada en IC, aunque los linfomas CD30+ tuvieron peor pronóstico71.
MORTALIDAD POR CÁNCER CUTÁNEO
Ya se ha visto que el CC es la neoplasia más frecuente en los RTOS. En un estudio reciente en Estados Unidos se calculó la mortalidad por CC en RTOS en 35,27/100.000 personas-año72. Los factores de riesgo para fallecer por CC fueron el sexo masculino, la raza caucásica y los trasplantes torácicos (pulmonar, corazón o cardiopulmonar). La mortalidad fue mayor por melanoma, seguido de CE y CCM.
CONCLUSIONES
El pronóstico del CC se puede controlar si se utilizan medidas de fotoprotección y se trata el campo de cancerización, pero no se debe olvidar que la educación sanitaria y el control estricto de por vida de estos pacientes también son imprescindibles. El papel del dermatólogo ocupa una posición central en el campo de la medicina del trasplante en términos de evaluación dermatológica y tratamiento del pre- y postrasplante, así como por su implicación en la profilaxis secundaria de los pacientes de alto riesgo. La presencia del dermatólogo en el equipo de trasplantes les da acceso a los RTOS a consultas especializadas, screenings frecuentes, educación del paciente y tratamiento multidisciplinar.
CONCEPTOS CLAVE
• El CC es el cáncer más frecuente en los pacientes RTOS. El CCNM representa el 95% de las neoplasias cutáneas.
• La incidencia de CCNM aumenta a medida que pasa el tiempo desde el trasplante, y aparece en torno al 5% de los pacientes a los 2 años del trasplante, del 10-27% a los 10 años y del 40-60% a los 20 años. Esta incidencia es longitudinal en el caso del CBC y exponencial en el caso del CE; además, este último es más agresivo.
• Los factores de riesgo para el desarrollo de CCNM incluyen factores demográficos (varón, > 50 años, fototipos I-III), factores predisponentes (historia de CC, latitud de residencia baja, gran exposición solar acumulada, etc.) y factores modificables (tratamiento inmunosupresor y duración, fotoexposición, infecciones virales, etc.).
• Las medidas de prevención primaria incluyen la información a los pacientes y la educación sanitaria en medidas de fotoprotección y autoexploración, y las de prevención secundaria incluyen la detección y el tratamiento precoz de las QA, la modificación de los agentes IS en los de mayor riesgo y el control dermatológico periódico.
• El antecedente de melanoma en el receptor no es una contraindicación absoluta para realizar el trasplante, pero sí debe contraindicarse la donación de órganos en un candidato a donante con antecedente de melanoma.
• La incidencia de melanoma en los receptores de trasplante de órgano sólido es 2-3 veces mayor que en la población inmunocompetente, pero el pronóstico es peor solo en los casos de melanoma con índice de Breslow > 1,5 mm.
• El SK es 80-500 veces más frecuente que en la población inmunocompetente y aparece con más frecuencia en los primeros 2 años tras realizarse el trasplante.
• El tratamiento de elección del SK es la modificación de la inmunosupresión a un fármaco inhibidor de mTOR.
• Se ha calculado la mortalidad por CC en RTOS en 35,27/100.000 personas-año. Los factores de riesgo para fallecer por CC fueron el sexo masculino, la raza caucásica y los trasplantes torácicos (pulmonar, corazón o cardiopulmonar).
Conflicto de intereses
La autora declara que no tiene conflicto de intereses potencial relacionado con los contenidos de este artículo.
Correspondencia:
Carla Ferrándiz-Pulido
Servicio de Dermatología.
Hospital Universitario Vall d’Hebron, Barcelona.
40879cfp@comb.cat