Los principales mensajes escogidos para la diálisis peritoneal en 2008 con una visión desde el laboratorio a la clínica son los siguientes:
- La ultrafiltración (UF) peritoneal resulta de la transferencia de agua y sal inducida por el gradiente osmótico de la glucosa a través de dos vías distintas.
- Agua libre (poros ultrapequeños).
- Agua con solutos (poros intercelulares), atraviesa el glucocáliz endotelial.
- «Menos» la retrofiltración.
- El gradiente osmótico se pierde con la transferencia retrógrada de glucosa, mucho más en altos trasportadores, a través de los mismos poros pequeños.
- El primer cambio que sufre el tejido peritoneal es la transición epitelio-mesenquimal de la célula mesotelial y la transformación de su entorno (por TGF-β y VEGF).
- La vasodilatación capilar inducida por factor de crecimiento endotelial vascular (VEGF) aumenta el transporte de pequeños solutos en ambos sentidos con menor UF sin requerir incremento en la angiogénesis.
- Los líquidos más biocompatibles protegen la membrana mediante la protección de la célula mesotelial, evitando que se transforme en fibroblastoide y adquiera capacidad transformante de su entorno.
INTRODUCCIÓN
La investigación translacional ha sido defendida por algunos como aquella que debe ocupar la mayor parte (o la totalidad) del gasto público en investigación sanitaria. Es una visión de médicos de cara a la política científica, en el convencimiento de que hay tanto que hacer y tantas oportunidades generadas desde el paciente, que este tipo de visión debe eclipsar al resto de la investigación biológica en España. Así ha sido vista y desarrollada en nuestro grupo desde tiempos remotos en el campo de la diálisis peritoneal (DP) y ésta es simplemente una oportunidad para revisar y explicar la situación en 2009.
La DP trabaja con una membrana biológica que ofrece toda su diversidad en composición y reacción ante el reto de utilizarla para diálisis. Aunque simple, la membrana peritoneal es también un pequeño mundo para explorar el transporte de solutos y agua transcapilar y transintersticial desde el capilar peritoneal. Sus modificaciones, como consecuencia de ser bañada por un extraño líquido de diálisis, determinan cambios tisulares que modifican el modo de transporte. La biología de sus células componentes y de las emigradas hacia ella constituye, además de una ocasión de interés específico, una capacidad de análisis de un modelo in vivo cuya simplicidad representa una verdadera oportunidad.
Aunque en investigación translacional tendemos a hacer el discurso desde el problema del paciente, en nuestro caso los trastornos del transporte peritoneal, para esta ocasión nos hemos permitido invertir ese orden clásico en el reconocimiento de que definir primero los mecanismos ayuda a comprender mejor el conjunto.
NUEVA VISIÓN DE LA MICROANATOMÍA FUNCIONAL DE LA MEMBRANA PERITONEAL
Las dificultades de la membrana peritoneal para mantener a medio o largo plazo un adecuado transporte de solutos y agua a largo plazo es un hecho clásicamente aceptado1. La alteración funcional más frecuente del peritoneo es el fallo del transporte de agua, denominado fallo de ultrafiltración (UF)2,3, que determina un mayor riesgo cardiovascular4 secundario a sobrecarga de volumen. El uso de soluciones bioincompatibles, así como las peritonitis o los hemoperitoneos, se han relacionado con su aparición5.
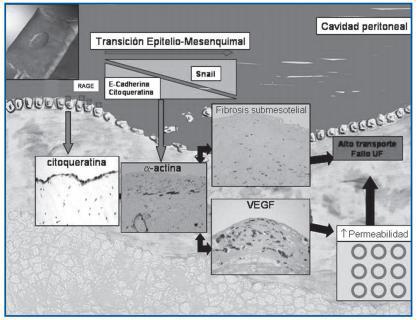
Paralelamente al deterioro funcional, el peritoneo de los pacientes en DP sufre con el tiempo cambios morfológicos, a distintos niveles (figura 1):
- Mesotelio: monocapa de células mesoteliales con características de células epiteliales que secretan diversas sustancias. La lesión más temprana, frecuente en pacientes en DP, es la pérdida de la superficie mesotelial. En la membrana peritoneal de pacientes en DP se ha demostrado la presencia de transición epitelio-mesenquimal(TEM)6 de la célula mesotelial, que se evidencia in vivo por la presencia de células fibroblastoides submesoteliales que expresan marcadores mesoteliales (citoqueratina). La célula mesotelial transdiferenciada secreta más cantidad de matriz extracelular que la célula mesotelial normal, y un estudio en ratas ha demostrado que la TEM mesotelial constituye la lesión inicial del proceso de fibrosis peritoneal7.
- Membrana basal: en DP hay reduplicación y engrosamiento de la membrana basal submesotelial y subendotelial.
- Fibrosis submesotelial: el submesotelio del paciente en DP presenta un aumento del espesor y su aspecto es homogéneo, con escasas células debido al aumento de matriz extracelular desproporcionado al incremento de fibroblastos8. Todos los pacientes en DP desarrollan con el tiempo fibrosis peritoneal9, en cuya patogenia se han implicado múltiples moléculas, como TGF-β, VEGF, FGF y CTGF.
- Sistema vascular: pueden aparecer dos lesiones a nivel vascular, ambas con gran repercusión funcional10:
- Vasculopatía hialinizante: por reduplicación de la membrana basal subendotelial y relacionada con la fibrosis. Asociada al tiempo en diálisis e implicada en la patogenia del fallo de ultrafiltración.
- Neoangiogénesis: aumento del área vascular peritoneal que determina un aumento de la superficie de intercambio11, debido, en parte, a la síntesis del factor de crecimiento del endotelio vascular (VEGF) en rescuesta a diferentes estímulos. El VEGF es una potente citocina proangiogénica que induce proliferación del endotelio vascular y aumento de la permeabilidad vascular. La producción de VEGF en el peritoneo de pacientes en DP está aumentada, siendo la célula mesotelial, la endotelial y el macrófago las fuentes de VEGF peritoneal. Los miofibroblastos peritoneales derivados de la TEM mesotelial producen mucha mayor cantidad de VEGF que las células mesoteliales normales12.
BIOPSIAS PERITONEALES ANTES Y AL INICIO DE DP
Honda et al.13 han demostrado la presencia de fibrosis submesotelial y vasculopatía hialinizante, generalmente en grados leves, en pacientes urémicos prediálisis, añadiendo que la diabetes en estos pacientes determina la gravedad de la fibrosis y la vasculopatía. Sus efectos aceleradores sobre dichas lesiones desaparecen una vez iniciada la DP, posiblemente por el mayor impacto que ejercen a partir de entonces factores relacionados con la propia DP.
La mayoría de los datos disponibles sobre la anatomía y función peritoneales están basados en biopsias de pacientes con largas estancias en DP y fallo de UF; por ello, es frecuente encontrar lesiones avanzadas, con fibrosis, vasculopatía y angiogénesis. Un reciente estudio de nuestro grupo14 ha analizado las biopsias de peritoneo parietal de 35 pacientes estables con menos de 2 años en DP, excluyendo aquellos con fallos de membrana y diabéticos. Menos del 25% de los pacientes mostraban intacta la capa mesotelial y casi la mitad presentaron algún grado de fibrosis submesotelial (espesor >150 µm). El 17% de los pacientes mostró evidencia in situ de TEM mesotelial. En el sistema vascular, un 17% de los pacientes tenía vasculopatía hialinizante, en grado leve, o rara vez moderado. El número de vasos peritoneales no se modificó de forma significativa con el tiempo en diálisis, hallazgo que ha sido confirmado por Sherif et al.15 en peritoneos no complicados de pacientes con largas estancias en DP. Cuando se compararon los hallazgos anatómicos con los funcionales, el único factor asociado con el alto transporte de pequeños solutos fue la presencia de TEM de la célula mesotelial, no encontrándose relación con la presencia de fibrosis o vasculopatía. Al contrario de lo observado en el alto transporte adquirido en etapas más tardías, el alto transporte en pacientes con menos de 2 años en DP no se relacionó con mayor vascularización peritoneal. De todo ello, se concluye que la primera lesión con repercusión funcional que aparece en el peritoneo en DP es la TEM mesotelial, que se relaciona con el alto transporte de pequeños solutos y es independiente del número de vasos peritoneales. La presencia de TEM mesotelial y la ausencia de un número aumentado de vasos, junto con el incremento de la expresión de VEGF a nivel peritoneal encontrado en pacientes con alto transporte de pequeños solutos, sugiere que un aumento de la permeabilidad de los capilares peritoneales o la vasodilatación de éstos está participando en su patogenia. El hallazgo de que la TEM de la célula mesotelial parece ser el inicio del proceso de fibrosis y neoangiogénesis peritoneal ha sido confirmado en modelos animales7.
La mayoría de estudios a largo plazo describen un aumento progresivo de la prevalencia y gravedad de la fibrosis submesotelial y la vasculopatía hialinizante con el tiempo en DP, no acompañadas necesariamente de proliferación vascular, la cual aparece sobre todo en peritoneos de pacientes con fallo tardío y esclerosis de membrana13.
La incorporación al estudio de la patogenia del fallo de UF de modelos animales tratados con líquido hipertónico para DP permite confirmar los hallazgos observados en humanos, y conocer exactamente la secuencia de fenómenos que suceden en el peritoneo a lo largo de la DP16. Éstos demuestran que la transición epitelio-mesenquimal de la célula mesotelial y su migración hacia zonas más profundas del tejido es el primer paso.
NUEVOS COMPONENTES Y DEFINICIONES EN EL TRANSPORTE PERITONEAL (EL GLUCOCÁLIZ ENDOTELIAL Y LA RETROFILTRACIÓN)
El capilar peritoneal es la fuente de agua y solutos para el propósito que busca la diálisis. La célula endotelial representa la primera barrera para la difusión y el ultrafiltrado que se va a producir. La teoría de los tres poros adjudica a cada uno de ellos el paso de un rango de tamaño molecular, siendo los microporos los representantes del paso exclusivo de agua transcelular. Se admite que su sustrato anatómico es el canal de aquaporina-1. Muy recientemente se ha propuesto una nueva estructura del sistema en la superficie sanguínea de la célula, el glucocáliz17,18. En 1979, Klitzman y Duling definieron esta capa y su capacidad para rechazar hematíes y dextranos; su desaparición implicaba el paso hacia el intersticio de elementos sanguíneos de alto peso molecular (hiperpermeabilidad capilar). Está compuesto de proteoglucanos, los vasos recién formados no lo tienen, la glucosa lo daña y determina el transporte transendotelial de solutos y agua. El glucocáliz podría ser alterado en la depleción proteica intersticial del tejido adyacente a la cavidad peritoneal y así impactaría sobre el balance de fuerzas transcapilar. De la misma manera, su daño (p. ej., por la glucosa) podría favorecer la excesiva llegada de factores de crecimiento desde la sangre, todos ellos capaces de modificar sensiblemente la composición del intersticio (p. ej., VEGF y angiogénesis). Una inevitable reflexión surge sobre el glucocáliz para explicar la vasculopatía hialinizante peritoneal asociada a la diabetes y a la DP. Para esta entidad no se ha encontrado otra explicación que la hiperglicación de las estructuras, entre las que podría caer el glucocáliz, induciendo el depósito proteico en la pared vascular que caracteriza la hialinización.
La retrofiltración
El gradiente osmótico inducido por la glucosa de la solución recién instilada en el peritoneo asegura la transferencia de agua desde el plasma. Sin embargo, es un hecho universalmente reconocido que después de un tiempo intraperitoneal este gradiente resulta insuficiente y, a pesar de existir, no puede impedir la retrofiltración de agua antes transferida a la cavidad. La capacidad de UF de cada paciente es el resultado del agua transferida libre de solutos (dependiente de aquaporinas) más el agua transportada por convección (con solutos) menos el agua retrofiltrada al plasma.
La técnica de mini-PET de La Milia ha sido propuesta19 y confirmada para la evaluación del transporte de agua libre y convectiva, antes de que la retrofiltración influya en el valor final de UF. El estudio de Asghar y Davies20 sugiere que el modelo de tres poros predice que cuando el gradiente osmótico se disipa, la reabsorción de líquido será conducida por los pequeños poros inducida por presión oncótica intravascular, predominando sobre la conducida por los linfáticos. Sucede así un flujo de agua contra gradiente de glucosa. La diferente relación en la reabsorción de líquido, detectada según el tipo de transportador, sugiere que depende de la disponibilidad de poros pequeños y muy secundariamente del flujo linfático (estimado con albúmina marcada). Rippe y Venturoli21 aceptan que este estudio confirma la existencia de retrofiltración, difícil de demostrar hasta ahora, gracias al modelo empleado con glucosa 1,36%. Y que esta retrofiltración empieza después de los 60 minutos, tal y como predice el modelo computarizado. Añaden que en caso de querer medir retrofiltración bajo glucosa al 3,86%, se requerirán 6-8 horas de permanencia para cuantificarla.
El concepto de retrofiltración permite abordar el déficit de UF de una manera etiopatogénica más específica. Desde nuestro punto de vista, el déficit de transporte de agua libre, por falta de aquaporinas endoteliales, no tiene abordaje terapéutico directo pues requiere la restauración endotelial, o en todo caso estructural. Se beneficiaría de un descanso peritoneal muy a tiempo y tal vez de administración local de proteoglucanos (heparina). La falta de transporte de agua convectiva se beneficiaría de cortas permanencias (y se podría beneficiar de terapias anti-TEM y anti-VEGF). Finalmente, la retrofiltración se evita con icodextrina y cortas permanencias para glucosa. La primera deficiencia se prevendría eludiendo definitivamente la glucosa como agente osmótico.
NUEVAS INFLUENCIAS EN EL TRANSPORTE PERITONEAL: LOS LÍQUIDOS MÁS BIOCOMPATIBLES
Una vez reconocidas las debilidades de los componentes del sistema peritoneal de transporte, los elementos más determinantes de su involución son los componentes de los líquidos de diálisis1,5. Un denominador común del deterioro del tejido peritoneal es la glucosa de estos líquidos y los productos de su degradación (PDG) que se producen durante el proceso de esterilización. Desde hace 5 años disponemos de líquidos que no aportan altos niveles de PDG y teóricamente protegen el peritoneo. Nuestro grupo ha presentado en el pasado congreso de la ASN22 los resultados de un estudio comparativo de 2 años de duración sobre el uso de soluciones convencionales y bajas en PDG. Estudiamos los efectos de ambas sobre las células mesoteliales que se recogen en el efluente y se cultivan. El uso de líquidos bajos en PDG se ha asociado al mantenimiento a medio plazo del fenotipo redondeado normal (en contraste con el líquido alto en PDG que inducía el fibroblastoide en casi todos los pacientes) y una menor producción de VEGF por estas células. Los dos datos caracterizan la TEM de estas células mesoteliales. Por ello, ambas características definen una mejor tolerancia de la célula mesotelial a este tratamiento y hacen previsible un menor cambio de su entorno al evitar la TEM.
Las claudinas23, proteínas de la unión intercelular, han sido propuestas como marcadores tempranos (igual que la E-cadherina) del fenómeno de la TEM, con posibilidad de incorporarlas a la fase de diagnóstico temprano citológico en efluente peritoneal.
El bicarbonato24 en el líquido de diálisis, en sustitución del clásico lactato, representa también una potencialidad positiva añadida, pues este último elemento es en sí mismo un verdadero tóxico celular. Los resultados de un estudio cruzado que comparó las influencias locales y sistémicas del líquido con bicarbonato han demostrado una mejor viabilidad mesotelial, mayor presencia individual de macrófagos, menor liberación local de interleucina 6 (IL-6) a pesar de una mayor activación de los macrófagos, y unos niveles de IL-6 y proteína C reactiva (PCR) en suero similares. Los resultados pueden considerarse muy positivos para las células del peritoneo y limitados para la influencia sistémica.
En resumen, los principales mensajes escogidos para la DP en 2008 con una visión desde el laboratorio a la clínica son los siguientes:
- La UF peritoneal es el resultado de la transferencia de agua y sal inducida por el gradiente osmótico de la glucosa a través de dos vías distintas.
- Agua libre (poros ultrapequeños).
- Agua con solutos (poros intercelulares), atraviesa el glucocáliz.
- «Menos» la retrofiltración.
- El gradiente osmótico se pierde con la transferencia retrógrada de glucosa en altos transportadores, a través de los mismos poros pequeños.
- El primer cambio que sufre el tejido peritoneal es la TEM de la célula mesotelial y la transformación de su entorno (por TGF-β y VEGF).
- La vasodilatación capilar inducida por VEGF aumenta el transporte de pequeños solutos en ambos sentidos con menor UF, sin requerir incremento en la angiogénesis.
- Los líquidos más biocompatibles protegen la membrana mediante una protección de la célula mesotelial evitando que se transforme en fibroblastoide y adquiera capacidad transformante de su entorno.
Figura 1.